Introducción
La importancia de las funciones de la biodiversidad ha ido aumentando a través del tiempo Cardinale et al. (2007), a razón de entender y mejorar la funcionalidad y producción de sistemas agrícolas Tilman et al. (1996); (Moonen y Bàrberi, 2008). La preocupación viene de la demanda mundial de alimentos, se ha proyectado que la población mundial a finales de este siglo será de once mil millones (ONU, 2011). En consecuencia crecerá la demanda de los recursos tales como la tierra, energía, biomasa, y reservas de fósforo. El reto está en alimentar a la totalidad de la población sin causar daños con consecuencias irremediables para el medio ambiente (Rockström et al., 2009a; Rockström et al., 2009b).
Los flujos de nitrógeno reactivo y fósforo representan un gran peligro para el ecosistema, en general el flujo de nutrientes excesivos causan eutrofización en consecuencia la biodiversidad disminuye, este es uno de tantos problemas ocasionados por la agricultura tratando de satisfacer la demanda de alimentos. La diversidad microbiana del suelo ha tomado demasiada importancia hasta la fecha debido a que tienen la capacidad de mejorar la eficiencia en el uso de nutrientes, aumentan la estabilidad de agregados del suelo, mejoran la formación de materia orgánica y el uso eficiente de agua (Mäder et al., 2002; Brussaard et al., 2007).
Los hongos micorrícicos arbusculares (HMA; Glomeromycota; Schüßler et al. (2001) son microorganismos que establecen simbiosis con más de 80% de las plantas terrestres ( Read et al., 2008). Esta simbiosis que surge desde más de 450 millones de años, es sin duda la simbiosis más abundante del mundo (van der Heijden et al., 2008). Los HMA poseen la capacidad de proporcionar importantes servicios ecosistémicos (Philippot et al., 2013) tales como tolerancia a estrés biótico y abiótico, mejoran la absorción de agua y nutrientes (Hodge y Storer, 2015) y la plasticidad fenotípica de las plantas. Esta simbiosis representa un ventaja de suma importancia en entornos heterogéneos donde la asignación de recursos es limitada entre el crecimiento y la resistencia a diferentes estreses lo que lleva a la planta a adaptarse y sobrevivir (Pozo et al., 2015). A pesar de la gran cantidad de estudios ecológicos que van enfocados a la diversidad en función de eco y agroecosistema la información es limitada (Shennan 2008; Toljander et al., 2008).
La evidencia que existe actualmente sobre el número de especies en el filo de Glomeromycota Schüßler et al. (2001) es de aproximadamente 200 (Redecker et al., 2000). Sin embargo, el número de especies puede ser en realidad de magnitud mayor (Vandenkoornhuyse et al., 2002). Una razón por la cual se reporta un bajo número de especies es por cuestiones técnicas ya que la delimitación taxonómica es uno de los mayores problemas.
La taxonomía actual sigue siendo la determinación de caracteres morfológicos de esporas asexuales en descanso Vandenkoornhuyse et al. (2003); sin embargo, esto no descarta la utilidad de determinar caracteres morfológicos y técnicas moleculares para confirmar los tipos de HMA presentes en el suelo y la cantidad. Su aislamiento permite estudiar más profundamente al organismo al cual pertenecen y la relación entre la estructuración genética de las comunidades de hongos micorrícicos, eficiencia y diversidad funcional están relacionadas con las condiciones ambientales y especies vegetales. Los sistemas agrícolas están sometidos a presiones de selección de microorganismos tanto patógenos como benéficos debido a ciclos cortos de cultivos de interés agrícola, característica que no comparten los sistemas naturales (Burdon y Thrall, 2008). Es por ello que en la presente investigación se planteó el objetivo de evaluar y caracterizar a nivel morfológico aislados monospóricos de HMA nativos asociados a tomatillo en plantas de trigo bajo condiciones controladas.
Materiales y Métodos
Muestreo de suelo
En diciembre del 2012, fueron tomadas muestras de suelo de 1 kg en área natural (no cultivada) y suelo de uso agrícola. La muestra fue tomada de la rizosfera de tomatillo cultivado (variedad rendidora) y tomatillo silvestre en un perfil de 0-30 cm de profundidad. En dos localidades de Arteaga, Coahuila, México 25° 20' 56.35" latitud norte- 100° 40' 45.84" longitud oeste y 25° 23' 23.63" latitud norte 100° 37' 33.97 longitud oeste respectivamente. Cabe destacar que el tomatillo ha sido cultivado por 10 años consecutivos y en lo que respecta a tomatillo del sistema natural ha permanecido por el mismo periodo de tiempo sin labores culturales.
Análisis fisicoquímico de suelo
Se realizaron dos análisis de suelo en la Universidad Autónoma Agraria Antonio Narro (25° 23' latitud norte - 101° 02' longitud oeste) en el departamento de suelos, con el objeto de determinar condiciones fisicoquímicas donde se desarrollaron plantas de tomatillo y trigo, se determinó materia orgánica utilizando el método de Walkley y Black Bornemisza (1979), nitrógeno (N) con el método Kjeldhal Bremner (1960), fósforo (P) Olsen (1954), potasio (K) (espectrometría de absorción atómica), pH (suelo: agua 2: 4) y textura (Bouyoucos, 1936).
Cultivo monospórico
Las esporas de hongos micorrìcicos arbusculares se extrajeron de las muestras de suelo mediante el método de tamizado húmedo (núm. tamiz: 50, 325 y 400 µm) y decantación Gerdemann et al. (1963) seguido de un gradiente de sacarosa 2 M (Furlan et al., 1980; Horn et al., 1992). Se realizó una agrupación morfológica considerando forma, color y tamaño (INVAM, 2014). Los morfotipos obtenidos se inocularon en plántulas de Triticum aestivum L. (1 espora por planta/10 repeticiones). El cultivo monospórico se estableció en macetas de 1 litro de capacidad, y como sustrato arena estéril, además para evitar contaminación se cubrieron las macetas con plástico. Las plantas se mantuvieron en invernadero a una temperatura promedio de 40 °C, se aplicó solución nutritiva Steiner et al. (1973) modificada en fósforo 20%, pH de 7.5- 8, aplicando riegos a diario. Se realizaron muestreo de suelo mensualmente para evaluar la propagación de la espora inoculada de los diferentes morfotipos; en el cuarto mes se colocó una semilla de trigo por maceta para un segundo ciclo de cultivo con la finalidad que la espora se multiplicara y estableciera simbiosis. Además, las plantas se sometieron a estrés hídrico, suspendiendo totalmente el riego en los últimos dos meses con el objeto de acelerar dicha simbiosis.
Colonización de raíz (Triticum aestivum L.)
Con el objeto de determinar el grado de colonización radical se llevó a cabo en el octavo mes el análisis de cada una de las macetas por morfotipo. Para evaluar simbiosis exitosa de los morfotipos de hongos micorrìcicos arbusculares en trigo se clarificaron y tiñeron con azul de tripano fragmentos de raíz de trigo de 1 cm de longitud de los diferentes morfotipos siguiendo la técnica de Clarificación-Tinción de raíces y estimación de la colonización radical por hongos micorrícicos -Arbusculares (Walker et al., 2005). Finalmente, los fragmentos de raíz se montaron de manera vertical sobre portaobjetos (3 laminillas por planta/ 50 observaciones) agregando una gota de glicerol acidificado fresco para la observación al microscopio para estimación de la colonización (McGonigle et al., 1990).
Análisis morfológico
Las características morfológicas de esporas fueron descritas de esporas montadas en una mezcla (1:1) de reactivo de PVLG y Melzer (Brundrett et al., 1994). Para el color y forma se tomó como referencia la colección internacional de HMA (INVAM, 2014). Las fotografías fueron tomadas en microscopio óptico (Axio Scope A1, Carl Zeiss, Microscopy GmbH, Gottingen, Germany) con cámara integrada modelo Axio Cam Icc 1 objetivo 10 X, las mediciones se realizaron con el software Axion Visión Release 4.8.2.
Resultados y discusión
Análisis fisicoquímico de suelo
El Cuadro 1 muestra a detalle los resultados del análisis fisicoquímico de suelo en donde se desarrollaron plantas de tomatillo bajo los sistemas de uso agrícola (TC) y sistema natural (TS). Se observa que las plantas de tomatillo de ambos sistemas se desarrollaron en suelos alcalinos, clase textural arcilla y migajón arcillo arenoso respectivamente; el contenido de materia orgánica (M.O), nitrógeno (N), fósforo (P) y potasio es mayor en suelo de uso agrícola (TC) en comparación de suelo de un sistema natural (TS). Estudios realizados a largo plazo han demostrado que la fertilización causa impacto significativo en las comunidades de hongos micorrìcicos arbusculares tanto en la diversidad de especies como su funcionamiento (Thomson et al., 1992; Kahiluoto et al., 2009).

* TC= tomatillo cultivado; TS= tomatillo silvestre.
Cuadro 1 Características fisicoquímicas de suelo donde se desarrollaron plantas de tomatillo bajo dos sistemas diferentes.
Las características de hongos micorrícicos arbusculares difieren, ya que estudios realizados han demostrado que algunas especies forman más de un morfotipo de esporas Stockinger et al. (2009); sin embargo, la presente caracterización realizada en este estudio indica los tipos de hongos micorrícicos arbusculares presentes en dicho suelo y su abundancia. Esto de igual forma permite su aislamiento para estudiar a mayor profundidad al organismo que pertenece.
Análisis morfológico
La diversidad morfológica de esporas de hongos micorrícicos arbusculares que se encontraron asociados a la rizósfera de tomatillo de suelo silvestre (TS) fue mayor comparado con tomatillo cultivado (TC) (Figura 1). Se ha demostrado en diferentes estudios que los sistemas agrícolas están expuestos a presiones de selección microbiana muy intensos debido a ciclos cortos y manejo de cultivo por lo tanto la esporulación de hongos micorrìcicos arbusculares se ve afectada por la agricultura siendo totalmente lo contrario en sistemas naturales Burdon y Thrall (2008); Oehl et al. (2003), lo que concuerda con los resultados obtenidos en el presente estudio.
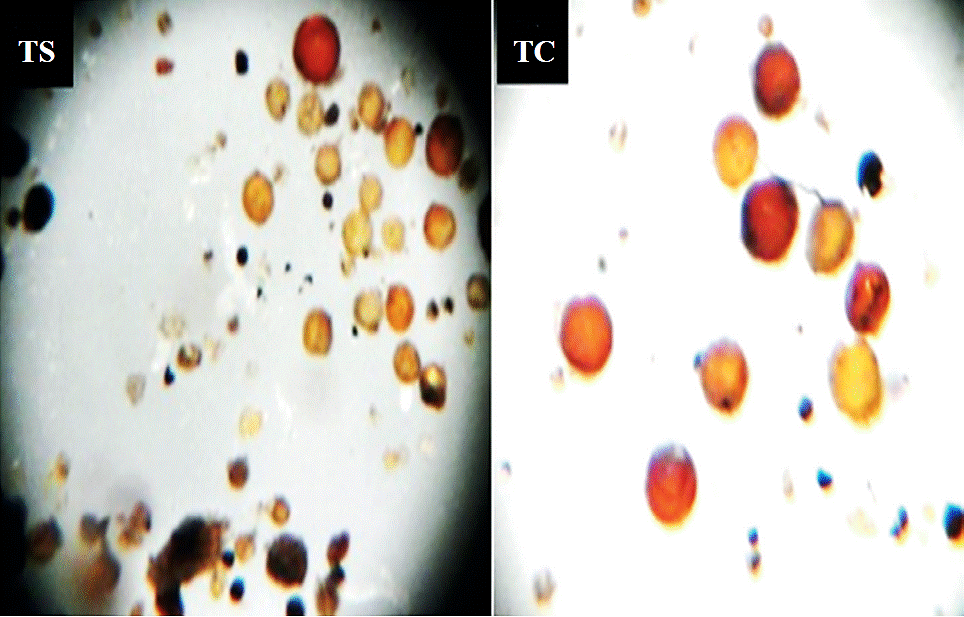
Figura 1 Diversidad morfológica de hongos micorrìcicos arbusculares asociados a rizósfera de tomatillo silvestre (TS) y tomatillo cultivado (TC) (objetivo 3X).
De acuerdo a las características morfológicas de las esporas asociadas a la rizosfera de tomatillo cultivado (variedad rendidora) se agruparon nueve morfotipos (Cuadro 2).
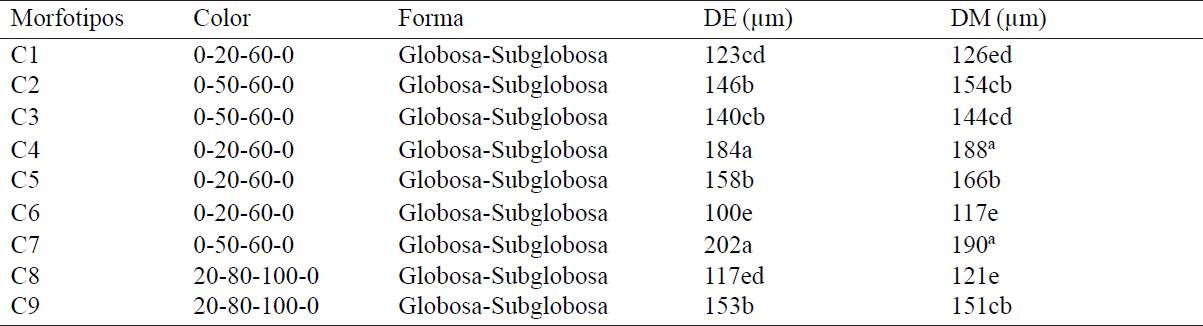
*0-20-60-0= red- brown, 0-50-60-0=reddish-orange, 20-80-100-0= red- brown (INVAM, 2014). DE= diámetro ecuatorial; DM= Diámetro meridional. Promedios con la misma letra indican diferencia no significativa (Tukey´s 0.05).
Cuadro 2 Características morfológicas de esporas de hongos micorrícicos arbusculares asociados a rizósfera de tomatillo cultivado (Physalis ixocarpa cv. Rendidora).
La prueba de comparación de medias Tukey (≤ 0.05) señala que los morfotipos C7 y C4 presentan mayor diámetro ecuatorial como meridional con 202 µm - 190 µm; 184 µm-188µm respectivamente; mientras que el morfotipo C6 presenta menor diámetro con 100 µm - 117 µm, los colores de espora determinados son: 0-50-60-0 (reddish-orange), 20-80-100-0 (red- brown ) y 0-20-60-0 (red- brown) siendo este observado con mayor frecuencia, la totalidad de los morfotipos presentó forma globosa- subglobosa.
En el Cuadro 3 se muestra la agrupación de 12 morfotipos asociados a la rizósfera de tomatillo silvestre de acuerdo a las características morfológicas de la espora. La prueba de comparación de medias Tukey (≤ 0.05) señala que el morfotipo S9 presenta mayor diámetro ecuatorial y meridional con 249 µm- 238 µm mientras que el morfotipo S7 presenta diámetros de 95 µm-104 µm considerándose como el morfotipo de menor tamaño; los colores de espora determinados son: 20-80-100-0 (red-brown), 0-10-90-5 (orange), 0-60-100-10 (orange brown) y 0-50-60-0 (reddish-orange) observando con mayor frecuencia a 0-60-100-10 (orange brown), la forma de la totalidad de morfotipos es globosa- subglobosa.
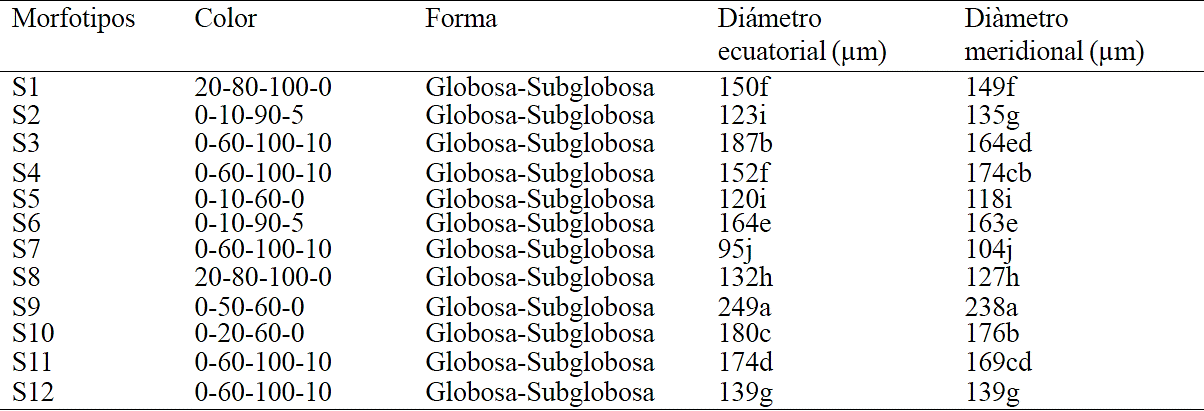
*20-80-100-0=red-brown, 0-10-90-5=orange, 0-60-100-10=orange brown, 0-10-60-0=pale orange-yellow, 0-50-60-0=reddish-orange, 0-20-60-0=red brown (INVAM, 2014). Promedios con la misma letra indican diferencia no significativa (Tukey p ≤ 0.05).
Cuadro 3 Características morfológicas de esporas de hongos micorrícicos arbusculares asociados a rizósfera de tomatillo silvestre.
En el presente estudio se determinó que existe mayor diversidad morfológica de esporas de hongos micorrícicos arbusculares asociados a la rizósfera de tomatillo silvestre con 12 morfotipos en comparación al tomatillo cultivado con nine morfotipos, es importante señalar que las plantas de tomatillo de los dos sistemas se han desarrollado en este sitio por un periodo de 10 años. Se han realizado publicaciones recientes Oehl et al. (2009) donde demuestran que las tierras cultivadas realizando rotación de cultivos y la presencia de malezas o hierbas perenes (trébol) resultaron ser más ricas en especies de hongos micorrìcicos arbusculares, efecto contrario resultó en cultivos que se siembran consecutivamente ( monocultivos) e incluso más ricos que pastizales naturales, por lo que es evidente que los resultados de diversidad morfológica de esporas de hongos micorrìcicos arbusculares sean menores en tomatillo cultivado debido a que es un sistema de agricultura intensiva por lo tanto la presencia de otros hospedantes (malezas) es nula o mínima por periodos muy cortos que no hay oportunidad de que se expresen más morfotipos de micorrizas, viceversa en el sistema natural de tomatillo silvestre.
Estudios realizados a largo plazo han demostrado el impacto de la fertilización sobre las comunidades de hongos micorrìcicos arbusculares reportando impactos negativos sobre la composición y funcionamiento de las diferentes especies (Thomson et al., 1992; Kahiluoto et al., 2009). Se ha encontrado que la adición de fertilizantes nitrogenados pueden alterar la diversidad funcional de micorrizas arbusculares, además, realizando fertilización alta de nitrógeno en suelos ricos en fósforo disminuyen la riqueza y diversidad de las comunidades de hongos micorrìcicos arbusculares (Egerton y Warburton et al., 2007). Debido a lo anterior se puede entender que tomatillo silvestre presentó mayor diversidad esporal de micorrizas debido a las limitaciones de nitrógeno presentando 0.16% con clasificación según análisis fisicoquímico como un suelo medio en comparación de tomatillo cultivado (variedad rendidora) con 0.22% considerado medianamente rico.
La materia orgánica y pH son parámetros que influyen en la composición de los hongos micorrìcicos arbusculares, estudios realizados en Colombia encontraron alta diversidad y abundancia de hongos micorricicos arbusculares en suelos ácidos (Serralde y Ramírez, 2004). La relación real ya sea fuerte o débil (Hijri et al., 2006) entre las propiedades del suelo y la distribución de especies de hongos micorrícicos arbusculares en condiciones de campo es poco conocido (Carvalho et al., 2003).
Análisis morfológico de aislados micorrícicos en trigo (Triticum aestivum L.)
Las esporas resultantes de los aislados presentan forma globosa- subglobosa, el diámetro ecuatorial (DE) de los aislados de sistema silvestre y cultivado oscilan de 108 µm - 170 µm y el diámetro meridional (DM) de 112 µm- 196 µm, el espesor se su pared esporal (EPE) es de 7 µm - 12.8 µm, los colores de la espora de los diferentes aislados fueron: 0-60-100-10 (orange- brown), 0-10-60-0 (pale orangeyellow), 0-10-90-5 (orange), 0-0-40-0 (pale yellow ), 0-5060-0 (reddish-orange), 0-20-60-0 (red-brown), el número de capas de la espora es de 1 en su mayoría a excepción del morfotipo S1 quien presenta dos capas esporales, el total de morfotipos presenta vesícula y arbùsculo (Cuadro 4).

*0-50-60-0= reddish-orange, 0-20-60-0= red-brown, 0-10-90-5= orange, 0-60-100-10= orange- brown, 0-10-60-0= pale orange-yellow, 0-040-0= pale yellow (INVAM, 2014). Promedios con la misma letra indican diferencia no significativa (Tukey p≤ 0.05).
Cuadro 4 Características morfológicas de aislados de hongos micorrícicos arbusculares asociados a rizósfera de trigo (Triticum aestivum L.).
De acuerdo al análisis estadístico en diámetro ecuatorial el aislado S9 es significativamente diferente con una media de 183a de acuerdo a la agrupación de medias (Tukey p≤ 0.05) seguido de S10 con una media de 170ba; en lo que respecta a diámetro meridional el aislado S4 presentó diferencia significativa con una media de 196a seguido de S10 con una media de 173ba. El aislado S7 presenta el menor diámetro tanto ecuatorial como meridional con una media de 108d-112e respectivamente. El espesor de la pared esporal de acuerdo a análisis estadístico y la prueba de comparación de medias (Tukey p≤ 0.05) el aislado S4 y S10 nos son estadísticamente diferentes pero numéricamente su diámetro difiere siendo mayor S10 con una media de 12.8a seguido de S4 con 12.6a, el aislado S7 presenta menor espesor de la pared esporal con una media de 7c.
Se aprecia que las características morfológicas de los aislados difieren de su sistema natural tanto del cultivado como silvestre, como se ha mencionado anteriormente algunas especies forman más de un morfotipo de esporas Stockinger et al. (2009). Recientemente Ehinger et al. (2009) estudiaron genéticamente distintos individuos de G. intraradices aislados del mismo campo y encontraron que los aislados mostraron diferentes estrategias de crecimiento dependiendo del hospedero y diferentes niveles de fósforo, esto significa que la disponibilidad de fosfato afecta el genotipo de un hongo formador de micorriza arbuscular aislado a través de múltiples generaciones.
Dinámicas similares han sido encontradas por Oliveira et al. (2010) trabajando con aislados de Glomus geosporum durante un año en dos suelos con diferentes pH (ácido-alcalino), estos estudios han demostrado que los linajes resultantes de hongos micorrícicos arbusculares comparten un tercio de sus marcadores genéticos lo que significa que cuando se cultivan bajo las mismas condiciones la densidad de micelio y de esporas difieren significativamente. Situación que pudo ser diferente en los caracteres morfológicos de los aislados de micorrizas nativas ya que se modificó su ambiente natural sometiéndolos a solución nutritiva Steiner modificada a 20% en fósforo y pH de 7.5- 8 y en sustrato tipo arena bajo condiciones controladas.
Potencial de inoculo de aislados de micorrizas en trigo (Triticum aestivum L.)
De 21 morfotipos que se obtuvieron del sistema silvestre y 12 de cultivado no todos establecieron simbiosis exitosa en plantas de trigo (Figura 2). De las cuales 10 morfotipos pertenecen al sistema silvestre (S1, S2, S3, S4, S5, S6, S7, S9, S10 y S11) y 2 (C2 y C5) al sistema cultivado.
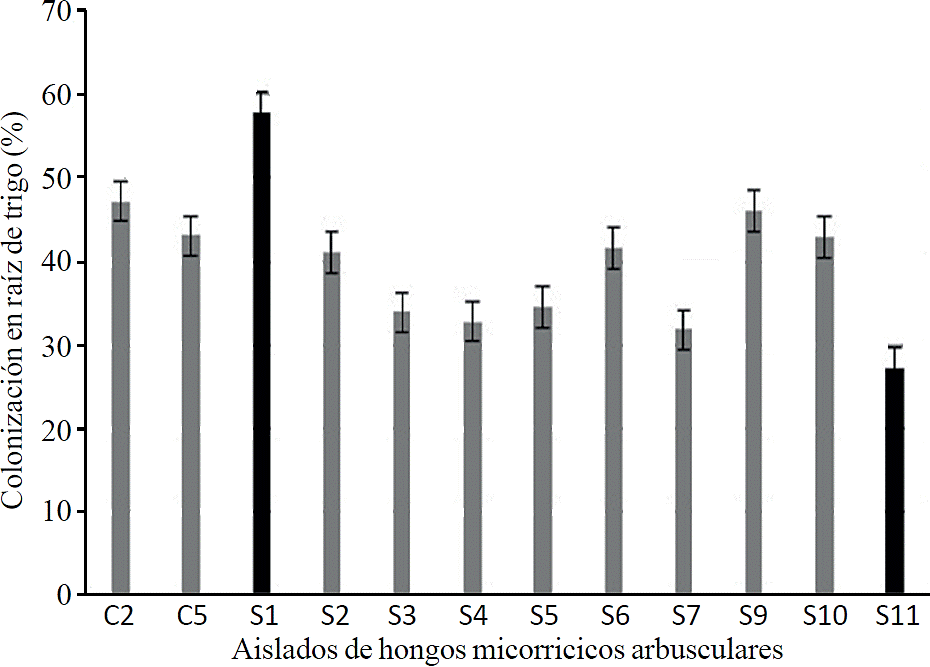
Figura 2 Colonización de aislados de hongos micorrícicos en raíz de trigo (Triticum aestivum L.) 8 meses después de la inoculación.
De acuerdo al análisis estadístico, el aislado S1 es significativamente diferente con un 57.81 a de acuerdo a la agrupación de medias (Tukey p≤ 0.05), seguido de C2 con una media de 47.2ba, el asilado S11 fue quien estableció menor simbiosis en raíz de trigo con una media de 27.16c. Los aislados C1, C2, C3, C4, C6, C7, C8, C9 de sistema cultivado y S8, S12 del sistema silvestre no establecieron simbiosis en plantas de trigo por lo que no son considerados con potencial de inóculo en la presente investigación. En este estudio se puede decir que las características de forma, diámetro, espesor de la pared esporal no son indicadores de hongos micorrícicos con potencial de inóculo. Se ha demostrado que existe una especificidad estricta entre hospedero y hongo micorrìcico arbuscular el resultado de las interacciones depende de su hospedero y condiciones ambientales ( Walder et al., 2012; Smith y Smith, 2015). El trigo es un cultivo que no depende en gran medida de la asociación con hongos micorrícicos arbusculares para obtener nutrientes, pero existen estudios que demuestran que las plantas de trigo se benefician al establecer simbiosis (Manske, 1990; Tawaraya, 2003).
En la Figura 3 se muestran características morfológicas de aislados que establecieron simbiosis exitosa en trigo (Triticum aestivum L.) y que son considerados con potencial de inóculo.

Figura 3 Caracteres morfológicos de aislados de hongos micorricícos arbusculares con potencial de inóculo en trigo. S1A, S1B, S1C, S2A, S2B, S2C, S3A, S3B, S3C, S4A, S4B, S4C, S5A, S5B, S5C, S6A, S6B, S6C, S7A, S7B, S7C, S9A, S9B, S9C, S10A, S10B, S10C, S11A, S11B y S11C son morfotipos del sistema silvestre; C2A, C2B, C2C y C5A, C5B, C5C son morfotipos del sistema cultivado donde (A) espora completa, (B) espora fraccionada y (C) colonización en raíz respectivamente.
Conclusiones
La diversidad morfológica de hongos micorrícicos arbusculares asociados en la rizósfera de tomatillo de un sistema silvestre es mayor en comparación a la rizosfera de tomatillo (variedad rendidora) de un sistema agrícola intensivo, esto fue debido a la disponibilidad de nutrientes, labores culturales nulas en el sistema silvestre y manejo intensivo en el sistema cultivado.
La morfología esporal de los hongos micorrícicos arbusculares difiere de acuerdo a las condiciones en las que se establezcan.
Los morfotipos aislados en plantas de trigo del sistema silvestre presentaron mayor potencial de inóculo debido a que de 12 morfotipos inoculados 10 establecieron simbiosis exitosa sobresaliendo el aislado S1 con mayor porcentaje de colonización siendo que los morfotipos asilados del sistema cultivado de nueve morfotipos inoculados solo dos establecieron simbiosis exitosa.











 texto en
texto en 


