Introducción
Las especies ornamentales tienen gran importancia en el sector agrícola mexicano debido a su alto valor y la variedad de flores de corte, follaje, y en contenedor que son comercializados tanto a nivel nacional como internacional. Según un estudio realizado por la Financiera Nacional de Desarrollo Agropecuario, Rural, Forestal y Pesquero (2014), destacan por su valor de producción la rosa (1 480 mdp), el crisantemo (1 079 mdp), el gladiolo (824 mdp) y la flor de nochebuena (431 mdp). El crisantemo (Chrysanthemum morifolium Ramat) es la segunda flor de corte más importante de las tres principales que se cultivan a nivel internacional (Villanueva et al., 2005). En el Estado de México se cultivaron 2 466.75 ha con crisantemo (SIAP, 2012) y se produjeron 8 731 240 gruesas, de cuyo total, 60% se destina al mercado interno y 40% al externo. La producción de flor de crisantemo bajo invernadero a nivel nacional registra un crecimiento promedio de 99.9% entre el 2004 y 2010, ascendiendo en este último año a 583 654 t.
En general, los floricultores en México realizan las actividades culturales de manera tradicional, ya que no cuentan con infraestructura adecuada ni con un sistema de producción eficiente que les permita reducir los costos de producción y mejorar la calidad (Cabrera y Orozco, 2003). Un problema frecuente entre los productores es que no se sigue un plan de fertilización acorde a las necesidades reales de demanda de nutrimentos por parte del cultivo a lo largo de su ciclo de producción (Quesada-Roldán y Bertsh-Hernández, 2013). En particular, uno de los problemas que enfrenta la producción de crisantemo es la disminución del rendimiento y la calidad debido a los desbalances nutrimentales que resultan de una fertilización inadecuada, principalmente entre N, P, K, Ca y Mg.
En general, los floricultores utilizan cantidades excesivas de fertilizantes de acuerdo con un programa preestablecido que se repite cada ciclo de cultivo, al igual de la aplicación de fertilizaciones foliares cada siete días, con productos en los que no se ajusta el pH del agua para la fertilización foliar (Gaytán-Acuña et al., 2006), lo cual repercute en un uso excesivo de fertilizantes, baja calidad de la flor y mayor costo de producción, así como también la contaminación de suelo y mantos acuíferos.
Un componente de suma importancia como la nutrición mineral está considerada como uno de los factores más importantes que afectan la producción (Quesada-Roldán y Bertsh-Hernández, 2013) ya que existen problemas con la dosificación de fertilizantes que deben aplicarse (Bugarín-Montoya et al., 2002). Las tendencias actuales indican que debe tomarse en cuenta cuestiones como el impacto del uso excesivo de fertilizantes (Basheer y Agrawal, 2013; Sepat et al., 2012), así como el incremento en el costo de estos y su disponibilidad en el futuro (Basheer y Agrawal, 2013; Gad y Hassan, 2013; Mehdizadeh et al., 2013). Las preocupaciones ambientales, económicas y de disponibilidad han aumentado la conciencia del manejo preciso de los programas de fertilización. En el marco del concepto de manejo de nutrimentos conocido como "4R" (cantidad, fuente de fertilizante, lugar de aplicación y momento de aplicación correcto), al igual que las curvas de extracción de nutrimentos, son una opción para preservar la calidad del medio ambiente, mientras se mantiene la productividad (Santos, 2011).
Los estudios de absorción de nutrimentos permiten establecer las bases de la fertilización de los cultivos, de tal manera que puede ser ajustada al ciclo de crecimiento, lo que a su vez permite optimizar la cantidad de fertilizante a utilizar, evitar el deterioro de los suelos y disminuir el impacto de la fertilización en el ambiente y la salud humana. El aumento en la eficiencia de los nutrimentos se basa fundamentalmente en la posibilidad de aplicarlos según la demanda de la planta y la etapa fenológica (Terry, 2008), para lo cual se estudian las curvas de extracción nutrimental.
Las curvas de absorción nutrimental determinan el momento o etapa fenológica del cultivo en que un nutrimento es extraído en mayor o menor cantidad, y al final del ciclo se obtiene la acumulación total del mismo. Las curvas de absorción se han empleado en muchos cultivos y abren nuevas posibilidades al productor en cuanto a la eficiencia y ahorro de fertilizantes, sin embargo, para el crisantemo no existe esta información. Por este motivo, el presente estudio estuvo encaminado a modelar la concentración y extracción de macronutrimentos en diferentes etapas fenológica del crisantemo en condiciones de cultivo sin suelo, con el objetivo de determinar con más precisión la aplicación oportuna de fertilizantes de acuerdo a la demanda de la planta.
Materiales y métodos
El presente estudio se realizó bajo condiciones de invernadero en la Universidad Autónoma Agraria Antonio Narro (UAAAN), en Buenavista, Saltillo, Coahuila. La temperatura mínima y máxima promedio que se registró durante el estudio fue de 14.3 y 27.6 °C respectivamente.
Se utilizaron esquejes enraizados de crisantemo (Chrysathemum morifolium Ramat) cv. Indianápolis White con tres hojas, longitud de raíz de 3 cm y longitud de tallo de 8 cm. Este cultivar pertenece al grupo de respuesta de 9 semanas a floración. Los esquejes fueron trasplantados el 28 de julio de 2012 en contendores de polietileno negro con un volumen de 10 L. Los contenedores se llenaron con una mezcla de sustrato a base de turba ácida y perlita en una relación de 4:1 (v/v). Se plantaron tres esquejes enraizados en cada contenedor cubriendo totalmente las raíces; la distancia entre plantas fue de 10 cm y entre contendores de 20 cm.
Para la nutrición de las plantas se empleó una solución nutritiva base con las siguientes concentraciones de macronutrimentos (meq L-1): NO3- =14, H2PO4- = 1, K+ = 8, Ca2+= 6, Mg2+ = 2, misma que fue preparada con agua potable considerando sus propiedades químicas para esta formulación. El pH se ajustó a 6.1 ± 0.1 con ácido sulfúrico y la conductividad eléctrica (CE) fue de 3.1 dS m-1. Los micronutrimentos se agregaron en forma de quelato-EDTA a una concentración de hierro, zinc, manganeso, y cobre de 5 ppm, 0.5 ppm, 0.01 ppm y 0.02 ppm, respectivamente. La concentración de la solución antes mencionada fue manejada en función de la CE del lixiviado del sustrato con el objetivo de mantenerla en el nivel inicial; cuando la CE del lixiviado disminuía, la concentración de la solución nutritiva se incrementaba a 25% ó 50%, y por el contrario, cuando aumentaba la CE del lixiviado, la concentración de la formulación de la solución se disminuía en la misma proporción.
El manejo del fotoperiodo se inició desde el día del trasplante, proporcionándole a la planta días largos por 25 días mediante lámparas incandescentes de 100 W encendidas de las 22:00 a las 02:00 h y colocadas a 1.5 m de altura y una separación de 1.5 m. Los días largos se interrumpieron cuando la planta alcanzó una altura de 20 cm, iniciando así los días cortos para inducción de la floración. Los días cortos se manipularon colocando un plástico de color negro por 9 semanas de las 18:00 a 8:00 h hasta finalizar el estudio.
La cosecha de flor se realizó a los 80 días después de trasplante, definiendo el punto de corte cuando a estas solo les faltaba por abrir de 3 a 4 anillos centrales de las flores del disco. Durante el periodo del estudio realizaron siete muestreos destructivos, uno cada 14 días; para ello las plantas se extrajeron completamente del contenedor y fueron separados en raíz, tallo, hojas y flor. Las raíces se lavaron con agua para eliminar el exceso de sustrato. Posteriormente, los órganos separados se introdujeron en un horno de secado a 70 °C por 72 h y se registró el peso de la materia seca utilizando una balanza digital.
A la raíz, tallo-hoja y la inflorescencia se les determinó la concentración de macronutrimentos. Los tejidos se digestaron en una mezcla de 2:1 de H2SO4:HClO4 y 2 ml de H2O2 al 30% y las muestras digeridas fueron analizadas para nitrógeno (N) con el procedimiento de microKjeldahl (Bremner, 1996), mientras que la concentración de fósforo (P), potasio (K), calcio (Ca) y magnesio (Mg) se realizó con espectrómetro de emisión de plasma acoplado inductivamente (ICP-AES, model Liberty, VARIAN, Santa Clara, CA) (Soltanpour et al., 1996).
Los cálculos de la extracción de macronutrimentos se realizaron considerando la materia seca y la concentración de estos en los diferentes órganos de la planta; la sumatoria de la extracción de los diferentes órganos representó la extracción total por planta. La distribución de los nutrimentos en los diferentes órganos, expresada en porcentaje, se determinó a partir del contenido nutrimental.
La unidad experimental fue conformada por un contenedor con tres plantas, con cuatro repeticiones en cada muestreo. Los datos de materia seca y extracción nutrimental fueron utilizados para la estimación de los modelos de tres segmentos lineales con el programa SigmaPlot 12.5.
Resultados
Acumulación de biomasa
La mayor acumulación de biomasa de la raíz se registró a partir de los 70 y 80 días después del trasplante (ddt) con 71.2% del total de la materia seca acumulada en este órgano, en cambio, para el tallo, esta se presentó entre los 56 y 80 ddt con 85.8% de la materia seca total (Cuadro 1). La materia seca de hoja tuvo la mayor acumulación después de los 42 ddt con 95.4% del total, mientras que en la inflorescencia la mayor acumulación se registró entre los 70 y 80 ddt (Cuadro 2).
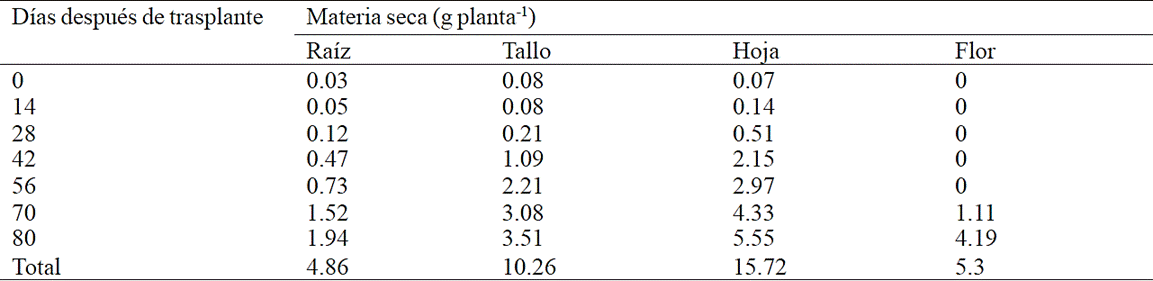
Cuadro 1 Acumulación de materia seca en los órganos de plantas de crisantemo (Chrysanthemum morifolium Ramat) cv. Indianápolis White.
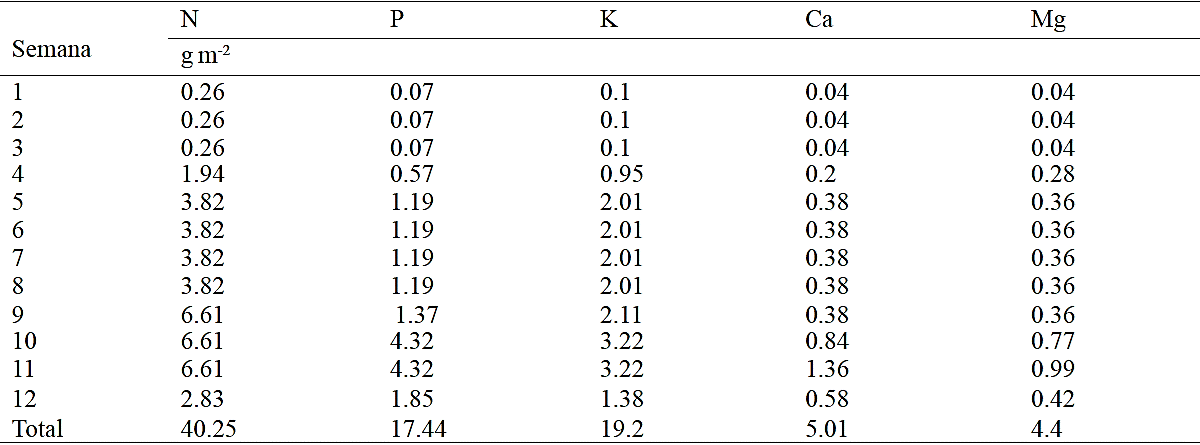
Cuadro 2 Programa de fertilización obtenida a partir de modelos de extracción nutrimental en crisantemo (Chrysanthemum morifolium Ramat) cv. Indianápolis White. Los cálculos fueron realizados considerando una densidad de 69 plantas por m-2 (12 cm x 12 cm) y una eficiencia del 50%, 40%, 80%, 75% y 75% en el uso del nitrógeno (N), fosforo (P), potasio (K), calcio (Ca) y magnesio (Mg), respectivamente.
El ciclo del crisantemo se dividió en las siguientes fases fenológicas: vegetativa (correspondiente a la fase de días cortos), inductiva (correspondiente al inicio de los días cortos hasta que el botón floral es visible), y floración (desde el botón floral visible hasta la cosecha) (Figura 1). De acuerdo a los modelos estimados, la acumulación de la materia seca total comienza a aumentar desde poco antes del inicio de los días cortos (después de los 26 ddt), pero este aumento es aún más marcado después de la mitad de la fase de la floración (66 ddt), fase que corresponde al desarrollo de la inflorescencia (Figura 1).
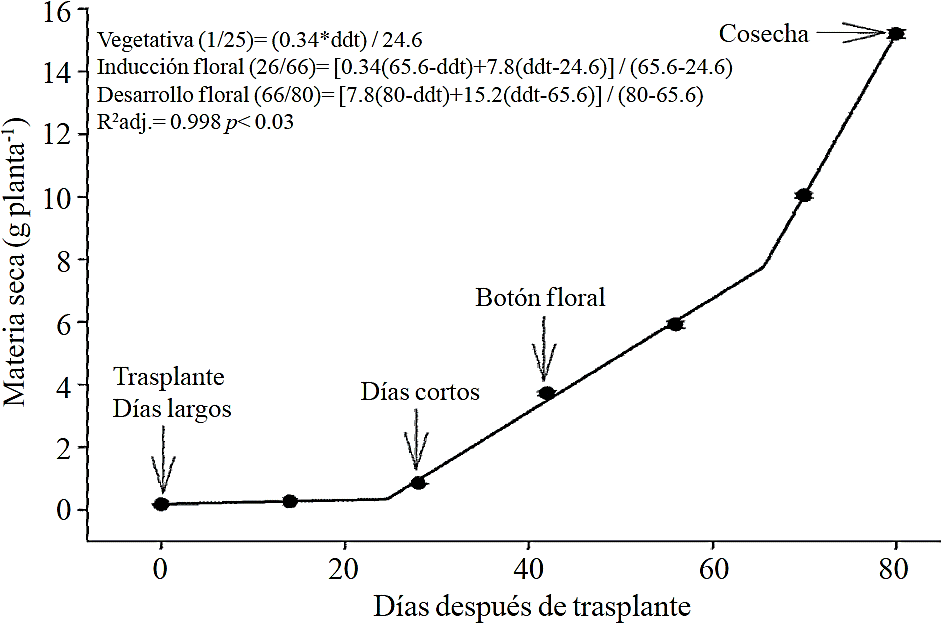
Figura 1 Acumulación de materia seca total en crisantemo (Chrysanthemum morifolium Ramat) cv. Indianápolis White. Se presentan los modelos correspondientes a las tres fases fenológicas detectadas, y entre paréntesis, los días después del trasplante (ddt) que comprenden la fase respectiva. Las barras indican el error estándar de la media (n=4).
Extracción nutrimental
La extracción de macronutrimentos siguió un comportamiento similar a la acumulación de materia seca total. De acuerdo a los modelos estimados, la extracción de N (Figura 2) y K (Figura 3) se inicia después de los 26 y 25 ddt, respectivamente, es decir, cercano a la fase inductiva por inicio de los días cortos, mientras que a los 58 o 63 ddt, prácticamente en la fase de desarrollo de la inflorescencia, se presenta un cambio mínimo en la pendiente, lo que sugiere una tasa similar de absorción de estos nutrimento en ambas fases. Similar comportamiento se registra para P (Figura 4), Ca (Figura 5) y Mg (Figura 6), pero a la mitad de la fase de desarrollo de la inflorescencia (67, 68 y 67 ddt para P, Ca y Mg, respectivamente) se presenta una marcado aumento en la tasa de absorción de estos nutrimentos.
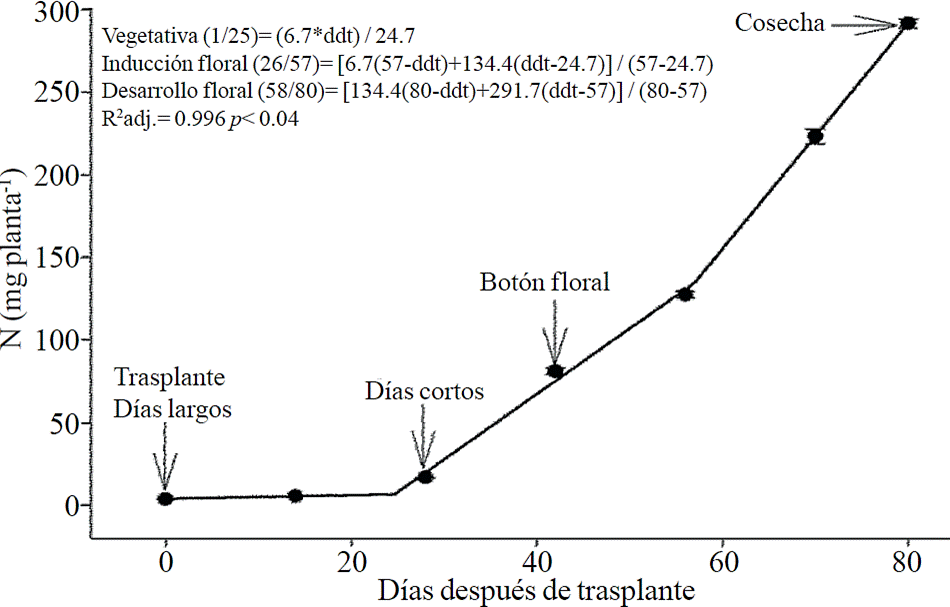
Figura 2 Extracción de nitrógeno (N) en crisantemo (Chrysanthemum morifolium Ramat) cv. Indianápolis White. Se presentan los modelos correspondientes a las tres fases fenológicas detectadas y entre paréntesis los días después del trasplante (ddt) que comprenden la fase respectiva. Las barras indican el error estándar de la media (n=4).
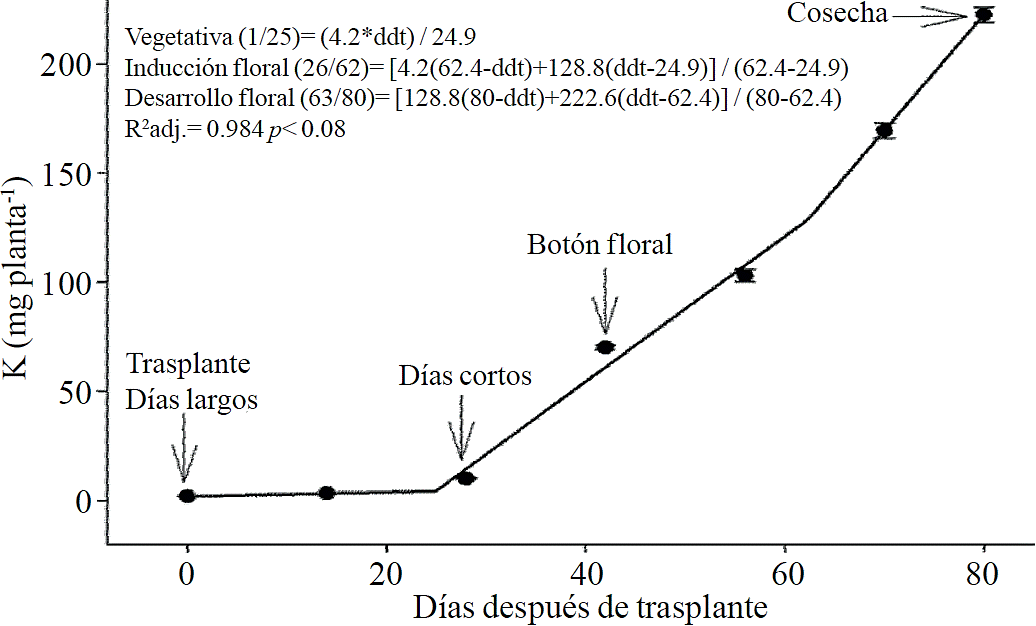
Figura 3 Extracción de potasio (K) en crisantemo (Chrysanthemum morifolium Ramat) cv. Indianápolis White. Se presentan los modelos correspondientes a las tres fases fenológicas detectadas y entre paréntesis los días después del trasplante (ddt) que comprenden a la fase respectiva. Las barras indican el error estándar de la media (n=4).
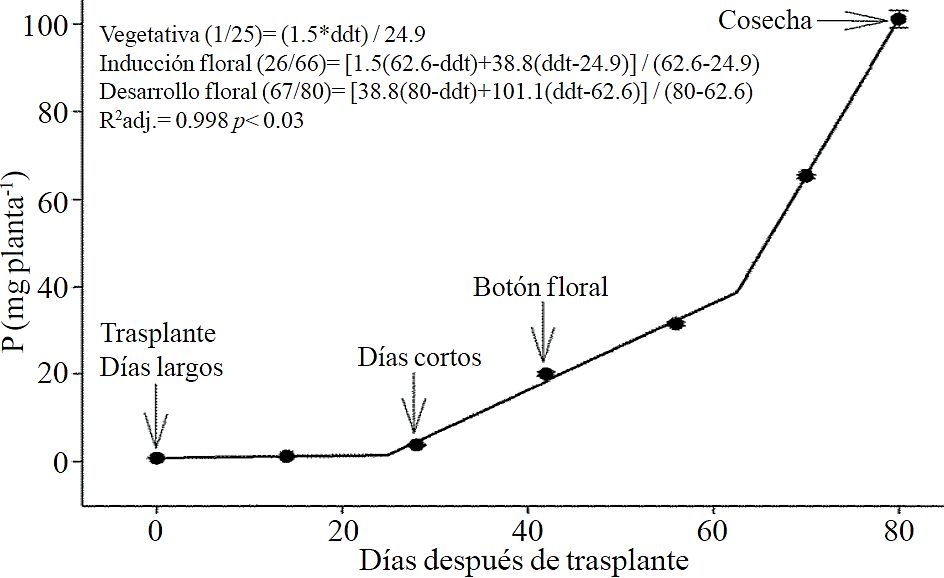
Figura 4 Extracción de fósforo (P) en crisantemo (Chrysanthemum morifolium Ramat) cv. Indianápolis White. Se presentan los modelos correspondientes a las tres fases fenológicas detectadas y entre paréntesis los días después del trasplante (ddt) que comprenden la fase respectiva. Las barras indican el error estándar de la media (n=4).
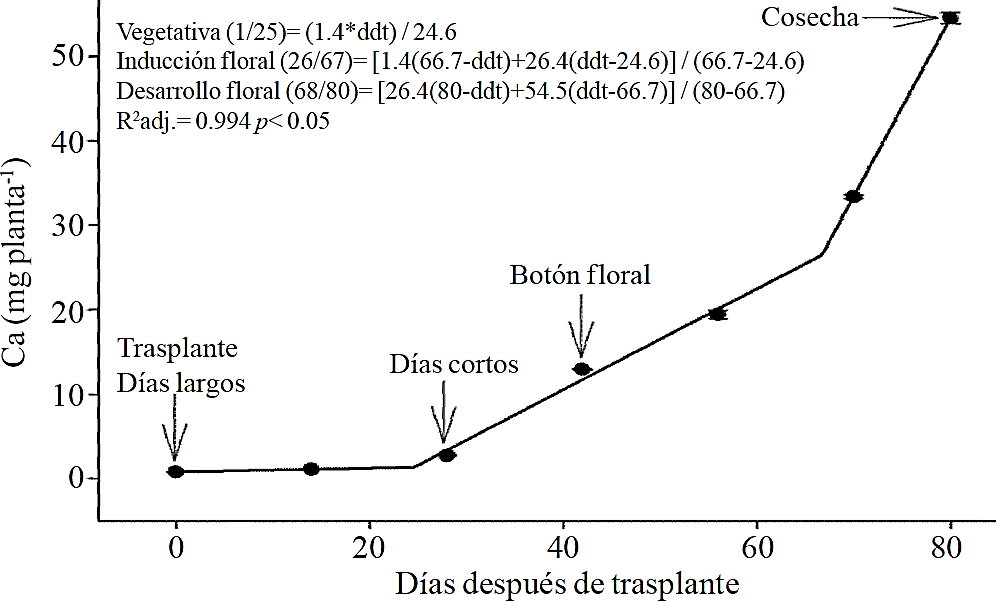
Figura 5 Extracción de calcio (Ca) en crisantemo (Chrysanthemum morifolium Ramat) cv. Indianápolis White. Se presentan los modelos correspondientes a las tres fases fenológicas detectadas y entre paréntesis los días después del trasplante (ddt) que comprenden a la fase respectiva. Las barras indican el error estándar de la media (n=4).
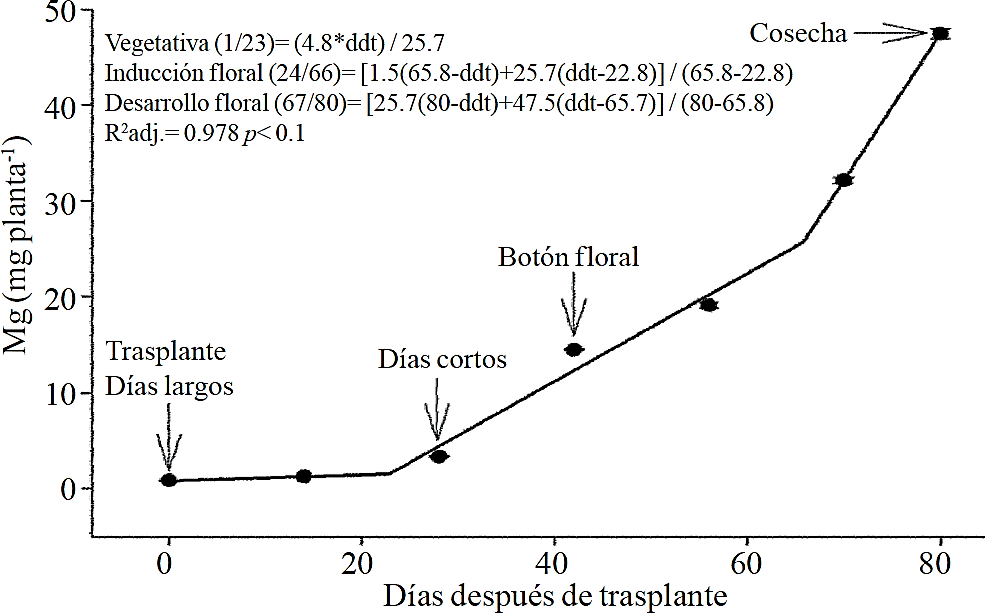
Figura 6 Extracción de magnesio (Mg) en crisantemo (Chrysanthemum morifolium Ramat) cv. Indianápolis White. Se presentan los modelos correspondientes a las tres fases fenológicas detectadas y entre paréntesis los días después del trasplante (ddt) que comprenden a la fase respectiva. Las barras indican el error estándar de la media (n=4).
Extracción relativa de macronutrimentos
La mayor tasa de acumulación de N (Figura 7A) y K (Figura 7B) se registró en los últimos 30 días del ciclo de cultivo, ya que del total absorbido por la planta, 66.1% y 63.6% de todo el N y K, respectivamente, se acumuló durante la fase de desarrollo de la inflorescencia. En el caso del P (Figura 7C), Ca (Figura 7D) y Mg (Figura 7E), la mayor tasa de acumulación se presentó en los últimos 15 días con 56.7%, 54.5% y 48.5%, respectivamente.
Distribución nutrimental
La mayor parte del N absorbido durante el ciclo de crecimiento se acumuló principalmente en los tallos y hojas, seguido por la inflorescencia, mientras que la menor acumulación de este se presentó en la raíz (Figura 8). Este mismo efecto se registra para P, sin embargo, la acumulación de este nutrimento es mayor en la raíz que en la flor (Figura 9). El K (Figura 10) y Ca (Figura 11) se acumularon más en los tallos y hojas, mientras en la raíz y flor se no observa una diferencia en la acumulación de estos nutrimentos; la distribución de Mg (Figura 12) en los diferentes órganos fue similar que la de N.
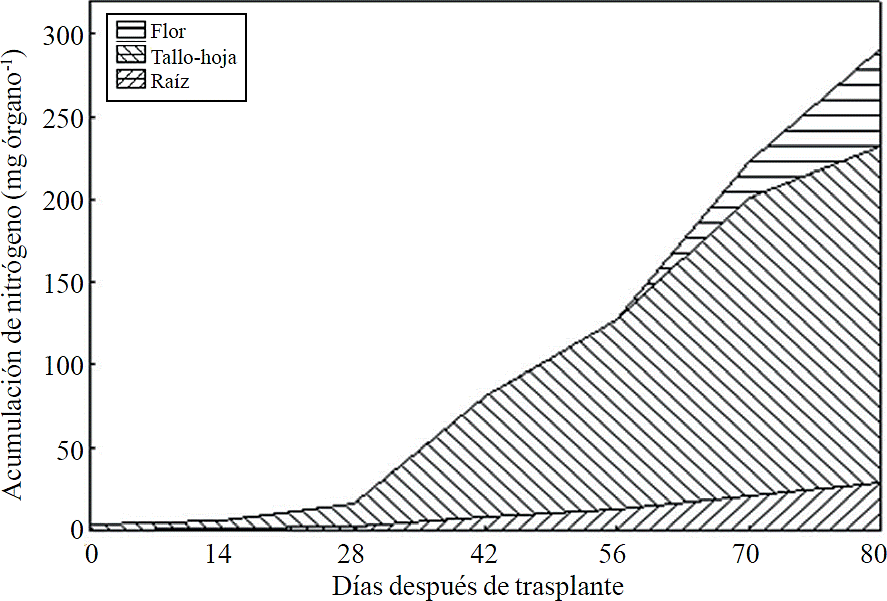
Figura 8 Acumulación de nitrógeno en los órganos de la planta de crisantemo (Chrysanthemum morifolium Ramat) cv. Indianápolis White.
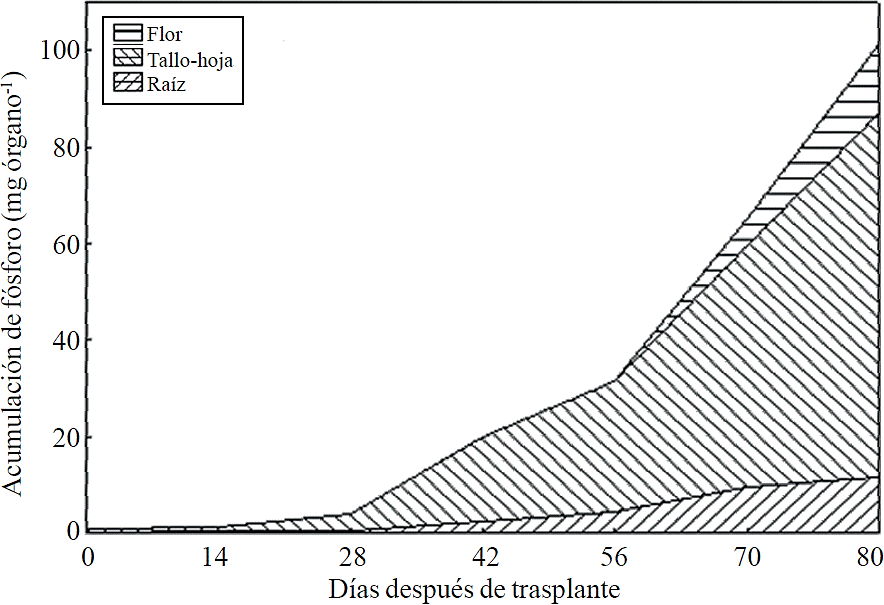
Figura 9 Acumulación y distribución de fósforo en los órganos de la planta de crisantemo (Chrysanthemum morifolium Ramat) cv. Indianápolis White.
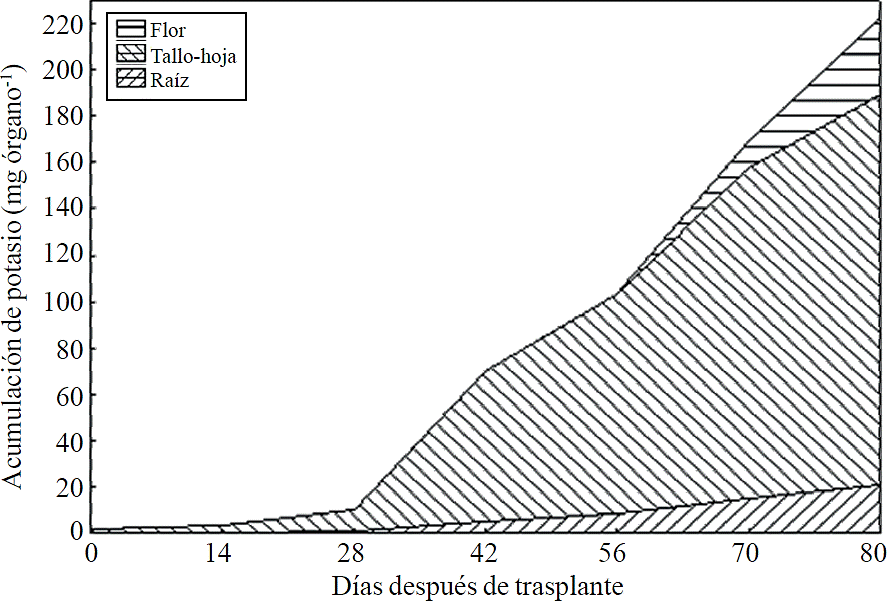
Figura 10 Acumulación y distribución de potasio en los órganos de la planta de crisantemo (Chrysanthemum morifolium Ramat) cv. Indianápolis White.
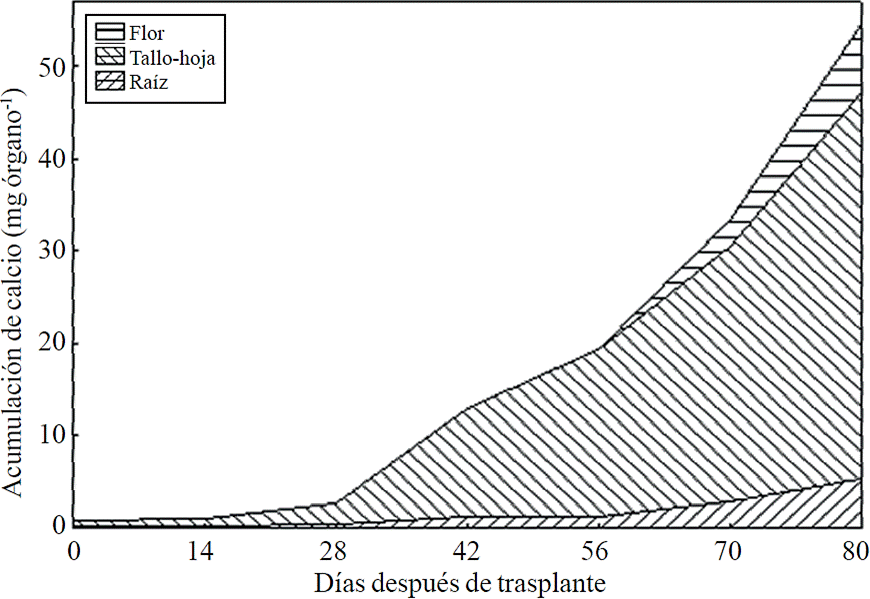
Figura 11 Acumulación y distribución de calcio en los órganos de la planta de crisantemo (Chrysanthemum morifolium Ramat) cv. Indianápolis White.
Programa de fertilización
Basándose en los modelos estimados es posible determinar un programa de fertilización de acuerdo al intervalo de tiempo de interés para el floricultor así como la eficiencia en el uso de los nutrimentos, el cual se determina de acuerdo al nivel tecnológico con que se cuente, y la densidad de población. En el Cuadro 2 por ejemplo, se presenta un programa de fertilización en base semanal considerando una eficiencia determinada. Como se observa, la dosis de fertilización aumenta conforme avanza el crecimiento y desarrollo de las plantas, sin embargo, las primeras tres semanas después de trasplante la cantidad a suministrar se mantiene constante, en tanto que en las semanas 9, 10 y 11 es cuando se aplica la mayor cantidad de N y K, mientras que en las semanas 10, 11 y 12 se debe aplicar la mayor cantidad de P, Ca y Mg (Cuadro 2). Considerando una densidad de población de 69 plantas m-2, la demanda total de nutrimentos en crisantemos fue de 40.25 g m-2 N, 17.44 g m-2 P, 19.29 g m-2 K, 5.01 g m-2 Ca y 4.4 g m-2 Mg.
Discusión
En crisantemo, la acumulación de biomasa aumentó de manera sustancial a partir de la fase de inducción floral justo cuando inicia la aplicación del fotoperiodo corto, lo cual estuvo asociado principalmente con una alta formación de hojas y alargamiento del tallo, así como con la eventual aparición del botón floral, aproximadamente dos semanas más tarde, y su desarrollo. Estos resultados coinciden con lo reportado por Pineda-Pineda et al. (2008) en plantas de frambueso rojo (Rubus idaeus L.) ya que en esta especie se presentó la mayor acumulación de materia seca en etapas de brotación, floración y fructificación. Un posterior aumento en la velocidad de acumulación de biomasa se presentó, de acuerdo a los modelos, 14 días antes de la cosecha, cuando el crisantemo está desarrollando la inflorescencia.
La extracción de N, P, K, Ca y Mg siguió un patrón muy similar a la acumulación de biomasa, coincidiendo con lo reportado por Liu et al. (2009) quienes indican que el aumento en la acumulación de materia seca es linealmente proporcional a la absorción y acumulación de estos nutrimentos en crisantemo. Entre las etapas de inducción y el inicio del crecimiento de la inflorescencia se presentó un aumento muy marcado en la extracción de N y K, la cual estuvo comprendida entre los 26 y 57 ddt para N y los 26 y 62 ddt para K; sin embargo, durante la etapa de crecimiento de la inflorescencia se presentó otro aumento en la tasa de extracción de estos nutrimentos, aunque no tan acentuado como el de otros nutrimentos. La fuerte demanda de N en la etapa de inducción puede deberse a que este nutrimento es el principal constituyente de las proteínas fijadoras del CO2 y la clorofila, requeridos para la formación de nuevas hojas, mientras que el K juega un papel importante en la turgencia y expansión celular (Marschner, 2012).
La extracción de P, Ca y Mg también se elevó entre las etapas de inducción y el inicio del crecimiento de la inflorescencia, las cuales estuvieron comprendidas entre los 26 a 66, 26 a 67 y 24 a 66 ddt, respectivamente. Sin embargo, el aumento en la tasa de extracción en los últimos 15 días antes de la cosecha fue mucho más importante para P, Ca y Mg en comparación con lo observado para N y K. Lo anterior sugiere que la extracción de N y K inicia desde etapas más tempranas, por lo que su aplicación debe iniciar junto con el fotoperiodo largo e ir disminuyendo ligeramente después de los 66 a 67 ddt; la aplicación de P, Ca y Mg también debe iniciar al momento de aplicar el fotoperiodo largo pero debe continuar durante el crecimiento de la inflorescencia.
El aumento de la extracción de P antes de la cosecha puede deberse a su participación en la síntesis de antocianinas y otros pigmentos, pues de acuerdo con Anuradha et al. (1990), el incremento en el suministro de P produce una mayor intensidad del color de la inflorescencia en cempasúchil (Tagetes erecta L.), así como a una mayor tasa de división celular por el rápido crecimiento en un periodo de tiempo corto, pues se ha demostrado que la disminución de P limita el número de divisiones celulares (Chiera et al., 2002). El Mg también forma parte de algunos pigmentos en flores de Salvia patens (Takeda et al., 1994) y aumenta la acumulación de antocianinas en aster (Aster ericoides) (Shaked-Sachray et al., 2002). Por otra parte, el Ca es muy importante durante la fase de crecimiento de la inflorescencia antes de la cosecha ya que se ha reportado que este regula el crecimiento y desarrollo de las células (Tuteja y Mahajan, 2007), así como en la formación de las nuevas paredes celulares en los tejidos meristemáticos en una etapa de división celular muy activa para completar la floración.
El N, P, K, Ca y Mg se acumularon principalmente en la parte aérea (tallo-hoja) en un promedio de 81.5%, en la inflorescencia 9.3%, mientras que en la raíz 9.2%. En frambueso rojo, la hoja fue el órgano que acumuló mayor cantidad de los macronutrimentos, seguido por la raíz, tallo, fruto y flor (Pineda-Pineda et al., 2008).
Generalmente, en los programas de fertilización se indica que el mayor suministro de nutrimentos deben ser aplicados en la fertilización de fondo en tanto que el último suministro debe aplicarse al inicio la floración (ICAMEX, 2003). Sin embargo, en concordancia con nuestros resultados, en la fase vegetativa (1 a 25 ddt) el crisantemo tiene un requerimiento mínimo de nutrimentos, por lo que es innecesario la fertilización de fondo con elevadas cantidades, a excepción del P cuando se aplica en forma de superfosfato.
En la fase inductiva (26 a 66 ddt aproximadamente) aumentan los requerimientos nutrimentales pero la demanda es aún más elevada en la fase de floración (67 a 80 ddt aproximadamente), ya que debe de aplicarse una mayor cantidad de N y K en los últimos 30 días del ciclo del cultivo pues en esta fase se extrae 66% y 64% del total extraído en todo el ciclo de crecimiento. Para el caso de P, Ca y Mg, se requiere una fertilizacion mayor en los ultimos 15 dias pues en esta etapa se extrae 57% del P, 55% del Ca y 49% del Mg. Durante las primeras 3 semanas después de trasplante, la demanda de nutrimentos se mantiene constante, pero al final del ciclo el orden de requerimientos fue: N ˃ K ˃ P ˃ Ca ≈ Mg; sin embargo, al iniciar la fase de inducción los requerimientos fueron: N ≈ K ˃ Mg ≈ P > Ca, mientras que al inicio de la fase de desarrollo floral fue: K ≈ N ˃ P > Ca ≈ Mg y a la mitad de la fase de desarrollo de la inflorescencia fue: N ≈ K ˃ P > Ca > Mg.
En guías técnicas para el cultivo de crisantemo bajo invernadero se sugieren programas de fertilización que incluye la aplicación de 300 kg ha-1 de superfosfato de calco triple antes de preparar el suelo, mientras que dos semanas después del trasplante recomiendan aplicar 180 kg ha-1 de fosfonitrato (ICAMEX, 2003). Seis semanas después del trasplante, se recomienda aplicar 180 kg ha-1 de fosfonitrato más 90 kg ha-1 de superfosfato de calcio triple y 110 kg ha-1 de nitrato de potasio, repitiendo esta formulación cada dos semanas hasta el inicio de la floración (ICAMEX, 2003). Transformando estas unidades, resulta una formulación de N-P-K de 363-134-185+92 Ca; bajo el supuesto de que esta dosis de fertilización se aplica solo en el área útil del terreno (evitando aplicar el fertilizante en los pasillos de las camas de cultivo), en comparación con la formulación obtenida en el presente estudio, se estaría aplicando en exceso 50% de N, 28% de P, 61% de K y 206% de Ca.
Conclusiones
De acuerdo con los modelos estimados, en la etapa de inducción floral se incrementa la producción de biomasa, pero este aumento es más marcado en la fase de floración. Esta misma tendencia se registra para la extracción de N, P, K, Ca y Mg; sin embargo, la mayor tasa de acumulación de N y K fue en los últimos 30 días, pero para P, Ca y Mg se presenta en los últimos 15 días. Considerando una eficiencia de 50%, 40%, 80%, 75% y 75% en el uso del N, P, K, Ca y Mg, respectivamente, y una densidad de población de 69 plantas m-2, la demanda total de nutrimentos en crisantemo es: 40.25 g m-2 de N, 17.44 g m-2 de P, 19.2 g m-2 de K, 5.01 g m-2 de Ca y 4.4 g m-2 de Mg.











 texto en
texto en 




