Introducción
En los últimos años el interés por las hierbas aromáticas se ha incrementado debido a las características aromáticas, terapéuticas y de conservación que tienen estas plantas (Sangwan et al., 2001). Recientemente también han sido identificadas como valiosa fuente de diversos fitoquímicos, mucho de los cuales poseen actividad antioxidante significativa. Una especie de este tipo de plantas es la albahaca (Ocimum basilicum L.), pues su aceite esencial se utiliza ampliamente en los alimentos, perfumería y las industrias médicas. También se considera como una fuente de compuestos de aroma y posee una gama de actividades biológicas, así como propiedades antioxidantes (Lee, 2005).
La albahaca se cultiva en un gran número de países por sus cualidades medicinales, aromáticas, ornamentales y melíferas. Su esencia es utilizada en la industria de perfumería y cosméticos y como aromatizante de vinagre, vegetales en conserva y mostaza (Cheping, 1993). En México, durante los últimos años se ha incrementado el consumo de esta hierba, tanto en la condimentación de comidas como en forma de infusiones con fines terapéuticos.
La albahaca se cultiva en climas con una temperatura entre 7 y 27 °C, con un pH del suelo que oscile desde 4.3 hasta 8.2. La especie se desarrolla mejor en días largos, a pleno sol. Se puede sembrar directamente o trasplantar al campo (Kintzios y Makri, 2007). Dado al gran auge de este cultivo ha implicado que se tenga que enfrentar a diferentes condiciones climáticas y edáficas. Sin embargo, la información acerca de sus requerimientos nutricionales de acuerdo a cada zona de producción como cultivo es escasa. Es bien sabido que la fertilización de una planta influye en su producción, en el caso de la albahaca merece mayor atención debido a que las partes que se usan generalmente son las hojas y tallos. La calidad y producción dependerá entonces de las condiciones del medio donde se produzcan. La fertilización debe tener una relación de NPK de 1-1-1. Para suplir los requerimientos nutricionales de la planta se recomienda una aplicación de 250 - 500 kg ha-1 de nitrógeno (Kintzios y Makri, 2007).
Una alternativa a los fertilizantes convencionales son los abonos orgánicos ya que permiten reemplazar la utilización de recursos no renovables y transformar en sustrato aprovechable desechos orgánicos que eventualmente contaminan el medio ambiente. De este modo se favorece el crecimiento de las plantas a través de un aporte de micro y macronutrientes que de otra forma deberían ser incorporados mediante fertilización química (Atiyeh et al., 2000b). Entre las fuentes orgánicas más utilizadas están el compost, vermicompost y estiércol solarizado en mezclas de sustratos orgánicos (Rippy et al., 2004; Vázquez et al., 2012; Márquez-Hernández et al., 2013; Fortis et al., 2014). El uso de estos abonos orgánicos conlleva una mejora en las propiedades físicas y químicas de los sustratos, lo cual se refleja en un mejor desarrollo del cultivo.
Además, el uso de materiales orgánicos previamente tratados como el estiércol solarizado o vermicompost serían una excelente alternativa para la producción de hortalizas orgánicas con mayor contenido fitoquímico. Bansal y Kapoor (2000), señalan que utilizar en la elaboración de abonos orgánicos el estiércol bovino a través de Eisenia foetida contribuye a mantener una biodiversidad de organismos y se puede encontrar una buena relación carbono/nitrógeno.
La vermicompost es el producto de una serie de transformaciones bioquímicas y microbiológicas que sufre la materia orgánica al pasar a través del tracto digestivo de las lombrices (De la Cruz-Lázaro et al., 2009). Como sustrato permite satisfacer la demanda nutritiva de los cultivos hortícolas en invernadero y reduce significativamente el uso de fertilizantes sintéticos. Además, vermicompost contiene sustancias activas que actúan como reguladores de crecimiento, elevan la capacidad de intercambio catiónico (CIC), tiene alto contenido de ácidos húmicos, y aumenta la capacidad de retención de humedad y la porosidad, lo que facilita la aireación, drenaje del suelo y los medios de crecimiento (Atiyeh et al., 2000a, 2000b; Moreno et al., 2005).
Para obtener información más detallada del uso de sustratos orgánicos y dar utilidad apropiada a la gran cantidad de desechos orgánicos, como el estiércol bovino producido en la Comarca Lagunera, el presente trabajo pretende evaluar la producción y calidad fitoquímica del cultivo de albahaca producida con mezclas de abonos orgánicos bajo condiciones de malla sombra.
Materiales y métodos
El trabajo se realizó en malla sombra en 2014 en el Instituto Tecnológico de Torreón (ITT), localizado en la antigua Carretera Torreón - San Pedro, km. 7.5 del municipio de Torreón, Coahuila.
Los factores de estudio fueron cinco mezclas de sustratos orgánicos elaborados a partir de estiércol solarizado (ES), vermicompost (VER), compost mineralizado (COM), piedra pómez (P), arena (A) y suelo agrícola (S). Las mezclas de los sustratos se formulan en base a volumen (v/v), quedando de la siguiente manera: T1=arena 80% + estiércol solarizado 20%; T2= arena 80% + estiércol solarizado 15% + tierra 5%; T3= arena 80% + vermicompost 20%; T4= arena 80% + compost mineralizado 20%; T5= arena 80% + vermicompost 15% + tierra 5% y T6= arena 80%+piedra pómez 20% (testigo con solución nutritiva Steiner). El tratamiento de fertilización química aplicado fue la solución Steiner (1984), se preparó usando fertilizantes comerciales altamente solubles, se ajustó a un pH de 5.5 con ácido sulfúrico (Capulín-Grande et al., 2011), y la conductividad eléctrica (CE) de 2 dS m1 aforando con agua (Carballo et al., 2009).
Cuadro 1 Composición química de estiércol solarizado y vermicompost.
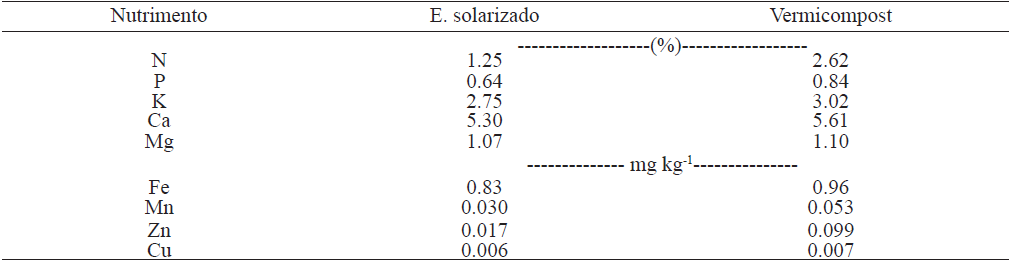
Fuente: análisis realizados en la Cooperativa de la Comarca Lagunera (2014).
El material evaluado fue la albahaca genovesa Variedad "Nuffar". Se sembró en una charola para almacigo usando peat moss. El trasplante a los sustratos se realizó a los 20 días después de la siembra (dds) cuando las plántulas desarrolladas en charola ya presentaban de 2 a 3 hojas verdaderas.
Cuadro 2 Formulación de la solución nutritiva utilizada en el experimento.
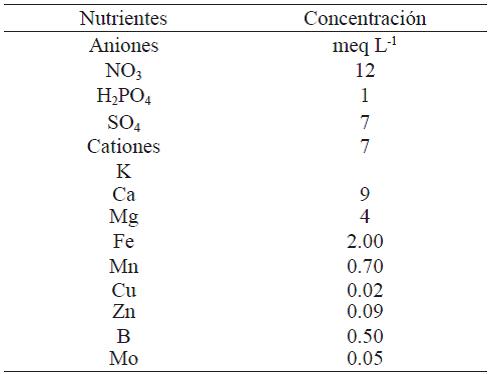
Fuente: elaboración basada en metodología de Steiner (1984).
Las plántulas de albahaca fueron colocadas en bolsas de plástico de polietileno calibre 800 color negro de 10 k de capacidad; fue colocada una plántula/maceta; estás fueron distribuidas en doble hilera con una separación de 30 cm a una densidad de población de 4 plantas m-2. El riego de las plantas fue realizado dos veces al día, con un volumen de 0.500 litros maceta día-1 desde el trasplante hasta la cosecha. En el caso del tratamiento testigo el criterio de riego fue aplicar la solución nutritiva siempre controlando regar con un pH de 5 y una conductividad eléctrica de 2 dS m-1. Fueron empleados productos orgánicos para control de mosquita blanca, como aceite vegetal de Neem y extracto de ajo a razón de 5 cm3 por litro de agua.
Se realizó análisis físico y químico para determinar capacidad de intercambio catiónico (CIC), capacidad de campo (CC), densidad aparente (Da), potencial de hidrógeno (pH), materia orgánica (MO), nitratos (N-NO3 -), carbonato de calcio (CaCO3), conductividad eléctrica (CE), relación de adsorción de sodio (RAS) y porcentaje de sodio intercambiable (PSI), estas determinaciones se realizaron en muestras obtenidas al inicio y al término del estudio.
Variables evaluadas en planta. Rendimiento (kg m-2). En cada fecha de corte (30, 71,139 y 179 días de trasplante) las muestras frescas de hojas y de tallo se pesaron, se secaron y se repitió el pesaje, para obtener así los datos de peso fresco de hoja (PFH), peso seco de hoja (PSH), peso fresco de tallo (PFT), peso seco de tallo (PST) y el índice de área foliar (IAF). Se evaluó la calidad nutracéutica (contenido fenólico y capacidad antioxidante por el ABTS+).
Extracto de obtención. Cinco gramos de la muestra (hojas de albahaca fresca) se mezclaron con 10 ml de metanol en un tubo de plástico tapón de rosca, que se colocaron en un agitador (ATR Inc., EU) durante 6 h (20 rpm) a 5 °C. Los tubos se centrifugaron a 3000 rpm durante 10 min, y el sobrenadante se extrajo para pruebas analíticas.
Contenido de fenólicos totales. El contenido fenólico total se midió usando una modificación del método Folin-Ciocalteau (Esparza- Rivera et al., 2006). Se mezclaron 300 μl de muestra y se le agregaron 1.080 ml de agua destilada y 120 μl de reactivo Folin-Ciocalteau (Sigma-Aldrich, St. Louis MO, EU), agitando en vórtex durante 10 s. Después de 10 min se añadieron 0.9 ml de carbonato de sodio (7.5% p/v) agitándose durante 10 s. La solución fue dejada en reposo a temperatura ambiente por 30 min, y luego fue leída su absorbancia a 765 nm en un espectrofotómetro HACH 4000. El contenido fenólico se calculó mediante una curva patrón usando ácido gálico (Sigma, St. Louis, Missouri, EU) como estándar, y los resultados se reportaron en mg de ácido gálico equivalente por g de muestra base seca (mg equiv AG g-1 BS). Los análisis se realizaron por triplicado.
Capacidad antioxidante equivalente en Trolox (método ABTS+). La capacidad antioxidante equivalente en Trolox se evaluó de acuerdo al método in vitro ABTS + publicado por Esparza Rivera et al. (2006). Se preparó una solución de ABTS+ con 40 mg de ABTS (Aldrich, St. Louis, Missouri, EU) y 1,5 g de dióxido de manganeso (Fermont, Nuevo León, México) en 15 ml de agua destilada. La mezcla fue agitada vigorosamente y se dejó reposar cubierta durante 20 min. Luego, la solución se filtró en papel Whatman 40 (GE Healthcare UK Limited, Little Chalfont, Buckinghamshire, Reino Unido), y la absorbancia se ajustó a 0.700 ± 0.010 a una longitud de onda de 734 nm utilizando solución fosfato buffer 5 mM. Para la determinación de capacidad antioxidante se mezclaron 100 μl de muestra y 1 ml de solución ABTS+, y después de 60 y 90 segundos de reacción se leyó la absorbancia de la muestra a 734 nm. Se preparó una curva estándar con Trolox (Aldrich, St. Louis, Missouri, EU), y los resultados se reportaron como capacidad antioxidante equivalente en (M equivalente en Trolox por g base seca (μM equiv Troloxgm-1 BS). Los análisis se realizaron por triplicado.
El diseño experimental fue completamente al azar; considerando cuatro repeticiones. Los análisis estadísticos de Anova y prueba de comparación de medias se realizaron con el paquete estadístico SAS (Statistical Analysis System) Versión 9.1, utilizando prueba de Tukey al 5% de significancia (p≤ 0.05).
Resultados y discusión
En el análisis estadístico para la variable índice de área foliar (IAF) de Ocimum basilicum L. se muestra una diferencia significativa (p≤ 0.05) entre el testigo (T6) y el resto de los tratamientos, con un promedio de los cuatro cortes de 4981.6 g (Figura 1). El IAF disminuye en todos los tratamientos en el último corte pero se conserva la tendencia. La tasa de crecimiento de las hojas depende de la masiva e irreversible expansión de células jóvenes, las cuales, son producidas por la división celular en los tejidos meristemáticos (Carranza et al., 2009). El IAF, ha sido directamente relacionado con la cantidad de clorofila, es un parámetro importante para estimar la habilidad de la planta para sintetizar materia seca (Warnock et al., 2006).
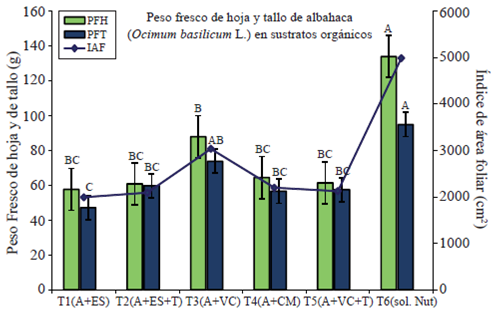
Figura 1 Determinación del índice de área foliar (IAF), peso fresco de hoja (PFH) y el peso fresco de tallo (PFT) en el cultivo de albahaca producido en sustratos orgánicos en malla sombra.
En la determinación del peso fresco de hoja (PFH) se incluye el agua que se encuentra en los tejidos vegetales y sirve como un parámetro de referencia para establecer el desarrollo del follaje y por tanto el desarrollo de la planta. El peso fresco de hoja (PFH), también conocido como biomasa de hoja muestra un incremento en todos los tratamientos a los 71 días de trasplante (fecha del segundo corte) pero disminuye gradualmente en todos los tratamientos con excepción del testigo (solución de Steiner). Se observa diferencia significativa entre los tratamientos siendo el T3 y el T6 (testigo) los de más producción de biomasa (Figura 2).
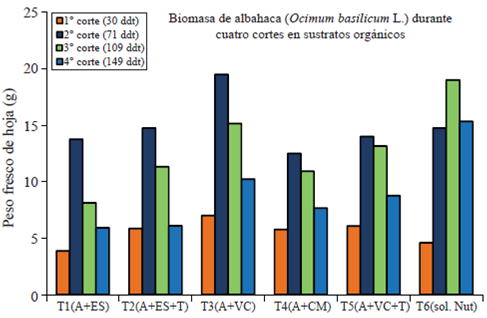
Figura 2 Determinación de biomasa de albahaca (Ocimum basilicum L.) durante cuatro cortes evaluada en sustratos orgánicos.
El T3 y el T6 (testigo) mostraron una diferencia estadísticamente significativa (p≤ 0.05) con respecto al resto de los tratamientos en el peso seco de hoja, con un promedio de 15.62 g y 13.60 g respectivamente; sin embargo, durante el primer y segundo corte el T3 tiene el mayor PSH incluido el tratamiento testigo. Todos los tratamientos disminuyen el PSH al cuarto corte con excepción del testigo que conserva elevado el PSH.
Con respecto al peso fresco de tallo (PFT) en los tratamientos T1 (47.1 g) y T2 (59.7g) que contienen estiércol solarizado, se observa diferencia significativa con respecto al testigo (94.8 g) y al T3 (73.7 g). El PFT oscila entre 47.1 g en el T1 y 94.8 g en el testigo (T6).
En el peso seco de tallo (PST) no se encuentra diferencia significativa entre los tratamientos T1, T2, T4 y T5, el T3 tiene un valor de 12.96 g y el testigo de 13.42 g.
No se encontró diferencia estadísticamente significativa en la Densidad aparente (Da= 1.4 gcm-3), ni en la capacidad de campo (CC= 21.5%), y tampoco en la capacidad de intercambio catiónico (CIC= 8.4 meq/100 g), según González et al. (2009) los materiales orgánicos poseen una elevada CIC (200-400 meq/100 g), lo que supone un depósito de reserva para los nutrientes, sin embargo, la mezcla del sustrato orgánico con arena disminuye la CIC.
En todos los tratamientos el pH es más alcalino al inicio del estudio, esto se explica por el carácter básico de los materiales orgánicos que han sufrido un proceso de degradación, el pH es básico por efecto del desprendimiento de amoniaco proveniente de la descomposición de proteínas (Fortis et al., 2012).
Con respecto a la materia orgánica (M.O.) de los sustratos se encuentra diferencia significativa del T3 con respecto al resto de los tratamientos. La pérdida de M.O. en los sustratos se atribuye a los compuestos orgánicos solubles en agua.
La poca pérdida de MO en el T2 permite considerar al estiércol solarizado mezclado con suelo como un material bioestable (MO inicial= 1.52 y MO final= 1.58). La bioestabilidad es la propiedad de un material orgánico de perder poco peso y conservar sus características físicas y químicas durante varios meses, (Figura 3) especialmente cuando en él crecen plantas (Lemaire, 1997).
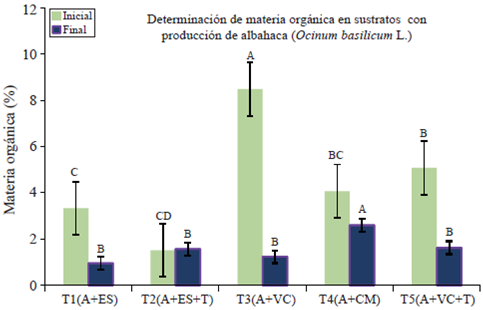
Figura 3 Determinación de materia orgánica (M.O.) en sustratos orgánicos para producción de albahaca en malla sombra.
La conductividad eléctrica (CE) es elevada (media de 4.7 dS m-1) en todos los sustratos (Figura 4); el contenido de sales es mayor (7.9 dS m-1) al inicio del estudio debido a la descomposición de los materiales orgánicos, por lo que asemejan el comportamiento de suelos salinos; es decir, se afecta el rendimiento de la mayoría de los cultivos; sin embargo, disminuye considerablemente a lo largo del estudio, teniendo al final lecturas de CE=2.2 para T1 y CE=2.3 para T3, por lo que se logra el comportamiento de un suelo normal.
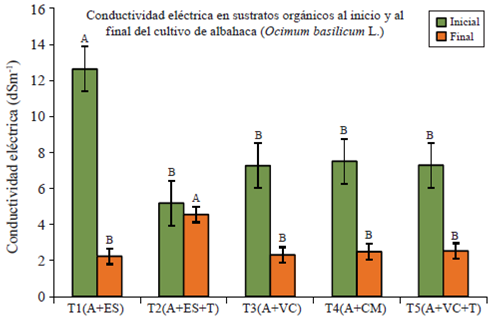
Figura 4 Conductividad eléctrica (inicial y final) en sustratos orgánicos para producción de albahaca en malla sombra.
El porcentaje de sodio intercambiable (PSI) encontrado en los T3 (4.19%) y T5 (4.5%) nos indica que los sustratos orgánicos no tienen problema de sodificación, lo que sucede si el PSI >15%, el valor mayor de PSI se presenta al final del estudio en el T2. (PSI= 5.05%).
Calidad fotoquímica de la albahaca. El contenido fenólico de las hojas de albahaca presentaron diferencias significativas, con valores de 62.42 y 41.55 mg equiv. de ac. gálico 100 g en peso seco para T6 y T2, respectivamente. Para la capacidad antioxidante método ABTS+ se encontró diferencia significativa con valores de 156.43 y 101.86 (μM equiv Trolox /100 g PF) obteniendo el mayor valor el T3 y el menor T2, respectivamente (Cuadro 3).
Cuadro 3 Contenido fenólico total y capacidad antioxidante de albahaca producida con diferentes sustratos orgánicos.
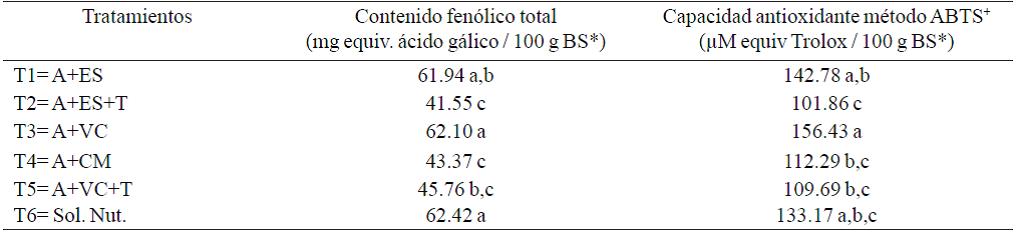
El contenido fenólico total y la capacidad antioxidante de albahaca fueron afectados por el tipo de sustrato usado (Tukey; p≤ 0.05). López-Blanco (2014), reportan valores de fenoles totales entre 4 y 5 mg kg-1 PFr (peso fresco). Kwee y Niemeyer (2011), reportan diferencias en las concentraciones de fenoles totales en diferentes variedades de albahaca, siendo el caso de 'Spice Blue' y 'Gecofure' las que presentaron los niveles más altos, que 'Limón Sweet Dani' y 'Nufar'.
Respecto a capacidad antioxidante, los valores obtenidos en este experimento oscilaron entre 101.86 y 156.43 μM equiv Trolox / 100 g BS, para los tratamientos T1 y T3, respectivamente. Siendo los tratamientos orgánicos los que presentaron la actividad oxidante más alta (Cuadro 3). López-Blancas (2014), obtuvieron valores máximos de 79.9 mg VCEAC/g/PFr, menores a los encontrados en este trabajo.
Cabe señalar, que diversos factores tienen un efecto directo sobre la presencia de antioxidantes individuales, tales como el cultivar, temporada de cosecha, factores genéticos o ambientales (Oboh, 2004).
Por otra parte, Kalt (2005) comenta que los niveles de antioxidantes fenólicos parecen ser más sensibles a las condiciones ambientales pre y poscosecha; aunque el contenido de ciertos compuestos fenólicos puede aumentar durante las condiciones adecuadas de almacenamiento. Por lo cual, la preservación del contenido fenólico tiene un gran impacto en la calidad debido a la contribución de los fenoles no sólo en las reacciones de pardeamiento enzimático, sino también sobre el valor nutricional del producto (Kevers et al., 2007).
La capacidad de albahaca como antioxidante natural se ha atribuido a la alta prevalencia de compuestos fenólicos, siendo el ácido rosmarínico, el principal componente activo que se encuentra en O. basilicum, y se ha comprobado que tiene valor medicinal y su actividad antioxidante es superior a la vitamina E (R-tocoferol) (Jayasinghe et al., 2003). En O. sanctum sus constituyentes interrumpen la cadena de los radicales libres de oxidación mediante la donación de hidrógeno del grupo hidroxilo del fenol, formando de este modo radicales libres estables, evitando así el posterior pardeamiento (Tangkanakul et al., 2009; Tabassum et al., 2009).
La respuesta de las plantas a ambientes estresantes, como en sistemas de producción orgánica, genera mecanismos de defensa incluyendo la producción de antioxidantes (Winter y Davis, 2006). En el presente estudio se utilizaron materiales orgánicos como fuente nutricional, además de que confirieron ciertas propiedades a los sustratos usados debido a los porcentajes aplicados (10 a 20% en base a v/v). Es posible que el aporte nutricional de los tratamientos orgánicos usados en el experimento haya sido un factor estresante para la planta en las etapas iniciales de crecimiento, lo cual resulto en la formación de compuestos fenólicos a un nivel relativamente alto.
En el presente estudio los tratamientos orgánicos que obtuvieron el mayor contenido fenólico y capacidad antioxidante fueron el T3 (A+VC) y T1 (A+ES), los cuales resultaron similares a la calidad fitoquímica del producto obtenido bajo fertilización tradicional (solución Steiner), lo cual indica la factibilidad de los tratamientos orgánicos por su bajo costo en la implementación de la producción orgánica de albahaca. Dada la relativa actividad antioxidante de albahaca, se sugiere que esta puede constituir una fuente de compuestos fenólicos antioxidantes en la dieta (Juliani y Simon, 2002).
Conclusiones
El mejor sustrato orgánicos que reporto mayor IAF (3031.94) y PFH (87.8 g) fue la mezcla de vermicompost con arena (80:20). Las mezclas de sustratos orgánicos presentaron CE>4 y un PSI<15, son alcalinos (pH>7). No presentaron diferencias estadísticamente significativas en densidad aparente (Da= 1.4 gcm-3), capacidad de campo (CC= 21.5%) y en la capacidad de intercambio catiónico (CIC=8.4 meq/100g). La utilización de vermicompost en mezclas de sustratos podría permitir reducir la fertilización química, sin afectar el rendimiento del cultivo de albahaca. La calidad fitoquímica no mostro diferencias significativas entre tratamientos, sin embargo, valores mayores fueron encontrados en los tratamientos orgánicos. Lo cual indica la factibilidad de su uso e implementación en la producción orgánica de albahaca en malla sombra y promover el reciclado del estiércol, a través de proceso de vermicomposteo.











 texto em
texto em 


