Introducción
El maíz (Zea mays L.) es una especie de origen subtropical, sensible a bajas temperaturas, que puede morir con la exposición por cortos períodos de tiempo a temperaturas cercanas a 0 °C (Restrepo et al., 2013). En México, durante los últimos 25 años, cerca de 260 mil hectáreas cultivadas con maíz son afectadas anualmente por bajas temperaturas y las entidades con mayor incidencia de este tipo de siniestros son: Chihuahua, Durango, Sonora, Baja california, Puebla, Oaxaca, Hidalgo, Tlaxcala, Zacatecas y Estado de México (CONAGUA, 2013), principalmente en altitudes superiores a los 2 200 metros. Las siembras tempranas de maíz en estos lugares requieren de genotipos tolerantes a bajas temperaturas durante la germinación y establecimiento de plántulas. La mayoría de los indicadores de tolerancia se han evaluado entre las fases de germinación y tercera hoja ligulada, por lo que es fundamental el vigor inicial para la expresión de variables importantes de clasificación, como: germinación, emergencia, supervivencia y acumulación de materia seca en plántula, evaluadas en temperaturas subóptimas (Aguilera et al., 1999).
La temperatura es el principal factor que determina la adaptación de las especies a diferentes localidades dado que altera diversas funciones vitales. Entre las actividades afectadas están la velocidad de las reacciones químicas; los cambios de estado del agua (hielo- líquido- vapor), cambios en la estructura y actividad de las macro moléculas, las funciones asociadas a la membrana y la actividad enzimática.
Las plantas sometidas a bajas temperaturas crecen lentamente y se originan alteraciones en la composición de ácidos grasos, fluidez de membranas celulares, tasa de actividad metabólica (Nishida y Murata, 1996), pérdida de solutos celulares, reducido transporte a través del plasmalema, disfunción de la respiración, inducción de altos niveles de especies activas de oxígeno (EAO), ácido indolácetico, ácido abscísico y oxidasas, además de modificaciones en la composición de las proteínas de las membranas celulares (Anderson et al., 1994), especialmente en los puntos de crecimiento. Al elevarse el proceso de respiración, en presencia de luz y con la inducción del cierre de estomas, la producción de EAO puede provocar un daño fotoxidativo importante que se acentúa en el epicotilo de plántulas de maíz, lo que incrementa la relación raíz/parte aérea (Richner et al., 1996).
El proceso de germinación y desarrollo de las plántulas, como todos los procesos fisiológicos está afectado por la temperatura. Ésta afecta principalmente la actividad enzimática necesaria para la degradación de las sustancias de reservas. El mayor efecto nocivo de las bajas temperaturas con humedad se da durante la etapa de imbibición-activación enzimática de la semilla (entrada de agua a la semilla). El daño se conoce como "daño por imbibición en frío", la entrada de agua fría a la semilla, produce daño en las membranas celulares, esto último más los exudados del contenido celular, facilita la entrada de hongos (Olivares et al., 1990).
Los principales aspectos que influyen en la sensibilidad de los vegetales al frío son la especie, la edad, la historia previa y las condiciones ambientales. En general, las plántulas muy jóvenes, las semillas en germinación y las flores son las más afectadas por las bajas temperaturas, mientras que las semillas dormantes son las más resistentes. Habitualmente, las raíces son más sensibles que la parte aérea y los tallos más que las yemas (Sung y Amasino, 2004). Las bajas temperaturas son un factor importante que determina la distribución geográfica de las especies y de los cultivos. Los daños a los cultivos son cuantiosos, se estima que un descenso de 1 °C, en la temperatura promedio anual, provocaría una disminución de 40% en la cosecha mundial de arroz. La expectativa de utilizar cultivos sensibles a bajas temperaturas en regiones de clima frío se basa en las posibilidades de manipular las respuestas naturales de las plantas a esas temperaturas. En los últimos años se ha realizado esfuerzos para conocer la forma en que las plantas "sensan" el ambiente y responden a los cambios ambientales por la aplicación potencial de este conocimiento (Thomashow, 2001). En el transcurso de la evolución, las plantas adquirieron numerosos mecanismos de supervivencia relacionados con el frío. Para sobrevivir a este estrés, las plantas usan mecanismos de evasión y de tolerancia. La evasión consiste en minimizar la presencia del estrés; en cambio, la tolerancia es la capacidad de resistir las alteraciones que ocasiona el frío a través de mecanismos internos extremadamente complejos que están controlados por genes "gatillados" por las bajas temperaturas (Olivares et al., 1990). Una de las estrategias de tolerancia es la aclimatación al frío, proceso por el cuál las plantas aumentan su tolerancia al congelamiento después de ser expuestas a bajas temperaturas por un período de tiempo. Las señales ambientales que la desencadenan son días cortos y una disminución paulatina de la temperatura; las plantas se acondicionan a medida que la temperatura baja en otoño, esto requiere energía e involucra cambios en la expresión genética que se traducen en cambios cualitativos en el patrón de proteínas sintetizadas (Sung y Amasino, 2004).
En general, las plantas aclimatadas sobreviven con mayor cantidad de agua congelada en sus tejidos; la resistencia a la congelación depende, tanto de la capacidad de los espacios extracelulares para controlar el volumen del cristal como de la capacidad del protoplasto de resistir a la deshidratación. Se ha observado que la aclimatación al frío está correlacionada con una disminución del potencial osmótico y con una activa fotosíntesis. El grado de aclimatación alcanzado depende de las temperaturas a la que la planta ha estado expuesta (Örvard et al., 2000).
La adaptación de las plantas a bajas temperaturas es una característica genética que no se manifiesta de forma consistente durante todo el ciclo de cultivo y se puede inducir a través del preacondicionamiento con temperaturas menores a 10 °C, fenómeno conocido como "aclimatación o respuesta de preacondiciomaniento a bajas temperaturas" (Thomashow, 2001). La respuesta a bajas temperaturas ha sido estudiada comparando plántulas aclimatadas y no aclimatadas (Prasad, 1997; Madakadze et al., 2003), o entrecruzando genotipos con diferente procedencia y tolerancia en varias fases del desarrollo. Sin embargo, esta tolerancia en líneas endogámicas de maíz aún no se define si es determinante o no el comportamiento de los híbridos que puede formar (Revilla et al., 2000).
En el Valle de Toluca - Atlacomulco, la temperatura media anual de 12 °C, para las siembras tempranas de maíz (15 marzo - 20 abril) se requieren genotipos tolerantes a bajas temperaturas durante la fase inicial del desarrollo; donde la germinación y desarrollo inicial de plántulas permitan un ciclo mayor de cultivo y por lo tanto se reducen los riesgos debidos a la presencia de heladas tempranas al final del ciclo (septiembre), mayor aprovechamiento del periodo de precipitación pluvial y mayor rendimiento. El objetivo del presente trabajo fue clasificar los progenitores y cruzas simples de H-52, H-68, por su tolerancia a bajas temperaturas e identificar las variables involucradas con el vigor inicial de semilla y plántulas en líneas e híbridos de maíz generados por el Campo Experimental Valle de Toluca, perteneciente al Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP).
Materiales y métodos
Se utilizó semilla de las líneas M-43, M-44, M-60 y M-61 las dos primeras forman el híbrido H-52 de ciclo intermedio y las dos últimas al H-68, de ciclo precoz. Con cada par de líneas progenitoras, y en cada caso con las poblaciones F1, F2, RC1 y RC2 (retrocruza hacia la línea hembra y macho, respectivamente) se formó una familia. Además de ambas familias (12 genotipos) se incluyeron, tres testigos adaptados al Valle de Toluca - Atlacomulco (H-52, VS-46 y criollo), H-516 formado para condiciones de trópico seco y el Sintético-1 adaptado a condiciones tipo Bajío; teniendo en total 17 genotipos. La semilla se produjo en el ciclo agrícola primavera - verano 2005 en Metepec, Estado de México. Los genotipos desarrollados para el Valle de Toluca -Atlacomulco, fueron descritos y evaluados por (María et al., 2003).
Se realizaron pruebas en laboratorio e invernadero, en instalaciones de la Universidad Autónoma Agraria Antonio Narro (UAAAN). En laboratorio se evaluó la exposición de la semilla de los genotipos a temperaturas de: 4, 8 y 12 °C además de haber realizado la prueba de germinación a 25 °C. Para esto 100 semillas de cada genotipo fueron colocadas entre toallas de papel anchor húmedo (cuatro repeticiones de 25) y se enrollaron en forma de taco. En seguida se colocaron en cámaras calibradas a las temperaturas señaladas por un período de siete días. Posteriormente las semillas (tacos) se colocaron en una germinadora a 25 °C en ausencia de luz por seis días. Como testigo, las semillas fueron evaluadas en prueba de germinación estándar (ISTA, 2004), en cuatro repeticiones de 25 semillas. La evaluación se realizó siguiendo los criterios de la (ISTA, 2004), excepto que los conteos fueron al cuarto y sexto día. En este último además se midieron el peso seco de plúmula y radícula. El diseño experimental fue completamente al azar, con arreglo factorial 17 x 4. El modelo lineal utilizado fue: γij= μ + αi + τj + ατij + εijk.
En invernadero, se estableció un experimento para evaluar la velocidad de emergencia bajo condiciones de riego, utilizando como sustrato una mezcla de peat moss, perlita y vermiculita en una proporción 4:1:1 (v/v). La siembra se realizó en almacigo a una profundidad de 7 cm. El diseño experimental fue completamente al azar con cuatro repeticiones, donde la unidad experimental fue de 25 semillas. Los datos se tomaron a partir del cuarto día después de la siembra, a las 11:00 h en cada caso, y se concluyó a los 13 días. El índice de velocidad de emergencia se estimó de acuerdo a (Maguire, 1962).
La semilla empleada en ambos experimentos fue la que pasó por la criba de perforaciones oblongas de 5 x 19 mm y redonda de 7 mm, pero que fue retenida en la criba de peroraciones redondas de 6.35 mm.
Análisis estadístico. Se hicieron análisis de varianza para el arreglo factorial; de componentes principales, para explorar la variación de los genotipos y clasificar la tolerancia de los genotipos (Cuadro 1); y análisis de regresión entre los genotipos y temperaturas. Los análisis estadísticos se hicieron con los procedimientos PROC GLM, PROC PRINCOMP y PROC REG (SAS, 2010), considerando un modelo de efectos fijos.
Resultados y discusión
En el análisis de componentes principales (Figura 1) se determinó que los dos primeros componentes justifican el 75.2 % de la varianza, y permite clasificar a los genotipos por su tolerancia a bajas temperaturas. En la distribución de los genotipos (Figura 1A), se observa que H-516, M-44 y M-61 (genotipos p, b y h, respectivamente) forman el grupo de materiales susceptibles a bajas temperaturas. La susceptibilidad del H-516 se debe principalmente a que no fue seleccionado para tolerar temperaturas subóptimas, lo cual coincide con lo reportado por (Madakadze et al., 2003), respecto a que la presión de selección ecofisiológica es determinante para la tolerancia a bajas temperaturas. Los grupos de los materiales tolerantes y susceptibles se pueden incluso separar en dos subgrupos bien definidos, situado uno de ellos en los cuadrantes III y IV (Figura 1B) y que agrupa a las temperaturas de 4 y 25 °C.
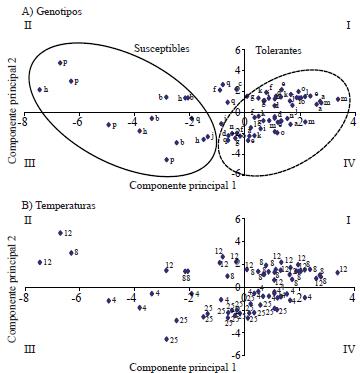
Figura 1 Dispersión de los genotipos (A) y temperaturas (B) con base en dos componentes principales (75.2% de la varianza). CP1= [germinación 4° y 6° día (+), peso seco de radícula (-), semillas muertas (-) y plántulas anormales al 6° día (-)]; CP2= [semillas muertas al 4° día (+), peso seco de plúmula (+), longitud de plúmula (+) y radícula (+)]. Genótipos: a= M-43; b= M-44; c= a x b, d= cF2; e= c x a; f= c x b; g= M-60; h= M-61; i= g x h; j= iF2; k= i x g; l= i x h; m= H-52; n= VS-46; o= Criollo; p= H-516; y q= Sintético-1.
En tanto, las temperaturas correspondientes a los tratamientos de 8 y 12 °C se ubican en los cuadrantes I y II. Es decir, que las temperaturas de 12 y 8 °C presentan condiciones similares de estrés, por lo que si se desea realizar una prueba rápida, habría que elegir entre ambas posibilidades. La diferencia ente los dos grupos, es la alta frecuencia de semillas muertas, así como el mayor peso seco de plúmula, que se obtuvieron en los tratamientos de 8 y 12 °C.
Los materiales se clasificaron por su tolerancia a bajas temperaturas (primer componente principal), ubicando a los materiales de susceptibles a tolerantes, de izquierda a derecha en el eje de las abscisas (Figura 1A), quedando el testigo susceptible tropical (H-516, p), las líneas progenitoras macho (b y h), el testigo susceptible del Bajío (Sintético -1, q), las líneas progenitoras hembra (a y g), las retrocruzas (e, f, k y l) , las poblaciones F2 (d y j) y finalmente los híbridos (c, i, n, o y m ) y el testigo criollo; clasificados estos últimos como los más tolerantes a bajas temperaturas.
El análisis factorial de los experimentos desarrollados de laboratorio, detectó diferencias estadísticas (p≤ 0.01) entre los ambientes de evaluación, los materiales genéticos y la interacción genotipo x ambiente; es decir, las temperaturas de evaluación (25, 12, 8 y 4 °C) fueron lo suficientemente contrastantes como para permitir que los genotipos manifestaran un comportamiento diferencial en cada una de las variables evaluadas.
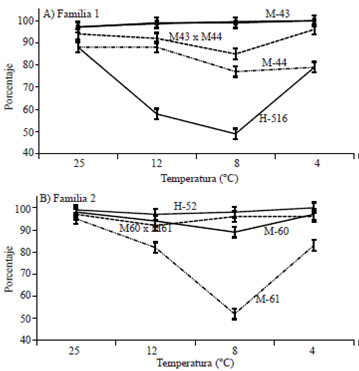
En germinación se obtuvo una respuesta contrastante entre los genotipos seleccionados en Metepec y los testigos susceptibles del trópico y bajío (Figura 2A); la línea hembra M-43 presentó una respuesta similar en las cuatro temperaturas, superando estadísticamente (Tukey, p≤ 0.05) a todas las líneas, e incluso a la cruza simple M-43 x M-44. Ésta última cruza simple muestra una recuperación de la germinación a los 4 °C, que se podría atribuir a su mayor capacidad de inducir la respuesta de tolerancia, asociada probablemente con el comportamiento de su línea hembra (M-43), la cual mostró una tolerancia constitutiva a las bajas temperaturas. En contraste, H-516 mostró inicialmente una reducción de su germinación; recuperándose posteriormente, lo que puede estar asociado con una inducción de la tolerancia promovida por el tratamiento de 4 °C; sin embargo, no superó a la línea M-44, clasificada también como susceptible.
En el caso de los híbridos (H-516 y M43 x M44) existe una temperatura entre los 8 y 4 °C, que desencadena una respuesta de sobrevivencia a las bajas temperaturas, lo que coincide con lo reportado por Castro et al. (2008) quienes señalaron que la aclimatación a bajas temperaturas se logra con temperaturas menores a 10 °C. Este mismo fenómeno no es tan evidente con las líneas en cuestión, las cuales tienen una respuesta más uniforme, probablemente asociada al proceso de selección genético desarrollado en el Valle de Toluca, donde las bajas temperaturas son comunes.
En contraste en la segunda familia, formada con las líneas progenitoras de la cruza M60 x M61 (Figura 2B), la línea hembra M-60, fue superada por la cruza simple y por el testigo H-52, en la prueba de 8 °C, por lo que el vigor híbrido permitió una mayor respuesta que incluso el mejor progenitor. Como en el caso anterior, también se observa que la línea macho (M61) fue el progenitor más susceptible a las bajas temperaturas, pues presentó los menores porcentajes de germinación en todas las pruebas con bajas temperaturas.
En el análisis de la respuesta a los tratamientos de temperatura subóptima de las dos familias, conformadas por sus híbridos y líneas progenitoras (Figura 2) destaca, en ambos casos, la expresión de la respuesta asociada al progenitor hembra, quien confiere la tolerancia a bajas temperaturas en la semilla de maíz, lo que coincide con (Revilla et al., 2000 y Cano et al., 2000) quienes asocian esta respuesta con la doble contribución materna determinada durante el proceso de la fecundación y sus implicaciones en la calidad y cantidad del endospermo de la semilla.
En esta figura nuevamente se observa que la prueba fría a 8 °C permitió una mejor clasificación de los genotipos por su tolerancia a bajas temperaturas. Además de considerar que las diferencias en tolerancia a temperaturas subóptimas entre las líneas hembras M-43 y M-60, podrían asociarse con el nivel de precocidad de ambas, ya que M-43 es de ciclo intermedio y se seleccionó básicamente en siembras tempranas y M-60 es de ciclo precoz, por lo que fue seleccionada en posteriores fechas de siembra.
Las bajas temperaturas provocaron la reducción de la germinación (95 a 85%), conforme se redujo de 25 a 8 °C; lo que coincide con lo reportado por (Revilla et al., 2000), quienes asocian las bajas temperaturas con daño oxidativo a las membranas y muerte celular. La germinación se recuperó cuando los materiales genéticos fueron sometidos a 4 °C, lo cual (Pastori et al., 2000), explican a través de la acumulación de compuestos antioxidantes. Por otro lado, al comparar los días de evaluación de la germinación (4° y 6° día), no hubo diferencias estadísticas con la prueba fría a 12 y 8 °C; por lo que la prueba fría con 8 °C podría ser una forma rápida para detectar genotipos tolerantes a bajas temperaturas.
El número de semillas muertas fue la variable que principalmente se incrementó con la reducción de la temperatura hasta a 8 °C (Figura 3), pero a 4 °C se redujo significativamente en los materiales susceptibles. En esta variable no se detectaron diferencias estadísticas importantes al ser evaluada a los 4 ó 6 días de desarrollo en la cámara de germinación, a ninguna de las temperaturas de evaluación. Lo que permitiría evaluarla a uno u otro plazo.
En cuanto a las variables, peso seco de plúmula y radícula el mayor efecto por bajas temperaturas se presentó en la reducción del peso seco de plúmula, especialmente cuando la temperatura fue menor a 8 °C (Figura 4). Al respecto, (Fryer et al., 1998; Leipner et al., 1999) reportan una reducida tasa de actividad metabólica en la planta por temperaturas menores a la temperatura base. En ambas variables los tratamientos de 12 y 8 °C fueron similares, superando estadísticamente (Tukey, p≤ 0.01) al tratamiento de 4 °C. El peso seco de radícula fue menos afectado que el de plúmula, en este sentido (Martin y Dodd, 2011) reportan que esta es la causa principal de que se incremente la relación raíz - parte aérea en las plantas desarrolladas a bajas temperaturas.
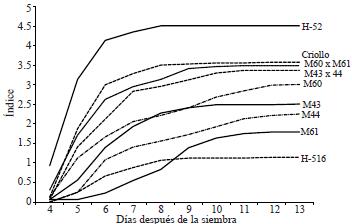
El índice de velocidad de emergencia (Figura 5) de los genotipos clasificados como tolerantes a bajas temperaturas M60 x M61 y M43 x M44, superó a sus respectivas líneas progenitoras hembra debido probablemente al vigor híbrido, con índices entre 2.5 y 3.0. Los materiales susceptibles H-516, M44 y M61 presentaron los menores índices (valores entre 1.1 y 2.3). La respuesta de los testigos adaptados a bajas temperaturas fue similar al presentarse el H-52 como el testigo de mayor vigor, seguido del VS-46 y del criollo de valles altos (índices superiores a 3.5), los cuales son materiales comerciales que superaron en vigor y adaptación a las cruzas simples y sus progenitores. Este comportamiento pudiera asociarse con la expresión de la respuesta bajo condiciones de campo, especialmente en las fases tempranas del establecimiento y desarrollo del cultivo, como lo señalan (Tiryaki y Andrews, 2001).
Conclusiones
Los genotipos con mayor tolerancia a bajas temperaturas fueron las cruzas simples (M-43 x M44 y M-60 x M-61) y líneas hembra M-43, y M-60, además de los testigos de valles altos: H-52, criollo local y VS-22. Las líneas macho M-44 y M-61 presentaron una tolerancia de intermedia a baja y en un tercer grupo se ubicaron los testigos: Sintético-1 y H-516, que son para condiciones tipo Bajío y Trópico.
Los genotipos tolerantes a bajas temperaturas presentan mayor germinación, peso seco de plúmula, peso seco de radícula e índice de velocidad de emergencia de plántulas.
El comportamiento superior de los materiales tolerantes fue similar a través de las diferentes temperaturas, probablemente debida a una respuesta constitutiva de los genes de tolerancia a bajas temperaturas.
La respuesta de tolerancia a bajas temperaturas se indujo en los genotipos susceptibles al reducir la temperatura de la prueba fría de 8 a 4 °C.
La prueba fría con 8 °C permite clasificar materiales tolerantes en una prueba rápida de evaluación en laboratorio que requiere poco tiempo.











 texto em
texto em