Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de ciencias agrícolas
Print version ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.6 n.7 Texcoco Sep./Nov. 2015
Ensayos
Ácido benzoico: biosíntesis, modificación y función en plantas*
Benzoic acid: biosynthesis, modification and function in plants
Lidia Valdez Sepúlveda1, Susana González-Morales1 y Adalberto Benavides Mendoza1§
1 Universidad Autónoma Agraria Antonio Narro-Departamento de Horticultura. Buenavista, Saltillo, Coahuila, México. C. P. 25315. Tel: 01 844 411 0215. (lgvsk8@hotmail.com; qfb_sgm@hotmail.com). §Autor para correspondencia: abenmen@gmail.com.
* Recibido: enero de 2015
Aceptado: abril de 2015
Resumen
El ácido benzoico, se encuentra de forma natural en las plantas desempeñando importantes papeles en el metabolismo. A pesar de la importancia del BA como un precursor para una amplia gama de metabolitos primarios y secundarios, la biosíntesis y sus derivaciones metabólicas en plantas no han sido totalmente dilucidadas. El objetivo de este trabajo, es presentar los avances reportados en la literatura científica acerca de este compuesto, su biosíntesis, modificación y función en plantas. Es probable que existan varias vías biosintéticas del BA en una especie determinada. La evidencia creciente sugiere que el BA en las plantas es sintetizado directamente del shiquimato/corismato y de la fenilalanina; sin embargo, se han identificado pocos genes en estas vías.Aplicado en plantas superiores, el BAmodifica el crecimiento, la tolerancia al estrés y la anatomía y morfología de especies comestibles y ornamentales.
Palabras clave: corismato, fenilpropanoide, shiquimato, vía biosintética.
Abstract
Benzoic acid is found naturally in plants playing an important role in metabolism. Despite the importance of BA as a precursor for a wide range of primary and secondary metabolites, the biosynthesis and its metabolic derivatives in plants have not been fully elucidated. The aim of this paper is to present the progress reported in scientific literature on this compound, its biosynthesis, modification and function in plants. It is likely that there are several biosynthetic pathways of BA in a given species. Growing evidence suggests that BA in plants is synthesized directly from the shikimate/chorismate and phenylalanine; however, few genes have been identified in these pathways. Applied in higher plants, BAmodifies growth, stress tolerance, anatomy and morphology of edible and ornamental species.
Keywords: biosynthetic pathway, chorismate, phenylpropanoid, shikimate.
Introducción
El ácido benzoico (BA), es un ácido carboxílico aromático que se encuentra de forma natural en las plantas, desempeñando importantes papeles en cuanto al crecimiento. Su biosíntesis se ubica en la vía de los fenilpropanoides y es precursor para una amplia gama de metabolitos primarios y secundarios (Qualley et al, 2012). Además, participa en las señales internas que regulan la respuesta de defensa de las plantas frente a diversas condiciones bióticas y abióticas (Williams etal., 2003; Senaratna etal., 2003). Sus sales y ésteres son conocidos como benzoatos.
El BA y sus derivados son elementos estructurales en un gran número de metabolitos y productos naturales realizando funciones críticas en las plantas, como reguladores de crecimiento, compuestos defensivos y atrayentes de polinizadores (Qualley et al, 2012). Por otra parte, en los procesos industriales se utilizan ampliamente como conservantes y potenciadores del sabor, analgésicos, antisépticos y quimioterapéuticos (Quan et al, 1996; Chipley, 2005). A pesar de su sencilla estructura y amplia distribución, la comprensión de las vías bioquímicas que conducen a la formación del BA sigue siendo incompleta. Por lo tanto, el conocimiento de la biosíntesis y modificación del BA en las plantas, es un paso crucial para entender la regulación y la función de esta importante molécula. Por lo que un primer objetivo de este trabajo, es presentar los avances reportados en la literatura científica acerca de este compuesto, su biosíntesis, modificación y función. Asimismo, un segundo objetivo es comparar los trabajos realizados utilizando este compuesto con lo reportado para el ácido salicílico (SA), un compuesto análogo encontrado en la vía de los fenilpropanoides.
Ácido benzoico
El BA (C6H5COOH) es un ácido carboxílico aromático que tiene un grupo carboxilo unido a un anillo fenólico (Figura 1). Fue descubierto en el siglo XVI en la goma de benjuí (resina extraída de la corteza de varias especies de árboles del género Styrax) (Neumüller, 1988). Se produce naturalmente como lo hacen sus ésteres en muchas especies animales y vegetales, reportándose en estos últimos en frutas y bayas (Zuo et al, 2002).

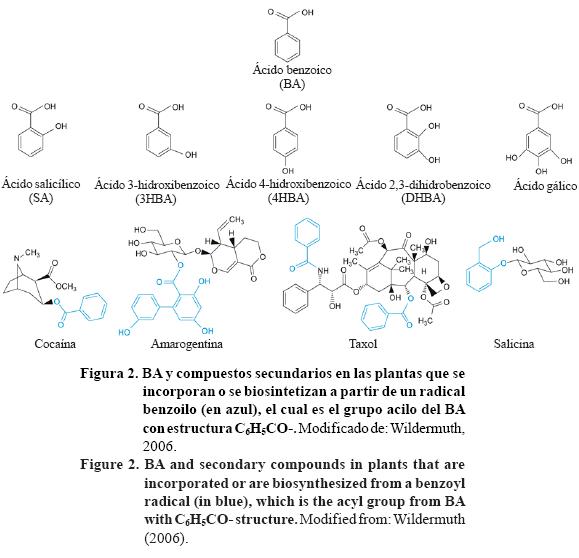
En las plantas, el BA parece desempeñar importantes papeles en el metabolismo al regular el crecimiento y la modificación química de la rizosfera formando parte de los exudados radicales (Elliott and Cheng, 1987) que aumentan la capacidad de captura de minerales (Maffei et al, 1999); cuando se acumula en gran concentración en el suelo el BA funciona como un aleloquímico (Kaur et al., 2005). Es igualmente un mediador de respuestas al estrés (Wildermuth, 2006), al incorporarse en numerosos metabolitos secundarios asociados con interacciones planta-herbívoro o planta-patógeno tales como: ésteres de glucosinolatos en Arabidopsis thaliana (Graser et al, 2001); salicina, principal glucósido fenólico en sauce (Salix) (Ruuhola and Julkunen-Titto, 2003); xantonas en Hypericum androsaemum (Abd El-Mawla and Beerhues, 2002); cocaína en Erythroxylum coca (Bjorklund and Leete, 1992) y taxol en Taxus cuspidate (Walker and Croteau, 2000). Muchos de estos compuestos también son importantes agentes farmacológicos (Figura 2).
Vía biosintética del BA en plantas
A pesar de la importancia de los benzoatos en las plantas el mecanismo para su biosíntesis no ha sido totalmente dilucidado (Qualley et al, 2012). Es probable que existan varias vías biosintéticas del BA en una especie determinada (Wildermuth, 2006), proporcionando un control espacial y temporal sobre la síntesis del mismo, así como sobre la disponibilidad de intermediarios para la fabricación de derivados de los benzoatos.
La evidencia actual sugiere que el BA en las plantas, es sintetizado a partir de la fenilalanina (Phe) o directamente a partir de un producto derivado del shiquimato, posiblemente el isocorismato (Wildermuth, 2006), en el que el carbono carbonilo del shiquimato se retiene en el BA. Sin embargo, se han identificado pocos genes en estas vías metabólicas (Klempien et al, 2012). Los primeros estudios apoyaron la síntesis del BAa partir de la Phe, por lo tanto, la mayoría del trabajo se ha centrado en la vía de derivados de esta. Solo algunos de los genes de plantas que codifican las enzimas de estas vías se han clonado; por ello, queda mucho por hacer para validar, definir y refinar en cuanto a las vías biosínteticas del BA (Wildermuth, 2006).
Biosíntesis del BA a partir de la vía shiquimato/corismato
El término vía directa shiquimato/corismato se utiliza para considerar la posibilidad de que otros intermediarios (por ejemplo shiquimato-3-fosfato o antranilato), además de isocorismato, puedan ser utilizados para la biosíntesis del BA (Wildermuth, 2006) (Figura 3). La interconversión de los productos del BA (por ejemplo SA, ácido 2,3 dihidroxibenzoico (DHBA), ácido 3-hidroxibenzoico (3HBA) y BA) podría ocurrir entonces mediante BA libre o activado, por ejemplo, a través de los conjugado benzoil-Coenzima A (CoA) o BA -glucosa.
En A. thaliana, la mayor parte del SA que se produce en respuesta a agentes patógenos se sintetiza a partir de isocorismato y no de la Phe, como se confirma por la falta de acumulación de SA inducido en mutantes de la isocorismato sintasa (ICS) (Wildermuth et al., 2001). Este estudio proporcionó asimismo la primera evidencia genética de una vía directa shiquimato/corismato para la síntesis de BA en las plantas. Estudios adicionales que apoyan esta hipótesis, pero que no proporcionan una evidencia directa de esta vía, incluyen: primero, la correlación de acumulación de DHBA con actividad ICS en cultivos celulares de Catharanthus roseus (Van Tegelen et al, 1999) y segundo, la incorporación de 3HBA radiomarcado en el radical benzoilo de xantonas junto con la falta de inducción de fenilalanina amonio liasa (PAL) en células de Centaurium erythraea (Abd El-Mawla et al, 2001).
En las plantas, la evidencia de la vía shiquimato/corismato en la síntesis del BA incluye dos estudios de resonancia magnética nuclear (NMR) en la que el 13C marcado del carbono carbonilo, es compatible directamente con la síntesis de shiquimato/corismato para el ácido gálico (ácido 3,4,5-trihidroxibenzoico) en Rhus typina (Werner et al, 1997) y 3HBA que se incorpora en la amarogencina en Swertia chirata (Wang et al., 2001). Los estudios de NMR utilizando sustratos marcados tales como glucosa y shiquimato, proporcionan un enfoque imparcial y fisiológicamente relevante para la elucidación de la biosíntesis del BA en diferentes condiciones.
Recientemente se encontró que de forma similar a las bacterias, las plantas también producen SA (Wildermuth et al, 2001) y DHBA (Muljono et al, 2002) a partir de isocorismato, sin embargo no ha habido ninguna evidencia que apoye la producción de exudados radicales que incorporen SA o DHBA (Strawn et al, 2007). Aunque la síntesis y regulación de las vías bacterianas de isocorismato han sido investigadas, hay un conocimiento limitado acerca la ICS y otras enzimas involucradas en estas vías metabólicas, sus productos y sus funciones en las plantas (Strawn et al, 2007). En las bacterias, las enzimas ICS se han asociado con la síntesis de sideróforos para el transporte de Fe+3 o menaquinonas que funcionan como aceptores de electrones. Los pasos iniciales para la producción de sideróforos bacterianos de isocorismato implican la síntesis de SA o DHBA; estos compuestos se incorporan en sideróforos, tales como piochelina en Pseudomonas aeruginosa (Serino et al, 1995) y enterobactina en E. coli (Gehring et al, 1997). En P. aeruginosa, la ICS e isocorismato piruvato liasa son necesarias para la síntesis de SA a partir de corismato (Gaille et al., 2002).
Por otra parte, se cree que las plantas son capaces de producir compuestos esenciales derivados de isocorismato, similares a la menaquinona bacteriana a través de orto benzoato de succinil y 1,4-dihidroxi-2 naftoato de metilo (Dosselaere and Vanderleyden, 2001).
Biosíntesis del BA a partir de la Phe
En las plantas, la biosíntesis inicia con la desaminación de la L-fenilalanina a ácido trans-cinámico (CA) por la acción de la enzima PAL (Coquoz et al, 1998). Se cree que el BA es sintetizado a partir de Phe, através de la reducción de la cadena lateral de propilo por dos carbonos (Orlova et al, 2006). Se ha reportado, que esta reducción puede ocurrir mediante una vía β-oxidativa (Hertweck et al., 2001) o una vía no β-oxidativa con benzoil-CoA y benzaldehído como precursores para BA, respectivamente. Mientras que la vía β-oxidativa necesita la activación de CoA, la vía no β-oxidativa se produce tanto dependiente de CoA (Boatright et al., 2004), como independiente de la misma (Long et al, 2009; Mustafa et al, 2009) (Figura 3). La ruta β-oxidativa propuesta, es análoga a la que funciona en el catabolismo de ácidos grasos y de ciertos aminoácidos de cadena ramificada en los peroxisomas de plantas (Hertweck et al, 2001; Wildermuth, 2006).
La formación de benzoato de feniletilo y benzoato de bencilo se produce en el citosol (Boatright et al., 2004), pero requiere BA-CoA producido a través de la vía β-oxidativa en los peroxisomas (Van Moerkercke et al., 2009; Klempien et al, 2012). El benzoato de bencilo se utiliza como un acaricida y escabicida, en los hospitales veterinarios (Jamaluddin, 2005).
Los experimentos con precursores marcados con isótopos estables en hojas de tabaco sugieren que el BA, se produce a partir de Phe derivada de CA a través de la vía β-oxidativa, produciendo benzoil-CoA, que puede ser hidrolizado por una tioesterasa a BA libre (Ribnicky et al, 1998). Por el contrario, en cultivos celulares en Hypericum androsaemum (Abd El-Mawla and Beerhues, 2002) los experimentos con precursores marcados, junto a la caracterización inicial de la enzima, apoyaron la existencia de la conversión no oxidativa de CA a benzaldehído con la posterior formación de BA, que se puede convertir adicionalmente a benzoil-CoA (Beuerle and Pichersky, 2002).
El mayor progreso en la elucidación de la vía β-oxidativa se ha realizado utilizando Petunia hybrida, cuyas flores son ricas en compuestos bencenoides y fenilpropanoides (Qualley et al., 2012). Las actividades enzimáticas de las otras dos vías, es decir, la no oxidativa y la combinación de ambas, hasta el momento no han sido completamente dilucidadas, si bien muchos experimentos de marcado con precursores, han sugerido su presencia en plantas (Orlova et al., 2006).
Modificaciones del BA en plantas
Las modificaciones (metilación, glicosilación, conjugación de aminoácidos y activación con CoA) en las moléculas del BA influyen en su volatilidad, permeabilidad en los diferentes compartimientos celulares, solubilidad y actividad, siendo también cruciales para su transporte y función. En los últimos años se ha avanzado en la identificación de los genes y enzimas que están implicadas en la modificación de la molécula del BA en las plantas. Algunas de estas enzimas también son capaces de utilizar SA u otras moléculas estructuralmente relacionadas (Wildermuth, 2006).
Metilación
La BA metiltransferasa carboxilo cataliza la transferencia del grupo metilo del S- adenosil-L-metionina (SAM) al carboxilo libre del BA, formando ésteres metílicos volátiles como benzoato de metilo y salicilato de metilo. Estos ésteres metílicos son componentes importantes de muchos aromas florales de las plantas. Las primeras BA metiltransferasas carboxilo fueron identificadas y aisladas a partir de tejido floral (Effmert et al, 2005). Se ha indicado que las BA metiltransferasas carboxilo tienen un papel en la defensa contra el estrés biótico y abiótico (Chen et al., 2003).
Glicosilación
Las UDP-glucosiltransferasas (UGT's) catalizan la transferencia de glucosa al carboxilo del BA, formando un éster de glucosa de benzoilo (BAE) en tabaco (Lee and Raskin, 1999) y en A. thaliana (Lim et al, 2002) in vitro. Estas enzimas también pueden glicosilar moléculas estructuralmente relacionadas, como SA, formando éster de glucosa salicílico (SAE) o 2-O-β-D glucósido (SAG) (Lim et al, 2002). La glicosilación altera la hidrofilicidad, estabilidad y localización subcelular de la molécula receptora, modificando por lo tanto su bioactividad (Bowles et al, 2005). La glicosilación puede desempeñar un papel en la homeostasis y la utilización del BA en las plantas, a través de la interconversión controlada de los ácidos y ésteres de glucosa/glucósidos. Además, los compuestos glicosilados también pueden servir como intermediarios en la biosíntesis del BA en las plantas. El éster CA-glucosa se ha propuesto como un paso intermedio en la formación de BAE y BA en tabaco (Chong et al, 2001).
Conjugación de aminoácidos
La conjugación de una hormona vegetal con los aminoácidos puede activarla (por ejemplo, ácido jasmónico) (Staswick and Tiryaki, 2004) o inactivarla (por ejemplo, ácido indol ácetico, IAA) (Woodward and Bartel, 2005). Las enzimas que catalizan la formación de estos conjugados de fitohormonas unidos a amidas son proteínas denominadas GH-3 (Staswick et al, 2002). En A. thaliana se han identificado amido hidrolasas que catalizan la conjugación de IAA-aminoácidos, sin embargo, aún no se han identificado sintetasas de aminoácidos o amidohidrolasas especificas del BA; a pesar de lo anterior, es posible que los conjugados de aminoácidos desempeñen un papel en el control temporal y espacial de los benzoatos libres (Wildermuth, 2006).
Activación con CoA
La incorporación de un radical benzoilo en metabolitos secundarios se produce por la transferencia de un BA intermedio activado, como benzoil-CoA, a través de una aciltransferasa. Se han aislado y caracterizado benzoato-CoA ligasas en microorganismos degradadores de benzoato (López-Barragán et al, 2004). En las plantas la caracterización de benzoato-CoA ligasas es más reciente (Wildermuth, 2006). Una 3HBA: CoA ligasa se aisló y caracterizo a partir de Centaruium erythrae (Barillas and Beerhues, 2000). Por otro lado, una BA: CoA ligasa fue purificada y caracterizada a partir de Clarkia breweri (Beuerle and Pichersky, 2002). La acción de estas enzimas podría facilitar la canalización específica de benzoil-CoA a la aciltransferasa adecuada para la adición del radical benzoilo para un metabolito secundario dado.
Funciones del BA y efectos reportados de su aplicación exógena en plantas
El BA ejerce efectos positivos en las plantas bajo condiciones de crecimiento alejadas del óptimo. El Cuadro 1 muestra un resumen de trabajos aplicando BA, SA y sus derivados (compuestos asociados a la vía de los fenilpropanoides). En todos ellos parecen jugar un papel importante los salicilatos, los cuales aparentemente regulan la inducción selectiva de las diferentes vías de resistencia (Maleck and Dietrich, 1999).
El BA aplicado en plantas superiores modifica el perfil de los nutrientes minerales acumulados en los tejidos, y el crecimiento y la anatomía y morfología de especies comestibles y ornamentales. Del mismo modo, el SA mejora la absorción y trasporte de nutrientes, incrementa la actividad de enzimas antioxidantes, provoca cambios en la anatomía de las plantas e incrementa el rendimiento (Khan et al, 2010; Purcarea and Cachita-Cosma, 2010).
Por otro lado, se ha reportado que las plantas acumulan BA en el suelo, en donde funciona como un aleloquímico (Kaur et al., 2005); es decir, como un compuesto emitido al medio por las plantas y que interfiere con el crecimiento de organismos competidores. De manera similar se ha reportado que el SA funciona como compuesto alelopático y termogénico (Raskin, 1992).
Se ha documentado que el BA ejerce efectos positivos en las plantas bajo condiciones de crecimiento alejadas del óptimo, ya que induce tolerancia al estrés abiótico (Senaratna et al., 2003). Mientras tanto, se menciona que las aplicaciones de SA afectan positivamente varios procesos fisiológicos, entre los cuales destacan los relacionados con plantas bajo condiciones de estrés, como déficit de agua (Singh and Usha, 2003; Horváth et al, 2007), fitotoxicidad (Metwally et al, 2003) y bajas temperaturas (Farooq et al, 2008).
Entre otros reportes se menciona que el BA, mejora la germinación en medios salinos (Benavides-Mendoza, 2004) y permite un mejor crecimiento y productividad de plantas de tomate que crecen en suelos calcáreos (Benavides-Mendoza et al., 2007). Por su parte, se ha reportado que el SA incrementa la actividad enzimática catalasa y peroxidasa en tomate (Ortega-Ortiz et al, 2007).
Finalmente, se ha descubierto que el SA endógeno está involucrado en las respuestas fisiológicas a patógenos, área en donde se ha desarrollado gran cantidad de información referente a su producción endógena a nivel celular en la llamada resistencia sistémica adquirida (Maksimov and Yarullina, 2007). Hasta donde se sabe Williams et al. (2003), reportaron el primer informe de la resistencia inducida a un patógeno por una aplicación exógena de BA. Los mismos autores indican la posibilidad de que el BA sea el grupo común, encontrado en el ácido salicílico, sulfosalicílico y metil salicílico, responsable de las propiedades de inducción de tolerancia al estrés en estudios previos (Senaratna et al, 2003).
Conclusiones
La perspectiva expuesta en esta revisión muestra los avances obtenidos en relación al papel que desempeña el BA en las actividades fisiológicas de las plantas. Los pocos estudios realizados apoyan la idea de que el BA se sintetiza tanto directamente desde shiquimato/corismato y de Phe en la mayoría de las plantas. La complejidad bservada, probablemente se deba a la simplicidad de estas moléculas y su evolución química. Es necesario realizar más investigación, utilizando mayor cantidad de especies vegetales, para determinar en qué tejidos y en qué condiciones se utilizan estas distintas vías. Por último, los reporte s indican que la aplicación exógena de e sta sustancia, modifica el crecimiento, la tolerancia al estrés y la anatomía y morfología de especies comestibles y ornamentales.
Literatura citada
Abd El-Mawla, A. M.; Schmidt, W. and Beerhues, L. 2001. Cinnamic acid is a precursor of benzoic acids in cell cultures of Hypericum androsaemum L. but not in cell cultures of Centaurium erythraea RAFN. Planta. 212(2):288-293. [ Links ]
Abd El-Mawla,A. M. and Beerhues, L. 2002. Benzoic acid biosynthesis in cell cultures of Hypericum androsaemum. Planta. 214(5):727-733. [ Links ]
Anjum, S. A.; Xue, L.; Wang, L.; Saleem, M. F. and Huang, C. 2013. Exogenous benzoic acid (BZA) treatment can induce drought tolerance in soybean plants by improving gas-exchange and chlorophyll contents. Australian J. Crop Sci. 7(5):555-560. [ Links ]
Ashraf, M.; Akram, N. A.; Arteca, R. N. and Foolad, M. R. 2010. The physiological, biochemical and molecular roles of brassinosteroids and salicylic acid in plant processes and salt tolerance. Crit. Rev. Plant Sci. 29(3):162-190. [ Links ]
Barillas, W. and Beerhues, L. 2000. 3-Hydroxybenzoate: coenzyme A ligase from cell cultures of Centaurium erythraea: isolation and characterization. Biol. Chem. 381(2):155-160. [ Links ]
Benavides-Mendoza, A. 2004. Estrategias para el uso de los mecanismos naturales de tolerancia al estrés en plantas. In: tópicos selectos de botánica. Foroughbakhch, P. R.; Torres-Cepeda, T. E. y Alvarado-Vázquez, M.A. (Eds.). Primera edición. Universidad Autónoma de Nuevo León. San Nicolás de los Garza, N. L. México. 163-172 pp. [ Links ]
Benavides-Mendoza, A.; Burgos-Limón, D; Ortega-Ortíz, H. y Ramírez, H. 2007. El ácido benzoico y poliácido acrílico-quitosán en la calidad y rendimiento del tomate cultivado en suelo calcáreo. Terra Latinoam. 25(3):261-268. [ Links ]
Benavides-Mendoza, A.; Salazar-Torres, A. M.; Ramírez-Godina, F.; Robledo-Torres, V.; Ramírez-Rodríguez, H. y Maiti, R. 2004. Tratamiento de semilla de chile con ácidos salicílico y sulfosalicílico y respuesta de las plántulas al frío. Terra Latinoam. 22(1):41-47. [ Links ]
Beuerle, T. and Pichersky, E. 2002. Purification and characterization of benzoate: coenzyme A ligase from Clarkia breweri. Arch. Biochem. Biophys. 400(2):258-264. [ Links ]
Bjorklund, J. A. and Leete, E. 1992. Biosynthesis of the benzoyl moiety of cocaine from cinnamic acid via (R)-(+)-3-hydroxy-3-phenylpropanoic acid. Phytochemistry. 31(11):3883-3887. [ Links ]
Boatright, J.; Negre, F.; Chen, X.; Kish, C. M.; Wood, B.; Peel, G.; Orlova, I.; Gang, D.; Rhodes, D. and Dudareva, N. 2004. Understanding in vivo benzenoid metabolism in petunia petal tissue. Plant Physiol. 135(4):1993-2011. [ Links ]
Bowles, D.; Isayenkova, J.; Lim, E. K. and Poppenberger, B. 2005. Glycosyltransferases: managers of small molecules. Curr. Opin. Plant Biol. 8(3):254-263. [ Links ]
Chen, F.; D'Auria, J. C.; Tholl, D.; Ross, J. R.; Gershenzon, J.; Noel, J. P. and Pichersky, E. 2003. An Arabidopsis thaliana gene for methylsalicylate biosynthesis, identified by a biochemical genomics approach, has a role in defense. Plant J. 36(5): 577-588. [ Links ]
Chipley, J. 2005. Sodium benzoate and benzoic acid. In: antimicrobials in foods. Davidson, P. M.; Sofos, J. N. and Branen, A. L. (Eds.). Third edition. CRC Press. Boca Raton, FL, USA. 11-48 pp. [ Links ]
Chong, J.; Pierrel, M. A.; Atanassova, R.; Werck-Reichhart, D.; Fritig, B. and Saindrenan, P. 2001. Free and conjugated benzoic acid in tobacco plants and cell cultures. Induced accumulation upon elicitation of defense responses and role as salicylic acid precursors. Plant Physiol. 125(1):318-328. [ Links ]
Coquoz, J. L.; Buchala, A. and Metraux, J. P. 1998. The biosynthesis of salicylic acid in potato plants. Plant Physiol. 117(3): 1095-1101. [ Links ]
Dosselaere, F. and Vanderleyden, J. 2001. A metabolic node in action: chorismate-utilizing enzymes in microorganisms. Crit. Rev. Microbiol. 27(2):75-131. [ Links ]
Effmert, U.; Saschenbrecker, S.; Ross, J.; Negre, F.; Fraser, C. M.; Noel, J. P.; Dudareva, N. and Piechulla, B. 2005. Floral benzenoid carboxyl methyltransferases: from in vitro to in planta function. Phytochemistry. 66(11):1211-1230. [ Links ]
Elliott, L. F. and Cheng, H. H. 1987. Assessment of allelopathy among microbes and plants. In: Allelochemicals: Role in agriculture and forestry. Waller, G. R. (Ed.). First edition. ACS. Washington, D.C., USA. 504-515 pp. [ Links ]
Farooq, M.;Aziz, T.; Basra, S. M.A.; Cheema M. A. and Rehman, H. 2008. Chilling tolerance in hybrid maize induced by seed priming with salicylic acid. J. Agron. Crop. Sci. 194(2):161-168. [ Links ]
Franck, T.; Mouithys-Mickalad, A.; Robert, T.; Ghitti, G.; Deby-Dupont, G.; Neven, P. and Serteyn, D. 2013. Differentiation between stoichiometric and anticatalytic antioxidant properties of benzoic acid analogues: a structure/redox potential relationship study. Chem. Biol. Interact. 206(2):194-203. [ Links ]
Gaille, C.; Kast, P. and Haas, D. 2002. Salicylate biosynthesis in Pseudomonas aeruginosa. Purification and characterization of PchB, a novel bifunctional enzyme displaying isochorismate pyruvate-lyase and chorismate mutase activities. J. Biol. Chem. 277(24):21768-21775. [ Links ]
Gehring, A. M.; Bradley, K. A. and Walsh, C. T. 1997. Enterobactin biosynthesis in Escherichia coli: isochorismate lyase (EntB) is a bifunctional enzyme that is phosphopantetheinylated by EntD and then acylated by EntE using ATP and 2,3-dihydroxybenzoate. Biochemistry. 36(28):8495-8503. [ Links ]
Graser, G.; Oldham, N. J.; Brown, P. D.; Temp, U. and Gershenzon, J. 2001. The biosynthesis of benzoic acid glucosinolate esters in Arabidopsis thaliana. Phytochemistry. 57(1):23-32. [ Links ]
Gutiérrez-Coronado, M. A.; Trejo-López, C. and Larqué-Saavedra, A. 1998. Effect of salicylic acid on the growth of roots and shoots in soybean. Plant Physiol. Biochem. 36(8):563-565. [ Links ]
Hertweck, C.; Jarvis, A. P.; Xiang, L.; Moore, B. S. and Oldham, N. J. 2001. A mechanism of benzoic acid biosynthesis in plants and bacteria that mirrors fatty acid P-oxidation. Chem. Bio. Chem. 2(10):784-786. [ Links ]
Horváth, E.; Pál, M.; Szalai, G.; Páldi, E. and Janda T. 2007. Exogenous 4-hydroxybenzoic acid and salicylic acid modulate the effect of short-term drought and freezing stress on wheat plants. Biol. Plant. 51(3):480-487. [ Links ]
Jamaluddin, S. 2005. Benzyl benzoate. In: Encyclopedia of toxicology 1. Wexler, P. (Ed.). Second edition. Elsevier Inc. Waltham, MA, USA. 264-265 pp. [ Links ]
Kaur, H.; Inderjit and Kaushik, S. 2005. Cellular evidence of allelopathic interference of benzoic acid to mustard (Brassica juncea L.) seedling growth. Plant Physiol. Biochem. 43(1):77-81. [ Links ]
Khan, N.; Syeed, S.; Masood, A.; Nazar, R. and Iqbal, N. 2010. Application of salicylic acid increases contents of nutrients and antioxidative metabolism in mungbean and alleviates adverse effects of salinity stress. Int. J. Plant Biol. 1:1-9. [ Links ]
Klempien,A.; Kaminaga, Y.; Qualley,A.; Nagegowda, D. A.; Widhalm, J .R.; Orlova, I.; Shasany,A. K.; Taguchi, G.; Kish, C. M.; Cooper, B. R.; D'auria, J. C.; Rhodes, D.; Pichersky, E. and Dudareva, N. 2012. Contribution of CoA ligases to benzenoid biosynthesis in petunia flowers. Plant Cell. 24(5):2015-2030. [ Links ]
Lee, H. I. and Raskin, I. 1999. Purification, cloning, and expression of a pathogen inducible UDP-glucose: salicylic acid glucosyltransferase from tobacco. J. Biol. Chem. 274(51):36637-36642. [ Links ]
Lim, E. K.; Doucet, C. J.; Li, Y.; Elias, L.; Worrall, D.; Spencer, S. P.; Ross, J. and Bowles, D. J. 2002. The activity of Arabidopsis glycosyltransferases toward salicylic acid, 4-hydroxybenzoic acid, and other benzoates. J. Biol. Chem. 277(1):586-592. [ Links ]
Long, M. C.; Nagegowda, D. A.; Kaminaga, Y.; Ho, K. K.; Kish, C. M.; Schnepp, J.; Sherman, D.; Weiner, H.; Rhodes, D. and Dudareva, N. 2009. Involvement of snapdragon benzaldehyde dehydrogenase in benzoic acid biosynthesis. Plant J. 59(2):256-265. [ Links ]
López-Barragán, M. J.; Carmona, M.; Zamarro, M. T.; Thiele, B.; Boll, M.; Fuchs, G.; García, J. L. and Díaz, E. 2004. The bzd gene cluster, coding for anaerobic benzoate catabolism, in Azoarcus sp. strain CIB. J. Bacteriol. 186(17):5762-5774. [ Links ]
Maffei, M.; Bertea C. M.; Garneri, F. and Scannerini, S. 1999. Effect of benzoic acid hydroxy- and methoxy- ring substituents during cucumber (Cucumis sativus L.) germination. I.: Isocitrate lyase and catalase activity. Plant Sci. 141(2):139-147. [ Links ]
Maksimov, I. V. and Yarullina, L. G. 2007. Salicylic acid and local resistance to pathogens. In: Salicylic acid -A plant hormone. Hayat, S. and Ahmad, A. (Eds.). First edition. Springer Netherlands. Dordrecht, The Netherlands. 323-334 pp. [ Links ]
Maleck, K. and Dietrich, R. A. 1999. Defense on multiple fronts: how do plants cope with diverse enemies? Trends Plant Sci. 4(6):215-219. [ Links ]
Metwally, A.; Finkmemeier, I; Georgi, M. and Dietz, K. J. 2003. Salicylic acid alleviates the cadmium toxicity in barley seedlings. Plant Physiol. 132(1):272-281. [ Links ]
Muljono, R.A. B.; Scheffer, J. J. C. and Verpoorte, R. 2002. Isochorismate is an intermediate in 2,3-dihydroxybenzoic acid biosynthesis in Catharanthus roseus cell cultures. Plant Physiol. Biochem. 40(3):231-234. [ Links ]
Mustafa, N. R.; Kim, H. K.; Choi, Y. H. and Vepoorte, R. 2009. Metabolic changes of salicylic acid-elicited Catharanthus roseus cell suspension cultures monitored by NMR-based metabolomics. Biotechnol. Lett. 31(12):1967-1974. [ Links ]
Neumüller, O. A. 1988. Römpps Chemie-Lexikon. Franckh'sche Verlagsbuchhandlung Stuttgart. 101(3):365-366. [ Links ]
Orlova, I.; Marshall-Colón, A.; Schnepp, J.; Wood, B.; Varbanova, M.; Fridman, E.; Blakeslee, J. J.; Peer, W. A.; Murphy, A. S.; Rhodes, D.; Pichersky, E. and Dudareva, N. 2006. Reduction of benzenoid synthesis in petunia flowers reveals multiple pathways to benzoic acid and enhancement in auxin transport. Plant Cell. 18(12):3458-3475. [ Links ]
Ortega-Ortiz, H.; Benavides-Mendoza, A.; Mendoza-Villarreal, R.; Ramírez-Rodríguez, H. and De Alba, R. K. 2007. Enzymatic activity in tomato fruits as a response to chemical elicitors. J. Mex. Chem. Soc. 51(3): 141-144. [ Links ]
Purcarea, C. and Cachita-Cosma, D. 2010. Studies regarding the effects of salicylic acid on maize (Zea mays L.) seedling under salt stress. Studia Universitatis Vasile Goldis Seria Stiintele Vietii. 20(1):63-68. [ Links ]
Qualley, A. V.; Widhalm, J. R.; Adebesin, F.; Kish, C. M. and Dudareva, N. 2012. Completion of the core β-oxidative pathway of benzoic acid biosynthesis in plants. Proc. Natl.Acad. Sci. USA. 109(40):16383-16388. [ Links ]
Quan, C.; Mok, W. M. and Wang, G. K. 1996. Use-dependent inhibition of Na+ currents by benzocaine homologs. Biophys. J. 70(1):194-201. [ Links ]
Raskin, I. 1992. Role of salicylic acid in plants. Annu. Rev. Plant Physiol. Plant Mol. Biol. 43:439-463. [ Links ]
Ribnicky, D. M.; Shulaev, V. and Raskin, I. I. 1998. Intermediates of salicylic acid biosynthesis in tobacco. Plant Physiol. 118(2):565-572. [ Links ]
Ruuhola, T. and Julkunen-Titto, R. 2003. Trade-off between synthesis of salicylates and growth of micropropagated Salix pentandra. J. Chem. Ecol. 29(7): 1565-1588. [ Links ]
Sandoval-Rangel, A.; Benavides-Mendoza, A.; Alvarado-Vázquez, M. A.; Foroughbakhch-Pournavab, R.; Núñez-González, M. A. y Robledo-Torres, V. 2011. Influencia de ácidos orgánicos sobre el crecimiento, perfil bromatológico y metabolitos secundarios en chile piquín. Terra Latinoam. 29(4):395-401. [ Links ]
Senaratna, T.; Merritt, D.; Dixon, K.; Bunn, E.; Touchell, D. and Sivasithamparam, K. 2003. Benzoic acid may act as the functional group in salicylic acid and derivatives in the induction of multiple stress tolerance in plants. Plant Growth Regul. 39(1):77-81. [ Links ]
Serino, L.; Reimmann, C.; Baur, H.; Beyeler, M.; Visca, P. and Haas, D. 1995. Structural genes for salicylate biosynthesis from chorismate in Pseudomonas aeruginosa. Mol. Gen. Genet. 249(2):217-228. [ Links ]
Singh, B. and Usha, K. 2003. Salicylic acid induced physiological and biochemical changes in wheat seedlings under water stress. Plant Growth Regul. 39(2):137-141. [ Links ]
Staswick, P. E.; Tiryaki, I. and Rowe, M. L. 2002. Jasmonate response locus JAR1 and several related Arabidopsis genes encode enzymes of the firefly luciferase superfamily that show activity on jasmonic, salicylic, and indole-3-acetic acids in an assay for adenylation. Plant Cell. 14(6):1405-1415. [ Links ]
Staswick, P. E. and Tiryaki, I. 2004. The oxylipin signal jasmonic acid is activated by an enzyme that conjugates it to isoleucine in Arabidopsis. Plant Cell. 16(8):2117-2127. [ Links ]
Strawn, M. A.; Marr, S. K.; Inoue, K.; Inada, N.; Zubieta, C. and Wildermuth, M. C. 2007. Arabidopsis isochorismate synthase functional in pathogen-induced salicylate biosynthesis exhibits properties consistent with a role in diverse stress responses. J. Biol. Chem. 282(8):5919-5933. [ Links ]
Van Moerkercke, A.; Schauvinhold, I.; Pichersky, E.; Haring, M.A. and Schuurink, R. C. 2009. A plant thiolase involved in benzoic acid biosynthesis and volatile benzenoid production. Plant J. 60(2):292-302. [ Links ]
Van Tegelen, L. J. P.; Moreno, P. R. H.; Croes, A. F.; Verpoorte, R. and Wullems, G. J. 1999. Purification and cDNA cloning of isochorismate synthase from elicited cell cultures of Catharanthus roseus. Plant Physiol. 119(2):705-712. [ Links ]
Vogt, T. 2010. Phenylpropanoid biosynthesis. Mol. Plant. 3(1):2-20. [ Links ]
Walker, K. and Croteau, R. 2000. Taxol biosynthesis: molecular cloning of a benzoyl-CoA: taxane 2a-O-benzoyltransferase cDNA from Taxus and functional expression in Escherichia coli. Proc. Natl. Acad. Sci. USA. 97(25):13591-13596. [ Links ]
Wang, C. Z.; Maier, U. H.; Eisenreich, W.; Adam, P.; Obersteiner, I.; Keil, M.; Bacher,A. and Zenk, M. H. 2001. Unexpected biosynthetic precursors of amarogentin - A retrobiosynthetic 13CNMR study. Eur. J. Org. Chem. 2001(8):1459-1465. [ Links ]
Werner, I.; Bacher, A. and Eisenreich, W. 1997. Retrobiosynthetic NMR studies with 13C-labeled glucose. Formation of gallic acid in plants and fungi. J. Biol. Chem. 272(41):25474-25482. [ Links ]
Wildermuth, M. C.; Dewdney, J.; Wu, G. and Ausubel, F. M. 2001. Isochorismate synthase is required to synthesize salicylic acid for plant defence. Nature. 414(6863):562-565. [ Links ]
Wildermuth, M. C. 2006. Variations on a theme: synthesis and modification of plant benzoic acids. Curr. Opin. Plant Biol. 9(3):288-296. [ Links ]
Williams, M.; Senaratna, T.; Dixon, K. and Sivasithamparam, K. 2003. Benzoic acid induces tolerance to biotic stress caused by Phytophthora cinnamomi in Banksia attenuate. Plant Growth Regul. 41(1):89-91. [ Links ]
Woodward, A. W. and Bartel, B. 2005. Auxin: regulation, action, and interaction. Ann. Bot. 95(5):707-735. [ Links ]
Zuo, Y.; Wang, C. and Zhan, J. 2002. Separation, characterization and quantitation of benzoic and phenolic antioxidants in American cranberry fruit by GC-MS. J. Agric. Food Chem. 50(13):3789-3794. [ Links ]














