Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de ciencias agrícolas
Print version ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.6 n.6 Texcoco Aug./Sep. 2015
Artículos
Efecto del jugo de brócoli y cambios químicos en la inhibición de Alternaria en arúgula mínimamente procesada*
Effect of broccoli juice and chemical changes in the inhibition of Alternaria in minimally processed arugula
María Antonia Flores-Córdova1, Ma Teresa Martínez-Damián2§, Juan Enrique Rodríguez-Pérez2, Daniel Nieto-Ángel3, María Teresa Colinas-León2 y Juan Martínez Solís2
1 Universidad Autónoma Chapingo-Departamento de Horticultura. Carretera México-Texcoco km 38.5. Chapingo, México. C. P. 56230. Tel: 6142424330 (mariflor_556@hotmail.com).
2 Departamento de Fitotecnia. Universidad Autónoma Chapingo. Carretera México-Texcoco, km 38.5. C. P. 56230. Chapingo, México. Tel: 595 952 1500, Ext. 6163, 6133, 6389, 1616. (erodriguezx@yahoo.com; dnieto@colpos.com; lozcol@gmail.com).
3 Colegio de Postgraduados, Campus Montecillo. Carretera México-Texcoco km 36.5. 56230, Montecillo, Texcoco, Estado de México. Tel: 595 951 0279. §Autor para correspondencia: teremd13@gmail.com.
* Recibido: febrero de 2015
Aceptado: mayo de 2015
Resumen
El brócoli es una especie de la familia de las Brassicas, que posee gran cantidad de glucosinolatos los cuales tienen propiedades antifúngicas y han sido probados in vitro en contra de diferentes hongos. En este estudio se probó el efecto del jugo de brócoli (GLs) in vitro y en vivo en la inhibición de Alternaria y conservación de la calidad de arúgula. Para el ensayo in vitro se utilizó medio de cultivo papa dextrosa agar (PDA) y concentraciones de 0.15, 0.11, 0.07, 0.04, 0.01 y 0 (μg/μl del jugo de brócoli, para evaluar su efecto en la germinación de esporas de Alternaria alternata. Se evaluó la fisiología postcosecha deArúgula almacenadas a 0. 4 °C y temperatura ambiente por 15 días, después de la inoculación con esporas de Alternaria (1x106). Los tratamiento fueron: 2.98 (μg mL-1 de GLs + inóculo, 1.49 μg mL-1 de GLs+inóculo, con solución de esporas de Alternaria y el testigo. Cada tercer día se evaluó la severidad del daño por hongo. Las variables medidas fueron vitamina C, capacidad antioxidante y fenoles. Los resultados obtenidos mostraron que la concentración mínima de jugo de brócoli in vitro para obtener 100% de inhibición fue de 0.07 μg/μl, en vivo la concentración de 2.98 μg mL-1 y la temperatura de 0 °C fueron las que conservaron los parámetros de calidad en excelentes condiciones hasta el almacenamiento. Por lo que se concluye que el jugo de brócoli (GLs) puede ser usado en postcosecha para el control de Alternaria alternata.
Palabras claves: Eruca sativa, capacidad antioxidante, fenoles, glucosinolatos, vitamina C.
Abstract
Broccoli is a species of the Brassica family, which has lots of glucosinolates which have antifungal properties and have been tested in vitro against different fungi. In this study the effect of broccoli juice (GLs) in vitro and live in the inhibition of Alternaria and preservation of the quality of arugula tested. For testing in vitro, we used culture in a medium potato dextrose agar (PDA) and concentrations of 0.15 was used, 0.11, 0.07, 0.04, 0.01 and 0 μg/μl ofbroccoli juice to evaluate its effect on the germination of spores of Alternaria alternata. The postharvest stored physiology was evaluated at 0.4 °C and room temperature for 15 days after inoculation with spores of Alternaria (1x106). The treatments were: 2.98 μg mL-1 of GLs+inoculum, 1.49 μg mL-1 of GLs+ inoculum, with spores of Alternaria solution and the control. Every third day, the severity ofthe damage was evaluated by fungus. The variables measured were vitamin C, antioxidant capacity and phenolics. The results showed that, the lowest concentration of broccoli juice in vitro for 100% inhibition was 0.07 μg/μl, on live the concentration of 2.98 μg mL-1 and a temperature of 0 °C were the parameters retained quality and condition to storage. So, it is concluded that broccoli juice (GLs) can be used to control postharvest Alternaria.
Keywords: Eruca sativa, antioxidant capacity, glucosinolates, phenols, vitamin C.
Introducción
La calidad y seguridad microbiológica de los productos vegetales frescos cortados es un aspecto esencial en su procesamiento y distribución. Su contaminación puede ocurrir en cualquier punto entre el cultivo y el consumo de los mismos. Para lograr productos de alta calidad que cumplan con estos requisitos es necesaria la puesta en práctica de métodos de conservación con bajo impacto sobre el alimento y a menudo una combinación inteligente de ellos (González-Aguilar, 2005). Hoy los consumidores demandan productos vegetales como la arúgula, (Eruca sativa Mill.), perteneciente a la familia Brassicaceae, originaria de la región mediterránea, y que se distribuye en todo el mundo.
Sin embargo, esta es susceptible al daño causado por Alternaria, hongo patógeno causante de la pérdida de calidad del producto, acortándose su vida postcosecha por lo que se ha considerado el uso de la refrigeración durante el almacenamiento (Kader, 2003), este método ha sido eficiente en la disminución de las alteraciones mecánicas, microbiológicas y biológicas, la cual se ha convertido en un método ampliamente utilizado durante el manejo postcosecha (Tonoiven, 2004).
Los glucosinolatos (GLs) son una serie de compuestos del metabolismo secundario de las plantas principalmente del orden de los Capparales, familia Brassicales. Los GLs intactos tienen actividad biológica limitada, se incrementa cuando son hidrolizados a isotiocianatos (ITCs). El brócoli es la principal fuente natural del isotiocianato sulforafano (1-isotiocianato-4-(metilsulfinil)-butano), su precursor glucorafanina constituye más de 80% de los glucosinolatos totales presentes en este vegetal (Campas-Baypoli et al., 2009). Se ha comprobado que los isotiocianatos tienen la propiedad de controlar el crecimiento de microorganismos patógenos tales como Fusarium oxysporum, (Smolinska et al., 2003), Alternaria rot (Troncoso et al., 2005), Rhizopus nigricans (Mucete et al., 2006) Penicillium expansum (Mari et al., 2002) y Aspergillus spp., agentes causantes de enfermedades en los alimentos y descomposición de los mismos (Viuda-Martos et al., 2007).
Algunos autores han reportado que el mecanismo por el cual los ITCs inhiben el crecimiento de hongos y microoiganismos aún no se conoce bien (Báez-Flores et al., 2008); sin embaigo, algunas hipótesis proponen que estos compuestos son la causa de la inactivación de las enzimas intracelulares por medio de la degradación oxidativa de los puentes disulfuro, de la inhibición de enzimas metabólicas por la acción del radical tiocianato y su acción desacopladora de la fosforilación oxidativa. Al parecer, la alta reactividad de los ITCs se debe principalmente a la fuerte naturaleza electrofílica del grupo funcional isotiocianato (Báez-Flores et al., 2008; Kroll et al., 1994). Es por ello, que el objetivo de este estudio fue evaluar el efecto de la aplicación de refrigeración y el uso de jugo de brócoli tanto in vitro como en vivo en la inhibición de la germinación de esporas de Alternaria así como en la conservación y vida de anaquel de Arúgula.
Materiales y métodos
Preparación del jugo crudo de brócoli
Se obtuvo brócoli procedente del mercado de abastos de Texcoco, Estado de México. Los floretes y tallos de brócoli fueron desinfectados con hipoclorito de sodio 100 mg g-1 y extraído en un extractor Moulinex, el jugo obtenido se dejó reposar por espacio de una hora, con el fin de llevar a cabo el proceso de hidrólisis mediante la enzima mirosina. La muestra obtenida se pasó a una centrifuga a 7 080 G por 10 min. De acuerdo a la metodología establecida por Brandi et al. (2006). El sobrenadante se almacenó a -20 °C hasta su uso.
Determinación espectrofotométrica de glucosinolatos
Se tomaron aproximadamente 0.5 mg de extracto de brócoli liofilizado (Jezek et al., 1999) el cual se diluyo en 9 ml de solución, de los cuales 7.5 mL corresponden de amortiguador acetato 0.2 M a pH 4.2 y 1.5 mL de acetato de plomo y bario 0.5 M. La mezcla se agitó vigorosamente en vortex. Se adicionaron 0.4 G de polivinilpolipirrolidona (PVPP) y se incubó a temperatura ambiente, con agitación en vortex, por 15 min. Después se agregaron 1.5 mL de sulfato de sodio 2 M y se centrifugó a 11 336 G por 5 min a temperatura ambiente. Se tomaron 0.9 mL de extracto tratado con PVPP se mezclaron con 0.9 mL de hidróxido de sodio 2M y se incubaron por 30 min.
A la mezcla se le adicionó 0.138 mL de ácido clorhídrico concentrado y se centrifugó a 4 000 G por 10 minutos. Para la determinación espectrofotométrica se tomaron 0.5 mL de sobrenadante y se mezclaron con 0.5 μl de solución de ferricianuro 2 mM en amortiguador fosfato 0.2 M a pH de 7. Finalmente se midió la absorbancia de la solución a 420 nm antes de 15 s. Se tomó como blanco amortiguador fosfato 0.2 M a pH 7. Para la curva de calibración se utilizó el patrón sinigrina 5.6 mM con diluciones de 0 a 90 μl. Con los datos del espectrofotómetro se ajustó un modelo de regresión lineal, para determinar la concentración de los GLs obtenidos del jugo de brócoli.
Actividad del jugo de brócoli (GLs) in vitro sobre Alternaria
El aislamiento de Alternaria se obtuvo de hojas de arúgula proporcionada por la empresa Glezte ubicada en Axochiapan estado de Morelos, con síntomas de la mancha de la hoja. Las muestras de Alternaria fueron sembradas en medio de cultivo Papa Dextrosa Agar (PDA). Se estudiaron las características de los hongos de acuerdo a las claves morfológicas de Barnett y Hunter (1998) y Rotem (1994). La identificación definitiva se realizó mediante secuenciación del ADN fungal.
Se colocaron 150 μl de medio de cultivo PDA en recipientes translúcidos con una capacidad de 300 μl, antes de que el medio de cultivo solidificara se mezcló con 50 μl del extracto puro de brócoli, después se añadió 20 μl de la suspensión de conidios, sobre cada uno de los recipientes. Se probaron las concentraciones 0.15, 0.11, 0.07, 0.04, 0.01, 0 μg/μl, posteriormente se colocaron en cámara húmeda y se incubaron por 2,4, y 6 h a 28±3 °C. Con la ayuda de un microscopio se cuantificó los conidios germinados, se consideraron 100 conidios al azar, de cada concentración se hicieron tres repeticiones (Flores et al., 2013). Los datos obtenidos se sometieron a un análisis de varianza. El porcentaje de inhibición se determinó mediante la fórmula: IN (%) = a-b/a * 100.
Actividad del jugo de brócoli (GLs) en vivo en Alternaria
Las hojas de arúgula se lavaron y desinfectaron con hipoclorito de sodio a100 mg g-1, posteriormente se dividió el material en 4 grupos para los tratamientos correspondientes: grupo o tratamiento uno, fue sumergido en jugo de brócoli puro a una concentración de 2.98 μg mL-1 de GLs más la inoculación de Alternaria 1x106 esporas por mL; grupo dos, fue sumergido enjugo de brócoli a una concentración de 1.49 μg mL-1 de GLs más la inoculación de esporas de Alternaria; grupo tres, inoculado sólo con la solución de esporas de Alternaria; grupo cuatro, testigo sin glucosinolatos y sin esporas; posteriormente se secaron las hojas y luego se envasaron 100 g en charolas rígidas y se almacenaron en refrigeración a 0. 4 y 22 °C (temperatura ambiente) durante 15 días, con un diseño experimental completamente al azar y arreglo factorial de 3 x 4 y tres repeticiones.
La severidad del daño por hongo se evaluó cada tercer día y se reportó como porcentaje de infección por planta. Se utilizó una escala hedónica elaborada con el programa 2log. Con esta calificación nominal se obtuvo el índice poblacional de severidad al aplicar la siguiente fórmula:
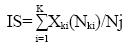
Donde: IS= índice de severidad; Xki= nivel del daño en el momento i; Nki= número de hojas con el nivel del daño en el momento i; Nj= número total de hojas evaluadas.
Efecto de GLs en la fisiología poscosecha de arúgula en vivo
Se determinó la fisiología y vida de anaquel de las hojas de arúgula, mediante el uso del jugo de brócoli (GLs) en las siguientes variables:
Vitamina C (ácido ascórbico)
Se homogeneizaron 5 mL dejugo con 50 mL de una solución de ácido oxálico (0.5%), de la cual se tomó una alicuota de 5 mL y se tituló con solución de Tillman (0.01%) hasta que permaneció una coloración rosa visible por 1 min. La concentración se expresó en mg g-1 utilizando como estándar el ácido ascórbico (AOAC, 1980).
Fenoles totales
Se empleó el método espectrofotométrico desarrollado por Folin y Ciocalteu descrito por Waterman y Mole (1994). Se pesaron 0.5 G de tejido fresco y se agregaron 5 mL de metanol al 100%, se homogenizaron por 5 min a13 147 G. Se tomaron 60 μl del sobrenadante, se tomaron 16 mL de agua desionizada y 0.5 mL de folin, se agitaron y antes de 8 min se agregó Na2CO3 al 20% esta mezcla se agitó vigorosamente y luego se dejó reposar por 2 h, lejos de la luz. Transcurrido el periodo de incubación, la mezcla de reacción se analizó en un espectrofotómetro a λ de 760 nm para determinar su absorbancia. Se utilizó como blanco agua desionizada. La cuantificación se realizó mediante una curva patrón de ácido tánico, los datos se expresaron en mg g-1 de peso fresco.
Determinación de la capacidad antioxidante
La determinación de la capacidad antioxidante, se realizó de acuerdo con el método ABTS [2,2'azinobis (3-etilbenzotiazolin-6-ácido sulfónico] propuesto por Rice-Evans et al. (1997) modificado por Ozgen et al. (2006), para lo cual el radicalABTS se formó tras la reacción de ABTS (7 mM) con persulfato potásico (2.45mM, concentración final) incubados a temperatura ambiente y en oscuridad durante 16 h. Una vez formado el radical ABTS este se diluyó con PBS (solución amortiguador de fosfato) (pH 7.4) hasta obtener un valor de absorbancia de 0.7 ± 0.1 a 734 nm (longitud de máxima absorción). Para el ensayo se mezclaron 3 mL de la solución ABTS y 20 μl de extracto de la muestra, dejándose reposar por 2 h y posteriormente se realizó la lectura de absorbancia a 734 nm. El antioxidante de referencia fue el ácido ascórbico (de 0 a 2.5 mM).
Análisis estadístico
Los resultados in vitro y en vivo de las variables químicas y fisiológicas se sometieron a un análisis de varianza y pruebas de comparación de medias (Tukey, p= 0.05). Se empleó el paquete de análisis estadístico SAS® (Statistical Analysis System) ver. 9.0 (SAS, 2002).
Resultados y discusión
Determinación espectrofotométrica de glucosinolatos
El cual se basó en la metodología establecida por Jezeck et al. (1999) para determinar glucosinolatos, mediante espectrofotometría, usando una alcalina degradación y reacción con ferricianuro, utilizando sinigrina como modelo de glucosinolatos, así mismo Gallaher et al. (2012) validaron el método de cuantificación de glucosinolatos totales en crucíferas como el brócoli, basado en la misma reacción y como estándar usaron sinigrina. El modelo utilizado fue: Y= -0.0041x+0.9313 (r2 de 0.97, p= 0.002) y la concentración de glucosinolatos fue de 0.0029 mg mL-1.
Actividad del jugo de brócoli (GLs) in vitro en Alternaria alternata
Se identificó una colonia fungal de color verde obscuro en hojas de arúgula. Al observarla al microscopio ésta presentó, conidióforos simples de color café claro tabicados, y conidios con septa transversal y longitudinal, características que corresponden a la especie de Alternaria alternara de acuerdo a las claves y descripciones de Barnett y Hunter (1998) y Rotem (1994). Esta identificación morfológica fue confirmada por la secuenciación del genoma fungal alineada en el banco de genes (NCBI), reportado por Andersen et al. (2001) y Fraire et al. (2010).
En la Figura 1 se muestra el efecto a las 6 horas de las concentraciones de jugo de brócoli (GLs) en la inhibición de la germinación de esporas de Alternaria incubadas a 26 °C. En ella se puede observar que para las concentraciones 0.15, 0.11 y 0.07 μg/μl, el porcentaje de germinación fue de 0%, mientras que las concentraciones de 0.01 y 0.04 μg/μl presentan menor control, lo cual sugiere que a mayor concentración de GLs se presentó un menor crecimiento fungal. Todos los tratamientos con jugo de brócoli GLs disminuyeron el crecimiento del hongo respeto al testigo 0.0 μg/μl de GLs. Varios autores han demostrado previamente que los GLs tienen efecto en contra de algunos patógenos. Mari et al. (1996) reportan que los isotiocinatos derivados de los glucosinolatos usados a una concentración de 3.6 mg mL-1 controlaron completamente al hongo Penicillium expansum en frutos de pera. Masahiro et al. (2006), probaron concentraciones de 20 mg g-1 de compuestos volátiles de Brasicca rapa inhibió el crecimiento micelial de Rhizoctonia solani.

Por su parte Sisti et al. (2006), utilizaron jugo crudo de Brassica en la inhibición del crecimiento del hongo Candidas albicans a una concentración de 10.9 μg mL1, después de 4 horas de incubación, obtuvieron 95% de inhibición, resultados similares a los encontrados pero con concentraciones diferentes.
Los resultados obtenidos en la presente sugieren el efecto inhibitorio del jugo de brócoli GLs en la germinación de esporas de Alternaria alternata en concordancia con lo obtenido en trabajos previos.
Actividad del jugo de broccoli (GLs): en vivo en Alternaria alternata
En el Cuadro 1 se presentó el porcentaje de severidad de daño causado por A. alternata en hojas de Arúgula. Se puede observar que el tratamiento sin GLs + inóculo presentó la mayor severidad del daño durante todo el periodo de evaluación, mientras que la menor severidad se obtuvo cuando se utilizó la concentración de 2.98 μg mL-1 de GLs contenidos en el jugo de brócoli + inóculo. En el presente trabajo se observó una disminución del daño causado por A. alternata en hojas de arúgula. Los resultados obtenidos en este trabajo fueron superiores a los reportados por Troncoso-Rojas et al. (2005) quienes tuvieron una reducción de 80% en el daño causado por Alternaria alternata en tomates, al utilizar isotiocinatos (ITCs) (derivados de los glucosinolatos), a una concentración de 0.56 mg mL-1.
Asimismo, se encontró que existieron diferencias significativas (p≤0.05) entre tratamientos los días siete, once, trece y quince lo que indica que no todos las concentraciones producen el mismo efecto en la severidad de daño para esos días y la concentración de 2.98 μg mL-1 de GLs + inóculo presentó la menor severidad de daño. Por lo que dicha concentración resultó ser más efectiva para el control de A. alternata, similar resultado obtenido por Tiznado-Hernández y Troncoso-Rojas (2006) quienes demostraron que el isotiocinato (ITC) 3-metilsufnil-3-butenil a una concentración de 3.6 mg mL-1, inhibió totalmente el crecimiento de Monilinia laxa en frutos de pera. Troncoso-Rojas et al. (2005), demostraron que el (ITC) de bencil a las concentraciones de 0.28 y 0.56 mg/mL-1 inhibió 100% el crecimiento micelial de A. alternata en frutos de pimiento morrón.
En cuanto al tratamiento manejado a temperatura ambiente (22 °C) se observó mayor daño causado por A. alternata durante el periodo de almacenamiento. Las temperaturas de almacenamiento de 0 y 4 °C fueron estadísticamente iguales los días tres y cinco de almacenamiento; sin embargo, a partir del día siete en adelante existieron diferencias significativas entre ambos. La temperatura de 0 °C proporcionó mayor control de la presencia de A. alternata que la de 4 °C, Koukounaras et al. (2007) mencionan que las hojas de arúgula se pueden refrigerar con buenos resultados a 0 °C, con una vida de almacenamiento máximo de 16 días, un comportamiento similar a los resultados de éste trabajo. Además reportan que el almacenamiento a 5 °C produjo un deterioro ligero de la calidad y la vida útil se redujo 3 días, resultados similares a los obtenidos en este estudio, por lo que se puede concluir que el almacenamiento a 0 °C incrementa la vida de anaquel de las hojas de arúgula, e inhibe el crecimiento de A. alternata.
En los resultados del ensayo en vivo, se observó que las hojas de arúgula tratadas con las concentraciones de GLs contenidas en el jugo de brócoli, presentaron una menor incidencia de A. alternata. El modo de acción de los GLs no está dilucidado aún pero la evidencia experimental apoya la acción de que los isotiocinatos en el organismo vivo, llevan a cabo las reacciones interespecíficas con cualquier proteína del organismo. Estas reacciones se cree que están teniendo lugar entre el grupo isotiocinato (R-N=C= S) y el grupo amino del grupo R de la lisina, el grupo sulfhidrilo del grupo R de la cisteína y con enlaces disulfuro. Después de la reacción, los isotiocinatos permanecen unidos covalentemente a la proteína que trae cambios en la estructura terciaria de la proteína y conduce a la pérdida parcial total de la actividad enzimática (Tiznado-Hernández et al., 2006).
Capacidad antioxidante
Con relación a la capacidad antioxidante la concentración de 2.98 μg mL-1 + inóculo presentó una ligera disminución de 3.16 a 2.89 mg g-1, mientras que el tratamiento Sin GLs + inóculo oscilo entre 3.16 y 2.32 mg g-1. De acuerdo al Cuadro 2, los días tres, cinco, siete, nueve, once trece y quince, mostraron diferencias estadísticas significativas (p≤0 0.05), en todos los tratamientos con concentraciones de GLs y GLs mas inoculo, lo que sugiere que no tuvieron el mismo efecto en las hojas de arúgula la capacidad antioxidante con la concentración de 2.98 μg mL-1 presenta una disminución de 8% al día 15 de almacenamiento. En un trabajo realizado por Venneria et al. (2012) mencionan que tuvieron una disminución de la capacidad antioxidante de 8% al segundo día de almacenamiento, obteniendo valores de 12.9 mM Fe2+ por kg, en hojas de arúgula fresca.
Los resultados de la capacidad antioxidante podrían atribuirse, a la vitamina C y los compuestos fenólicos, presentes en las hojas de arúgula los cuales no fueron afectados. Recientemente se ha ganado más la atención a una dieta rica en vegetales que por su capacidad antioxidante protegen al organismo de la acción de radicales libres, causantes de los procesos de envejecimiento y que pueden ayudar a prevenir ciertas enfermedades como el cáncer (Sun-Ju et al., 2004).
La temperatura de almacenamiento mantuvo la capacidad antioxidante a 0 °C de 3.0 mg g-1 a 2.7 mg g-1, durante los 15 días de almacenamiento, con diferencias de los tratamientos de 4 y 22 °C. Autores como Martínez-Sánchez et al. (2006) cuando almacenaron a 4 °C, obtuvieron una reducción de 60% en la capacidad antioxidante con valores que pasaron de 104.8 hasta 47.6 mg 100 g-1 a los 14 días. Por su parte Nicola et al. (2010) tuvieron un decremento de 69% al almacenar a 12 °C con un valor de 1.96 (imol Fe2+ g-1 al respecto señalan que la capacidad antioxidante, fue dedicada a controlar las especies de radicales formados después del corte y significativamente influenciada por la temperatura de almacenamiento a través del tiempo.
Vitamina C
El contenido de Vitamina C se mantuvo dentro de los valores de 86.3 a 48.3 mg g-1, en el tratamiento 2.98 μg mL-1+ inóculo, mientras que en el tratamiento sin GLs+inóculo decayó hasta 19.5 mg g-1 (Cuadro 3). Autores como Kim e Ishi (2007) obtuvieron contenido de vitamina C de 1.45 mg g-1 a los 10 días de almacenamiento a 4 °C en hojas de arúgula, valores más bajos a los obtenidos en este trabajo. El contenido es importante en la conservación de alimentos, toda vez que es uno de los antioxidantes más efectivos, con efecto protector frente a los radicales libres (González-Aguilar, 2005). En el Cuadro 6 puede apreciarse que para esta variable existieron diferencias significativas (p≥ 0.05) entre los tratamientos con concentraciones de GLs contenidos en eljugo de brócoli y GLs con inoculo, aplicados durante todo el periodo de evaluación.
En relación al efecto de la temperatura se obtuvo que el tratamiento de 2.98 μg mL-1 + inóculo a 0 °C fue el que conservó mejor el contenido de vitamina C con un valor al final del almacenamiento de 37.4 mg g-1 a diferencia del tratamiento a temperatura ambiente el cual mostró un valor de 32.1 mg g-1.
Por su parte Nicola et al. (2010) encontraron un decremento de 32.5% en el contenido de vitamina C (9.3 mg100 g-1) al almacenar a 4 °C y de 46.6% bajo temperaturas de 12 °C después de 10 días de almacenamiento.Al respecto Martínez-Sánchez et al. (2006) determinaron valores de 50 mg 100 g-1 al almacenar a 8 °C. Kim y Ishi (2007) mencionan que la disponibilidad de vitamina C total es influenciada por numerosos factores como la intensidad de la luz, temperatura de almacenamiento y exposición a contaminantes, que pueden modificar sus contenidos en productos almacenados ó durante su vida poscosecha, ya que es uno de los constituyentes más vulnerables a las condiciones de procesado y conservación (Davey et al., 2000).
Fenoles
En relación al contenido de fenoles (Cuadro 4), se observan diferencias significativas (p≥0.05) entre las concentraciones de GLs contenidos en el jugo de brócoli y GLs con inoculo, los días cinco, siete, nueve, once y quince de almacenamiento. El mejor contenido de fenoles (0.22 mg g-1) se obtuvo en la concentración de 2.98 μg mL-1 de GLs, mientras que el tratamiento sin GLs+ inóculo mostró una disminución a partir del día nueve sin alcanzar el valor inicial terminando con 0.15 mg g-1, en el día 15, los valores obtenidos son comparados con los de Nicola et al. (2010) quienes reportan valores de 0.20 a 0.15 mg g-1, sin embargo los valores obtenidos en este estudio con las concentración de 2.98 μg mL-1y 1.49 μg mL-1 de GLs + inoculo fueron de 0.20 y 0.22 mg g-1, los compuestos fenólicos son un grupo de antioxidantes y la actividad puede ser atribuida al efectos sinérgico de la vitamina C y la capacidad antioxidante.
El almacenamiento a 0 °C presentó mantener cantidades de ácido tánico de 0.26 a 0.19 mg g-1 después de 15 días de almacenamiento. Estos resultados estuvieron más altos que de los observados por Martínez-Sánchez et al. (2006) quienes encontraron de valores de 109.3 g a 56.3 mg 100 g-1 de ácido gálico en hojas de arúgula, almacenadas a 4 °C, por 14 días lo que representó una disminución casi del 50 %, en comparación con la concentración que se utilizó en este estudio la cual fue menor. Los compuestos fenólicos han recibido una considerable atención por ser factores potencialmente protectores contra el cáncer y enfermedades del corazón, en parte debido a sus propiedades antioxidantes potentes en la dieta en todo el mundo (Cartea et al., 2011).
Conclusiones
La aplicación de GLs contenidos en el jugo de brócoli y el almacenamiento a 0 °C preservaron mejor la fisiología de las hojas de arúgula, según lo muestran las variables evaluadas, capacidad antioxidante, vitamina C y fenoles, las cuales no se vieron afectadas y alargaron la vida de anaquel. Por lo que estos resultados corroboran la actividad antifúngica del jugo de brócoli (GLs), in vitro y en vivo como una alternativa potencial para el control de Alternaria alternata en el manejo postcosecha de arúgula.
Literatura citada
Andersen, B.; Kroger, E. and Roberts, G. 2001. Chemical and morphological segregation of Alternaria alternata, A. gaisen and A. longipes. Mycol. Res. 105:291-299. [ Links ]
AOAC (Association of official analytical chemists). 1980. Official Methods of Analysis. Horwitz, (Ed). 13th (Ed.). Franklin, B. Station, Washington, DC. USA. 1018 p. [ Links ]
Barnett, H. L. and Hunter, B. B. 1998. Illustrated Genera of Imperfect Fungi. Cuarta edicción. Minnesota. APS Press. 210 p. [ Links ]
Báez-Flores, M. E.; Troncoso-Rojas, R. y Tiznado-Hernández, M.E. 2008. Respuestas genéticas provocadas por el tratamiento con isotiocianatos en hongos del género Alternaria. Rev. Mex. Fitopatol. 29:61-68. [ Links ]
Brandi, G.; Amagliani, G.; Schiavano, G. F.; De Santi, M. and Sisti, M. 2006. Activity of Brassica oleracea leaf juice on foodborne pathogenic bacteria. J. Food Protec. 9:2274-2279. [ Links ]
Campas-Baypoli, O. N.; Bueno-Solano, C.; Martínez-Ibarra, D. M.; Camacho-Gil, F.; Villa-Lerma, A. G.; Rodríguez-Núñez, J. R.; López-Cervantes, J. y Sánchez-Machado, D. I. 2009. Contenido de sulforafano (1 isotiocianato-4-(metilsulfinil)-butano) en vegetales crucíferos. Arch. Latinoam. Nut. 59:(1)95-100. [ Links ]
Davey, M. V.; Montagu, V. M.; Inzé, D.; Sanmartín, M.; Kanellis, A.; Smirnoff, N.; Benzie, J. J.; Strain, J. J.; Favell, D. and Fletcher, J. 2000. Plant L-ascorbic acid: chemistry, function, metabolism, bioavailability and effect of processing. J. Sci. Food Agric. 80:825-860. [ Links ]
Gallaher, C. M.; Gallaher, D. D. and Peterson, S. 2012. Development and validation of a spectrophotometric method for quantification oftotal glucosinolates in cruciferous vegetables. J. Agric. Food Chem. 60:1358-1362. [ Links ]
Flores, M.A.; Martínez, D. M. T.; Nieto,A. D., Rodríguez, P. J. E.; Colinas, L. M. T. y Martínez, S. J. 2013. Reducción en la germinación in vitro de conidios de Alternaria alternata aislada de Eruca sativa con jugo de brócoli. Fitopatología. 31:180-190. [ Links ]
Fraire-Cordero, M. L.; Nieto-Ángel, D. y Cárdenas-Soriano, E. 2010. Alternaria tenuissima, A. alternata y Fusarium oxysporum hongos causantes de la pudrición de florete de brócoli. Rev. Mex. Fitopatol. 28(1):25-33. [ Links ]
González-Aguilar, G. A.; Gardea, A. A. y Cuamea-Navarro, F. 2005. Nuevas tecnologías de conservación de productos vegetales frescos cortados. CIAD México. 558 p. [ Links ]
Jezek, J.; Barry, G.; Haggett, D.; Atkinson, A. and Rawson, D. M. 1999. Determination of glucosinolates using their alkaline degradation and with ferricyanide. J. Agric. Food Chem. 47:4669-4674. [ Links ]
Kader, A.A. 2003.A perspective on postharvest horticulture. HortScience. 38:(5)1004-1008. [ Links ]
Kim, S. J. and Ishi, G. 2007. Effect of storage temperature and duration on glucosinolate, total vitamin C and nitrate contents in rocket salad (Eruca sativa Mill). J. Sci. Food Agric. 87:966-973. [ Links ]
Sun-Ju, K.; Shigeki, J. and Gensho, I. 2004. Isolation and structural elucidation of 4-(B-glucopyranosyldisfultanyl) butyl glucosinolate from leaves of rocket salad (Eruca sativa L.) and its antioxidantive activity. Biosci. Biotechnol. Biochem. 68:2444-2450. [ Links ]
Koukounaras, A.; Siomos, A. S. and Sfakiotakis, E. 2007. Postharvest CO2 and ethylene production and quality of rocket (Eruca Sativa Mill.) leaves as affected by leaf age and storage temperature. Postharvest Biol. Technol. 46:167-173. [ Links ]
Kroll, J.; Noack, J.; Rawel, H.; Kroeck, R. and Proll, J. 1994. Chemical reactions of benzyl isothiocyanate with eggwhite protein fractions. J. Sci. Food Agric. 65:337-345. [ Links ]
Mari, M.; Iori, R.; Leoni, O. and Marchi, A. 1996. Bioassays of glucosinolate-derived isothiocyanates against postharvest pear pathogens. Plant Pathology. 45:753-760. [ Links ]
Mari, M.; Leoni, O.; Iori, R. and Cembali, T. 2002. Antifungal vapourphase of allyl-isothiocyanate against Penicillium expansum on pears. Plant Pathol. 51:231-236. [ Links ]
Martínez-Sánchez, A.; Allende, A.; Bennett, R. N.; Ferreres, F. and Gil, M. I. 2006. Microbial, nutritional and sensory quality of rocket leaves as affected by different sanitizers. Postharvest Biol. Technol. 42:86-97. [ Links ]
Masahiro, K.; Andriantsoa, R.; Yoko, O.; Motoaki, T.; Hitoshi, H. and Ryo, F. 2006. Induction of soil suppressiveness against Rhizoctonia solani by incorporation of dried plant residues into soil. Phytopatology. 96:1372-1379. [ Links ]
Mucete, D.; Borozan, A.; Radu, F. and Jianu, I. 2006. Antibacterial activity of isothiocyanates, active principales in Armoracia rusticana roots. J. Agroal. Proc. Technol. 2:443:452. [ Links ]
Nicola, S.; Fontana, E.; Tibaldi, G. and Zhan, L. 2010. Quantitative and physiological response of minimally processed rocket (Eruca sativa Mill.) to package filling amount and shelf-life temperature. Acta Hortic. 877: 611-618. [ Links ]
Ozgen, M.; Reese, N. R.; Artemio, Z.; Tulio, J. R.; Scheerens, C. J. and Miller, R. A. 2006. Modified 2,2-Azino-bis-3-ethylbenzothiazoline-6-sulfonic acid (ABTS) method to measure antioxidant capacity of selected small fruits and comparison to ferric reducing antioxidant power (FRAP) and 2,2'-diphenil-1-picrylhydrazyl (DPPH) methods. J. Agric. Food Chem. 54(4):1151-1157. [ Links ]
Rice-Evans, A. C.; Miller, N. J. and Paganga, G. 1997. Antioxidant properties of phenolic compounds. Trends in Plant Sci. 2(4):152-158. [ Links ]
Rodríguez-Sauceda, E. N. 2011. Uso de agentes antimicrobianos naturales en la conservación de frutas y hortalizas. Ra Ximhai. 7(1):153-170. [ Links ]
Rotem, Y. 1994. The genus Alternaria: biology, epidemiology and pathogenicity. APS Press, Am. Phytopathol. Soc. 326 p. [ Links ]
SAS Institute. 2002. users guide: Statics, Ver. 9.00. SAS Institute, Inc. Cary, NC, USA. 1503 p. [ Links ]
Sisti, M.; Amagliani, G. and Brandi, B. 2006. Antifungal activity of Brassica oleracea var. botritys fresh aqueousjuice. Fitoterapia. 74:453-458. [ Links ]
Smolinska, U.; Morra, M. J.; Knudsen, G. R. and James, R. L. 2003. Isothiocyanates produced by Brassicaceae species as inhibitors of Fusarium osysporum. Plant Dis. 87:407-412. [ Links ]
Tiznado-Hernández, M. and Troncoso-Rojas, R. 2006. Control of fungal diseases with isothiocyanates. Stewart Postharvest Review. 1(4):1-14. [ Links ]
Tonoiven, P. M. A. 2004. Postharvest storage procedures and oxidative stress. HortScience. 39(5):938-942. [ Links ]
Torales, A. C.; Chávez, A. R. y Rodríguez, S. C. 2010. Cambios en la calidad de rúcula mínimamente procesada, efecto de distintos envases. Rev. Iberoam. Tecnol. Post. 11(2):196-203. [ Links ]
Troncoso, R.; Espinoza, C.; Sánchez-Estrada, A.; Tiznado, M. E. and García, H. S. 2005. Analysis of the isothiocyanates application to control Alternaria rot in bell peppers. Food Res. Int. 38:701-708. [ Links ]
Troncoso-Rojas, R.; Sánchez-Estrada, A.; Ruelas, C. and García, H. S. 2005. Effect of benzyl isothiocyanate on tomato fruit infection development by Alternaria alternata. J. Sci. Food Agric. 85:1427-1434. [ Links ]
Venneria, E.; Marinelli, L.; Intorre, F.; Foddai, M. E.; Aurigemma, C.; Durazzo, A.; Maiani, G. and Giusti, M. 2012. Effect of harvest time and minimal processing on nutritional and microbiological quality of three leaf crops. J. Agric. Bio. Res. 1(1):11-17. [ Links ]
Viuda-Martos, M.; Ruiz-Navajas, Y.; Fernández-López, J. and Pérez-Álvarez, J.A. 2007. Antifungal activities of thyme, clove and oregano essential oils. J. Food Safety 27:91-101. [ Links ]
Waterman, P. G. and Mole, S. 1994. Analysis of phenolic plant metabolites. Blackwell Scientific Publications, Oxford, UK. 238 p. [ Links ]














