Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias agrícolas
versión impresa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.6 no.3 Texcoco abr./may. 2015
Artículos
Nivel de ploidía en poblaciones de Leptochloa dubia (Kunth) Nees nativas de México*
Ploidy level in native populations of Leptochloa dubia (Kunth) Nees from Mexico
Santiago Garduño Velázquez1, Adrián Raymundo Quero Carrillo1§, David Bonnett2, Raúl Rodríguez Herrera3, Alejandra Pérez Hernández1 y Alfonso Hernández Garay1
1 Colegio de Postgraduados en Ciencias Agrícolas-Campus Montecillo, Centro de Ganadería. Montecillo, Texcoco, Estado de México. (santiago432@hotmail.com; alejandra.perez@colpos.mx; hernan@colpos.mx). §Autor para correspondencia: queroadrian@colpos.mx.
2 Laboratorio de Cruzas Amplias-Centro Internacional de Mejoramiento de Maíz y Trigo. Texcoco, Estado de México. (D.Bonnett@cgiar.org).
3 Facultad de Ciencias Químicas. Universidad Autónoma de Coahuila. Saltillo, Coahuila. Colegio de Postgraduados Centro de Ganadería. Carretera km 36.5, México-Texcoco, Texcoco, Estado de México, C. P. 56230. (rrh961@hotmail.com).
* Recibido: agosto de 2014
Aceptado: enero de 2015
Resumen
Leptochloa dubia (Kunth) Nees es una gramínea forrajera perenne, nativa del centro-norte de México, adaptada a zonas de escaza precipitación, su número cromosómico básico es x= 10 y su nivel de ploidía desde diploide (2n= 2x= 20) a octoploide (2n= 2x= 80). El objetivo fue determinar el número cromosómico y nivel de ploidía de una colección de 67 poblaciones de pasto Gigante, recolectadas durante 2009 en el Altiplano Mexicano entre 19º a 28º latitud norte y 1 500 a 2 450 msnm. Los conteos cromosómicos se realizaron en ápices de raíces en crecimiento activo (5 a 10 mm), tratadas con 8-hidroxiquinolina (2 mM) por 3.5 h, fijadas en solución (3:1 v/v alcohol absoluto y ácido acético glacial) y se conservaron a 4 ºC, hasta el momento de su evaluación. El recuento de cromosomas se efectúo en microscopio compuesto de contraste de fases. Se observaron células en metafase, por lo menos, cinco preparaciones y 10 células por preparación, para cada planta y población. El 96% de las plantas analizadas fueron tetraploides 2n= 4x= 40 y 4% diploides 2n= 2x= 20. Las plantas diploides fueron originarias de seis poblaciones de Hidalgo, Guanajuato y de la zona limítrofe entre Aguascalientes, Jalisco y Guanajuato, las plantas tetraploides se encontraron en todas las poblaciones evaluadas; sin embargo, no se encontraron diferencias significativas entre localidades (p< 0.05), de acuerdo a su nivel de ploidía. Los niveles encontrados son indicativos del amplio centro de origen de esta especie.
Palabras clave: Leptochloa dubia, cromosomas, diploide, tetraploide.
Abstract
Leptochloa dubia (Kunth) Nees is a perennial forage grass, native to north-central Mexico, adapted to all regions of scarce precipitation, its basic chromosome number is x= 10 and its ploidy level from diploid (2n= 2x= 20) to octoploide (2n= 2x= 80). The objective was to determine the chromosome number and ploidy level of a collection of 67 populations of green sprangletop, collected during 2009 in the Mexican plateau between 19º to 28º north latitude and 1 500 a 2 450 masl. Chromosome counts were made in root tips actively growing (5 to 10 mm), treated with 8-hydroxyquinoline (2 mM) for 3.5 h, fixed in solution (3: 1 v / v absolute ethanol and glacial acetic acid) and stored at 4 °C until evaluation. Chromosome counting was made on a phase contrast microscope. Cells in metaphase were observed, at least, five preparations and 10 cells per preparation, for each plant and population. 96% of the analized plants were tetraploid 2n= 4x= 40 and 4% diploid 2n= 2x= 20. Diploid plants were from six populations of Hidalgo, Guanajuato and the border between Aguascalientes, Jalisco and Guanajuato; tetraploid plantswere found in all populations evaluated; however, no significant differences were found among sites (p< 0.05), according to their ploidy level. The levels found are indicative of the broad center of origin of this species.
Keywords: Leptochloa dubia, chromosomes, diploid, tetraploid.
Introducción
Leptochloa es un género Norteamericano y de origen polifilético (Peterson et al., 2012) que comprende aproximadamente 32 especies anuales y perennes, rizomatozas, estoloniferas o decumbentes (Snow, 1997), algunas con importancia económica y ecológica como maleza (L. coerulescens, L. fascicularis, L. filiformis, L. fusca, L. scabra, L. uninervia y L. virgata), y otras, como forrajeras (L. dubia, L. chinensis, L. obtusiflora y L. paniceae), con distribución pantropical (Watson y Dallwitz, 1992). En el continente Americano se han reportado 17 especies de Leptochloa, 13 de éstas como nativas (Peterson et al., 2001; 2007) y en México, distribuidas principalmente en los trópicos (Dávila et al., 2006).
El pasto Gigante Leptochloa dubia (Kunth) Nees, es perenne amacollado de crecimiento erecto, alcanza una altura de 30 a 110 cm; hojas verde brillante de 10 a 25 cm de longitud por 2 a 5 mm de ancho, panícula en forma piramidal con tres a 12 racimos espigados ascendentes, casi siempre de 4 a 12 cm de largo (Anderson et al., 1995; Snow et al., 2008), es de rápido crecimiento, posee buen potencial de producción de biomasa en zonas de escaza precipitación, alta tolerancia al frío (-10 ºC), buen contenido de proteína, excelente digestibilidad y buena capacidad para asociarse con otras gramíneas (Polk et al., 1976; Pitman, 1980; Mielke, 1993; Jaramillo, 1994; Urrutia et al., 2000; Beatriz et al., 2005). Su distribución geográfica se extiende desde el sur de Estados Unidos de América hasta Argentina, se ha encontrado desde los 100 hasta 2 600 y en ocasiones hasta los 3 150 msnm en la cordillera de los Andes (Valls, 1978; Snow, 1997; Peñaloza et al., 2002; Snow et al., 2008). En estudios aislados se ha reportado diferencia en desarrollo de plántula entre ecotipos nativos de México, para crecimiento de raíz, área foliar y peso seco de la parte aérea (Espinoza y Kuruvadi, 1986). Los estudios citogenéticos en gramíneas son importantes (Morares-Fernandes et al., 1973), ya que éste conocimiento, muestra las relaciones dentro de especie, género o familia, ayuda a caracterizar germoplasma, clarificar el origen de los híbridos naturales y variedades cultivadas (Stace, 2000; Pozzobon et al., 2006). Además, complementa la información obtenida por métodos moleculares, para el mejoramiento genético, cuando se usan en cruzamientos intra e inter-específicos (García, 1990; Sybenga, 1992; Stace, 2000).
La información citogenética es básica para programas de cruzamiento, así como para relacionar el potencial forrajero con el nivel de ploidía (Do Valle et al., 1998; Quero et al., 2007; Morales et al., 2007). Pasto Gigante se caracteriza por un número básico x= 10 cromosomas (Brown, 1951; Gould, 1960; Valls, 1978); estudios previos, reportaron cuatro complementos cromosómicos que van desde nivel diploide 2n= 2x= 20 hasta octoploide 2n= 2x= 80 (Covas, 1949; Brown, 1951; Gould y Soderstrom, 1967; Valls, 1978). La poliploidía es común en gramíneas (Echandi, 1970), y ésta puede aparecer como consecuencia de fallos en la meiosis que conducen a la formación de gametos no reducidos, con cambios consecuentes en la morfología, fisiología y la creación de barreras de aislamiento que conducen a la divergencia evolutiva o por hibridación de especies diploides (De Wet, 1980; Therman, 1995; Lacaeda, 1996).
La alta frecuencia de poliploides en gramíneas sugiere que ha hecho una contribución importante al proceso de diversificación y especiación en Poaceae (Thompson y Lumaret, 1992; Leitch y Bennet, 1997). A mayores altitudes y latitudes existe un aumento en poliploidía, ésto debido a que los genes que controlan caracteres de valor selectivo pueden acumularse con mayor facilidad en poliploides, por lo que pueden adaptarse rápidamente a condiciones ambientales extremas (Granados y López, 1980; Lacaeda, 1996; Comai, 2005).
El centro de origen del pasto gigante se localiza en el centro-norte de México (Mielke, 1993; Pohl y Davidse, 1994; Rodríguez, 2000). En los centros de origen de otras gramíneas forrajeras como: Panicum, Brachiaria, Tripsacum, Paspalum y Bouteloua es donde se ha encontrado la mayor riqueza de morfotipos, citotipos y resistencia (Nakajima et al., 1978; Quero et al., 1997; Morales et al., 2006; Dahmer et al., 2008; Quero et al., 2010; Morales et al., 2013); en éstos puede existir hibridación dentro de la especie con diferente nivel de ploidía (De Wet, 1968; De Wet, 1986; Do Valle), aunque la mayoría de los individuos híbridos son estériles o apomícticos, algunos de ellos pueden presentar ventajas evolutivas y fijar caracteres de importancia agronómica (De Wet, 1986; Sites y Reed, 1994; Leitch y Bennet, 1997), en estas zonas es donde ocurre mayor dinámica de flujo genético entre los diversos niveles de ploidía (Quero et al., 2010).
En las plantas la poliploidía ocurre de 35 a 40% y en gramíneas, hasta 70%, lo que indica que representa una ventaja de adaptación al ambiente (Stebbins, 1972; Thompson y Lumaret, 1992). En gramíneas forrajeras se ha encontrado que la mayoría de las especies incrementa la producción de biomasa, debido a células de mayor tamaño y mayor plasticidad del genoma para adaptarse a condiciones adversas (Echandi, 1970; Quero et al., 2010). El objetivo fue determinar el número cromosómico y nivel de ploidía de 67 poblaciones de pasto Gigante, nativas del altiplano mexicano y relacionarlos con su origen geográfico.
Materiales y métodos
Se colectó semilla de 67 poblaciones de pasto Gigante [Leptochloa dubia (Kunth) Nees], en diferentes regiones de 10 estados de la república Mexicana (Figura 1), en su área de distribución natural: Aguascalientes, Chihuahua, Durango, Guanajuato, Jalisco, México, Michoacán, Querétaro, San Luis Potosí y Zacatecas; entre los paralelos (19º a 28º latitud norte) y 1 500 a 2 450 msnm. En cada sitio se recolectó semilla de 10 plantas diferentes y éstas fueron consideradas como una población. Se sembraron 4 ó 5 plantas por población en charolas de germinación; tres semanas después de la emergencia, fueron trasplantadas a macetas de 15 cm de diámetro y 20 cm de altura, en condiciones de invernadero. El trabajo se realizó en el Laboratorio de Cruzas Amplias, del Centro Internacional de Mejoramiento de Maíz y Trigo (CIMMyT), en Texcoco, Estado de México.
El número cromosómico somático (2n) fue determinado a partir de muestras de ápices de raíces en crecimiento activo (5 a 10 mm). Con la finalidad de muestrear el meristemo apical, donde se encuentra mayor número de células en división (Becerra et al., 2002), el momento de muestreo varió entre 10:00 y 11:00 am, cuando se encontró mayor número de células en metafase. Las raíces se trataron con 8-hidroxiquinoleina (2 mM), a temperatura ambiente (18 a 24 ºC) durante 3.5 h, se fijaron en solución (3:1 v/v alcohol absoluto: ácido acético glacial), se tiñeron en orceina acética al 2% y se conservaron a 4 ºC hasta su evaluación al microscopio compuesto (García, 1990).
Para observar los cromosomas al microscopio óptico, las raíces se colocaron en ebullición en ácido acético al 45% por 30 s, se separó la masa celular y se colocaron sobre portaobjetos, adicionando una gota de ácido acético al 45%; enseguida, se ejerció presión uniforme con el pulgar sobre el cubreobjeto, para dispersar los cromosomas, se hicieron recuentos cromosómicos al menos en cinco preparaciones y 10 células metafásicas por preparación, por planta, con el objetivo de inmersión 100 X con contraste de fases (García, 1990; Valladolid et al., 2004).
Para determinar diferencias entre localidades para nivel de ploidía, los datos por localidad (para más de un nivel de ploidía) fueron analizados empleando análisis categórico de datos, con tablas 2 x r, donde 2 representó los niveles de poliploidía (diploides y tetraploides) y r las localidades (SAS,1997).
Resultados y discusión
El número cromosómico fue determinado para 224 plantas de 67 poblaciones de pasto Gigante, recolectadas en diferentes regiones (Figura 1), se detectaron 215 plantas tetraploides 2n= 2x= 40, el 96% de las plantas evaluadas y se presentaron en todas las poblaciones analizadas; además, se observaron nueve plantas diploides 2n= 2x= 20, 4% de las plantas evaluadas y éstas fueron encontradas en seis poblaciones, en tres regiones distintas (Figura 1; Cuadro 1): suroeste de Hidalgo (Poblaciones 43 y 45); Guanajuato, una planta diploide (Población 1) y tres sitios en los límites de Guanajuato, Jalisco y Aguascalientes (Poblaciones 11, 17 y 19). Covas (1949), encontró que L. dubia poseía 40 cromosomas 2n= 4x= 40 en Sudamérica; mientras que Brown (1950), en Texas, observó plantas hexaploides 2n= 2x= 60; Gould (1960), encontró tres accesiones diploides 2n= 2x= 20 y una tetraploide 2n= 4x= 40, en Texas y dos tetraploides en Arizona y Valls (1978), encontró ocho accesiones octoploides 2n= 8x= 80 y cuatro tetraploides 2n= 2x= 40, en Texas. En gramíneas es común la variación intraespecífica del número cromosómico y la hibridación entre éstas (Khidir, 1985; Fernández et al., 1991).
La poliploidía puede aparecer como consecuencia de la formación de gametos no reducidos, por la fecundación simultánea de un gameto femenino y dos masculinos o por la formación de quimeras o mosaicos poliploides, dando origen a poliploides (Lacaeda, 1996). A mayor nivel de ploidía, es mayor el tamaño del núcleo celular como resultado de la duplicación cromosómica y hay mayor producción de biomasa (Mayers, 1947; Echandi, 1970; Lacaeda, 1996; Quero et al., 2010). En especies simpátricas con diferente nivel de ploidía, la hibridación es abundante, por lo que éstos son fuente de diversidad genética (De Wet, 1986).
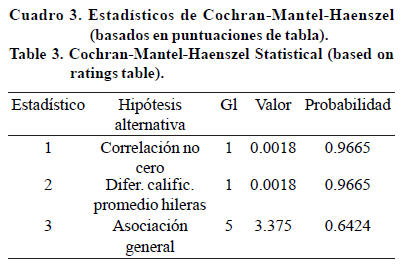
Al analizar las localidades y niveles de ploidía con el estadístico al azar Qs, que está marcado como Chi-cuadrada de Mantel-Haenszel, el valor Chi-cuadrada de Pearson Qp esta etiquetado "Chi-cuadrada". Qs tuvo un valor de 0.0018 (Cuadro 2) y p= 0.96; Qp tiene un valor de 3.51 y p= 0.62, ambos no son significativos; por tanto, no hay diferencia entre localidades, basándose en el nivel de ploidía. El valor QMH para la correlación no cero fue igual a 0.0018, con 1 grado de libertad, valor no significativo, reforzando la conclusión de que no existen diferencias entre localidades con base al nivel de ploidía (Cuadro 3).
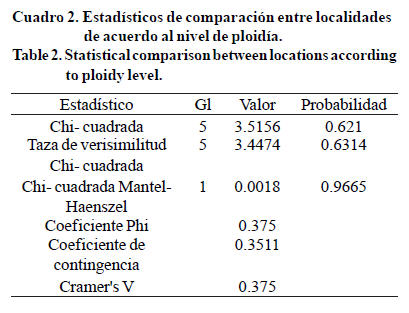
En las localidades, la frecuencia de diploides fue menor (tres magnitudes), en comparación con las tetraploides. Las plantas tetraploides tienen mayor valor adaptativo en comparación con plantas diploides. Hay tres ventajas de los poliploides. Las primeras dos, heterosis y redundancia génica, resultan de duplicación de genes; mientras que la tercera, reproducción asexual (apomixis) significa una ruta de escape a la esterilidad por desbalance embrión:endospermo (Quero et al., 2010). La heterosis causa que los poliploides sean más vigorosos que sus congéneres diploides, mientras que la redundancia génica los protege de efectos deletéreos de las mutaciones.
La reproducción asexual posibilita a los poliploides reproducirse en ausencia de compañeros sexuales (Comai, 2005). Solo en Tapezala (17) se encontró mayor presencia de individuos diploides en comparación con tetraploides. Una posible explicación es que los poliploides adaptados que evitan la extinción entran en una trayectoria evolutiva de diploidización, durante la cual la redundancia genómica es reducida (Comai, 2005).
Los recuentos cromosómicos en Leptochloa dubia (Kunth) Nees son particularmente difíciles, debido a la dureza de las paredes celulares y tamaño pequeño de los cromosomas, característico de la tribu Eragrostideae, que es de 2 a 3 micras en la mayoría de los casos (Valls, 1978; Granados y López, 1980). Es posible que debido a estas dificultades, ningún trabajo citológico sobre pasto gigante presenta descripciones del cariotipo. Sin embargo, estas observaciones muestran que predominan los cromosomas metacéntricos y submetacéntricos (Figura 2). Por lo difícil que resulta realizar conteos cromosómicos en esta especie, algunos autores trataron de estimar el nivel de ploidía por métodos indirectos. Valls (1978), trató de relacionar el nivel de ploidía con el tamaño de polen y estomas, encontró que el tamaño del grano de polen y del estoma era significativamente más grande, cuando se trataba de plantas octaploides, en comparación con plantas tetraploides.
Conclusiones
Las plantas tetraploides (2n= 4x= 40) incluyeron a 96% de las poblaciones evaluadas y fueron procedentes de todos los sitios de colecta y 4% fueron diploides (2n= 2x= 20). Las plantas diploides se ubicaron en tres regiones: Suroeste de Hidalgo, Sureste de Guanajuato y límites de Aguascalientes, Guanajuato y Jalisco. No se encontraron diferencias en localidad, de acuerdo a su nivel de ploidía. Conviene realizar estudios de embriología y relacionarlos con el nivel de ploidía.
Agradecimientos
Al Consejo Nacional de Ciencia y Tecnología (CONACyT), por la beca de postgrado otorgada a Santiago Garduño Velázquez, lo que permitió la realización de ésta investigación. A la LPI16 de COLPOS, por su valioso apoyo.
Literatura citada
Anderson, J. S.; W. Curtis, W. and Hanson, A. A. 1995. Grass varieties in the United States. United States Dep. of Agriculture. CRC Lewis Publishers. EE. UU. 296 p. [ Links ]
Beatriz, E. R.; Bianco, C. A.; Mercado, S. E. y Scappini, E. G. 2005. Poáceas de San Luis. Distribución e importancia económica. Universidad Nacional de Río Cuarto. Argentina. 150 p. [ Links ]
Becerra, N. L.; Barrera, T. E. y Marquínez, C. X. 2002. Anatomía y morfología de los órganos vegetativos de las plantas vasculares. UNIBIBLOS. Bogotá, Colombia. 276 p. [ Links ]
Brown, W. V. 1950. A cytological study of some Texas Gramineae. Bull. Torrey Bot. Club. 77:63-76. [ Links ]
Brown, W. V. 1951. Chromosome numbers of some Texas grasses. Bull. Torrey Bot. Club. 78:292-299. [ Links ]
Carnahan, H. L. and Hill, H. D. 1961. Cytology and genetics o forage grasses. Bot. Rev. 27:1-162. [ Links ]
Comai, L. 2005. The advantages and disadvantages of being polyploidy. Nature Reviews Genetics. 6:836-846. [ Links ]
COTECOCA (Comisión Técnico Consultiva de Coeficientes de Agostadero). 1991. Las Gramíneas de México. Tomo III. Secretaría de Agricultura y Recursos Hidráulicos (SARH). México. 332 p. [ Links ]
Covas, G. 1949. Estudios cariológicos en antófitas III. Darwiniana. 9:158-162. [ Links ]
Dahmer, N., Schifino-Wittmann, M. T.; Dall’, M. A. and Castro, B. 2008. Cytogenetic data for Paspalum notatum Flüge accessions. Sci. Agric. 65:381-388. [ Links ]
Dávila, P.; Mejía-Saulés, M. T.; Gómez-Sánchez, M.; Valdés-Reyna, J.; Ortiz, J. J.; Morín, C.; Castrejón, J. y Ocampo, A. 2006. Catálogo de las gramíneas de México. UNAM–CONABIO. México. 671 p. [ Links ]
De Wet, J. M. J. 1968. Diploid - tetraploid - haploid cycles and the origin of variability in Dichanthium agamospecies. Evolution. 22:394-397. [ Links ]
De Wet, J. M. J. 1980. Origins of poliploids In: Lewis, W. H. (Ed.). Poliploidy biological relevance. Plenum Press. New Yok and London. 583 p. [ Links ]
De Wet, J. M. J. 1986. Hybridization and polyploidy in the Poaceae. In: Soderstrom, T. R. Hilu, L.; Campbell, K. W. and Barkworth, M. E. (Eds.). Grass systematic and evolution 1st (Ed.). Washington, DC USA. Smithsonian Institution Press. 188-194 pp. [ Links ]
Do Valle, C. and Savidan, H. 1996. Genetics, cytogenetics and reproductive byology of Brachiaria. Brachiaria: biology, agronomy, and improvement. CIAT-EMBRAPA. 147-163 pp. [ Links ]
Do Valle, C.; Miles, B. J.; Agudelo, J.; Calderón, M. A. e Escandón, M. L. 1998. Collecão de germoplasma do espécies de Brachiaria. CIAT: estudios básicos visando ao melhoramiento genético. CIAT-EMBRAPA. 1-36 pp. [ Links ]
Echandi, Z. R. 1970. Mejoramiento de forrajes en especial de las gramíneas. In: Primer Seminario Internacional sobre la enseñanza de cultivos. Instituto Interamericano de Ciencias Agrícolas (IICA).Turrialba, Costa Rica. 30-37 pp. [ Links ]
Espinoza, Z. R.; Kuruvadi S. 1986. Potencial del sistema radical en colecciones de zacate gigante (Leptochloa dubia H. B. K. Nees). 1986. Universidad Agraria Antonio Narro (UAAAN). 2(1):36-48. [ Links ]
Fernández, O. A.; Brevedan, R. E. y Gargano, A. O. 1991. Citogenética In: el pasto llorón su biología y manejo. CERZOS. Universidad Nacional del Sur. Argentina. 19-38 pp. [ Links ]
García, V. A. 1990. Técnicas y procedimientos de citogenética vegetal. Colegio de Postgraduados en Ciencias Agrícolas. Montecillo, México. 144 p. [ Links ]
Gould, F. 1960. Cromosome numbers in southwestern grasses II. Amer. J. Bot. 47:873-877. [ Links ]
Gould, F. and Soderstrom, T. R. 1967. Chromosome numbers of tropical American grasses. Amer. J. Bot. 54:676-683. [ Links ]
Granados, S. D. y López, R. G. 1980. Manual de agrostología. Universidad Autónoma Chapingo (UACH), Departamento de Zonas Áridas. México. 216 p. [ Links ]
Jaramillo, V. 1994. Revegetación y reforestación de las áreas ganaderas de las zonas áridas y semiáridas de México. Comisión Técnica Consultiva de Coeficientes de Agostaderos (COTECOCA). Subsecretaría de Ganadería. Secretaría de Agricultura y Recursos Hidráulicos (SARH). México, D. F. 40 p. [ Links ]
Khidir, W. H. 1985. Biological basis for adaptation in grasses: an introduction. Ann. Missouri Bot. Garden. 72:824-825. [ Links ]
Lacadena, J. R. 1996. Citogenética. Editorial Complutense, S. A. Madrid, España. 931 p. [ Links ]
Leitch, I. J. and Bennet, M. D. 1997. Polyploidy in angiosperm. Trends Plant Sci. 2:470-476. [ Links ]
Mayers, W. M. 1947. Cytology and genetics of forage grasses. The botanical Review. Springer on behalf of New York Botanical Garden Press. 13:369-421. [ Links ]
Mielke, J. 1993. Native plants for Southewestern landscapes. University of Texas Press. Texas, EE.UU. 310 p. [ Links ]
Morales, N. C. R.; Quero, C. A. R.; Hernández, G. A.; Pérez, P. J. y González, S. S. 2006. Evaluación de la diversidad del pasto nativo Bouteloua curtipendula (Michx.) Torr. mediante marcadores de AFLP. Agrociencia. 40:711-720. [ Links ]
Morales, N. C. R., A. R. Quero y C. H. A. Avendaño. 2007. Caracterización de la diversidad nativa del zacate banderita Boutelua curtipendula (Michx.) Torr. mediante su nivel de ploidía. Téc. Pec. Méx. 45:263-278. [ Links ]
Morales-Nieto. C. R.; Rivero-Hernández, O.; Melgoza-Castillo A.; Jurado-Guerra P. y Martìnez-Salvador, M. 2013. Caracterización morfológica y molecular de Leptochloa dubia (Poaceae) en Chihuahua, México. Polibotánica. 36:79-94. [ Links ]
Morares-Fernandes, M. I.; Barreto, B. I. and Salzano, F. M. 1973. Cytogenetic, ecologic and morphologic studies in Brazilian form Paspalum notatum. Can. J. Gen. Cytol. 15:523-531. [ Links ]
Nakajima, K.; Ochi, M. and Mochizuki, N. 1978. Characteristics and variations of guineagrass strains collected and introduced from Africa. Evaluation of characteristics and variations. Bull. Natl. Grassl. Inst. Japan. 12:38-53. [ Links ]
Peñaloza, J. G.; Peterson, P. M. y Gilardo, D. C. 2002. Los géneros Eragrostis y Leptochloa (Poaceae: Cynodonteae) en Colombia. Hickenia 3. 35:133-141. [ Links ]
Peterson, P. M.; Soreng, R. J.; Davidse, G.; Filgueiras, T. S.; Zuloaga, F. O. and Judziewicz, E. J. 2001. Catalogue of new world grasses (Poaceae): II. Subfamily Chloridoideae. Contr. U.S. Natl. Herb. 41:1-255. [ Links ]
Peterson, P. M.; Columbus, J. T. and Pennington, S. J. 2007. Classification and biogeography of New World grasses: Chloridoideae. Aliso. 23:580-59. [ Links ]
Peterson, P. M.; Romaschenko, K.; Snow, N. and Johnson, G. 2012. A molecular phylogeny and classification of Leptochloa (Poaceae: Chloiroideae: Chlorideae) sensu lato and related genera. Ann. Bot. 109:1317-1329. [ Links ]
Pitman, W. 1980. Relationships between seasonal forage quality patterns and structural carbohydrates of warm-season grasses and enviromental factors. Thesis of Doctor of Philosophy. Texas A & M University. 97 p. [ Links ]
Pohl, R. W. y Davidse, G. 1994. Leptochloa. In: G. Davidse, M. Sousa S. y Chater, O. A. (Eds.). Flora Mesoamericana. Alismataceae a Cyperaceae. Universidad Nacional Autónoma de México (UNAM). Instituto de Biología. México, D. F. 6:335-352. [ Links ]
Polk, D. B.; Scifres, C. J. and Mutz, J. L. 1976. Establishment, production, and protein content of four grasses in South Texas. J. Range Manage. 29:240-244. [ Links ]
Pozzobon, M. T.; Schifino-Wittmann, M. T. and Bianchetti, L. B. 2006. Chromosome numbers in wild and semidomesticated Brazilian Capsicum L. (Solanaceae) species do: x= 12 and x= 13 represent two evolutionary lines?. Bot. J. Linnean Soc. London. 151:259-269. [ Links ]
Quero, C. A. R.; Savidan, Y. H.; Berthaud, J.; Pérez, P. J. y Espinoza, J. V. 1997. Estudios citogenéticos en el género Tripsacum. Agrociencia. 31:331-334. [ Links ]
Quero, C. A. R.; Enríquez, J. F. Q. y Miranda, L. J. 2007. Evaluación de especies forrajeras en América tropical, avances o status quo. Interciencia. 32:566-571. [ Links ]
Quero, C. A. R.; Enríquez, J. F. Q.; Morales, C. R. N. y Miranda, L. J. 2010. Apomixis y su importancia en el mejoramiento en la selección y mejoramiento de las gramíneas tropicales. Rev. Mex. Cienc. Pec. 1:25-41. [ Links ]
Rodríguez, C. B. 2000. Gramíneas características y claves. Universidad Autónoma Chapingo. México (UACH). 214 p. [ Links ]
Statistical Analysis System (SAS) Institute. 1997. SAS user’s guide. Statistics. Version 8. SAS Inst., Cary, NC. USA. Quality, and elemental removal. J. Environ. Qual. 1167. [ Links ]
Sites, J. W. and Reed, K. M. 1994. Chromosomal evolution, especiation and sistematics: some relevant issues. Herpetologica. 50:237-249. [ Links ]
Snow, N. 1997. Phylogeny and systematics of Leptochloa P. Beauv. sensu lato (Poaceae: Chloridoideae). Ph. D. dissertation, Washington University, St. Louis, Missouri. 506 p. [ Links ]
Snow, N.; Peterson, P. M. and Giraldo, D. C. 2008. Leptochloa (Poaceae: Chloridoideae) in Colombia. J. Bot. Res. Inst. Texas. 2:861-874. [ Links ]
Stace, C. A. 2000. Cytology and citogenetics as a fundamental taxonomic resourse for the 20th and 21th Centuries. Taxon. Utrecht. 49:451-477. [ Links ]
Stebbins, G. L. 1972. The evolution of the grass family. In: Youngner, V. B. and McKell, C. M. (Eds.). The biology and utilization of grasses. Academic Press, New York. 1-17 pp. [ Links ]
Sybenga, J. 1992. Cytogenetics in plant breeding. Springer, Berlin Heidelberg, New York. 469 p. [ Links ]
Therman, E. 1995. Chromosome behavior in cell diferentiation. A field ripe for exploration?. Genetics. 141:799-804. [ Links ]
Thompson, J. D. and Lumaret, R. 1992. The evolutionary dynamics of poliploid plants: origins, establishment and persistence. Trends Ecol. Evol. 7:302-306. [ Links ]
Urrutia, J. M.; Cordero, M. A. C. y Beltrán, S. L. 2000. Ovinocultura de agostadero en el norte de México. Universidad Autónoma de San Luis Potosí (UASLP). México. 104 p. [ Links ]
Valladolid, A.; Blas, B. y González, R. 2004. Introducción al recuento de cromosomas somáticos en raíces andinas. In: raíces Andinas: contribución al conocimiento y a la capacitación. Centro Internacional de la Papa (CIP). Lima, Perú. 95-100 pp. [ Links ]
Valls, J. M. F. 1978. A biosystematic study of Leptochloa with special emphasis on Leptochloa dubia (Graminae:Chlorideae). Ph. D. Thesis. Texas A & M. Univ., College Station. Texas, EE.UU. 205 p. [ Links ]
Watson, L. and Dallwitz, M. 1992. The grass genera of the world. Cab International. Cambridge, UK.1063 p. [ Links ]














