Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias agrícolas
versión impresa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.6 no.2 Texcoco feb./mar. 2015
Artículos
Mecanismos de defensa en portainjertos de aguacate ante Phytophthora cinnamomi Rands*
Defense mechanisms in avocado rootstocks to Phytophthora cinnamomi Rands
Petra Andrade-Hoyos1§, Eduardo Molina Gayosso2, Carlos De León1, María de la Cruz Espíndola Barquera3, Dionicio Alvarado Rosales1 y Alfredo López Jiménez1
1 Colegio de Postgraduados-Postgrado en Fitopatología. Carretera México-Texcoco, km 36.5, Montecillo, Texcoco, Estado de México. C. P. 56230. Tel: 01 738 724117, Ext. 150 y 151, 595 952 0200, Ext. 1740, 1681 y 1116. (pandrade@upfim.edu.mx; cdeleon@colpos.mx; dionicio@colpos.mx; lopezja@colpos.mx).
2 Universidad Politécnica de Puebla. Tercer Carril del Ejido "Serrano" s/n. San Mateo Cuanalá. Juan C. Bonilla. Tel. 01 222 7746654. (eduardo.molina@uppuebla.edu.mx).
3 Fundación Salvador Sánchez Colín-CICTAMEX S. C. Ignacio Zaragoza Núm. 6 Coatepec Harinas, Estado de México. C. P. 51700. Tel. 01 723 1450160. (mespindolab@gmail.com). §Autora para correspondencia: andrad@colpos.mx.
* Recibido: septiembre de 2014
Aceptado: enero de 2015
Resumen
El estudio de la resistencia en plantas a enfermedades de la raíz, frecuentemente se evalúa a nivel macroscópico, esto es, seleccionando plantas de apariencia sana o sobrevivientes a la presión de inóculo sin considerar los mecanismos de resistencia histológica ante patógenos de raíz, como es el caso de Phytophthora cinnamomi causante de la "tristeza del aguacatero". El objetivo del presente trabajo fue identificar la presencia de micelio P. cinnamomi en el xilema de la raíz y la implicación en los mecanismos de resistencia-tolerancia en plantas de aguacate de cinco variedades de portainjertos. Los mecanismos estudiados fueron la formación de tilosas y el depósito de fenoles. Se observó la presencia de hifas en xilema, formación de tilosas y acumulación de fenoles en raíces provenientes de plantas muertas, con síntomas de marchitez y asintomáticas de los portainjertos Duke-7 y Thomas, Tepetl, Atlixco y Tepeyanco, previamente inoculadas con P. cinnamomi en condiciones de temperatura controlada en el suelo (17 y 28 °C). El contenido de micelio en el xilema de plantas muertas de Duke-7, Thomas y Tepetl a 17 °C no mostró diferencias significativas; sin embargo, a 28 °C el contenido de micelio en Duke-7 fue altamente significativo (p< 0.05). En plantas con marchitez, la presencia de micelio fue abundante a 17 °C en Tepetl, por lo que se considera susceptible al patógeno. Atlixco mostró bajo contenido micelial a 28 °C, por lo que se considera tolerante. En plantas con síntomas de marchitez y asintomáticas, la formación de tilosas y la deposición de compuestos fenólicos contribuyeron a la defensa contra P. cinnamomi. Las selecciones de la raza Mexicana de Tepeyanco, Atlixco y Tepetl mostraron resistencia debido probablemente a que activaron sus mecanismos de defensa histológica estructural y química previo a la infección por P. cinnamomi.
Palabras clave: Persea americana Mill., defensa histológica, deposición de fenoles, tilosas.
Abstract
The study of the resistance in plants to root diseases are often evaluated at a macroscopic level, that is, selecting plants with healthy appearance and surviving the inoculum pressure regardless of histological resistance mechanisms to root pathogens, as is the case of Phytophthora cinnamomi causing the "sadness of avocado." The aim of this study was to identify the presence of P. cinnamomi mycelium in the xylem of the root and the mechanisms involved in resistance-tolerance in avocado plants from five varieties of rootstocks. The studied mechanisms were tylose formation and phenolic deposits. The presence of hyphae in xylem, tylose formation and phenolic accumulation in roots from dead plants with wilt symptoms and asymptomatic of Duke-7 and Thomas, Tepetl, Atlixco and Tepeyanco rootstocks was noted which were previously inoculated with P. cinnamomi under controlled temperature on the soil (17 and 28 °C). Mycelium content in the xylem of dead plants Duke-7, Thomas and Tepetl to 17 °C showed no significant differences; however, at 28 °C the mycelium content in Duke-7 was highly significant (p< 0.05). In wilted plants, the presence of mycelium was abundant in Tepetl at 17 °C, so it is considered susceptible to the pathogen. Atlixco showed low Mycelium content at 28 °C, which is considered tolerant. In plants with wilt symptoms and asymptomatic, tyloses formation and phenolic deposition compounds contribute to defense against P. cinnamomi. The selections of the Mexican race Tepeyanco,Atlixco and Tepetl showed resistance, probably because activated their structural histological mechanisms of defense and chemical prior to infection by P. cinnamomi.
Keywords: Persea americana Mill, histological defense, phenolic deposition, tyloses.
Introducción
La enfermedad conocida como "tristeza del aguacatero" es causada por el oomicete Phytophthora cinnamomi. El efecto principal causado por el oomicete es la pudrición de raíces con la subsiguiente muerte descendente del árbol. El control de esta enfermedad se basa generalmente en estudios epidemiológicos y manejo integrado del cultivo de aguacate. En varios países como EE. UU, Sudáfrica, España, Israel y recientemente en México la prioridad ha sido la búsqueda y selección de portainjertos tolerantes-resistentes a P. cinnamomi (Zentmyer y Schieber 1987; Gallo, 1992; Gallo et al, 1999; Vidales y Alcántar 1999; Téliz y Mora, 2007).
El centro de origen del aguacate es América. El subgénero Persea predomina desde la parte central de México, Guatemala y hasta Centroamérica. En este contexto, México es considerado como el país de mayor diversidad, donde existen 20 diferentes especies emparentadas con Persea americana (Barrientos y López, 2000). En las plantaciones de México sólo se utiliza el aguacate criollo Persea americana var. drymifolia raza Mexicana, debido a que los híbridos considerados como resistentes aP. cinnamomi no se adaptan a las condiciones edáficas y climáticas de la franja aguacatera comprendida por los estados de Michoacán, Puebla, Morelos, Nayarit y Veracruz. Asimismo, en el caso del uso de portainjertos, la mayoría de los árboles de aguacate en México están injertados sobre portainjertos de semilla procedente de árboles de la raza Mexicana de polinización libre (Newett et al., 2000; Salazar et al., 2004; Bellon et al, 2009). Lo anterior sugiere una variación significativa en los huertos y es a partir de esta variabilidad genética que se puede encontrar resistencia al oomicete.
El estudio de la resistencia en plantas a enfermedades de la raíz, frecuentemente se evalúa a nivel macroscópico, esto es, seleccionando plantas de apariencia sana o sobrevivientes a la presión de inóculo sin considerar los mecanismos de resistencia histológica ante patógenos. En el caso de las enfermedades que afectan el sistema vascular de las plantas, éstas reaccionan al ataque de patógenos produciendo estructuras y sustancias químicas que tratan de interferir en el desarrollo del mismo, como es el caso de tilosas, gomas, geles y diversos compuestos fenólicos. Éstos factores de resistencia estructural son inducidos para formar barreras y limitar al patógeno en una región del xilema con la finalidad de evitar el crecimiento del patógeno dentro del tejido de la raíz (Vleeshouwers et al, 2000; Del Río et al, 2002 y Hobbes, 2004; Cruz et al, 2006 y Agrios, 2010). La incorporación de estos factores de resistencia mediante la selección de variedades resistentes en el cultivo de aguacate probablemente sea la estrategia más efectiva a largo plazo para disminuir los daños causados por P. cinnamomi.
La formación de tilosas se produce en respuesta a la infección en tejidos vasculares donde ocurre un sobrecrecimiento de los protoplastos de las células parenquimatosas adyacentes. De igual manera, dentro de estos mecanismos de defensa, se producen compuestos fenólicos llamados fitoanticipinas (ácidos cinámicos, flavonoides, isoflavonoides, deoxiantocianinas, estilbenos, cumarinas, cromonas) alrededor de las células los cuales actúan de forma pasiva reforzando la pared celular e inhibiendo el crecimiento de hifas (Scalbert, 1991; Schlosser, 1994; Vleeshouwers et al., 2000).
La selección de portainjertos tolerantes-resistentes a la pudrición de raíz y su relación con el estudio de mecanismos de defensa histológica a P. cinnamomi no ha sido una prioridad en el cultivo de aguacate. En estudios histológicos en otras especies, como en el caso de la papa, afectada por Fusarium oxysporum, alfalfa por Verticillium alboatrum, olmo por verticillium, vid afectada por Phaeomoniella chlamydospora y Phaeoacremonium inflatipes y en el cultivo de chile con Phytophthora capsici y Fusarium sp., se ha observado que en estos patosistemas, las plantas tienen la capacidad de reaccionar ante una invasión microbiana desarrollando mecanismos de defensa como la formación de tilosas y síntesis de compuestos fenólicos para detener el avance del patógeno, y al final algunas plantas muestran susceptibilidad al patógeno debido a que superan las barreras de defensa producidas por la planta (Sepulveda et al., 1979; Grant y Byrt, 1984; Vleeshouwers et al, 2000; Nicks y Lindhout, 2004; Cruz et al, 2006). Así, el objetivo de este trabajo fue identificar la presencia de micelio de P. cinnamomi en el xilema de la raíz y su implicación en la formación de tilosas y depósito de fenoles como mecanismos de defensa histológica en portainjertos de aguacate.
Materiales y métodos
Muestreo de raíces y preparación de las muestras histopatológicas
La inoculación de P. cinnamomi y la selección de plantas tolerantes-resistentes a la enfermedad se realizó siguiendo una modificación de la técnica de tanques de agua con temperatura controlada utilizada por Walker (1957). Los tanques utilizados de 1.5 * 1.10 m conteniendo agua destilada se mantuvieron a temperaturas controladas a 17 y 28 °C y circulación continua de aire. Las plantas de aguacate, diez por cada variedad y de uno a dos años de edad, de los portainjertos comerciales Duke-7 y Thomas, y de los genotipos Tepetl, Tepeyanco y Atlixco de raza Mexicana fueron cultivados en contenedores de polietileno negro de 14 cm de diámetro y 30 cm de altura con suelo estéril, introducidos en los tanques e inoculados con 250 mL/contenedor de fragmentos de 2.5 * 103 mL de fragmentos de micelio de P. cinnamomi. Tanques con las mismas características en número y crecimiento de plantas, además de temperatura, fueron dejadas sin inocular como testigos.
Cuando las primeras plantas mostraron síntomas avanzados de marchitamiento se tomaron muestras al azar de raíces adventicias con síntomas de pudrición de una planta muerta, dos plantas con síntomas de marchitez y dos plantas asintomáticas (aproximadamente 5 gramos por planta), además de dos plantas testigo (sin inocular) por cada uno de los genotipos. Posteriormente, para la realización de los cortes histológicos, las raíces colectadas se lavaron con agua destilada y se cortaron segmentos de 1 cm de longitud. Las muestras colectadas se colocaron en solución FAA (formaldehido: 100 mL, ácido acético glacial: 50 mL, etanol: 500 mL y agua destilada: 350 mL) durante 24 h a temperatura ambiente. Se lavaron con agua y se colocaron para deshidratar en etanol a 50, 70, 96 y 100%, durante 3 horas en cada disolución.
Posteriormente, se transfirieron a diluciones 3:1, 1:1 y 1:3 de alcohol-xileno y xileno a 100% durante 72 h en cada dilución. Al término de este tiempo, las muestras se retiraron y embebieron en parafina fundida (Paraplast SIGMA®) por 24 h a ± 60 °C (López et al. 2005) en un procesador automático de tejidos Tissue-Tek R II, modelo 4640-BR® (Sakura Finetechnical Co., LTD Tokio, Japan). Finalmente, se extrajeron del procesador, se vertió parafina fundida en cubos de papel (1 cm de ancho por 1.5 cm de largo) para embeber el tejido radical y se dejó enfriar hasta solidificarse. Los cubos de parafina con el tejido se montaron en cubos de madera y se procedió a realizar cortes de 15 μ de grosor con un micrótomo rotatorio (Spencer 820®). Los cortes se suspendieron en agua con grenetina grado bacteriológico a 55 °C y se montaron en portaobjetos hasta dejarlos secar a temperatura ambiente.
Tinción safranina-verde rápido
La parafina se removió de los portaobjetos colocándolos en estufa a 50 °C por 20 min. Posteriormente, los cortes se pasaron por tres cambios de xileno a 100% por tres minutos cada uno y se hidrataron en dos cambios de alcohol a 96 y 100% por tres minutos cada uno. Al final, las muestras se tiñeron con la técnica de doble safranina y verde rápido Fast Green FCF (López et al, 2005). Las muestras se montaron en resina sintética (SIGMA®) y se observaron al microscopio de luz a 40 X (VE-B6 Velab®) para identificar la presencia de micelio, tilosas y depósito de compuestos fenólicos en los tejidos radicales.
Evaluación de variables histológicas
La presencia de micelio, tilosas y el depósito de compuestos fenólicos de color rojizo con paredes lignificadas se determinaron visualmente como ausencia o presencia. Para la evaluación microscópica de los cortes histológicos se consideraron 10 portaobjetos (repeticiones) por cada uno de los cinco genotipos que presentaron plantas muertas, con síntomas de marchitez y plantas asintomáticas inoculadas con P. cinnamomi y sin inocular con temperaturas de 17 y 28 °C. Se revisaron 5 cortes de cada una de las 10 repeticiones y se observaron 5 campos con el objetivo 40 X (250 observaciones en total). Los datos obtenidos se arreglaron de manera factorial (5 * 2) para plantas muertas, asintomáticas y con marchitez, en donde el nivel 5 correspondió a los 5 genotipos y el 2 a las temperaturas de 17 y 28 °C. Se realizó análisis de varianza a los datos obtenidos y comparación de medias con la prueba de Duncan (p< 0.05). Se utilizó el paquete estadístico SAS (Statistical Analysis System V 9.0; SAS Institute, 2001).
Resultados y discusión
En los cortes histológicos de raíces de los genotipos de aguacate previamente infectados con el oomicete P. cinnamomi, se observó infección y activación de mecanismos de defensa. Se detectó la presencia de micelio de P. cinnamomi, tilosas y depósito de compuestos fenólicos tanto en plantas muertas, como con síntomas de marchitez y en plantas asintomáticas a 17 y 28 °C (Cuadro 1, 2 y 3), (p< 0.05) con un coeficiente de variación elevado, indicativo de la variabilidad genética de los materiales evaluados. Muy al contrario, en las raíces de portainjertos testigo (sin inocular) a las dos temperaturas probadas, 17 y 28 °C, no se detectó la presencia de micelio de P. cinnamomi, tilosas ni compuestos fenólicos. Lo anterior, pone de manifiesto que la presencia de tilosas y depósitos de compuestos fenólicos son mecanismos de defensa que, en este caso, están en función de la presencia o ausencia de P. cinnamomi.
Presencia de micelio en plantas muertas
En las raíces de los portainjertos Duke-7, y Thomas, y del genotipo Tepetl mantenidas a 17 °C, el porcentaje de micelio presente en el xilema de raíces adventicias (1 a 4 mm. de diámetro aproximadamente) no mostró diferencias estadísticamente significativas. Sin embargo, a 28 °C Tepetl y Thomas, tuvieron un porcentaje de presencia de micelio en el xilema significativamente menor en comparación con Duke-7, que presentó mayor contenido de micelio (13.92%). Esto sugiere que la cantidad de micelio en el xilema de raíces de los portainjertos muertos está relacionado con la infección del oomicete y sobre todo por la incapacidad de las plantas para contrarrestar el efecto de invasión del micelio, la infección superó las barreras estructurales de defensa (Cuadro 1).
La temperatura y alta humedad del suelo en las que se mantuvieron las plantas fueron determinantes para que el oomicete causara infección y se facilitara el establecimiento, colonización y progreso del patógeno en el sistema radical y finalmente culminar con la muerte de plantas susceptibles. El micelio logró penetrar las células adyacentes al xilema hasta llegar al xilema y células parenquimatosas, superando las barreras estructurales de resistencia como lo son las tilosas, presentándose síntomas de marchitamiento y por último la muerte de las plantas (Grant y Byrt, 1984; Agrios, 2010).
Presencia de micelio en plantas con síntomas de marchitez
En el genotipo Tepetl, la presencia de micelio en el xilema de las plantas en condiciones de temperatura en el suelo a 17 °C fue significativamente mayor (19.04%) en comparación con Thomas y Duke-7 (3.12 y 5.76%), por lo que se considera susceptible histológicamente al observarse mayor colonización de hifas de P. cinnamomi a nivel microscópico. Sin embargo, este mismo genotipo a 28 °C presentó 7.92% de micelio en el xilema, siendo menor a Thomas (p< 0.05). El alto y bajo contenido de micelio en el xilema en el genotipo Tepetl a 17 y 28 °C respectivamente, posiblemente se debe a la variabilidad genética que resulta generalmente en susceptibilidad y cierta tolerancia al impedir la invasión vascular por este patógeno.
El portainjerto Thomas presentó síntomas de marchitamiento con un menor desarrollo micelial (3.12%) en el xilema a 17 °C; sin embargo, a 28 °C mostró mayor desarrollo micelial (15.12%) en comparación con los genotipos Tepetl, Tepeyanco y Atlixco (p< 0.05). Por otro lado, el genotipo Tepeyanco presentó el menor contenido de micelio en el xilema (Cuadro 1), lo que sugiere que el alto o bajo porcentaje de micelio en el xilema es capaz de causar síntomas de marchitez y alteraciones microscópicas en la raíz de éste genotipo; bajo porcentaje que es debido a la formación de barreras físicas y contenido de compuestos antifúngicos (tilosas y polifenoles, respectivamente) como defensa de la planta ante la presencia del oomicete. Se sugiere que esta respuesta, bajo porcentaje de micelio y síntomas de marchitez, se debe a la habilidad del patógeno para avanzar sistémicamente a lo largo de la raíz y a la susceptibilidad del hospedante, coincidiendo con lo observado en raíces de Ulmus minor Mill, Vitis vinífera L. y Capsicum sp., que mostraron diferentes niveles de susceptibilidad y tolerancia a las enfermedades sistémicas causadas por Verticillium sp., Fusarium sp. y Ophiostoma novo-ulmi (Sepúlveda et al., 1979; Grant y Byrt, 1984; Vleeshouwers et al., 2000; Niksy Lindhout, 2004), respectivamente.
Los genotipos Tepetl y Atlixco mostraron contenido micelial similar a 28 °C, por lo que, a nivel histológico pueden considerarse como tolerantes aP. cinnamomi. Por otra parte, Tepeyanco obtuvo una significativa disminución porcentual de desarrollo micelial en el xilema a 28 °C, indicando que éste puede ser un portainjerto resistente al oomicete al activar sus mecanismos de defensa impidiendo el avance del patógeno (Cuadro 1). Aunque a 28 °C se detectó una mayor cantidad de micelio lo que indicó que la raíz en esta temperatura permitió la interacción con el patógeno y causó infección del sistema radical.
Presencia de micelio en plantas asintomáticas
Los plantas asintomáticas de los genotipos Tepeyanco y Atlixco, de la raza Mexicana, presentaron el mayor porcentaje de desarrollo micelial en el xilema de la raíz cuando fueron tratados a 17 y 28 °C. De acuerdo con los resultados macroscópicos (plantas con síntomas, sin síntomas y muertas) obtenidos a 28 °C, estos genotipos tuvieron resistencia al oomicete al presentar mayor número de plantas asintomáticas, ausencia de plantas muertas y solamente 10% de plantas con síntomas de marchitez p< 0.05 (Andrade et al., 2012). De acuerdo con García y Fraile (1996), el daño causado por el patógeno puede resultar en una alteración microscópica sin presentar síntomas o alteraciones macroscópicas, como se observó en plantas asintomáticas, que no desarrollaron síntomas de marchitamiento causado por P. cinnamomi. De acuerdo a la definición de resistencia de plantas a enfermedades, se requiere de plantas con atributos genéticos que regulen y permitan restringir el crecimiento del patógeno y, consecuentemente el desarrollo de la enfermedad en el hospedante (Nicks et al., 2004; Cruz et al., 2006).
Las plantas asintomáticas del portainjerto comercial Thomas y del genotipo de la selección Tepetl presentaron poco desarrollo micelial a 17 °C. En comparación, Tepetl a 28 °C tuvo el mayor contenido de micelio. En la selección para resistencia aP. cinnamomi a 28 °C se observó una disminución del desarrollo micelial en las plantas asintomáticas de los portainjertos Thomas y Duke-7 en comparación con las plantas asintomáticas de los genotipos restantes (p< 0.05); sin embargo, estos genotipos presentaron el menor número de plantas asintomáticas y un número importante de plantas muertas y con síntomas de marchitez, por lo que, a nivel histológico pueden considerarse con tolerancia moderada p<0.05 (Andrade et al, 2012).
Cuando se evaluaron los síntomas de marchitez y mortalidad en materiales de la raza Mexicana Atlixco y Tepeyanco, éstos mostraron más de 90% de plantas asintomáticas y al evaluar a nivel histopatológico se detectó el avance inter e intracelular de las hifas de P. cinnamomi (Figura 1 A y B). Éstos resultados sugieren que las plantas asintomáticas restringen el avance del micelio, por lo que, Tepeyanco y Atlixco de la raza Mexicana, podrían ser portainjertos promisorios debido a su capacidad de impedir la invasión y avance micelial del oomicete en el tejido de la raíz. Esto, posiblemente se debe a la activación oportuna de los mecanismos de resistencia estructural y química considerados como los más eficaces para disminuir la infección del patógeno (Ouellette y Rioux, 1992; Hobbes, 2004).
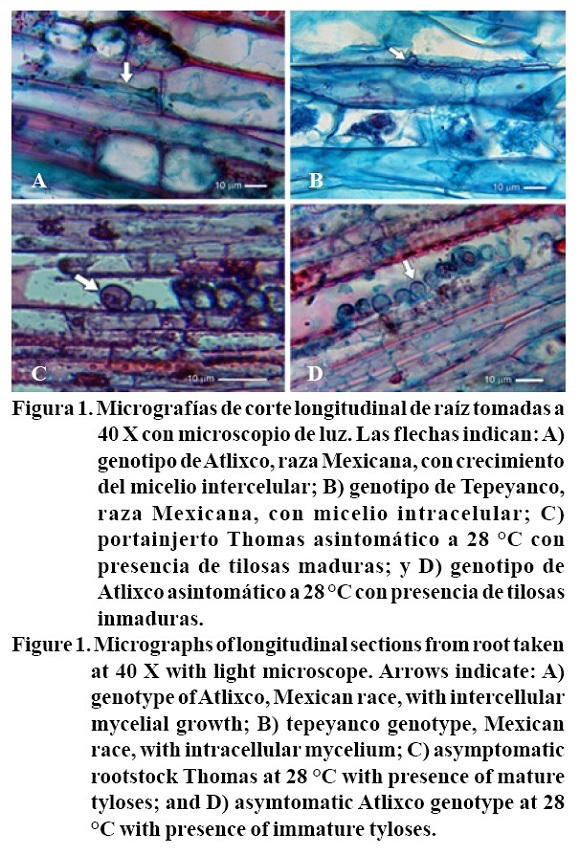
Presencia de tilosas en plantas muertas
En las plantas muertas de los portainjertos Thomas y Duke-7, reportados como tolerantes a P. cinnamomi (Kremer y Kohne, 2007), se encontró mayor cantidad de tilosas en la raíz a 17 °C, mientras que a 28 °C en Tepetl y Duke-7 no se observaron tilosas en el xilema. El mayor porcentaje de tilosas se observó en Thomas con 1.12% p< 0.05 (Cuadro 2).
En las plantas muertas, el patógeno superó las estructuras de defensa penetrando las tilosas del xilema, mostrando la destrucción del tejido celular causado por la enfermedad, por lo que se deduce que las plantas son susceptibles porque no fueron suficientes los mecanismos de defensa contra P. cinnamomi. Respecto a la formación de tilosas, Dimond (1955), Misaghi et al. (1978) y Cruz et al. (2006) señalan que la sintomatología de marchitamiento se debe principalmente a que el micelio supera las barreras estructurales de defensa avanzando inter e intracelularmente, induciendo hidrólisis de la pared celular al causar la destrucción de raíces e impedir la absorción de agua, nutrientes y finalmente la muerte de las plantas.
Presencia de tilosas en plantas con síntomas de marchitez
Los portainjertos comerciales conocidos por su resistencia a síntomas de marchitamiento (Kremer y Kohne, 2007), como Duke-7 mostró un elevado porcentaje (4.40%) de tilosas a17 °C, mientras que en Thomas hubo ausencia total de tilosas en el xilema (Cuadro 2). El genotipo Tepetl presentó entre 1.44 y 2.56% de tilosas en comparación con Thomas con 0 y 4% a 17 y 28 °C, respectivamente. El porcentaje más elevado de tilosas a 28 °C se observó en la raza Mexicana de Atlixco y Tepeyanco (Cuadro 2), por lo que estos genotipos pueden ser considerados como resistentes a la marchitez causada por P. cinnamomi. Las tilosas son producidas para limitar la invasión del micelio, de aquí que no todas las variedades tienen la capacidad de producir una o más tilosas como mecanismo de defensa para impedir el avance del micelio.
Presencia de tilosas en plantas asintomáticas
La presencia de tilosas en los genotipos de aguacate asintomáticos fue estadísticamente diferente p< 0.05 (Cuadro 2). El genotipo Tepetl presentó mayor porcentaje de tilosas a 17 y 28 °C, mientras que la variedad Atlixco presentó mayor contenido de tilosas en el xilema sólo a 28 °C (Cuadro 2, Figura 1 D). La menor formación de tilosas en el xilema a 17 °C la presentaron los portainjertos Thomas, Atlixco y Tepeyanco, mientras que a 28 °C el porcentaje más bajo se observó en Thomas (Figura 1 C). Por su parte, Cruz et al. (2006) señalan que en algunas variedades, las tilosas se forman cuando el patógeno se encuentra en raíces jóvenes y tienen la función de obstruir el paso del patógeno, bloqueando su avance y permitiendo que las plantas permanezcan libres del patógeno, a lo cual este comportamiento se atribuye la tolerancia-resistencia de los genotipos de Tepeyanco y Atlixco.
Compuestos fenólicos en plantas muertas
El incremento de compuestos fenólicos es un mecanismo de respuesta ante la presencia de micelio (Cruz et al., 2006). El depósito de estos fenoles está estrechamente relacionado con la defensa histológica frente a la severidad de la infección y supervivencia de la planta ante la invasión del patógeno en plantas muertas (Del Río et al., 2002). Los resultados obtenidos en el presente estudio muestran una mayor acumulación de compuestos fenólicos en células colapsadas en ambas temperaturas. Los compuestos fenólicos encontrados por Bekker et al. (2007) en raíces de árboles de aguacate infectados con P. cinnamomi fueron el ácido 3,4-hidroxibenzoico y el ácido vanillínico, compuestos que al contacto con el patógeno funcionan como barreras físicas y confieren a la pared celular cierta resistencia a la penetración de P. cinnamomi.
En los cortes histológicos, otra característica observada como mecanismo de defensa química en plantas muertas frente a la infección causada por P. cinnamomi, fue la acumulación de compuestos fenólicos. El mayor porcentaje en el depósito de compuestos fenólicos se presentó en Tepetl y Thomas a 17 °C (Cuadro 3). Los porcentajes más bajos de contenido de fenoles a 28 °C se presentaron en los portainjertos comerciales Duke-7 y Thomas en comparación con el genotipo Tepetl en el que se observó mayor porcentaje de compuestos fenólicos p< 0.05 (Cuadro 3).
Compuestos fenólicos en plantas con síntomas de marchitez
En la cuantificación del depósito de fenoles en plantas con síntomas de marchitez, Tepetl mostró el porcentaje más alto a 17 °C (67.68%; p< 0.05), mientras que el más bajo contenido lo tuvieron los portainjertos Thomas y Duke-7 (procedentes de semilla en segregación). El porcentaje en el contenido de fenoles fue significativamente mayor (p< 0.05) en Tepeyanco (83.92%) a 28 °C (Cuadro 3). En las variedades Atlixco, Tepetl y Thomas a 28 °C, el contenido de compuestos fenólicos fue entre 47.28 y 58.48% sin mostrar una diferencia significativa con el genotipo Tepeyanco.
En pruebas in vitro se ha probado la presencia de compuestos fenólicos asociada a la resistencia a éste patógeno, y se ha demostrado que la presencia de polifenoles tiene la capacidad de inhibir el crecimiento del oomiceto (Candela et al, 1995; Fernández y Liddell, 1997; Vidhyasekaran, 2008).
Compuestos fenólicos en plantas asintomáticas
El mayor contenido de compuestos fenólicos se presentó en los genotipos Tepeyanco y Tepetl a17 °C y en el portainjerto Thomas a 28 °C. Mientras que, el genotipo Atlixco a 17 °C presentó 18.40% de fenoles en la raíz y Tepeyanco a 28 °C tuvo el porcentaje más bajo de éstos compuestos fenólicos (p< 0.05, Cuadro 3). Las plantas asintomáticas presentaron resistencia al activar sus mecanismos de defensa química. Los compuestos fenólicos actúan como inhibidores bioquímicos producidos en respuesta al daño ocasionado porP. cinnamomi. Estos resultados muestran que la temperatura no es un factor determinante en la presencia de fenoles en la raíz. La resistencia de la planta está relacionada con el depósito de fenoles, ya que la acumulación rápida y temprana de compuestos fenólicos en el sitio de infección es una respuesta de defensa. Esta respuesta de acumulación de fenoles antifúngicos generalmente se producen en mayor cantidad en el momento de la infección (De Ascensao y Dubery, 2003). Estas barreras químicas forman bandas en las células con compuestos fenólicos antifúngicos que refuerzan la pared celular brindándole resistencia (Oullette et al, 1992; Cruz et al, 2006). Lo anterior explica por qué las plantas asintomáticas tras la inoculación de P. cinnamomi, presentaron resistencia al activar sus mecanismos de defensa química.
Conclusiones
La cantidad de micelio deP. cinnamomi en el xilema de raíces en plantas de aguacate muertas se debió a la susceptibilidad que culmina con la muerte de la planta sin importar la temperatura. Los porcentajes más altos de presencia de micelio en el xilema se observó en el genotipo Tepetl y el portainjerto comercial
Thomas cuando presentaron síntomas de marchitez a 17 y 28 °C, lo que indica que permiten el establecimiento y desarrollo del patógeno dentro de la raíz. A nivel histológico, las plantas de las selecciones Tepeyanco y Atlixco de raza Mexicana, son genotipos resistentes por sólo presentar síntomas de marchitez a 28 °C. Se observó, que el contenido de tilosas en estos dos genotipos, fue suficiente para impedir el desarrollo de P. cinnamomi, además de que mostraron mayor porcentaje de plantas asintomáticas macroscópicamente aún con presencia de micelio en el xilema.
Los portainjertos Thomas a 17 °C y Duke-7 a 28 °C se consideran tolerantes por mostrar porcentaje similar de tilosas en plantas con síntomas de marchitez. En los genotipos asintomáticos de las selecciones de Tepetl y Tepeyanco tuvieron un aumento porcentual en la presencia de micelio en el xilema a 17 y 28 °C. Estos genotipos son considerados resistentes por estar en contacto íntimo con P. cinnamomi a pesar de que no presentaron síntomas macroscópicos. Las selecciones de la raza Mexicana de Tepeyanco, Atlixco y Tepetl mostraron resistencia debido probablemente a que activaron sus mecanismos de defensa histológica estructural y química previo a la infección por P. cinnamomi.
Literatura citada
Andrade, H. P.; De León, C.; Espíndola, B. M. C.; Alvarado, R.D.; López, J.A. y García, E. R. 2012. Selección de porta-injertos de aguacate para tolerancia-resistencia a Phytophthora cinnamomi Rands. usando temperaturas controladas. Spanish J. Rural Development. 4:1-8. [ Links ]
Agrios, G. N. 2010. Fitopatología. 2ª. ed. Edit. Limusa. D. F., México. 856 p. [ Links ]
Barrientos, P. A. F. y López, L. L. 2000 Historia y genética del aguacate. In: Téliz, O. D.; González, R. H. y Dromundo, R. El aguacate y su manejo integrado. Mundi-Prensa, México. 19-31 pp. [ Links ]
Bekker, T. ;Aveling, T.; Kaiser, C.; Labuschagne, N. and Regnier, T. 2007. Accumulation of total phenolics due to silicon application in roots of avocado trees infected with Phytophthora cinnamomi. Sixth World Avocado Cong. Villa del Mar, Chile. 1-11 pp. [ Links ]
Bellon, M. R.; Barrientos, P. A. F.; Colunga, G. M. P.; Perales, H.; Reyes, A. J. A.; Rosales, S. R. y Zizumbo, V. D. 2009. Diversidad y conservación de recursos genéticos en plantas cultivadas, en capital natural de México. Estado de conservación y tendencias de cambio. Conabio, México. 2:365-368. [ Links ]
Candela, M. E.; Alcazar, M. D.; Espín, A.; Egea, C. and Almela, L. 1995. Soluble phenolic acids in capsicum annum stems infected with Phytophthora capsici. Plant Pathol. 44:116-123. [ Links ]
Cruz, B. M.; Hernández, F. y Rivas, F. E. 2006. Mecanismos de resistencia de las plantas al ataque de patógenos y plagas. La Habana, Cuba. Temas de Ciencia y Tecnología. 29:45-54. [ Links ]
De Ascensao, A. R. and Dubery, I. A. 2003. Soluble and wall-bound phenolics and phenolic polymers in Musa acuminata roots exposed to elicitors of Fusarium oxysporum f.sp. cubense. Phytochemistry. 63:679-686. [ Links ]
Del Río, J. A.; González, A.; Fuster, M. D.; Botía, J. M.; Gómez, P.; Frías, V. and Ortuño, A. 2002. Tylose formation and changes in phenolic compounds of grape roots infected with Phaeomoniella chlamydospora and Phaeoacremonium species. Phytopathology Mediterranean. 40:S394-S399. [ Links ]
Dimond, A. E. 1955. Pathogenesis in the wilt diseases. Ann. Rev. Plant Physiol. 6:329-350. [ Links ]
Fernández, P. S. and Liddell, C. M. 1997. Resistance of capsicum annum CM-334 to Phytophthora root rot and phenol biosynthesis. Phytopathology. 87:529. [ Links ]
Gallo, L. L. 1992. Update of Canary Island research on West Indian avocado rootstocks tolerant/resistance to Phytophthora root rot. Proc. of second world avocado Cong. 105-110 pp. [ Links ]
Gallo, L. L.; Pérez, Z. S. y Siverio, D. R. F. 1999. Búsqueda de resistencia a Phytophthora cinnamomi Rands. en patrones de aguacate de raza antillana. Rev. Chapingo, Serie Hortic. 5:275-277. [ Links ]
García,A. F. y Fraile, A. 1996. Patología vegetal. Edit. Phytoma. Sociedad Española de Fitopatología. 25 p. [ Links ]
Grant, B. R. and Byrt, P. N. 1984. Root temperature effects on the growth of Phytophthora cinnamomi in the roots of eucalyptus marginata y E. calophylla. Phytopathology. 74:179-184. [ Links ]
Hobbes, M. 2004. Induced resistance for the control of Dutch elm disease. Formerly Investigación Agraria: Sistemas y Recursos Forestales. 13:185-196. [ Links ]
Kremer, K. S. and Kohne, J. S. 2007. 25 years of avocado rootstock development in South Africa. In: Preoceedings VI World Avocado Congress 2007. Viña del Mar, Chile. P 1-7. [ Links ]
López, C. M. L.; Márquez, G. J. y Murguía, S.G. 2005. Técnicas para el estudio del desarrollo de angiospermas. 2ª. (Ed.). Las prensas de ciencias. Facultad de Ciencias Universidad Autónoma de México (UNAM). México, D. F. 178 p. [ Links ]
Misaghi, I. J.; Devay, J. E. and Duniway, J. M. 1978. Relationship between occlusions of xylem elements and disease symptoms in leaves of cotton plants infected with Verticillium dahliae. Can. J. Bot. 56:339-342. [ Links ]
Newett, S. D. E.; Crandy, J. H. and Balerdi, C. F. 2002. Cultivars and rootstocks. In: Whiley, A.; Schaffer, W. and Wolstenholme, B. Avocado: botany, production and uses. B. N. Eds. CABI Publ. 161-187 pp. [ Links ]
Niks, R. E. y Lindhout, W. H. 2004. Curso sobre mejoramiento para resistencia a enfermedades y plagas. Dept. Plant Breeding. Wageningen University. 216 p. [ Links ]
Ouellette, G. B. and Rioux, D. 1992. Anatomical and physiological aspects of resistance to Dutch Elm Disease. In: Blanchette, A. and Biggs, R. Defense mechanisms of woody plants against fungi. Edits. Springer-Verlag, Berlin. 257-310 pp. [ Links ]
Salazar, G. S.; Velasco, C. J. J.; Medina, T. R. y Gómez, A. J. R. 2004. Selecciones de aguacate con potencial de uso como portainjertos. I. Prendimiento y crecimiento de injerto. Rev. Fitotec. Mex. 27:23-30. [ Links ]
Statistical Analysis System (SAS) Institute. 2001. SAS/STAT User guide. Release 9.0. Ed. North Carolina, USA. 1289 p. [ Links ]
Scalbert, A. 1991. Antimicrobial properties of tannins. Phytochemistry. 30:3875-3883. [ Links ]
Schlosser, E. 1994. Preformed phenols as resistance factors. Acta Horticulturae. 381:615-630. [ Links ]
Sepúlveda, R. P.; Álvarez,A. M.; Botti, G. C.; Valenzuela, B. J. y Sepúlveda, R. G. 1979. Estudio morfoanatómico del amarillamiento de la vid (Vitis vinifera L.). Agric. Téc. 39:95-102. [ Links ]
Téliz, O. D. y Mora, A. J.A. 2007. El manejo integral parcial del aguacate. In Téliz, O. D.; Mora, A. El aguacate y su manejo integral. 2ª. (Eds.). Editorial Mundi- Prensa, México. D. F., 287-306 pp. [ Links ]
Vidales, F. J. A. y Alcántar, R. J. J. 1999. Acción de la solarización y de la materia orgánica en el control de la tristeza (Phytophthora cinnamomi Rands) del aguacate (Persea americana Mill.). Rev. Chapingo, Serie Hortic. 5:255-259. [ Links ]
Vidhyasekaran, P. 2008. Fungal pathogenesis in plant and crops. Molecular biology and host defense mechanisms. 2nd. ed. CRC Press. Florida, USA. 509 p. [ Links ]
Vleeshouwers, V.; van Dooijeweert, W. V.; Govers, F.; Kamoun, S. and Colon, L. T. 2000. The hypersensitive response is associated with host and nonhost resistance to Phytophthora infestans. Planta. 210:853-864. [ Links ]
Walker, J. C. H. 1957. Plant pathology. 2nd (Ed.). McGraw-Hill Book Co., Inc. USA. 707 p. [ Links ]
Zentmyer, G. A. and Schieber, E. 1987. The search for resistance to Phytohpthora root rot in Latin America. South African Avocado Growers Assoc. Yearbook 10:109-110. [ Links ]














