Introducción
Una amplia gama de factores de estrés abiótico como alta y baja temperaturas, sequía, alcalinidad, salinidad, luz UV, entre otros, son potencialmente perjudiciales para las plantas. En particular, la salinidad es uno de los principales factores que afectan negativamente la producción agrícola a nivel global, dado que más de 800 millones de ha a nivel mundial son afectadas por la salinidad, lo que representa más de 6% de la superficie del planeta. La salinidad afecta a los cultivos al causar desbalance nutrimental, estrés osmótico, deficiencia de agua y estrés oxidativo (Munns y Tester, 2008).
La tolerancia a la salinidad en plantas superiores es un rasgo fisiológicamente multifacético, por tanto involucra diversos mecanismos. Entre los más importantes se encuentran el ajuste osmótico, reducción en la absorción de Na+ por parte de las raíces y el incremento de eflujo de este ión fuera de la célula, secuestro intracelular de Na+, acumulación de K+ en citosol; secuestro tejido-específico de Na+, control de la carga de este catión en el xilema, exclusión del Na+ del vástago y tolerancia al estrés oxidativo (Zhu, 2003).
En particular, para la tolerancia al estrés causado por la salinidad, las plantas modifican la síntesis de metabolitos secundarios (Wahid y Ghazanfar, 2006). Los metabolitos secundarios son referidos a menudo como compuestos que no tienen una función fundamental en el mantenimiento de los procesos vitales de las plantas, pero son importantes para la interacción de la planta con su ambiente, su adaptación a éste y como defensa (Ramakrishna y Ravishankar, 2011).
De esta manera, en especies tolerantes a salinidad, el incremento en el contenido de antocianinas es una respuesta de éstas, cuando son sometidas a estrés salino (Parida y Das, 2005). Así también como una consecuencia del estrés osmótico, el ajuste osmótico en el citoplasma celular debe ser inducido, lo cual conduce a la acumulación de osmolitos de bajo peso molecular como rafinosa, glicina betaína y prolina, así como de proteínas hidrofílicas de alto peso molecular de la superfamila de proteínas abundantes durante la embriogénesis tardía (Kosova et al., 2011). En plantas medicinales, se ha asociado el incremento en la concentración de compuestos aromáticos tales como isoprenoides, fenoles y alcaloides, como parte de su respuesta al estrés salino debido a las propiedades antioxidantes de estos compuestos aromáticos. Por otra parte, los fenoles derivados de fenilpropanoides, tales como flavonoides, taninos e hidroxicinamatos (ésteres); los cuales son producidos bajo condiciones diversas situaciones de estrés, representan importantes eliminadores de radicales libres (Selmar, 2008).
En lo que respecta a la síntesis de aceites esenciales en respuesta a salinidad, los resultados son contradictorios. En manzanilla (Matricaria chamomila), regada con agua con diferentes niveles de salinidad (0, 84, 168, 252 y 336 mM NaCl), se registró el mayor contenido de aceites esenciales en el tratamiento testigo (Razmjoo et al., 2008). Por el contrario, en mejorana tunecina (Origanum majorana) se registró un incremento significativo en el rendimiento de aceites esenciales cuando las plantas fueron regadas con aguas con conductividad eléctrica de 5 dS m-1 respecto al testigo (0 dS m-1); dicho incremento fue de 55.5%; mientras que el aumento en la conductividad del agua de riego a 10 dS m-1 redujo significativamente el rendimiento de éstos (Jelali et al., 2011).
Si bien, los efectos del estrés salino se han investigado ampliamente en cultivos, es necesaria la generación de información referente a las modificaciones del metabolismo secundario en plantas medicinales como lo es el cempasúchil, en respuesta a salinidad. En este contexto, este estudio tiene como objetivo evaluar dos niveles de salinidad a partir de NaCl en las concentraciones de carotenoides y flavonoides en flores, clorofilas en hojas; así como en la identificación y cuantificación de aceites esenciales por órgano, en cempasúchil (Tagetes erecta Linn.) var. Inca.
Materiales y métodos
Condiciones experimentales y material vegetal. La investigación se realizó bajo condiciones de invernadero. Plántulas de cempasúchil (Tagetes erecta Linn.) var. Inca fueron trasplantadas en macetas de plástico negras de 1 L de capacidad, conteniendo como sustrato una mezcla de tezontle:perlita (60:40, v:v).
Manejo del experimento. Una vez trasplantadas, las plántulas fueron regadas con agua de la llave (pH 7.3 y CE de 0.37 dS m-1) durante siete días. Posteriormente fueron regadas con la solución nutritiva de Steiner a 25% (Steiner, 1984) complementada con micronutrimentos a partir del producto comercial Tradecorp AZ™, en las concentraciones descritas por Trejo-Téllez et al. (2013). El pH de la solución nutritiva fue ajustado a 5.5 y ésta se suministró mediante un sistema de riego por goteo. Se realizaron dos riegos por día en cada maceta, cada uno de ellas con un volumen de 150 mL.
Tratamientos evaluados. Al inicio de la floración se adicionaron a la solución nutritiva los tratamientos con NaCl: 10 y 47 mM de NaCl, con valores de conductividad de 1.25y 5.25%, respectivamente. La adición de 10 mM de NaCl (1.25 dS m-1) no causa daños ni afectaciones significativas de ningún tipo en esta especie (Valdez-Aguilar et al., 2009), por tanto puede considerarse como un tratamiento de referencia.
Diseño experimental. El diseño experimental empleado fue completamente al azar, y cada uno de los tratamientos tuvo 32 repeticiones. La unidad experimental consistió en una maceta con una planta.
Variables evaluadas
Carotenoides totales en flores. La cosecha de las flores fue manual cuando éstas alcanzaron su mayor apertura. Las flores cosechadas fueron secadas en estufa de aire forzado (Felisa, FE291AD, México) a 40 °C por 48 h; posteriormente se pesaron en una balanza analítica (Ohaus, Adventurer™Pro, Estados Unidos de América) y se molieron finamente y se almacenaron en recipientes de plástico con tapa a 4 °C, para su posterior análisis. La técnica de extracción de carotenoides totales, se realizó con el método descrito por Nagata y Yamashita (2002). Las absorbancias de los extractos de diez repeticiones fueron leídas en un espectrofotómetro (Thermo Scientific, Multiskan®, Estados Unidos de América) a 453, 503, 645 y 663 nm de longitud de onda; para la estimación de carotenoides totales, los valores obtenidos se sustituyeron en la siguiente fórmula (Nagata y Yamashita, 2002):
Carotenoides totales (mg/100 mL)= (0.216)(A663)-(1.220)(A645)-(0.304)(A505)+(0.452)(A453)
Flavonoides totales. La preparación de la muestra (secado, molido y almacenamiento) es la indicada en el apartado anterior para carotenoides. La concentración de flavonoides totales se cuantificó con un método modificado a partir de los descritos por Ghasemi et al. (2009), Ebrahimzadeh et al. (2008) y Nanyonga et al. (2013). Los extractos de las muestras se leyeron en un espectrofotómetro (Bausch and Lomb, Spectronic 20, Estados Unidos de América) a 415 nm. Para la elaboración de la curva de calibración que permitió estimar la concentración de flavonoides totales se utilizó como estándar quercetina.
Identificación de compuestos de aceites esenciales por cromatografía de gases acoplada a espectrometría de masas (GC-MS). Para esta determinación, cuatro plantas por tratamiento seleccionadas al azar fueron seccionadas en flores, hojas, tallos y raíces. Las muestras se secaron en una estufa de aire forzado a 40 °C por 48 h (Felisa, FE291AD, México), las muestras secas fueron molidas y se procesaron cada uno de los órganos de la planta por separado.
Para la identificación de compuestos se utilizó la cromatografía de gases acoplada a espectrometría de masas (GC -MS), con un cromátografo de gases (HP-6890) acoplado a un detector de masas (HP-5973). Se utilizó una columna HP-5MS (Largo 30m, ID 0.250 mm, film 0.25µm), velocidad promedio de 36 cm/seg. Las condiciones de operación del cromatógrafo fueron: temperatura inicial de 40 °C por 5 min, primera rampa hasta 150 °C, con un aumento de 9 °C min-1. Se mantiene por 3 min, segunda rampa hasta 220 °C con un aumento de 9 °C min-1. La fuente de iones a 230 °C, cuadrupolo a 150 °C. Inyector modo splitlees, temperatura de 220 °C, 6.97 psi. Como gas acarreador se usó helio y se inyectó 1 µL de las muestras concentradas en forma manual.
En la identificación de terpenoides se usó el programa Data Analysis y la base de datos que se consultó fue NIST (National Institute of Standards and Technology), basándose en tiempos de retención de cada compuesto y los espectros de masas.
Clorofilas a, b y totales. La concentración de clorofilas, se determinó en hojas frescas por el método de Harbone (1973). La absorbancia de las muestras se realizó en un espectrofotómetro (Spectronic 20, Bausch and Lomb), a longitudes de onda de 663 y 645 nm. Los valores obtenidos se sustituyeron en las siguientes fórmulas para la estimación de los pigmentos fotosintéticos.
Clorofila a= (12.7*A663) - (2.59*A645)
Clorofila b= (22.9*A645) - (4.7*A663)
Clorofila total= (8.2*A663) + (20.2A645)
Análisis de resultados. Los datos obtenidos se analizaron estadísticamente de acuerdo al diseño experimental empleado, usando análisis de varianza (ANOVA) del paquete estadístico SAS (SAS, 2011). Las medias se compararon con la prueba de Tukey (p 0.05).
Resultados y discusión
Carotenoides totales. Entre los antioxidantes no-enzimáticos se encuentran los carotenoides, mismos que se presentan de manera ubicua en plantas y han sido reportados como actores vitales en la mitigación de efectos adversos de la salinidad en el crecimiento y metabolismo vegetal (Rawia et al., 2011). Ejemplo de esta relación directa entre el nivel de salinidad y concentración de carotenoides, son los resultados de Borghesi et al. (2011), quienes reportaron que el estrés salino puede conducir a incrementos similares o superiores en el fruto de tomate de carotenoides y antocianinas, a aquellos logrados por la ingeniería genética; por tanto, esto representa una opción con potencial de explotación considerable de los suelos salinos para obtener tomates con niveles mayores de metabolitos secundarios. Asimismo, en brotes de trigo sarraceno (Fagorpyrum esculentum M.) tratados con 50 y 100 mM de NaCl, la concentración de carotenoides fue dos veces más grande a plantas testigo (Lim et al., 2012). No obstante lo anterior, en esta investigación la concentración de carotenoides totales en flores fue reducida significativamente, con la adición de 47 mM de NaCl, en comparación con el suministro de 10 mM de NaCl; dicha reducción es del orden de 26.7% (Figura 1).
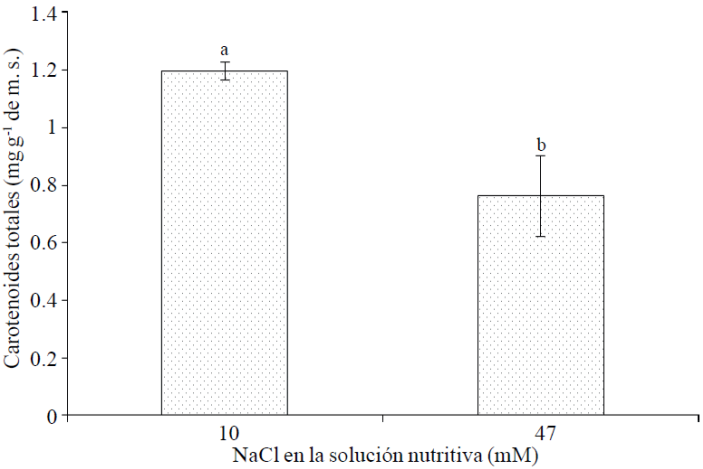
Figura 1 Carotenoides totales en flores de plantas de cempasúchil var. Inca, tratadas con dos concentraciones de NaCl en fase de floración. Medias ± DE con letras distintas indican diferencias significativas (Tukey, p≤ 0.05) entre tratamientos.
Flavonoides totales. La concentración de flavonoides en flores tuvo una relación negativa con la concentración de NaCl en la solución nutritiva; observándose que el aumento de NaCl de 10 a 47 mM redujo en 27.9% la concentración de éstos (Figura 2). De manera similar, en manzanilla (Matricaria chamomilla L.) tratada con diferentes niveles de NaCl (40, 80, 120 y 190 mM), se observó una reducción en la concentración de flavonoides respecto al testigo (sin NaCl); no obstante, con una concentración de NaCl de 40 mM, se encontró el mayor contenido de flavonoles 3-O-glicósidos, flavonoides más abundantes en flores de esta especie (Afzali et al., 2007).
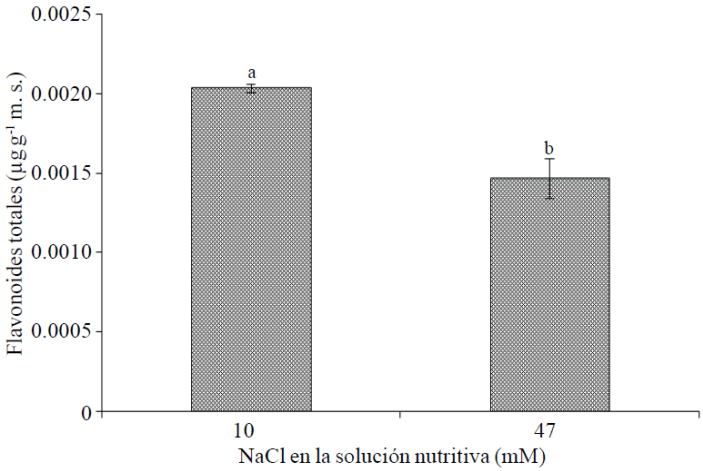
Figura 2 Flavonoides totales en flores de plantas de cempasúchil var. Inca, tratadas con dos concentraciones de NaCl en fase de floración. Medias ± DE con letras distintas indican diferencias significativas (Tukey, p≤ 0.05) entre tratamientos.
Contrario a los resultados de flavonoides obtenidos en este estudio, en hipocotilos y cotiledones de plántulas de tomate (Solanum esculentum cv. H- 2274) y de col roja (Brassica oleraceae convar. capitata (L.) Alef. var. rubra DC., cv Möhrenkopf), se observaron incrementos graduales en las concentraciones de antocianinas, a medida que se incrementó la concentración de NaCl desde 0 a 150 mM (Eryılmaz, 2006).
Clorofilas totales. En el Cuadro 1 se presentan las concentraciones foliares de clorofilas bajo dos niveles de NaCl. Las concentraciones de clorofilas a y total no fueron afectadas por el nivel de NaCl adicionado a la solución nutritiva; mientras que, la concentración de clorofila b, fue estadísticamente superior 47 mM de NaCl, en comparación con 10 mM.
Cuadro 1 Concentraciones foliares de clorofilas bajo dos niveles de NaCl.
| NaCl, mM | Clorofila | ||
| a | B | total | |
| 10 | 67.42 ± 1.46 a | 23.1 ± 0.51 b | 91.43 ± 1.87 a |
| 47 | 48.8 ± 2.73 a | 15.02 ± 0.39 a | 64.48 ± 5.82 a |
Medias ± DE con letras distintas en cada columna indican diferencias significativas (Tukey, p≤ 0.05) entre tratamientos.
Los estudios sobre los efectos del estrés salino en las plantas se han centrado principalmente en el crecimiento, la acumulación de prolina, contenido de clorofila, relación K+/Na+, relación Ca2+/Na+, acumulación de Na + y Cl-. Se ha dicho que los genotipos con una alta acumulación de prolina y contenidos de clorofila, así como con alta relación K+/Na+, y baja acumulación de Na+ y Cl- son más tolerantes a la sal (Mane et al., 2011). Considerando lo anterior, es posible afirmar que Tagetes erecta var. Inca es una especie tolerante a niveles de NaCl de 47 mM.
Aceites esenciales. Los tiempos de retención de los compuestos de aceites esenciales identificados en hojas, flores, tallos y raíces se presentan en el Cuadro 2.
Cuadro 2 Tiempos de retención de compuestos identificados en aceites esenciales de hojas, flores, tallos y raíces de plantas de cempasúchil tratadas con dos niveles de NaCl.
| Compuesto | Tiempo de retención | Compuesto | Tiempo de retención |
| D-Limoneno | 12.21 | β- Mirceno | 11.36 |
| Ocimeno | 12.59 | Piperitona | 16.5 |
| Cariofileno | 19.47 | Farneseno | 20.04 |
| α-Pineno | 9.95 | Óxido de cariofileno | 23.2 |
| Trans-pineno | 27.5 |
Es importante destacar la amplia diferencia que existe en los componentes de aceites esenciales entre especies de Tagetes, dado que de los compuestos aquí identificados no coinciden con los reportados en Tagetes coronopifolia Willd, los cuales son en raíces 2, 7, 7-trimetilbiciclo[3.1.1] heptan-2-ol y (1S, 2R, 5S)-4, 6,6-trimetilbiciclo[3.1.1] hept-3-en-2-ol (verbenol) (38%); en tallo-hoja, (1S) -6,6-dimetil-2-metilen-biciclo[3.1.1] heptan-3-ona, (1R)-cis-4,6,6-trimetilbiciclo-[3.1.1] hept-3-en-2-ona (verbenona), 2-oxo-decanoato de metilo y 2,7,7-trimetilbiciclo[3.1.1] hept-2-en-6-ona (crisantenona) (41%); mientras en flores, (1S)-6,6-dimetil-2-metilen-biciclo[3.1.1] heptan-3-ona y verbenona (Díaz-Cedillo et al., 2013).
El número de compuestos y su concentración en el aceite proveniente de hojas, fueron superiores con el nivel bajo de salinidad evaluado (10 mM), siendo los más abundantes D-limoneno (8.52%) y ocimeno (6.33%) y superiores en 58.92 y 46.13%, respectivamente, a los contenidos de éstos registrados en hojas de plantas tratadas con 47 mM NaCl. Asimismo, es importante destacar que solo con la adición de 10 mM NaCl, se identificaron trans-pineno, β-mirceno y piperitona (Figura 3A). Rawia et al. (2011) reportó en aceite proveniente tejido fresco de plantas de Tagetes erecta sometidas a tres concentraciones de NaCl (salinidad), 10 compuestos: cis-β-ocimeno, β-farneseno, óxido de trans-linalool, piperetona, β-jonona, trans-cariofilasa, óxido de cariofilasa, eugenol, linallool y ácido hexa-decanoice metil éster; en todos éstos, la concentración relativa fue reducida a medida que la concentración de NaCl se incrementó. Independientemente del tratamiento, los compuestos más abundantes fueron trans-cariofileno y eugenol. Así este estudio coincide parcialmente con los resultados de esta investigación; menor concentración relativa de aceites esenciales a medida que incrementa la concentración de NaCl; y difieren en la cantidad y tipo de compuestos identificados.

Figura 3 Aceites esenciales identificados en hojas (A), flores (B), tallos (C) y raíces (D) de plantas de cempasúchil var. Inca, tratadas con dos concentraciones de NaCl en fase de floración.
Contrario a los resultados obtenidos en hojas, en flores se encontraron tres compuestos en los aceites esenciales con mayor salinidad; mientras que con la menor salinidad solo dos, cariofileno y óxido de cariofileno. El farneseno solo fue identificado bajo mayor concentración de NaCl en porcentaje de 1.28 (Figura 3B). Coincidentemente, en plantas de menta (Mentha piperita L.), se observaron incrementos en algunos componentes de aceites esenciales en respuesta al tratamiento de NaCl, entre los que se encuentra el trans-β-farneseno; con concentraciones relativas de 0.01 y 0.89%, con los tratamientos 0 y 50 mM de NaCl, respectivamente; mientras que con 100 mM NaCl no fue identificado. En el caso de la concentración relativa de L-mentol, principal constituyente en el aceite esencial de esta especie, ésta incrementó gradualmente con el aumento de la dosis de NaCl a 50 y 100 mM (Khorasaninejad et al., 2010).
Tendencias similares a las registradas en flores, son observadas en tallos; es decir, tres compuestos identificados en plantas tratadas con 47 mM; mientras que solo la piperitona fue detectada con la menor concentración de 10 mM NaCl; no obstante, su concentración superó a la encontrada con mayor concentración de NaCl en 26.63% (Figura 3C).
En raíces, con la dosis alta de NaCl se identificaron cariofileno, farneseno y óxido de cariofileno; de éstos solo farneseno con el incremento en NaCl. Así también solo el compuesto piperitona fue identificado en raíces de plantas sometidas a bajos niveles de salinidad (Figura 3D).
Consistentemente, se observa que la concentración relativa de piperitona, en aceite proveniente de hojas, tallos y raíces fue afectada de manera importante por el aumento de la salinidad (Figura 3).
El incremento de contenido de aceite esencial, como el observado en flores, tallos y raíces de esta especie ha sido reportado en otras, sometidas a factores que causan estrés osmótico. Los contenidos de aceite y de prolina esenciales de albahaca fueron incrementados cuando las plantas se sometieron a estrés hídrico; por el contrario, el crecimiento fue inhibido significativamente (Baeck et al., 2001). Así también, Hendawy y Khalid (2005), reportan que los contenidos de aceite esencial, carbohidratos totales y prolina fueron incrementados en forma significativa con el aumento en el nivel de estrés salino en plantas de salvia (Saliva officinalis L. Sage).
Conclusiones
Las concentraciones de carotenoides y flavonoides fueron negativamente afectadas con el incremento de NaCl; por el contrario, las concentraciones de clorofilas a y total no fueron afectadas por el nivel de NaCl, mientras que, la concentración de clorofila b se incrementó con el aumento en la concentración de NaCl.
El tratamiento con 47 mM NaCl reduce los componentes del aceite esencial de hojas, y reduce las concentraciones relativas de éstos. En flores, tallos y raíces; por el contrario, con el aumento en el nivel de NaCl, de manera general se incrementaron los componentes del aceite esencial y sus concentraciones, destacando esta tendencia en tallos y raíces.











 texto en
texto en 


