Introducción
En México, se han caracterizado a nivel morfológico las especies del género Fusarium asociadas a clavel en Morelos, Estado de México y el Distrito Federal (Martínez, 2008).
En el estado de Baja California, que en los últimos años se ha posicionado como uno de los principales exportadores de clavel hacia Estados Unidos de América (Luque y Osuna, 2011), no existen reportes sobre este hongo. La caracterización morfológica se basa principalmente en el análisis de la forma, tamaño y la presencia o ausencia de estructuras de reproducción asexual en diferentes medios de cultivo (Leslie y Summerell, 2006). La caracterización molecular, se realiza utilizando diversos métodos basados en el ADN, tales como la secuenciación de regiones conservadas, entre las que destaca el gen codificante del factor de elongación de la traducción 1α (EF1α), que ha mostrado ser de gran utilidad en el análisis de secuencias para estudios a nivel taxonómico y filogenético (Geiser et al., 2004). El objetivo de este trabajo fue identificar morfológica y molecularmente cepas de Fusarium spp. aisladas de plantas con síntomas de marchitez.
Se realizaron colectas en dieciocho cultivares de clavel con síntomas de marchitez en los municipios de Ensenada y Playas de Rosarito, Baja California, México, de septiembre a diciembre del 2011. Para el aislamiento de cepas de corona y del tallo, se eliminaron los restos del suelo con agua corriente, se cortaron trozos de tejido sintomático, se desinfectaron y se sembraron en medio de cultivo Papa Dextrosa Agar (PDA; Difco®), suplementado con cloranfenicol (15 µg/ml). Las cajas se incubaron a 25 ±2 °C en total obscuridad. De todas las cepas se obtuvieron cultivos monoconidiales.
Para la caracterización morfológica, las cepas se crecieron en Carnation Leaf Agar (CLA), Spezieller Náhrstoffarmer Agar (SNA) y PDA. En medio PDA se analizó la morfología, la pigmentación de la colonia y la producción de esporodoquios y esclerocios. Se tomaron fotografías de las colonias con la cámara SLR Nikon D3000. Los esporodoquios y esclerocios se observaron en un microscopio estereoscópico Olympus SZX12 y se tomaron fotografías con una cámara DP70. En los medios CLA y SNA, se analizaron la forma, tamaño y presencia de macroconidios, microconidios, clamidosporas y células conidiogénicas, se tomaron y editaron imágenes usando un microscopio óptico invertido Axiovert 200 Zeiss®, con microscopía de contraste de fases.
Para la caracterización molecular, se extrajo ADN de las cepas con el DNeasy Plant Mini Kit (Qiagen®) y se amplificó por PCR el factor de elongación de la traducción 1α (EF1α). Para la reacción se usaron los oligonucleótidos EF1-728: 5' CATCGAGAAGTTCGAGAAGG 3' (Carbone y Kohn, 1999) y EF2: 5' GGA(G/A)GTACCAGT(G/C)ATCATGTT3'(O'Donnell et al., 1998) a 50 pmol, 50 ng de ADN genómico, 1.25 U de Taq ADN polimerasa (Fermentas), 2.5 µl de Buffer 10X Master Amp™ PCR Enhancer con betaína (Epicentre® Biotechnologies), 0.5 µl de dNTP's (20 mM), 4 µl de MgCl2 (25mM) y agua destilada estéril para completar 25 µl. El programa usado fue: desnaturalización inicial por 4 min a 95 °C; 35 ciclos de 1 min cada uno de desnaturalización a 95 °C, alineamiento a 50 °C y extensión a 72 °C; y una extensión final de 10 min a 72 °C.
Los fragmentos amplificados se purificaron usando el kit QIAquik® (Quiagen®) y se enviaron a secuenciar a Clemson University Genomics Institute, Carolina del Sur, Estados Unidos de América. Para analizar las secuencias, se ingresó a la base de datos (GenBank) de "The National Center for Biotechnology Information" (http://www.ncbi.nlm.nih.gov) y a la de FUSARIUM-ID (http://isolate.fusariumdb.org). Las secuencias obtenidas se compararon usando el algoritmo BLAST (Basic Local Alignment Search Tool). Se recuperaron secuencias que presentaron mayor porcentaje de identidad con las cepas en análisis y se editaron con el software Editseq (Lasergene, DNAstar, Inc., Madison, WI, EE.UU). Se realizó un alineamiento múltiple con el método ClustalW y se generó un árbol filogenético utilizando el software MegAlign (Lasergene, DNAstar, Inc., Madison, WI, EE.UU). Finalmente, para concluir la identidad de cada aislado, se analizaron en conjunto los resultados obtenidos de la caracterización morfológica y molecular.
Se obtuvieron cuarenta y dos cepas de Fusarium spp., veintidós aisladas de la corona y veinte del tallo. Con base en las características morfológicas analizadas se identificaron las especies: Fusarium oxysporum, F. proliferatum, F. solani, F. tricinctum,F. globosum,F.incarnatum y F. equiseti (Figura 1). El análisis filogenético usando las secuencias del EF1α, confirmó la identidad de las especies (Figura 2).
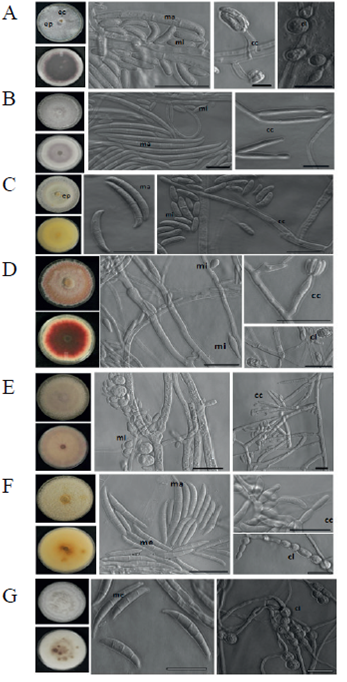
Figura 1 Fusarium spp. aisladas de plantas clavel con síntomas de marchitez. A) F. oxysporum; B) F. proliferatum; C) F. solani; D) F. tricinctum; E) F. globosum; F) F. incarnatum; y G) F. equiseti. ma= macroconidio; mi= microconidio; me= mesoconidio; cc= célula conidiogénica; cl= clamidospora; ep=esporodoquio; ec= esclerocio. Barra de escala= 10 µm.
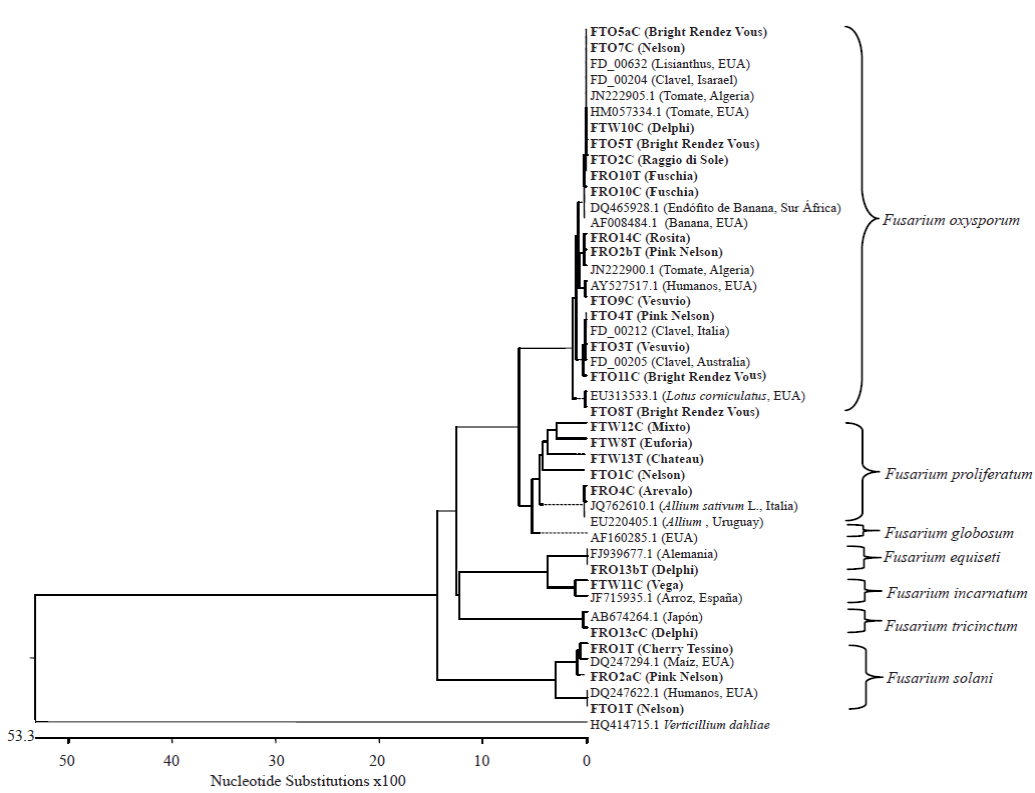
Figura 2 Árbol filogenético construido con método Clustal W con el software MegAlign (Lasergene, DNAstar, Ic., Madison, WI, EE.UU). Éste árbol contiene las secuencias generadas con los oligonucleótidos EF1-728/EF2. En negritas se muestran las cepas aisladas de los diferentes cultivares de clavel. Las especies que inician su clave de acceso con 'FD_' pertenecen a la base de datos FUSARIUM-ID, las otras especies se encuentran depositadas en el NCBI.
El cincuenta por ciento de las cepas aisladas correspondió a la especie F. oxysporum y se encontró asociada a los cultivares Delphi, Nelson, Pink Nelson, Raggio di sole, Bright Rendez Vous, Vesuvio, Tabor, Fushia, Miniblanca y Rosita. Filogenéticamente, estas cepas mostraron mayor porcentaje de homología con cepas reportadas en clavel en los países de Israel, Italia,Australia y España. Dentro de la especie F. oxysporum se han descrito varias formas especiales y razas patogénicas, las cuales son hospedero y cultivar específicas respectivamente; en este estudio se observaron diferencias morfológicas intraespecificas en la pigmentación y en la apariencia de la colonia, en la abundanciade macroconidiosy microconidios y en el tamaño de las monofiálides, por lo que probablemente exista más de una forma especial y quizás más de una raza patogénica.
La especie F. proliferatum se encontró en tres aislados de la corona y cuatro del tallo de los cultivares Euforia, Chateau, Nelson, Miniblanca, Arevalo y Pink Nelson. Filogenéticamente ésta especie presentó homología con cepas provenientes de cultivos del genero Allium (Italia y Uruguay), garbanzo (India) e insectos (EUA). La especie F. proliferatum se ha reportado como co-aislado en claveles que presentan pudrición de la corona; sin embargo, está considerada como una especie saprófita (Manicom y Baayen, 1993).
La especie F. solani se identificó en cinco aislados de la corona y tres del tallo de los cultivares Nelson, Pink Nelson, Lion King, Rendez Vous y Cherry tessino. Filogenéticamente, la mayoría presentaron alta homología con cepas de F. solani procedentes de Estados Unidos de América, reportadas en maíz, insectos y humanos, y con una cepa asociada a chirimoya en Pakistan. Dentro de la especie F. solani existen cepas patógenas que afectan cultivos con gran importancia económica como papa, aguacate, cítricos, orquídeas, leguminosas, plantas tropicales entre otras; sin embargo existen también cepas no patógenas que incluso han sido usadas para el control biológico del marchitez de tomate (Larkin y Fravel, 2002). Por lo que se considera conveniente evaluar su efecto en clavel.
F. tricinctum fue aislado de la corona y tallo de una planta del cultivar Delphi. Filogenéticamente, las cepas mostraron alto porcentaje de homología con la especie F. tricinctum de origen japonés (AB674264). Estas cepas fueron las únicas que produjeron pigmentos rojos en el anverso y reverso de la colonia en medio PDA. F. tricinctum fue reportada en Estados Unidos por Nelson et al. (1975) y en Australia por Wright et al. (1997) como el agente causal de la pudrición de yemas en el cultivo de clavel. Hasta este momento, en México, no existían reportes de esta especie y aunque F. tricinctum se aisló únicamente del cultivar Delphi, en este trabajo se reporta su presencia y se sugiere realizar pruebas de patogenicidad e intentar obtener aislamientos de yemas.
La única cepa que se obtuvo de F. globosum se aisló de la corona del cultivar Mixto. Esta especie fue aislada por primera vez de maíz en el Sur de África, subsecuentemente se aisló de trigo en Japón. Se han realizado múltiples análisis moleculares y se ha descubierto que a pesar de las similitudes morfológicas, los hongos aislados de ambos países exhiben múltiples diferencias biológicas (Moses et al., 2010). México, esta especie no había sido reportada, por lo que en este trabajo, se reporta por primera vez asociada a clavel.
En los cultivares Vega y Delphi se identificaron las especies F. incarnarum y F. equiseti, respectivamente. Filogenéticamente la cepa de F. incarnarum presentó alta homología con una proveniente de arroz en España y F. equiseti con una cepa proveniente de Alemania. Las especies F. incarnatum y F. equiseti están estrechamente relacionadas morfológica y molecularmente. Las dos producen manchas marrón en el anverso de la colonia en PDA, pero se diferencian por la presencia de microconidios en F. incarnatum. Ambas especies han sido reportadas principalmente como saprófitas, (Leslie y Summerell, 2006); sin embargo, F. equiseti reduce o impide la asociación de micorrizas con las raíces al ser un hongo colonizador de la raíz (McAllister et al., 1997) y F. semitectum (sinónimo de F. incarnatum) también se ha asociado con una infección causada por diferentes hongos en los frutos de Pitaya (Hylocereus polyrhizus) en Malasia (Hawa et al., 2010).
Conclusiones
Las especies asociadas a diferentes cultivares de clavel con síntomas de marchitez y pudrición de tallo, identificadas en este estudio fueron: F. oxysporum, F. solani, F. proliferatum, F. tricinctum, F. globosum, F.incarnatum y F. equiseti. Se reportan por primera vez en México, a F. tricinctum, F. globosum y F. solani asociadas a clavel con síntomas de marchitez. El mayor número de cepas aisladas correspondió a la especie F. oxysporum, con ligeras diferencias morfológicas y filogenéticas, muy posiblemente debido a la presencia de diferentes formas especiales y razas patogénicas que actualmente se están evaluando.











 texto em
texto em 


