Introducción
Los ecosistemas terrestres representan el carbono más interactivo (C). Hasta 67% de las 1 500 Gt de C orgánico del suelo están presentes entre 20 y 100 cm de profundidad, el C orgánico del suelo recibe el nombre de materia orgánica (MO), se compone de una mezcla heterogénea de compuestos orgánicos de diversos orígenes. En el subsuelo la MO se asocia principalmente con fases minerales y ambos forman agrupaciones orgánico-minerales, la formación de estos agrupamientos protege la MO de la degradación, sin embargo, los suelos no están hechos solo de minerales o sustancias orgánicas, estos dos componentes interactúan entre si y por lo tanto controlan la química de la superficie del suelo; estas interacciones son importantes, pero en especial los suelos que reciben o acumulan grandes cantidades de sustancias orgánicas (Juneta et al, 2013).
Las sustancias húmicas (SH) se componen de ácidos húmicos (AH), ácidos fúlvicos (AF) y huminas residuales (HR), definidas como macromoléculas orgánicas, con una estructura química compleja, distinta y estable que provienen de la degradación de plantas y animales, por la actividad enzimática de microorganismos y metamorfismo orgánico (Schnitzer, 2000 y Sutton y Sposito, 2005), el término humus, se utilizó en la antigüedad para hacer referencia a la totalidad del suelo, posteriormente se ha empleado como sinónimo de MO, mientras que en la actualidad y como ya se ha mencionado, hace referencia a una fracción de dicha MO que engloba a un grupo de sustancias (Berthelin et al, 2006), son la fracción orgánica del suelo más importante por su actividad en procesos físicos, químicos y biológicos en el suelo (Maccarthy, 2001), los AH son solubles en medios alcalinos, aunque no las condiciones de ácidos fuertes, si el pH < 2.
Los AF solubles en condiciones alcalinas y ácidas a diferencia de las huminas que son insolubles. La clasificación de las tres fracciones no representa tres tipos distintos de moléculas orgánicas (Hayes et al, 1989), esto es debido al hecho de que las sustancias húmicas contienen diversos tipos de grupos funcionales cuyas capacidades de agrupamiento de metal varían considerablemente, pues suelen incluir un esqueleto de moléculas aromáticas alquilo con grupos funcionales, como ácidos carboxílicos, hidroxilo fenólico y grupos quinona unidos a ellos (Flores-Cespedes et al., 2006; Chen et al., 2009). La evidencia sugiere que la agrupación del metal con inorgánicos y ligandos orgánicos en el suelo puede tener una influencia en la movilidad y la biodisponibilidad de los metales para los organismos del suelo y plantas.
Una alternativa para eficientar los nutrimentos a los cultivos consiste en la combinación con compuestos inorgánicos, la aplicación de AH como una enmienda orgánica del suelo en combinación con otros materiales, resulta en un aumento significativo en el crecimiento de la planta y rendimiento de los cultivos, mediante la mejora de las propiedades hidrofísicas y disponibilidad de nutrimentos de los suelos. Los complejos orgánico-minerales permiten a las plantas superar los efectos adversos de la salinidad del suelo, mejora la agregación, aireación, permeabilidad, capacidad de retención de agua, absorción de micronutrientes y disponibilidad y la disminución de la absorción de algunos elementos tóxicos (Ryabova, 2010).
Los métodos de espectroscopia cuantifican la composición química que forman las capas de los AH y AF, el método más acertado es el de infrarrojo cercano (Moros et al., 2008). La espectroscopia infrarroja (IR) es de precisión y desarrollado en la actualidad para caracterizar las SH y sus fracciones: AH y AF. Los espectros IR de SH se caracterizan por su simplicidad, en la comparación con los espectros de la estructura definida de compuestos puros. Ésta sencillez resulta de la mezcla compleja de grupos funcionales que existen en una amplia variedad de ambientes químicos, cada uno caracterizado por constantes de fuerza diferente, lo que provoca un ensanchamiento de las bandas de IR (MacCarthy y Rice, 1985). La espectroscopia infrarroja proporciona información sobre los grupos funcionales contenidos en la estructura de los AH y AF (Gostishcheva et al., 2009). El objetivo de este estudio es obtener y caracterizar un compuesto orgánico-mineral, húmico y fúlvico y caracterizar sus grupos funcionales mediante espectrofotometría infrarroja.
Materiales y métodos
Se utilizó un compuesto orgánico mineral de nombre leonardita obtenida de una mina ubicada a 29° 30' 22.18'' latitud norte, 103° 33' 57.13'' longitud oeste, a una altitud de 1 096 m, 96.5 km al norte de Presidio, Texas, EE.UU.
La leonardita recolectada se transportó al laboratorio donde fue molida y tamizada con una malla (1.0 mm diámetro), se pesaron 5 g de Leonardita, se colocó en un matraz de 250 ml y se le adicionaron 100 ml de hidróxido de potasio (KOH y pH 13.5), 1N. Se coloca en "Baño María" a 60 °C durante dos horas y se deja enfriar. Se toman 25 ml de la solución, se pesan y se le determina la Densidad. Después, con ácido acético (pH 2.4), se le lleva el pH a 4; aquí, el potenciómetro deberá calibrarse con las soluciones Buffer de 4, 7 y 10, se calienta a 70 °C y se centrifuga a 8 000 rpm durante 30 min. Los ácidos húmicos precipitan; mientras que los ácidos fúlvicos permanecen en solución. La extracción de los AF se dio por la identificación del color amarillo a amarillo marrón remanente en la solución después de haberse extraído los AH debido a su acidificación.
Espectrómetro infrarrojo características y forma de uso
Los grupos funcionales se determinaron mediante la generación de espectrogramas utilizando un espectrofotómetro de luz infrarroja (Nicolet IR Series, FTIR Spectrometer, EE.UU). Después de haberse obtenido la muestra sólida de los compuestos se mezclaron con bromuro de potasio (KBr) en un mortero de ágata hasta obtener un polvo fino. La proporción de la muestra con respecto al KBr fue 1:100 (muestra/KBr) y una porción de estos compuestos por separado se colocó en un portador de muestra para preparar submuestras en pastillas empleando una prensa, la pastilla debe ser homogénea y fina, colocándola en una placa para muestras de acero para leerse en el IR. Debe evitarse la contaminación por polvo de la muestra y seguir las indicaciones sobre el uso de la prensa para hacer la pastilla (submuestras).
Las submuestras se colocaron en el espectrofotómetro y el análisis de hizo en la misma banda con 32 escaneos hasta obtener el mejor espectro que debe presentarse en la banda fina e intensa de acuerdo al porcentaje de su transmitancia. Las variables para obtener el mejor espectro se basan en la relación de muestra-solvente (KBr), valor de ganancia y la velocidad de la carta. Una vez obtenido el espectro óptimo para cada muestra se calibró la escala del espectro en el papel, obteniendo el número de ondas de los diferentes componentes.
Resultados y discusión
Medición de porcentaje y grupos funcionales para ácidos húmicos y ácidos fúlvicos
Se tomaron 50 ml de la solución y con ácido acético, mediante la reducción del pH hasta cuatro, se separaron los ácidos húmicos de los fúlvicos. Con la metodología de laboratorio de titulación a retroceso con permanganato de potasio (K4MnO7), se midieron los porcentajes de ácidos húmicos y ácidos fúlvicos (Cuadro 1).
Les fueron medidos el contenido de acidez total (AT); es decir, el contenido de grupos funcionales oxigenados como los carboxilos (-COOH) y oxhidrilos (-OH), los procedimientos descritos aquí se basan en la medición de la acidez total y la acidez carboxílica de Wright y Schnitzer (1959), y Schnitzer y Gupta (1965).
Para la medición de la acidez total, la muestra se trata con una solución de hidróxido de bario en 2 N durante 24 h. El Ba (OH)2 queda en la solución después de la reacción se valora con una solución de ácido estándar.
Para la valoración de los grupos carboxílicos, los materiales húmicos se agitan durante 24 h con una solución de acetato de calcio en exceso lo que provoca la liberación de ácido acético de acuerdo a una reacción del tipo:
El ácido acético se libera a continuación, se titula con una solución de bicarbonato estándar.
La proporción de los grupos fenólicos se calculó por la diferencia entre la acidez total y la acidez de los grupos carboxílicos.
De forma general, se puede establecer que los ácidos fúlvicos están más oxidados que los ácidos húmicos, por lo cual esto quiere decir, que los primeros están más polimerizados que los segundos. De forma particular, se puede comentar que los ácidos fúlvicos, son los más oxidados, porque son los que presentan el superior valor de acidez total.
Lo anterior, pone de manifiesto que los ácidos fúlvicos, contienen mayor número de cargas eléctricas negativas.
Cuadro 2 Acidez total (AT) y grupos funcionales carboxilo (-COOH) y oxhidrilos (-OH), de substancias húmicas extraídas de leonardita.

AH= ácido húmico; AF= ácido fúlvico.
Canellas et al. (2008), definen las SH como asociaciones supramoleculares relativamente pequeñas, agrupadas básicamente por interacciones hidrofóbicas y puentes de hidrógeno. Schulten y Schnitzer (1993) desarrollaron una molécula de dos dimensiones (2D) la estructura del modelo de AH en la que cuenta con anillos aromáticos alquilo desempeñan un papel importante. El oxígeno está presente en forma de carboxilos, hidroxilos fenólicos y alcohólicas, ésteres y cetonas, mientras que el nitrógeno se produce en nitrilos y estructuras heterocíclicas. El esqueleto de carbono resultante muestra microporosidad alta con huecos de varias dimensiones, que pueden atrapar y se unen otros elementos del suelo orgánicos e inorgánicos, así como el agua.
Obtención del humato de calcio y fulvato de hierro regulando las condiciones de pH de la solución
Siguiendo el criterio establecido por Iakimenko, 2005 y Rady, 2012, los que comentaron de acuerdo a sus investigaciones que un ácido húmico al cual se le puede incorporar un mineral, se le llama en éste caso humato de calcio y fulvato de hierro, donde la incorporación que se siguió en esta investigación de éstos minerales fue como sigue:
Humato de calcio: a 100 mL del AH el cual contaba con un pH original de 8, se le aplicó 125 g de (CaNO3)2 observándose un decremento en el pH el cual llegó a 7, posteriormente se aplicaron 20 g más para llegar a un total de 145 g de (CaNO3)2 y se observó nuevamente un decremento de pH el cual llegó finalmente a 6.
Fulvato de hierro: a 100 mL de AF el cual contaba con pH original de 4, se le adiciono 0.5 mL de KOH incrementándose el pH de la solución a 8, posteriormente se añadieron 10 g de FeSO4 observando un decremento de pH hasta 7, después se añadió 1.75 g más y el pH disminuyo hasta 6.
Solidificación del ácido húmico, fúlvico, humatos de calcio y fulvatos de hierro
La solidificación se realizó mediante un rotovaporador (Yamato, Modelo SE 500, Japón), colocando 500 mL al ácido húmico (pH original 8), y sus fracciones elaboradas a pH 6 y 7, así mismo para el ácido fúlvico (pH original 4) y sus derivados a pH 6 y 7, dando un total de seis tratamientos, los cuales se depositaron en un matraz de 1 L, poniéndose bajo condiciones de baño maría a 60 oC, rotando a 80 rpm hasta eliminar el agua, este proceso de solidificación duró 8 h. El solvente no fue eliminado por completo por lo que se colocó en una cápsula de porcelana calentándola a 40 oC por 2 h en una parrilla eléctrica para eliminar el agua remanente y de ésta forma obtener el sólido.
El ácido húmico enriquecido con nitrato de calcio (Ca (NO3)2) en los niveles de pH 6, 7 y el pH original de 8 después de su extracción se pueden observar en el espectrograma de la Figura 1.
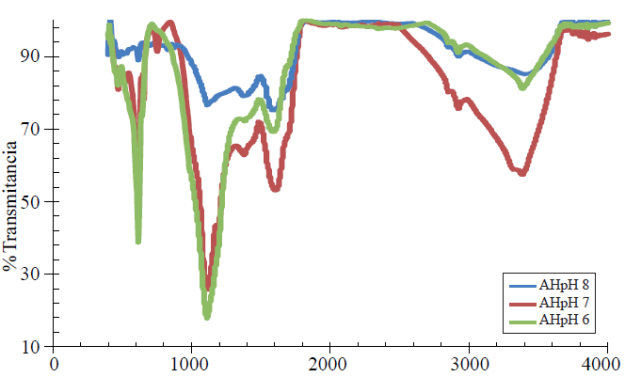
Figura 1 Espectro infrarrojo de ácidos húmicos enriquecidos con nitrato de calcio extraídos de leonardita.
La línea azul representa el AH con pH 8 en la cual se aprecian las señales o grupos funcionales que más participan en los procesos de intercambio iónico: el -OH del extractante o vehículo para extraer se presenta en la banda de 1 375cm-1, N-H aminas o amidas en 1 620cm-1, los -CH3 y -CH2 presentaron valores para de 2 922 cm-1 y grupos funcionales libres -OH en 3 400cm-1; en el AH con pH 7 y 6, líneas roja y verde respectivamente, después de la incorporación del elemento mineral la aparición de otros picos se pueden apreciar, lo que significa que la descripción de la señal se encuentra en mayor proporción, facilitando su descripción, diferenciándose los picos por su pureza y concentración; el grupo funcional en el rango más bajo de la longitud de onda se encontró un grupo aromático-N-R esto representa una amina terciaria en la banda 760 y 631cm-1 correspondiendo a los pH 7 y 6, los -OH secundarios para ambos AH en los dos pH se localizaron en las bandas 1 130 y 1 120 cm-1, los grupos CH-OH, -OH del vehículo de extracción, se encontraron en la misma banda 1 390 cm-1 para las dos mezclas, las aminas o amidas N-H o con enlace carboxilos-C= O en 1 620 y 1 600 cm-1, respectivamente, el -CH3 presento un valor similar de 1 930 cm-1, el CH2-CH3 se localizó en 2 870 y 2 840 cm-1, de igual manera el -OH libre se presentó en la misma onda 3 390 cm-1 entre uno y otro compuesto orgánico-mineral.
El AH a un pH 6 muestra un mayor contenido de -OH secundarios seguido de AH a pH 7; sin embargo, en el AH a pH 7 los grupos N-H, C= O y -OH libre se presentan en mayor cantidad, esto indica menor absorción de la luz o mayor frecuencia individual de este tipo de compuestos en la mezcla mencionada, por lo que la absorción de Ca (NO3)2 fue mayor en el AH a pH 7.
El espectrograma (Figura 2) del ácido fúlvico en su pH original, más los dos niveles que se generaron al mezclarlo con sulfato ferroso (FeSO4) arrojó los siguientes resultados.
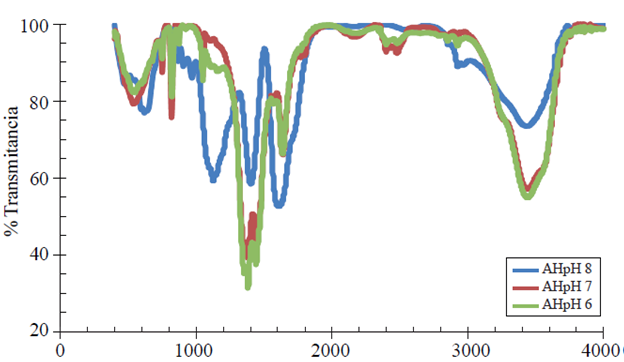
Figura 2 Espectro infrarrojo de ácidos fúlvicos enriquecidos con sulfato ferroso extraídos de leonardita.
El AF a pH 4 (línea azul), representa el pH original al momento de la extracción, en este espectro, la lectura denota los siguientes grupos funcionales, con la mejor señal, el metileno-CH2-CH3 presento el valor de 1 162 cm-1, para el -OH cuya función es ser el vehículo de extracción 1 439cm-1, el grupo de N-H aminas o amidas 1 620cm-1 y los -OH libres en 3 445cm-1; el AF con pH 7 y 6, líneas roja y verde respectivamente, posteriormente mezclado el FeSO4 diferentes picos se formaron, el AF en ambos pH el -OH primario se localiza en 1 050 cm-1, de igual manera el -CH2-CH3 en 1 360 cm-1, los grupos -CH2-(C=O)-, -CH2-(C=N) en las bandas 1 380 y 1 390 cm-1 respectivamente, para el -OH de extracción 1 440 y 1 450cm-1, los grupos de -N-H-aminas o amidas en el 1 640 cm-1 para ambas mezclas, un sobretodo provocado por un traslape de aminas o amidas-N-H- en la banda de 1 810 y 1 830 cm-1 en los pH 6 y 7, el grupo -CH3 en los dos pH se limita a la banda 1 860 cm-1, de igual manera el -CH2-CH3 para los pH se encuentra en 2 930 cm-1 y el -OH libre en AF a pH 6 en una lectura de 3 570 cm-1 yAF a pH 7; 3 430 cm-1. El AF a pH 6 y 7 muestran muchas similitudes, sin embargo, en el AF a pH 7 la frecuencia del grupo funcional libre (-OH) es mayor, por lo que la cantidad de adsorción de hierro también es mayor.
Estos resultados concuerdan con los obtenidos por Chassapis et al. (2010), con respecto al uso de un espectro infrarrojo típico donde se demuestran las interacciones y diferencias existentes en las sustancias húmicas, absorción, adsorción o asociaciones de los diferentes grupos fenólicos de importancia que se encuentran distribuidos en las regiones 1 050, 1 650 y 3 400 cm-1, esto coincide con lo expuesto por Sivakova et al. (2010) en los espectros de IR mostraron una serie de bandas de absorción características de los ácidos húmicos. La presencia de grupos carboxilos y carbonilos (1 720-2 700 cm-1), grupos hidroxilos (3 400-1 256 cm-1), éter-oxigeno (1 650 cm-1), -CH3-CH2 (2 930 cm-1).
También se observa que las propiedades fisicoquímicas de las sustancias húmicas varían según su origen (Fukushima et al, 2006), son biopolímeros multifimcionales amorfos, compuestos por cientos de componentes orgánicos que incluyen carbohidratos y anillos aromáticos condensados, que pueden ser sustituidos por grupos fenólicos, carboxilos, oxhidrilos y metilos, donde estos resultados concuerdan con los obtenidos por Peuravuori et al. (2006) y Evangelou et al. (1999). Éstos grupos tienen la particularidad de agrupar y quelatar cationes en la solución del suelo, llevarlos a la pared celular de la raíz, similar a agentes quelatantes y ser transportados los nutrimentos por el torrente xilemático hacia los puntos de crecimiento.
El enlace metal-ion (Ca o Fe) se ha demostrado que varía con la concentración de soluto de cationes, el pH, tipo de mineral y enlace (Puls and Bohn, 1988), los complejos orgánico-minerales permiten a las plantas superar los efectos adversos de la salinidad del suelo, mejora la agregación, aireación, permeabilidad, capacidad de retención de agua, absorción de micronutrientes y disponibilidad, y la disminución de la absorción de algunos elementos tóxicos (Ryabova, 2010). Los resultados obtenidos por muchos autores sugieren que la cantidad y la fuerza de agrupamiento de iones no parecen estar relacionados con el peso atómico, número atómico, radio iónico, o el radio hidratado del metal retenido, esto es debido al hecho de que las sustancias húmicas contiene diversos tipos de grupos funcionales cuyas capacidades de argrupamiento de iones varían considerablemente.
Una forma prometedora para mejorar la calidad de las sustancias húmicas consiste en su combinación con productos inorgánicos, esto hace que sea posible conferir resistencia mecánica y resistencia a la hidrólisis ácida y alcalina para los compuestos húmicos y mejorar sus propiedades de sorción. Es un procedimiento accesible y barato para ser utilizado en el desarrollo de adsorbentes orgánico-minerales porque dichas materias primas son abundantes, baratos, y capaz de ser modificado químicamente.
Conclusiones
El uso de la espectro fotometría infrarroja permitió caracterizar los grupos funcionales de las sustancias húmicas y su comparación.
La concentración total del elemento químico y el pH de la substancia húmica, son los dos factores más determinantes en la interacción compuesto húmico-elemento químico. Los ácidos húmicos y los ácidos fúlvicos, son más oxidados y por lo tanto, poseen mayor capacidad de agrupar cationes.
Los ácidos fúlvicos pueden ser considerados como asociaciones de pequeñas moléculas hidrofílicas en los que hay grupos funcionales ácidos suficiente para mantener los grupos fúlvicos dispersos en la solución a cualquier pH. Los ácidos húmicos son hechos por las asociaciones de compuestos predominantemente hidrofóbica (cadenas polimetilenica, ácidos grasos, compuestos esteroides), que se estabilizan a un pH neutro por fuerzas hidrofóbicas de dispersión. Sus conformaciones crecen progresivamente cuando sus vínculos intermoleculares de hidrógeno son cada vez más formada en valores de pH más bajos, hasta flocular. Spaccini et al. (2008) propone que, basándose en el concepto de asociación supramolecular, las definiciones clásicas de los ácidos húmicos y fúlvicos debe ser reconsiderada.
Los ácidos húmicos y fúlvicos extraídos de leonardita muestran una alta capacidad de adsorción debido a carboxilos, oxhidrilos, fenoles, aminas, amidas y metilos, donde los oxhidrilos presentan la mayor proporción de intercambio con Ca y Fe.
Los radicales libres de oxhidrilos se detectan en los intervalos altos de número de onda, diferenciándose de los oxhidrilos provenientes del vehículo de extracción (KOH) porque este produce intervalos bajos de número de onda.
La elaboración de las agrupaciones orgánico-minerales fue afectado por el manejo del pH, siendo afectada la mezcla final por el tipo de elemento que se incorpora, ya sean estos de una reacción ácida o alcalina.
Independientemente de la reacción original del ácido húmico (pH 8) y fúlvico (pH 4) al modificarse estas a pH 7, se tuvo la absorbancia de luz menor del infrarrojo indicándonos una mayor presencia de Ca y Fe.











 texto en
texto en 




