Durante los ciclos primavera-verano de 2009 y 2010, se colectaron semillas de avena de los cultivares Ágata, Chihuahua y Turquesa, en cinco localidades de Tlaxcala (Teacalco, Nanacamilpa, Francisco I. Madero, Terrenate y Velazco) y cuatro del Estado de México (Santa Lucía, Coatepec, Juchitepec y Chapingo). En cada localidad, se colectaron 80 semillas por cultivar, obteniendo así un total de 1 200 (ciclo 2009) y 1 680 (ciclo 2010). La inducción del crecimiento micelial y esporulación de los hongos, se realizó mediante la prueba de Freezing-Blotter descrita por Warham et al. (1998). La identificación de los géneros y especies de hongos se realizó usando las claves taxonómicas de Warham et al. (1998), Leslie y Summerell (2006), Simmons (2007), MAPA (2009), y Watanabe (2010).
Se evaluó la incidencia total de hongos, incidencia de fitopatógenos e incidencia de saprófitos. Para obtener la incidencia total, se observó la presencia/ausencia de hongos en la semilla, por localidad y cultivar. Las medias de los datos de incidencia general de hongos, incidencia de fitopatógenos e incidencia de saprófitos en porcentaje, se compararon mediante la prueba de Tukey, con p≥ 0.05., usando SAS Versión 9.1 (SAS Institute, 2003).
Se identificó un total de 26 especies de hongos, de los cuales 15 se han reportado como fitopatógenos y 11 como saprófitos. De acuerdo al número de colonias encontradas, se determinó que 65.69% de las semillas presentó incidencia de hongos, y 34.31% restante perteneció a semilla sana (Cuadro 1).
Cuadro 1 Incidencia de hongos presentes en semillas de avena de los cultivares Ágata, Chihuahua y Turquesa, obtenidas a partir de diferentes localidades del valle central de México, durante los ciclos primavera-verano 2009 y 2010.
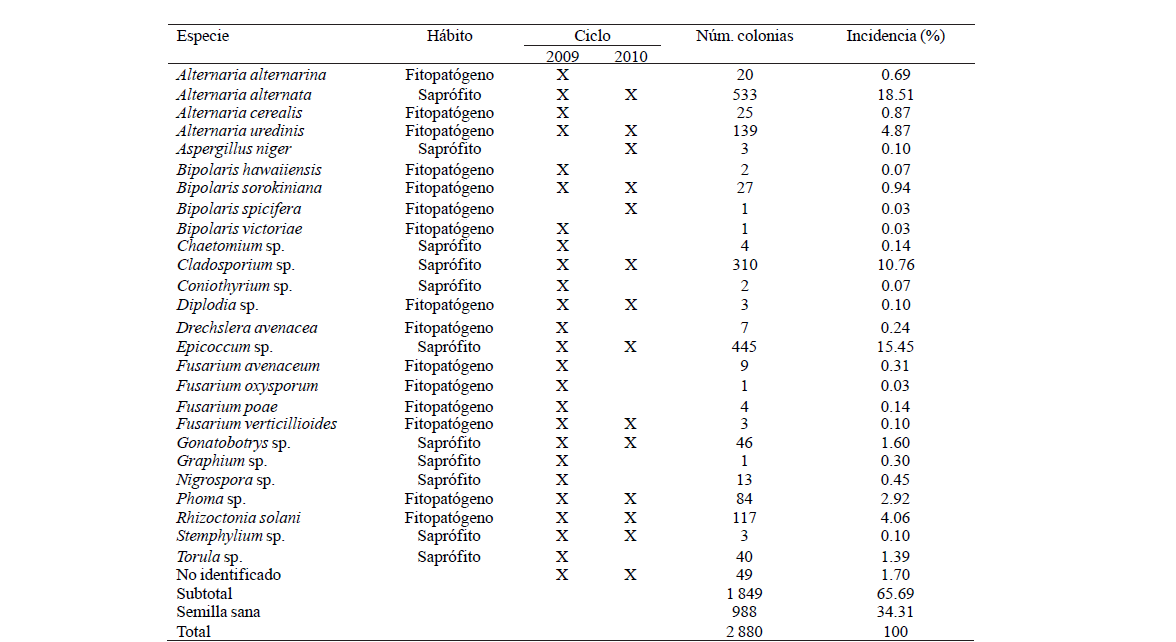
Alternaria uredinis, A. cerealis, A. alternarina, Rhizoctonia solani, Bipolaris spp. y Phoma sp. se encontraron como los hongos fitopatógenos con mayor incidencia, sumando 14.48%. Mientras que, Cladosporium sp. y Epicoccum sp. se detectaron como los hongos saprófitos con mayor incidencia, sumando 26.21%. Todas las semillas de avena presentaban apariencia sana al momento de la colecta, sin embargo, al colocarlas en cámara húmeda por el método Freezing-Bottler, se logró la germinación, crecimiento y reproducción de estructuras de los hongos presentes en la semilla.
Alternaria alternata se detectó con la mayor incidencia (18.51%), coincidiendo con Neergaard (1977) y Kurowski (2009), quienes señalaron que A. alternata está presente como un contaminante común en semillas de cereales. Por otra parte, se encontraron las siguientes especies fitopatógenas de Alternaria: A. alternarina, A. cerealis y A. uredinis sumando 6.43% de la incidencia total. Lo anterior concuerda con Simmons (2007) quien registró a estas especies como causantes de manchas y tizones foliares en avena.
Rhizoctonia solani mostró una incidencia considerable en este estudio, su rol como patógeno en plantas de avena es muy importante, debido a que este cereal es altamente susceptible, y las plantas infectadas por este hongo presentan lesiones en forma de diamante con el centro bronceado y márgenes color marrón oscuro sobre vainas de las hojas inferiores, además de retrasar su madurez y en ciertos casos ocasionar la muerte las plantas (Nyvall, 1999).
De acuerdo a Zyllinsky (1984), Bipolaris spp. siguen en importancia a las royas como patógenos destructivos de los cereales en todo el mundo. En este trabajo se obtuvieron colonias de Bipolaris sorokiniana, B. hawaiiensis, B. spicifera y B. victoriae. De manera similar, Bautista-Espinoza et al. (2011), registraron alta incidencia de B. sorokiniana y B. spicifera a partir de semillas de trigo obtenidas en la zona de colecta del presente estudio.
En esta investigación se identificaron cuatro especies de Fusarium: F. avenaceum, F. poae, F. oxysporum y F. verticillioides. Éste hongo ha sido comúnmente aislado a partir de semillas de Avena sativa (Clear et al., 2000; Kurowski y Wysocka, 2009), A. fatua (Mortensen y Hsiao, 1987) y A. strigosa (Farias et al, 2002). Fusarium avenaceum resultó ser la especie con mayor frecuencia, coincidiendo con lo indicado por Clear et al. (2000) en su investigación sobre Fusarium spp. en semillas de avena producidas en Canadá.
Drechslera avenacea se identificó en la semillas analizadas de este estudio, coincidiendo con lo mencionado por Lángaro et al. (2001), Silva et al. (2002), y Almeida y Reis (2009), quienes encontraron a esta especie en alta frecuencia en semillas de Avena sativa. La importancia de este hongo radica en que es uno de los principales patógenos trasmitidos a través de semillas de avena, además de ser el agente causal de tizón foliar de la avena (Lángaro et al., 2001; Carmona et al., 2004; Almeida y Reis, 2009).
Phoma sp. se obtuvo en baja proporción en ésta investigación, tal y como se ha detectado previamente en semillas de A. strigosa (Farias et al., 2002). Sin embargo, Tariq et al. (2004) encontraron a Phoma sp. en una incidencia 46%, sobre diferentes variedades de avena producidas en Pakistán, colocando a éste hongo como un patógeno de gran importancia actual en la producción de este cereal.
Se identificó a Diplodia sp. en la semilla proveniente de dos localidades de Tlaxcala, México, coincidiendo con Leyva-Mir et al. (2011), quienes reportaron a este fitopatógeno causando pudrición del grano de avena del cultivar Chihuahua en el mismo sitio. Por otra parte, la alta frecuencia de Cladosporium sp. en este estudio, concuerda con lo reportado por Farias et al. (2002), quienes señalaron que este género es uno de los principales saprófitos aislados a partir de semillas de A. strigosa.
El Cuadro 2, muestra la incidencia de hongos por localidad. En general, se encontró que las muestras de localidades del ciclo 2009 presentaron mayor incidencia de hongos comparadas con el periodo 2010. Además, se observaron diferencias significativas en incidencia total, incidencia de patógenos y saprófitos entre localidades, lo que indica que cada localidad mostró una problemática distinta de hongos presentes en la semilla. Zillinsky (1984), también encontró que la presencia de enfermedades en cereales varía según las condiciones ambientales de cada región.
Cuadro 2 Comparación de medias de la incidencia general de hongos, incidencia fitopatógenos e incidencia de saprófitos por localidad.
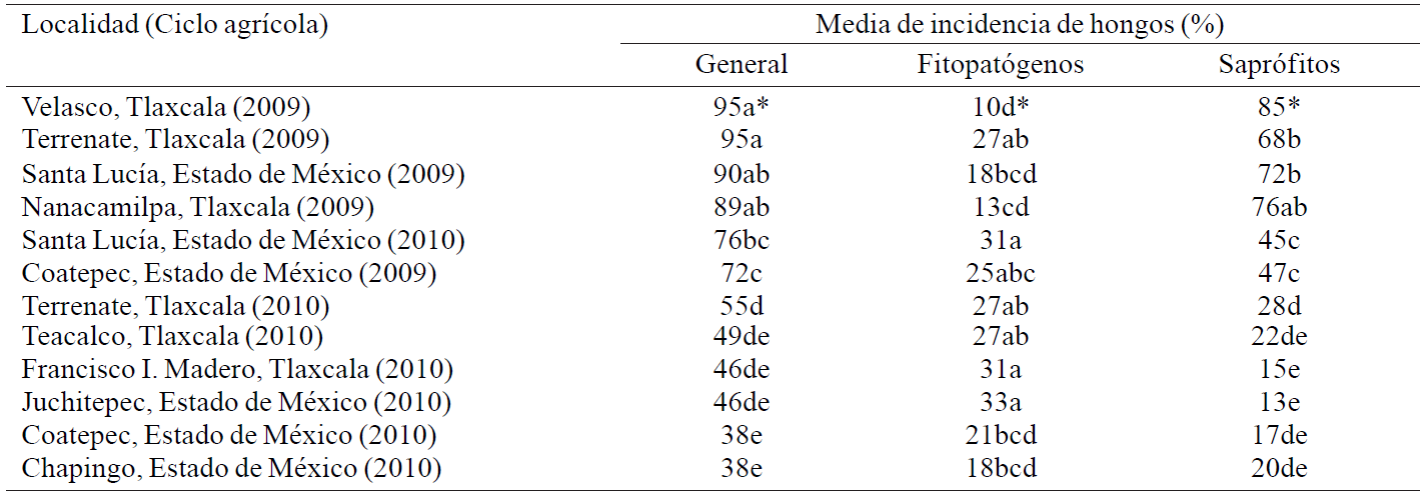
*Medias dentro de cada columna seguidas por la misma letra no difieren en la prueba de Tukey al 5% de probabilidad.
Las localidades donde se colectaron las muestras cuentan con una diferente precipitación anual, lo que probablemente incidió en una diferente frecuencia de hongos en la semilla, coincidiendo con Neergaard (1977), quien mencionó que la presencia de patógenos en las semillas puede fluctuar de un año a otro en una misma región, debido a variación en las condiciones de humedad.
Los resultados de incidencia de hongos por cultivar son mostrados en el Cuadro 3, señalando que el cultivar Chihuahua presentó mayor incidencia general seguido por Ágata y Turquesa. Lo anterior podría deberse a que el cultivar Chihuahua es el que posee mayor tiempo de haber sido liberado, además de que es altamente susceptible a enfermedades foliares y a roya del tallo (Puccinia graminis f. sp. avenae) (Jiménez, 1992). Mientras que, las variedades Ágata y Turquesa las cuales se liberaron en el año 2009, expresan tolerancia al complejo de enfermedades foliares causadas por Drechslera avenacea, Septoria avenae f. sp. avenae y Colletotrichum graminicola, además de ser moderadamente resistentes a roya del tallo y a roya de la corona (Puccinia coronata) (Villaseñor-Mir et al., 2009a, 2009b). Por otra parte, la incidencia de patógenos y saprófitos por cultivar, se registró de manera semejante, ya que los tres cultivares evaluados presentaron un porcentaje de incidencia con la misma agrupación de medias.
Cuadro 3 Incidencia general de hongos, incidencia de fitopatógenos e incidencia de saprófitos por cultivar de semillas de avena obtenidas de diferentes localidades del valle central de México, durante los ciclos primavera-verano 2009 y 2010.
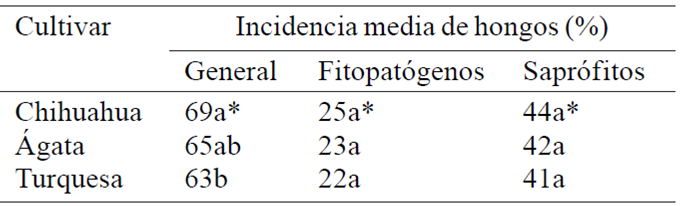
*Medias dentro de cada columna seguidas por la misma letra no difieren en la prueba de Tukey al 5% de probabilidad.
En conclusión, la incidencia de hongos fitopatógenos en semillas de avena provenientes de diferentes cultivares, ciclos de producción y localidades del valle central de México fue 15.4%; mientras que la incidencia de hongos saprófitos fue 48.87%. Por otra parte, la incidencia total de hongos fue mayor en el cultivar Chihuahua, seguido por los cultivares Ágata y Turquesa. Además, las semillas obtenidas durante el ciclo 2009, mostraron una mayor incidencia de hongos, tanto fitopatógenos como saprófitos.











 texto en
texto en 


