Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de ciencias agrícolas
Print version ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.5 n.6 Texcoco Aug./Sep. 2014
Artículos
Diversidad de poblaciones nativas de jitomate para germinación en condiciones salinas*
Diversity of native populations for germination of tomato under saline conditions
Victoria Estrada-Trejo1, Ricardo Lobato-Ortiz1§, Gabino García-de los Santos1, Guillermo Carrillo-Castañeda1, Fernando Castillo-González1, Efraín Contreras-Magaña2, Oscar Javier Ayala-Garay1, Micaela De la O Olan1 y Alberto Artola Mercadal1
1 Producción de Semillas-Colegio de Postgraduados. Carretera México-Texcoco km. 36.5, Montecillo, Texcoco 56230, Estado de México. Tel: 01 (595) 9520200. Ext. 1534, 1560, 1541, 1535, 1594. (trejovic@hotmail.com; garciag@colpos.mx; carrillo@colpos.mx; fcastill@colpos.mx; oayala@colpos.mx). §Autor para correspondencia: rlobato@colpos.mx.
2 Departamento de Fitotecnia-Universidad Autónoma Chapingo. Carretera México-Texcoco, km 38.5. 56230, Chapingo, Estado de México. Tel: 01 (595) 9521500. Ext. 6265. (cmefrain@yahoo.com).
* Recibido: octubre de 2013
Aceptado: julio de 2014
Resumen
En México algunas regiones productoras de jitomate a campo abierto como el noroeste presentan problemas de salinidad. Este problema también se presenta en condiciones de invernadero cuando la nutrición y el manejo del riego se hacen de manera inapropiada, esto se agrava cuando se usan aguas pesadas para riego. La salinidad afecta al cultivo del jitomate, por lo que tener materiales tolerantes a esas condiciones sería de gran beneficio. México es rico en diversidad genética de esta especie, misma que puede ser utilizada para buscar fuentes de tolerancia a la salinidad. Los objetivos del trabajo fueron evaluar el comportamiento fisiológico de 34 poblaciones de jitomate nativas de Puebla y Veracruz y dos testigos comerciales bajo condiciones salinas usando cinco concentraciones de cloruro de sodio (0, 0.25, 0.5, 0.75 y 1.0 %), con la finalidad de identificar germoplasma sobresaliente que tolere la salinidad en la etapa de germinación. El experimento se realizó en el Laboratorio de semillas del Colegio de Postgraduados en Ciencias Agrícolas en 2013. Las variables evaluadas fueron: porcentaje de germinación, velocidad de germinación, materia seca aérea y materia seca de raíz. Los resultados indican que el vigor de las semillas fue afectado de manera negativa en 100% de las colectas, la germinación en 78% y el desarrollo de las estructuras morfológicas de plántula como raíz, hipócotilo y cotiledones, el efecto negativo fue de un 33 %. De los 36 genotipos probados, ocho colectas presentaron diferentes grados de tolerancia. Estas poblaciones pueden ser utilizadas como fuentes potenciales para el mejoramiento genético.
Palabras clave: Solanum lycopersicum L., cloruro de sodio, salinidad, germinación.
Abstract
In Mexico some tomato growing regions like northwest have salinity problems. This problem also occurs under greenhouse conditions when nutrition and irrigation management are done improperly, this is exacerbated when heavy water is used for irrigation. Salinity affects tomato crops, so having tolerant materials to such conditions would be of great benefit. Mexico is rich in genetic diversity of this species, same that can be used to search for sources tolerant to salinity. The objectives of the study were to evaluate the physiological behavior of 34 populations of native tomatoes from Puebla and Veracruz and two commercial controls under saline conditions using five concentrations of sodium chloride (0, 0.25, 0.5, 0.75 and 1%), in order to identify outstanding germplasm tolerant to salinity in the germination stage. The experiment was performed at the Laboratory of seeds from the Postgraduate College in Agricultural Sciences in 2013. The evaluated variables were: germination percentage, germination rate, aerial dry matter and root dry matter. The results indicate that the seed vigor was negatively affected in 100% of the collections, germination in 78% and development of morphological structures of seedling as root, hypocotyl and cotyledons, the negative effect was 33%. Of the 36 genotypes tested, eight collections showed different degrees of tolerance. These populations can be used as potential sources for breeding.
Keywords: Solanum lycopersicum L., sodium chloride, salinity, germination.
Introducción
La superficie de la república mexicana es de aproximadamente 200 millones de hectáreas y se destina a la agricultura aproximadamente 21 millones de hectáreas (10.5% del territorio nacional), de toda esta superficie 6.5 millones de hectáreas son de riego y 14.5 de temporal (CONAGUA, 2008). Del total de esta superficie irrigada se estima que entre 15% (970, 000 ha) y 21% (1 300 000 ha) del área está afectada por exceso de sales (De la Peña, 1993; Feuchter, 2000), lo cual es un problema serio en varias zonas de riego del país que afecta a cultivos diversos, dentro de los cuales se encuentra el cultivo del jitomate. La probabilidad de encontrar variación genética para tolerancia a salinidad en esta especie es alta, ya que México es considerado centro de domesticación y de diversidad secundaria de la especie (Jenkins, 1948) y se encuentra distribuido en casi todo el territorio la variedad cerasiforme en su forma silvestre (Chávez-Servia et al., 2011).
El jitomate en México es cultivado en zonas de riego, donde hay problemas de salinidad, por lo que tener materiales tolerantes a este estrés abiótico es fundamental para poderlo cultivar en estas zonas. Los principales estados productores de la especie son Sinaloa, Baja California, Michoacán, Jalisco, San Luis Potosí, Baja California Sur, Querétaro y Estado de México (SAGARPA, 2010). En algunas regiones productoras de jitomate como Sinaloa, Baja California, Michoacán y San Luis Potosí presentan problemas de salinidad (Ortega, 1991).
La mayoría de los cultivares comerciales de jitomate presentan una sensibilidad moderada a este problema, en todas las etapas de desarrollo de la planta incluida la germinación, el desarrollo vegetativo y la reproducción. Esto trae como consecuencia una reducción significativa del rendimiento cuando es cultivado bajo estrés salino (Bolarín et al., 1993). Se han logrado avances en el desarrollo de cultivares de jitomate tolerantes a la salinidad mediante el mejoramiento convencional, con el uso de parientes silvestres como fuentes de genes para conferir tolerancia al problema (Ashraf, 1994).
La tolerancia en alguna etapa del desarrollo de las plantas, generalmente no está relacionada con la tolerancia de las otras, las etapas ontogénicas específicas como la germinación, emergencia, desarrollo vegetativo y reproductivo deben ser evaluadas de manera separada, para identificar, caracterizar y utilizar los recursos genéticos con tolerancia a dicho estrés (Foolad, 1999). En la germinación de la semilla participan diferentes factores ambientales y el potencial genético de la misma de todo esto en conjunto dependerá su sobrevivencia.
Anatómicamente la semilla de jitomate está cubierta por una testa, que encierra un embrión curvo filiforme y un endospermo que prácticamente llena el lumen (Esau, 1953). Para que se lleve a cabo la germinación, la fuerza de la extensión hidráulica del embrión debe superar la fuerza de oposición de la cubierta de la semilla y los tejidos vivos del endospermo (Groot y Karsen, 1987). Liptay y Schopfer (1983) plantearon que el genotipo del embrión, desempeña un papel importante en la determinación del tiempo de germinación del jitomate bajo condiciones de estrés y óptimas. Las diferencias que muestran las semillas de jitomate en su sensibilidad a las sales durante la germinación reside en el potencial osmótico o potencial de presión del embrión germinando. Sin embargo, el estrés osmótico puede afectar negativamente la imbibición de la semilla; por lo tanto, retarda o debilita las fuerzas restrictivas del endospermo y la cubierta de la semilla y como resultado se reduce o inhibe la germinación (Dahal et al., 1990). Los objetivos de este trabajo fueron evaluar el comportamiento fisiológico de 34 poblaciones nativas y dos testigos comerciales en cinco concentraciones salinas mediante la prueba de germinación e identificar germoplasma mexicano tolerante a la salinidad.
Materiales y métodos
Material genético
El material genético estuvo constituido por 34 poblaciones provenientes de los estados de Puebla y Veracruz más dos testigos comerciales (Sun-7705 y Super Sweet-100).
Para evaluar la tolerancia a la salinidad de las poblaciones se usó la prueba de germinación con una solución salina de NaCl a diferentes concentraciones en 2013. El experimento se desarrolló en el laboratorio de Análisis de Semillas del Colegio de Postgraduados en Ciencias Agrícolas. Las concentraciones salinas empleadas en la prueba de germinación fueron: 0%, 0.25% (42 mM), 0.5% (86 mM), 0.75% (128 mM) y 1% (171 mM) de NaCl. El experimento consistió en un arreglo factorial de 36 * 5 tratamientos, con un diseño experimental completamente al azar con tres repeticiones. Cada unidad experimental estuvo compuesta de 50 semillas.
Las semillas fueron germinadas en cajas Petri con sanitas, a cada caja se le añadió cuatro mL de solución; posteriormente las cajas fueron colocadas en una cámara artificial con humedad relativa de 87% y temperatura de 25 oC. Las cámaras artificiales fueron colocadas en una cámara de germinación a 26 oC y 50% de humedad relativa con luz fluorescente. A cada una de las soluciones, en una muestra de 30 mL, se les midió la conductividad eléctrica (CE) con un puente de conductividad MODEL 31 CONDUTIVITY BRIDGE.
Variables evaluadas
Se evaluó la germinación diaria, materia seca aérea y materia seca de raíz. La germinación se contabilizó cada 24 h durante 14 días. Se consideró a una semilla germinada cuando había ocurrido la protusión de la radícula y ésta tuviera una longitud mayor o igual de 3 mm. Para las variables materia seca aérea y de raíz se tomaron 10 plántulas al azar de cada repetición, se separó la raíz de la parte aérea y se dejaron a secar en una estufa a una temperatura de 70 oC hasta peso constante, luego su peso fue tomado en una báscula y registrado. Con los datos de las variables porcentaje de germinación (G), materia seca aérea (MSA) y materia seca de la raíz (MSR) se hicieron análisis de varianza y de regresión lineal con el paquete estadístico SAS (SAS; 2002). La variable velocidad de geminación (VG) se obtuvo mediante la fórmula 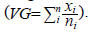
Donde: VG= velocidad de germinación; Xi= número de semillas por día; y Ni= número de días después de la siembra.
La velocidad de germinación (VG) es una manera de evaluar el vigor de la semilla (Maguire, 1962).
Resultados y discusión
Respuesta a las concentraciones de cloruro de sodio
Los resultados del análisis de varianzas de la regresión lineal mostraron que hubo un efecto de las concentraciones de cloruro de sodio en la germinación altamente significativo para 14% del germoplasma evaluado (cinco genotipos) y significativo para 64% (22 colectas y Sun-7705) (Cuadro 1). Lo anterior indica que 22% del material genético en estudio mostró tolerancia a la salinidad durante la prueba de germinación. Para la velocidad de germinación, el efecto fue altamente significativo en 83% de las poblaciones que equivale a 28 genotipos nativos y los dos híbridos testigos, y significativo 17% (siete genotipos) (Cuadro 2).
Lo anterior indica que mientras el vigor fue afectado 100% del material genético en estudio, la germinación lo fue 78%. Este resultado se debe que el vigor de la semilla es un rasgo muy complejo en comparación con la germinación estándar que es una sola característica medible. El vigor es un concepto que describe varias características asociadas con el funcionamiento de los lotes o poblaciones de semillas. Además, el vigor puede reflejar cambios directos con relación a la velocidad y totalidad de la germinación, así como la tolerancia al estrés ambiental o la capacidad de las plántulas de superarlo. También el vigor proporciona información adicional sobre la velocidad y uniformidad del crecimiento de las plántulas y su capacidad de establecerse en un rango amplio de condiciones ambientales (Tekrony, 2003).
En lo referente al desarrollo de las estructuras morfológicas, el efecto en la materia seca aérea fue altamente significativo para 2% de las poblaciones (genotipo 17); significativo para 31% (10 genotipos y el Super Sweet-100) y no significativo en 67% del material genético en estudio (23 genotipos y Sun-7705) (Cuadro 3). En el caso de materia seca de raíz, dicho efecto fue altamente significativo en 2% (población 52); significativo en 31% (11 genotipos) y no significativo 67% del germoplasma evaluado (Cuadro 4). De manera global se observa que 33% de las poblaciones se afectó negativamente el desarrollo de las estructuras como hipocótilo, cotiledones y raíz con las diferentes concentraciones de cloruro de sodio, mientras 67% de los 36 genotipos no fueron afectados por salinidad, lo cual indica que existió suficiente variabilidad genética en tolerancia a este estrés abiótico en estas características en el germoplasma evaluado.
De los 36 materiales genéticos estudiados bajo salinidad, los genotipos 14, 38, 41 y 92 no fueron afectados de manera significativa en la germinación, así como tampoco en el desarrollo de las estructuras morfológicas, pero si se afectó su velocidad de germinación (Cuadro 2). La tolerancia a la salinidad de las semillas en el proceso de germinación es una medida de la habilidad de éstas para soportar los efectos de altas concentraciones de sales solubles en el medio. La presencia de sales en el medio disminuye el potencial hídrico, provocando una menor disponibilidad de agua para las semillas, de manera que éstas deben generar suficiente potencial osmótico para mejorar el estatus hídrico de los embriones y permitir su crecimiento (Jones, 1986). También es notorio que la mayoría de las poblaciones fueron afectadas en diferentes niveles, esto puede deberse a los límites máximos de tolerancia a la salinidad en la germinación del germoplasma diverso utilizado, ya que la tolerancia a la salinidad está en función de los genotipos y la variabilidad en su respuesta (Cuartero y Fernández-Muñoz, 1999).
Estimación de parámetros de regresión lineal simple para 36 poblaciones de jitomate bajo condiciones salinas
Las ecuaciones de regresión lineal Y= β0 + β1 (X) para las variables germinación (G), velocidad de germinación (VG), materia seca aérea (MSA) y materia seca de raíz (MSR), permiten estimar el efecto que producen las diferentes concentraciones (0, 0.25, 0.5, 0.75, 1%) del cloruro de sodio en el germoplasma en estudio. En general en las cinco variables, la pendiente de la línea recta (β1) es negativa para cada una de las variables en cada una de los 36 genotipos (Cuadros 1, 2, 3 y 4); es decir, que las diferentes concentraciones de cloruro de sodio afectan de manera negativa la germinación, el vigor de semilla así como el desarrollo de las estructuras de la plántula evaluadas a través de materia seca aérea y de raíz.
Sin embargo, el efecto negativo fue diferente en cada una de los 36 genotipos, ya que los intervalos en cada una de las variables fue de la siguiente manera: el valor de β1 para porcentaje de germinación varió de -34.9 a -116.8 (Pob. 22 y Pob. 20, respectivamente), para la velocidad de germinación fue de -11.48 a -21.16 (Pob. 64 y Pob. 86, respectivamente), para la materia seca aérea el rango fue de -3.86 a -20.23 (Pob. 53 y el híbrido Sun 7705, respectivamente) y para materia seca de raíz fue de -0.81 a -3.49 (Pob. 92 y Sun 7705, respectivamente) (Cuadro 4). En este sentido, Fageria et al. (2012) indican que los efectos negativos de la salinidad en la agricultura influyen en el desarrollo, crecimiento y el rendimiento de los cultivos y típicamente, la disminución del desarrollo de las plantas se produce de manera lineal, una vez que ha alcanzado el valor del umbral de la salinidad.
Los tratamientos de las diferentes concentraciones de cloruro de sodio afectaron de manera significativa las variables evaluadas en las 36 poblaciones. Para las variables porcentaje de germinación y materia seca de raíz, la concentración 0% no presentó diferencias significativas comparada con la concentración al 0.25%, mientras que con respecto a las otras tres concentraciones, sí mostraron diferencias significativas y un efecto negativo para estos caracteres (Cuadro 5). Para velocidad de germinación hubo diferencias significativas en los cinco tratamientos. Para la materia seca aérea hubo diferencias significativas para las concentraciones de 0 y 0.25% y ambas fueron similares con la concentración de 0.5%. La concentración de 0.25% desarrolló mayor cantidad de materia seca aérea. En el caso de los otros dos tratamientos (0.75 y 1%), el efecto negativo de las sales fue tan drástico que no se desarrollaron los hipocótilos, ni los cotiledones, por lo que no se contabilizó la variable.
La variable materia seca de raíz no mostró diferencias significativas para las concentraciones de 0, 0.25 y 0.5%, pero las concentraciones de 0.75 y 1% si fueron significativamente diferentes. Estos resultados podrían deberse a que condiciones de estrés por salinidad, originan un déficit hídrico en la planta y obligan a que se sacrifique la acumulación de biomasa de la parte aérea y se deposite en la raíz, con el fin de que este órgano aumente su tamaño y pueda explorar el suelo para hallar condiciones favorables (Casierra-Posada y Rodríguez, 2006). Las plantas en condiciones salinas establecen un balance energético que consiste en una adaptación osmótica de sus células para seguir absorbiendo agua y este proceso requiere de mayor consumo de energía lo cual se hace a costa de un menor crecimiento (Berstein, 1961), afectando el crecimiento de forma irreversible, ya que las sales afectan la división celular y esto conlleva a un engrosamiento prematuro de la paredes celulares (Aceves, 1971).
De manera general se observó que los 36 genotipos evaluados son afectados de forma negativa en la calidad fisiológica (germinación y vigor), así como en el desarrollo de las estructuras de la plántula. De hecho, el efecto negativo de las sales en el crecimiento de las raíces en jitomate parece ser menos afectado en comparación con el tallo (hipócotilo) (Cuadro 2). Hamed et al. (2011), encontraron que el incremento del peso seco de raíz/vástago en jitomate en condiciones de salinidad va acompañada por cambios en la distribución de asimilados entre la raíz y el vástago y que hay mayor proporción de asimilados en la raíz en comparación con el vástago.
Los resultados de las comparaciones de medias permiten diferenciar a los genotipos más sobresalientes o tolerantes al efecto negativo de las condiciones estresantes de las soluciones con diferentes concentraciones de cloruro de sodio (Cuadro 6). Para la variable porcentaje de germinación, seis poblaciones del estado Puebla más el testigo Super Sweet-100 (19.4%) tuvieron una respuesta superior en promedio a las diferentes concentraciones de cloruro de sodio con respecto a los otros 29 genotipos.
Para velocidad de germinación, una manera de medir el vigor, fueron cuatro genotipos del estado de Puebla y el híbrido Sun-7705 (13.9%) superiores con respecto al resto de los genotipos. En lo que se refiere a la producción de materia seca aérea, el híbrido Sun-7705 fue el que desarrolló mejor sus estructuras, ninguna población nativa fue similar o superior a este híbrido, aunque las poblaciones nativas sobresalientes fueron cuatro del estado de Puebla y dos de Veracruz (16.7%). En la producción de materia seca de raíz sobresalieron dos poblaciones del estado de Puebla y el híbrido Sun-7705. Éstos resultados muestran que hay mayor número de poblaciones tolerantes a las condiciones salinas en la germinación comparada con el número de genotipos para vigor y desarrollo de estructuras morfológicas.
Una gran proporción de las poblaciones de Veracruz presentaron los resultados inferiores y que posiblemente por las características climáticas de su lugar de origen durante su evolución no han estado expuestas a estrés por salinidad. De acuerdo a los resultados de las comparaciones de medias (Cuadro 6), las poblaciones más sobresalientes en germinación, vigor y producción de materia seca aérea y de raíz fueron el genotipo 22 y el híbrido Sun 7705; para germinación, vigor y materia seca aérea el genotipo 86; para germinación y vigor los genotipos 92 y 38; para germinación y materia seca de raíz el genotipo 41; para germinación los genotipos 27, 14 y el híbrido Super Sweet-100 y para materia seca aérea el genotipo 23 del estado de Puebla. Los genotipos que mostraron cierto grado de tolerancia a la salinidad pueden ser usados como fuentes potenciales para el mejoramiento genético del jitomate (Amir et al., 2011; Hamed et al., 2011).
En total se identificaron ocho poblaciones de Puebla con cierto grado de tolerancia a la salinidad, seis de ellos, las poblaciones 22, 41, 38, 27, 14, 23 son originarias de la región norte con un intervalo de altitud de 210 a 1 538 m, mientras que las poblaciones 86 y 92 son de la región sur, colectadas a altitudes de 1 100 a 1 620 m (INEGI, 2004).
Conclusiones
Las diferentes concentraciones de cloruro de sodio afectaron de manera negativa y diferencial a cada uno de los 36 materiales genéticos en germinación, vigor de semilla, así como en el desarrollo de las estructuras de la plántula evaluadas a través de materia seca aérea y de raíz. Ésto demuestra que existió variabilidad genética en el germoplasma estudiado; ya que el efecto negativo (β1) fue diferente para cada una de los genotipos en estudio. Para (%) de germinación el intervalo fue de -34.9 a -116.8, para velocidad de germinación fue de -11.48 a -21.1, para materia seca aérea fue de -3.86 a -20.2 y para materia seca de raíz fue de -0.81 a -3.49.
El vigor de las semillas fue afectado por la salinidad de manera negativa en 100% del germoplasma estudiado. El 22% del mismo presento tolerancia en la prueba de germinación. Mientras 67% del material genético en estudio mostro tolerancia a la salinidad durante el desarrollo de las estructuras morfológicas de plántula como raíz, hipocótilo y cotiledones.
Ocho colectas (22, 86, 92, 38, 41, 27, 14 y 23) se destacaron por su tolerancia a salinidad. La colecta 22 fue la mejor en germinación, vigor y desarrollo de materia seca aérea y de raíz; la 86 se destacó en la prueba de germinación, vigor y materia seca aérea; las colectas 92 y 38 tuvieron mejor respuesta en germinación y vigor; la 41 en germinación y materia seca de raíz; las colectas 27 y 14 solo en germinación y finalmente la colecta 23 destacó en materia seca aérea.
Las poblaciones nativas de jitomate tolerantes a salinidad identificadas en este estudio pueden ser utilizadas como fuente de germoplasma para el mejoramiento genético de variedades e híbridos tolerantes a salinidad en la etapa de germinación.
Literatura citada
Aceves, N. E. 1979. Ensalitramiento de suelos bajo riego. Colegio de Postgraduados en Ciencias Agrícolas. Chapingo, Texcoco, Estado de México. 382 p. [ Links ]
Amir, N.; Muhammad, A.; Muhammad, A. P. and Irfan, A. 2011. Effect of halopriming on germination and seedling vigor of tomato. Afr. J. Agr. Res. 6(15):3551-3559. [ Links ]
Ashraf, M. 1994. Breeding for salinity tolerance in plants. Crit. Rev. Plant Sci. 13:17-42. [ Links ]
Bernstein, L. 1961. Osmotic adjustment of plants to saline media I. Steady state. Amer. J. Bot. 48:909-918. [ Links ]
Bolarín, M. C.; Pérez-Alfocea, F.; Cano, E. A.; Estaño, M. T. and Caro, M. 1993. Growth, fruit yield, and ion concentration in tomato eco-types after pre-emergence salt treatments. J. Am. Soc. Hort. Sci. 118:655-660. [ Links ]
Casierra-Posada, F. y Rodríguez, S. 2006. Tolerancia de plantas de feijoa (Acca sellowiana [Berg] Burret) a la salinidad por NaCl. Agron. Colomb. 24(2):258-265. [ Links ]
Comisión Nacional de Agua (CONAGUA). 2008. Programa nacional hídrico 2007-2012. SEMARNAT. Gobierno Federal. 163 p. [ Links ]
Cuartero, J. and Fernández-Muñoz, R. 1999. Tomato and salinity. Sci. Hortic. 78:83-125. [ Links ]
Chávez-Servia, J. L.; Carrillo-Rodríguez, J. C.; Vera-Guzmán, A. M.; Rodríguez-Guzmán, E. y Lobato-Ortiz, R. 2011. Utilización actual y potencial del jitomate silvestre mexicano. Subsistema Nacional de Recursos Fitogenéticos para la Alimentación y la Agricultura (SINAREFI). Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA). CIIDIR-Unidad Oaxaca del Instituto Politécnico Nacional e Instituto Tecnológico del Valle de Oaxaca. Oaxaca, México. 72 p. [ Links ]
Dahal, P.; BradfordK, K. J. and Jones, R. A. 1990. Effects of priming and endosperm and endosperm integrity on seed tomato genotypes: I. Germination at suboptimal temperature. J. Expt. Bot. 41:1431-1440. [ Links ]
Fageria, N. K.; Stone, L. F. and Baeta, dos S. A. 2012. Breeding for salinity tolerance. In: plant breeding for abiotic stress tolerance. Fritsche-Neto, R.; Borem, A. (Eds.). Spinger. Verlag Berlin Heidelberg. 103-122 pp. [ Links ]
Feuchter, A. F. R. 2000. Recuperación de suelos salinos agrícolas, mediante el establecimiento de praderas bajo cultivos alternativos. Diez acciones propuestas de Bioingeniería sostenible. Universidad Autónoma Chapingo. Centro regional Universitario del Noroeste. Cd. Obregón, Sonora: (http://www.zoetecnocampo.com/Documentos/01.htm. [ Links ]
Foolad, M. R. 1999. Comparison of salt tolerance during seed germination and vegetative growth in tomato by QTL mapping. Genome 42:727-734. [ Links ]
Groot, S. P. C. and Karsen, C. M. 1987. Gibberellins regulate seed germination in tomato by endosperm weakening: a study with gibberellin-deficient mutant. Planta 171:525-531. [ Links ]
Hamed, K.; Hossein, N.; Mohammad, F. and Safieh, V. J. 2011. How salinity affect germination and emergence of tomato lines. J. Biol. Environ. Sci. 5(15):159-163. [ Links ]
Instituto Nacional de Estadística Geografía e Informática (INEGI). 2004: sistema fisiográfico DGGTENAL. Escrito de la Subdirección de Actualización de Recursos Naturales: las provincias fisiográficas de México y sus subdivisiones. 56 p. [ Links ]
Jenkins, J. A. 1948. The origin of the cultivated tomato. Econ. Bot. 2:379-392. [ Links ]
Jones, R. A. 1986. High salt tolerance potential in Lycopersicon species during germination. Euphytica; 35:575-582. [ Links ]
Liptay, A. and Schopfer, P. 1983. Effect of water stress, seed coat restraint, and abscisic acid upon different germination capabilities of two tomato lines at low temperatura. Plant Physiol. 73:935-938. [ Links ]
Maguire, J. D. 1962. Speed of germination, aid in selection and evaluation of seedling emergence vigor. Crop Sci. 2:176-177. [ Links ]
Ortega, E. M. 1991. Manejo y uso de las aguas salinas bicarbonatadas y sulfáticas para riego (Memoria). Centro de Hidrociencias. Colegio de Postgraduados en Ciencias Agrícolas. Montecillo, Texcoco, Estado de México. 1-20 pp. [ Links ]
Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA). 2010. Monografía de cultivos- jitomate. Subsecretaría de Fomento a los agronegocios: http//www.sagarpa.gob.mx/agronegocios/Documentos. [ Links ]
Statistical Analysis System Institute (SAS Institute). 2002. SAS Guide for Personal Computers, 9th, Cary, NC, USA. [ Links ]
TeKrony, D. M. 2003. Precision is an essential component in seed vigour testing. Seed Sci. Technol. 31:435-447. [ Links ]














