Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias agrícolas
versión impresa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.5 no.5 Texcoco jun./ago. 2014
Artículos
Inoculación micorrízico arbuscular en portainjertos de plantas de aguacate cv 'Hass' en viveros de Michoacán, México*
Arbuscular mycorrhizal inoculation in avocado rootstocks cv 'Hass' in nurseries of Michoacán, Mexico
Yazmín Carreón Abud1§, Salvador Aguirre Paleo2, Mayra E. Gavito3, Dorian Javier Mendoza Solís2, Raúl Juárez Chávez2, Miguel Martínez Trujillo1 y Dora Trejo Aguilar4
1 Laboratorio de Genética y Microbiología. Facultad de Biología. Universidad Michoacana de San Nicolás de Hidalgo. Avenida Francisco J. Mujica S/N Ciudad Universitaria, C.P. 58030, Morelia, Michoacán, México. Tel: (443) 3 22 35 00. Ext. 4224. Fax: (443) 3 04 08 09. §Autora para correspondencia: ycabud@gmail.com, codigogenetico@gmail.com.
2 Facultad de Agrobiología "Presidente Juárez", Universidad Michoacana de San Nicolás de Hidalgo. aguirrepaleo@hotmail.com
3 Centro de Investigaciones en Ecosistemas, Universidad Nacional Autónoma de México. mgavito@cieco.unam.mx, mgavito@oikos.unam.mx
4 Laboratorio de Organismos Benéficos. Universidad Veracruzana. doratrejo@gmail.com.
* Recibido: febrero de 2014
Aceptado: abril de 2014
Resumen
El objetivo de este estudio fue evaluar el desempeño de 12 inoculantes de hongos micorrízicos arbusculares (HMA) en el desarrollo de portainjertos de plantas de aguacate cv. 'Hass' en etapa de vivero. El experimento fue llevado a cabo en Uruapan, Michoacán, México, utilizando plantas de 60 días de edad, recientemente injertados. Los 12 tratamientos se distribuyeron en un diseño completamente al aleatorio, con 6 repeticiones: A) Gigaspora gigantea; B) Acaulospora delicata; C) Rhizophagus fasciculatus (foráneo); D) Consorcio de Veracruz MTZ1-UV; E) Rhizophagus fasciculatus; F) Rhizophagus irregularis 28-A; G) comunidad nativa de AMF; H) Rhizophagus irregularis (MUCL); I) Rhizophagus fasciculatus + Azospirillum; J) Sclerocystis aff. rubiformis; K) Acaulospora laevis; L) Scutellospora pellucida; y M) testigo. La altura de las plantas, diámetro de los tallos y número de hojas fueron medidos cada 2 semanas durante 5 meses, después de lo cual las plantas fueron cosechadas y se dtermino el peso seco del tallo y de la raíz. Las mediciones periódicas a lo largo del experimento, demostraron que Acaulospora delicata y el testigo tuvieron un mejor desempeño en la altura de las plantas, Scutellospora pellucida en lo referente al diámetro del tallo y el testigo en el número de hojas. En la cosecha, las plantas inoculadas con Rhizophagus intraradices 28-A y Scutellospora pellucida tuvieron 2 veces más peso del tallo y de la raíz con relación a los otros tratamientos. Además, se concluye que la inoculación del cuello de la raíz de las plantas recientemente injertadas, mostró respuestas claras a la inoculación con cepas eficientes de hongos micorrízicos, aunque pasaron 6 meses para que las diferencias fueran evidentes.
Palabras clave: aguacate, portainjertos, hongos micorrízicos arbusculares, vivero.
Abstract
The aim of this study was to evaluate the performance of twelve inoculants of arbuscular mycorrhizal fungi (AMF) in the development of avocado rootstock cv. 'Hass' in the nursery stage. The experiment was conducted in Uruapan, Michoacán, Mexico, using 60-days-old, newly grafted rootstocks. The 12 treatments were in a completely randomized design with 6 replications: A) Gigaspora gigantea; B) Acaulospora delicata; C) Rhizophagus fasciculatus (foreign); D) MTZ1-UV Consortium from Veracruz; E) Rhizophagus fasciculatus; F) Rhizophagus irregularis 28-A; G) Native AMF community; H) Rhizophagus irregularis (MUCL); I) Rhizophagus fasciculatus + Azospirillum; J) Sclerocystis aff. rubiformis; K) Acaulospora laevis; L) Scutellospora pellucida; M) Control. Plant height, stem diameter and number of leaves were measured every two weeks for 5 months, after which plants were harvested and shoot and root dry weight were also measured. Periodical measurements showed that Acaulospora delicata and the control performed better in terms of plant height, Scutellospora pellucida in terms of stem diameter and the control in the number of leaves along the experiment. At harvest, plants inoculated with Rhizophagus intraradices 28-A and Scutellospora pellucida had twice as large shoot and root weights as the rest of plants. We conclude that stem collar inoculation of recently grafted plants showed clear responses to inoculation with efficient strains of mycorrhizal fungi even though it took over six months before differences became evident.
Keywords: avocado, arbuscular mycorrhizal fungi, nursery, rootstocks.
Introducción
El aguacate (Persea americana Mill.) es un cultivo nativo de México y Centroamérica altamente rentable (Smith, 1966; Sánchez et al., 2001). México es el mayor productor de aguacate en el mundo (SAGARPA, 2008) y Michoacán es el estado mexicano que contribuye con la mayor área cultivada y 80% de la producción nacional (Sánchez et al., 2001; SAGARPA, 2008; Gutiérrez et al., 2010). El aguacate tiene gran importancia económica en Michoacán debido a los beneficios que genera entre los participantes de la cadena de producción, tales como los productores, comerciantes, industriales y consumidores, así como también los trabajadores permanentes y temporales que desarrollan el trabajo de la siembra y del manejo post cosecha (Téliz y Marroquín, 2007). Por cada 10 ha que se cultivan, se proporciona empleo a 1.5 personas (Sánchez et al., 2001; Gutiérrez et al., 2010).
Michoacán también produce millones de plantas de aguacate al año en vivero para satisfacer la demanda para nuevas plantaciones y para el mantenimiento de las huertas establecidas. Además, esto es un mercado rentable; las plantas son solicitadas y vendidas localmente o bien a otras regiones del país donde su calidad es altamente apreciada. Sin embargo, se han cuestionado las altas cantidades de fertilizantes y productos para el control de plagas. Existe la necesidad de implementar nuevas tecnologías de producción que reduzcan estos insumos, pero que mejoren la nutrición, salud, crecimiento, resistencia a patógenos y tolerancia a las condiciones adversas en el vivero y posteriormente en el campo.
Una alternativa para mejorar la producción es la aplicación de inoculantes microbianos, tales como los producidos a partir de hongos micorrízicos arbusculares (HMA), los cuales tienen funciones importantes mediante el establecimiento de una simbiosis con las raíces de las plantas (Rivera et al., 2011). Los reportes publicados acerca de ensayos de inoculación probando el efecto de inoculantes de HMA son escasos y han mostrado un rango amplio de respuestas, desde nulas hasta respuestas claras del crecimiento (Menge et al., 1978, 1980; Silva y Siqueira, 1991; Vidal et al., 1992; Reyes et al., 1998; Silveira et al., 2002; Montañez, 2009; Montoya y Osorio, 2009). El presente estudio se llevó a cabo para evaluar el desempeño de una amplia variedad de inoculantes micorrízicos, incluyendo cepas de HMA nativas, foráneas, comerciales y no comerciales, sobre el desarrollo de portainjertos de aguacate cv 'Hass' en etapa de vivero. Se consideró que los inoculantes locales serían más efectivos que los inoculantes foráneos en la promoción del crecimiento de plantas de aguacate, asumiendo que los primeros estarían mejor adaptados para competir con los hongos micorrízicos nativos.
Materiales y métodos
Descripción del área de estudio
El experimento se llevó a cabo en un vivero localizado en Uruapan, Michoacán, México, con un clima templado húmedo con abundantes lluvias en verano y una temperatura promedio de 17.9-19.7 °C y una precipitación anual de 1 200-1 600 mm (Gutiérrez, 2010). Las plantas de 60 días de edad fueron obtenidas de la germinación de semillas de una variedad nativa de aguacate "criollo", las cuales se habían injertado recientemente con la variedad 'Hass'.
Producción de inoculantes micorrízicos
La inoculación se llevó a cabo con 12 cepas o consorcios de hongos micorrízicos provenientes de diferentes fuentes. Los inoculantes locales utilizados se obtuvieron directamente del suelo de los bosques templados, huertas de aguacate ó campos de maíz del estado de Michoacán, mediante el establecimiento de cultivos puros y propagación posterior en macetas. Las esporas fueron extraídas del suelo por decantación y tamizado húmedo (Gerdemann y Nicolson, 1963), seguido por una centrifugación en gradiente de sacarosa al 60% (Walker y Vestberg, 1994). Los morfotipos de esporas se separaron con base en el tamaño, color, forma y presencia o ausencia de hifas de soporte y se montaron en laminillas permanentes. La identificación de especies se llevó a cabo utilizando claves y descripciones originales reportadas en Schenck y Pérez (1990) y bases de datos públicas de la red de internet, siguiendo el arreglo taxonómico propuesto por Schuβler et al. (2001). Los morfotipos que mostraron mayor abundancia de esporas en buenas condiciones fueron seleccionados para su aislamiento en cultivos puros. Las esporas fueron utilizadas para inocular plantas hospederas de las especies Medicago sativa, Zea mays y Brachiaria decumbents, crecidas en suelo estéril en tubos de PVC, macetas ó cajas de Petri con minirizotrones (Ortega-Larrocea et al., 2008). La presencia de micorrizas fue examinada después de algunas semanas en las raíces muestreadas y se hizo una tinción con azul de tripano (Phillips y Hayman, 1970). Los otros inoculantes utilizados fueron comerciales ó bien no comerciales donados por otros investigadores. Los detalles de cada inóculo se presentan en el Cuadro 1.

Diseño experimental
Los inoculantes probados fueron aplicados alrededor de la base del tallo después de remover parte del suelo y exponiendo el cuello de la raíz. Cada inoculante fue aplicado utilizando una suspensión con 400 g de suelo de las macetas de propagación, diluidos en 4 L de agua para cada planta. Posteriormente la raíz se cubrió nuevamente con el mismo suelo. Los testigos se sometieron al mismo procedimiento pero recibieron sólo 4 L de agua estéril. Es importante mencionar que los portainjertos de aguacate ya tenían suelo del campo utilizado en el vivero, por lo que contenían la microbiota nativa del suelo tipo Andosol, llamado "Topuri". Por lo tanto, los inoculantes adicionados debieron interactuar y competir con los microorganismos nativos. Los tratamientos fueron asignados y distribuidos en un diseño completamente al azar, con 3 repeticiones. Cada unidad experimental consistió de 2 plantas en bolsas separadas, de manera que n= 6. La variables altura de la planta (cm), diámetro del tallo (mm) y número de hojas fueron medidas cada 2 semanas, aproximadamente. Los pesos secos del tallo y de la raíz (g) fueron determinados después de la cosecha, a los 205 días después de la inoculación, lo cual representó el tiempo en que las plantas de un año de edad pueden ser vendidas y transferidas a las huertas.
Análisis estadístico
El análisis de varianza multivariado fue utilizado para determinar el efecto de la inoculación de los diferentes tratamientos sobre las variables medidas periódicamente. El análisis de varianza univariado fue utilizado para examinar las diferencias en el tiempo de la cosecha. Las pruebas de Tukey se llevaron a cabo para determinar las diferencias estadísticas significativas entre las medias de los tratamientos. El software Statistix 7.0 fue utilizado para las pruebas estadísticas.
Resultados y discusión
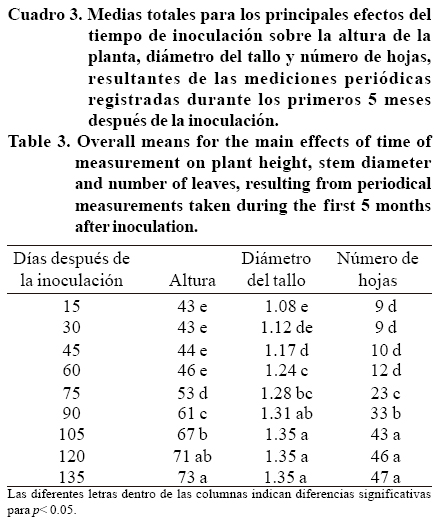
Se encontraron respuestas significativas a la inoculación con los tratamientos, pero éstas fueron considerablemente diferentes entre las variables medidas periódicamente durante los primeros 5 meses después de la inoculación, puesto que ningún tratamiento fue consistentemente mayor o menor que los otros para todas las variables (Cuadro 2). Además, todos los valores se incrementaron con el tiempo, pero no hubo una interacción significativa entre la inoculación y el tiempo. La mayoría de las diferencias entre los tratamientos de inoculación fueron más bien pequeñas durante este periodo, pero llegaron a ser significativas en las 3 variables medidas. A lo largo del experimento, Acaulospora delicata y el tratamiento testigo se desempeñaron mejor en términos de la altura de la planta, Scutellospora pellucida en el diámetro del tallo y el testigo en el número de hojas (Cuadro 2).
Se necesitaron 2 meses para detectar las primeras diferencias significativas en la altura de las plantas y el número de hojas, pero el diámetro del tallo empezó a incrementarse un mes después de la inoculación (Cuadro 3). Todas las variables mostraron incrementos grandes entre el segundo y el cuarto mes, después de lo cual hubo pocos cambios o ninguno.
La biomasa de la raíz siguió el mismo patrón que la biomasa del tallo, de manera que sólo se presentan los datos para la última variable mencionada. En la cosecha, las plantas inoculadas con Rhizophagus irregularis 28-A y Scutellospora pellucida tuvieron un peso de la raíz y del tallo 2 veces mayor con relación al resto de las plantas (Figura 1). La inoculación con el consorcio Veracruz y el testigo fueron los tratamientos con la menor biomasa, mientras que los otros 9 inoculantes produjeron una mayor biomasa, que fue intermedia entre los 2 mejores inoculantes y los 2 tratamientos más bajos.

Las plantas inoculadas con Rhizophagus irregularis 28-A y Scutellospora pellucida mostraron pesos secos de la raíz y del tallo 3 veces mayores con relación al tratamiento testigo (Figura 1). Acaulospora delicata, Acaulospora laevis, Sclerocystis rubiformis y Rhizophagus fasciculatus + Azospirillum indujeron un incremento de 2 veces en la biomasa de las plantas. La inoculación con Rhizophagus irregularis (MUCL), Gigaspora gigantea, Rhizophagus fasciculatus (foráneo), Rhizophagus fasciculatus (Culiacán) y la comunidad micorrízica nativa de la huerta, tuvieron la biomasa más baja pero aún significativamente mayor con relación al testigo. La inoculación con el consorcio no mostró diferencias significativas con relación al testigo.
No hubo diferencias significativas hasta los 2 meses después de la inoculación en la mayoría de las variables medidas. Lo anterior pudo deberse a que las plantas responden positivamente a la inoculación en periodos de rápido crecimiento y porque tuvieron reservas de alimento suficientes provenientes de la semilla grande en las primeras etapas de desarrollo. Las semillas de aguacate "criollo" usualmente tienen un peso seco entre 10 y 25 g y contienen grandes cantidades de reservas. El nitrógeno y el fósforo, por ejemplo, representan en promedio 1-2% y 0.03-0.3%, respectivamente, de la masa seca del fruto (Bárcenas et al., 2003) y las cantidades de N representan 1% aproximadamente del peso seco de la semilla (Weatherby y Sorber, 1931). Tal cantidad de nutrientes le permite a las plantas crecer bien entre 3 y 5 meses, dependiendo del tamaño, biomasa y calidad de la semilla, sin otros requerimientos más que luz y agua. La inoculación después del injerto ha mostrado hasta ahora las mejores respuestas, ya que las inoculaciones realizadas en la semilla, ya sea en la cama de semillas (Garciarreal-Sánchez, 2012) o directamente en las primeras bolsas (Vega, 2011), no mostraron respuestas incluso después de 7-8 meses.
La efectividad del inoculante Scutellospora pellucida coincide por lo reportado por Vega (2011), quien aisló este hongo de una huerta de aguacate de la región de Zacán, Michoacán. Él aplicó el inoculante cubriendo la semilla, la cual fue germinada directamente en la primera bolsa y encontró que las plantas de aguacate inoculadas con este hongo tuvieron los mayores pesos secos de raíz y tallo durante la cosecha. Aunque éstas fueron sólo significativamente diferentes de manera marginal con relación a los otros tratamientos de inoculación, las plantas inoculadas con Scutellospora pellucida fueron las más cercanas a una diferencia significativa con respecto al testigo no inoculado después de 8 meses. Es importante mencionar que el mejor inoculante probado en ambos estudios, Scutellospora pellucida, probablemente consista de especies diferentes y probablemente nuevas especies desconocidas, ya que semeja a Scutellospora pellucida en su morfología, pero no se ajusta completamente a su descripción y aunque la secuencia obtenida para este hongo se encuentra en el grupo de Scutellospora, no se alinea exactamente con las secuencias públicas disponibles en las bases de datos. Por lo tanto, el estudio de Vega (2011) es el otro que probó este hongo en particular y no haremos intentos de relacionar los resultados obtenidos con esta cepa con otros estudios que prueben aislados identificados como Scutellospora pellucida, hasta que su identidad taxonómica sea resuelta.
Silveira et al. (2003) probaron una variedad de especies de HMA sobre plantas de aguacate crecidas en suelos desinfectados y encontraron que otra especie de Scutellospora, Scutellospora heterogama fue el mejor promotor del crecimiento aunque otros inoculantes conteniendo especies de Glomus y Acaulospora fueron casi igual de buenos. Se ha argumentado que las especies que forman micelios y esporas grandes, tales como las especies de Scutellospora, demandan una gran transferencia de carbono para la mayoría de las plantas y la promoción del crecimiento con este tipo de especies de HMA son escasas. El hecho de que existen otros dos reportes que mencionan efectos positivos de estos hongos en plantas de aguacate, sugiere que esta especie arbórea es capaz de mantener a un hongo que potencialmente es demandante de carbono y beneficiarse de su asociación.
Las especies de Glomus (Montañez-Orozco, 2009; Rivera-Espinosa et al., 2011), Acaulospora (Montañez-Orozco, 2009) y Scutellospora (Silveira et al. (2003) han mostrado efectos positivos sobre el crecimiento y la biomasa de plantas de aguacate jóvenes (Silveira et al., 2003). Considerando que todas las plantas estuvieron micorrizadas (fueron crecidas en suelo fresco del campo), las grandes diferencias observadas con algunos de los tratamientos con inoculantes sugiere que la comunidad nativa del suelo utilizado para crecer las plantas no contenía cepas eficientes. Tampoco ocurrió con las cepas nativas de HMA de las huertas, introducida como uno de los inoculantes, lo cual es menos sorprendente en virtud de los altos niveles de fertilización utilizados en la mayoría de las huertas, lo cual tiende a seleccionar HMA resistentes a la alta fertilización y son frecuentemente consumidores del carbono de las plantas sin dar nada a cambio. El consorcio de especies (MTZ1-UV), que ha sido probado con una alta efectividad en varios cultivos incluyendo un árbol perenne, el café, sorpresivamente no fue diferente con respecto al testigo.
Nuestra expectativa de que los inoculantes locales tuvieran ventajas y fueran mejores promotores del crecimiento con relación a los inoculantes foráneos fue apoyada sólo parcialmente por nuestros resultados, ya que los mejores inoculantes fueron uno local y uno foráneo, y éste último de una región contrastante (Dinamarca). Hubo además una mezcla entre los otros inoculantes, con locales y foráneos, los que mostraron promociones del crecimiento más pequeñas, de manera que parece que la efectividad de los inoculantes estuvo más relacionada a su compatibilidad funcional con la planta que a su competitividad y adaptación en el contexto en que fueron probados. Aunque la simbiosis micorrízica arbuscular carece de especificidad taxonómica (Smith y Read, 2008), hay una compatibilidad funcional entre la planta, el hongo y el suelo, que resulta en combinaciones que trabajan mejor que otras (van der Heijden et al. 1988). La compatibilidad funcional fue evaluada en este trabajo sólo en términos del crecimiento de la planta, cuando hay otras variables que indican que la asociación es compatible.
Como los productores lo han sugerido, el diámetro del tallo fue la variable que mejor reflejó la biomasa final, pero esto pareció aplicarse sólo para unos pocos meses. Después de que las plantas pasaron el estado de rápido crecimiento, a los 1-2 meses, estas variables difícilmente cambiaron, por lo que no pudieron ser utilizadas posteriormente como indicadores. Éste estudio reveló que el desempeño de la inoculación sobre las plantas recién injertadas de aproximadamente 6 meses de edad, produjo las mayores respuestas de crecimiento que hemos observado en varios ensayos de inoculación realizados en diferentes etapas de crecimiento y con diferentes métodos, en plantas jóvenes de aguacate Vega (2011). Fue necesario esperar 6 meses para observar respuestas claras de algunos de los inoculantes, debido al crecimiento lento de las plantas de aguacate y los altos contenidos de reservas en las semillas que pueden mantener el crecimiento de las plantas por varios meses. Sin embargo, la inoculación de plantas injertadas no es una tarea simple de realizar en los viveros, ya que las plantas son muy grandes y las raíces se encuentran fuertemente empaquetadas en las bolsas de vivero, haciendo que la colocación del inóculo sea difícil e ineficiente. Es necesario probar otros métodos de inoculación, así como estados más apropiados de las plantas, para hacer la inoculación más eficiente y asegurar la producción de árboles micorrizados con simbiontes eficientes, que sean introducidos en las huertas junto con los beneficios que acompañan a una asociación simbiótica funcional.
Conclusiones
Los mejores hongos micorrízicos fueron diferentes para cada una de las variables evaluadas. Sin embargo, se puede concluir que para la variable de diámetro del tallo es recomendable el uso de cepas de Scutellospora pellucida.
Los mejores inoculantes fueron 28-A Rhizophagus irregularis y Scutellospora pellucida ya que tuvieron un peso seco de la raíz y el tallo 2 veces mayor con relación al resto de las plantas.
Concluimos que la inoculación del cuello de la raíz de las plantas recientemente injertadas mostró respuestas claras a la inoculación con cepas eficientes de hongos micorrízicos, aunque fue necesario esperar 6 meses para que las diferencias fueran evidentes.
Agradecimientos
Los y las autores(as) agradecen a los proyectos PROMEP-SEP redes de inoculantes micorrízicos y FOMIX-Michoacán 2009-115994 por el apoyo para esta investigación.
Literatura citada
Bárcenas, O. A. E.; Molina, E. J.; Huanosto, M. F. and Aguirre, P.S. 2003. Contenido de macro y microelementos en hojas, flor y fruto de aguacate "Hass" en la región de Uruapan, Michoacán. Actas V Congreso Mundial de Aguacate. pp 365-371. [ Links ]
Garciarreal-Sánchez, A. 2012. Evaluación de inoculantes micorrízicos y tratamientos de suelo para la producción orgánica de planta de aguacate (Persea americana Mill) en vivero. Thesis. Universidad Autónoma de México. [ Links ]
Gerdemann, J. W. and Nicolson, T. H. 1963. Spores of mycorrhizal Endogone species extracted from soil by wet sieving and decanting. Trans. Br. Mycol. Soc. 46: 235–244. [ Links ]
Gutiérrez-Contreras, M.; Lara-Chávez, M. B. N.; Guillén-Andrade, H. and Chávez-Bárcenas, A. T. 2010. Agroecología de la franja aguacatera en Michoacán, México. Interciencia. 35: 647-653. [ Links ]
Menge, J., Davis, R. M.; Johnson, E. L. and Zent-myer, G.A. 1978. Mycorrhizal fungi increase growth and reduce transpla nt injury in avocado. California Agriculture. 32:6-7. [ Links ]
Menge, J.; Larue, J.; Labanauskas, C. and Johnson, E. 1980. The effect of two mycorrhizal fungi upon growth and nutrition of avocado seedlings grown with six fertilizer treatments. J. Amer. Soc. Hort. Science. 105(3):400-404. [ Links ]
Montañez-Orozco, B. I. 2009. Efecto de la micorrización en plantas de aguacate (Persea americana L.) durante la fase de vivero en suelos provenientes de los Llanos Orientales (Colombia). Master Thesis. Universidad Nacional de Colombia. [ Links ]
Ortega-Larrocea, M. P.; Morales-Vazquez. J. A. and García-Sánchez, R. 2008. Cultivo monospóricos de hongos micorrízicos arbusculares. En: Álvarez-Sánchez. J y Monroy A. A. Técnicas de estudio de las asociaciones micorrízicas y su implicación de la restauración. Facultad de Ciencias, UNAM. México. pp 69-83. [ Links ]
Phillips, J. M. and Hayman, D. S. 1970. Improved procedure for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British Mycological Society. 55: 158-161. [ Links ]
Reyes, J. C.; Ferrera-Cerrato, R. and Alarcón, A. 1998. Endomicorriza vascular, bacteria vermicomposta en plántulas de aguacate en vivero. Memoria Fundación Salvador Sánchez Colín CICTAMEX S.C. Coatepec Harinas, México, pp. 12 –22. [ Links ]
Rivera Espinosa, R. A.; Martin Cárdenas, J. V.; Calderón Puig, A.; Torres Hernández, A. 2011. Utilización de cepas eficientes de hongos micorrízicos arbusculares en el desarrollo de portainjertos de aguacate en un sustrato suelo-cachaza. Cultivos Tropicales Vol. 32 (2) 172-183. [ Links ]
SAGARPA. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. 2008. Plan Rector Sistema Nacional Aguacate. Estadísticas. Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. México. www.sagarpa.gob.mx. [ Links ]
Sánchez, P. J. L.; Alcántar, R. J. J.; Coria, A. V. M.; Anguiano, C. J.; Vidales, F. I.; Tapia, V. L. M.; Aguilera, M. J.; Hernández, R. G. and Vidales, F. J. A. 2001. Tecnología para la Producción de aguacate en México. INIFAP. Libro Técnico N° 1. 208 p. [ Links ]
Schenck, N. C. and Pérez, Y. 1990. Manual for the identification of VA mycorrhizal fungi. 3a. ed. Published by Synergistic Publications. 286 p. [ Links ]
Schüβler, A.; Schwarzott, S. and Walker, C. 2001. Analysis of partial Glomales SSU Rrna gene sequences: implications for primer design and phylogeny. Mycological Research 105, 5-15. [ Links ]
Silva, L. F. C. and Siqueira, J. O. 1991. Growth and nutrient contents of avocado, mango and papaya seedlings under the influence of different vesicular-arbuscular mycorrhiza fungal species. Revista Brasileira de Ciencia do solo.15(3): 283-288. [ Links ]
Silveira, S. V.; de Souza, P. V. and Koller, O. C. 2002. Influência de fungos micorrízicos arbusculares sobre o desenvolvimento vegetativo de porta-enxertos de abacateiro Pesquisa agropecuaria brasileira. 37 (11) 1597-1604. [ Links ]
Silveira, S. V.; de Souza, P. V. D.; Koller, O. C.; and Schwarz, S.F. 2003. Elementos minerales y carbohidratos en plantones de aguacate 'carmen' inoculados con micorrizas arbusculares. En Actas V Congreso Mundial del Aguacate. pp. 415-420. [ Links ]
Smith, C. E. Jr. 1966. Archaeological evidence for selection in avocado. Econ. Bot. 20(2): 169-175. [ Links ]
Smith S. E. and Read, D.J. 2008. Mycorrhizal Symbiosis, 3a. Ed. Elsevier Ltd., London, England. 787 p. [ Links ]
Téliz, O. D. and Marroquín, P. F. 2007. Importancia histórica y socioeconómica del aguacate. En Téliz OD, Mora A (eds.) El aguacate y su manejo integrado. 2ª ed. Mundi-Prensa. México. pp. 3-16. [ Links ]
van der Heijden, M. G. A.; Klironomos, J. N.; Ursic, M.; Moutoglis, P.; Streitwolf-Engel, R.; Boller, T.; Wiemken, A. and Sanders, I.R. 1998. Mycorrhizal fungal diversity determines plant biodiversity, ecosystem variability and productivity. Nature 396: 69-72. [ Links ]
Vega, F. M. 2011. Diversidad de hongos micorrizógenos arbusculares y potencial micorrízico de dos agroecosistemas y una zona natural del estado de Michoacán. Master Thesis. Universidad Michoacana de San Nicolás de Hidalgo. [ Links ]
Vidal, M. T., Azcón-Aguilar, C., Barea, J. M. and Pliego-Alfaro, F. 1992. Mycorrhizal inoculation enhances growth and development of micropropagated plants of avocado. HortScience 27(7): 785-787. [ Links ]
Walker, C. and Vestberg, M. 1994. A simple and inexpensive method for producing and maintaining closed pot cultures of arbuscular mycorrhizal fungi. Agricultural Science in Finland 3: 233-239. [ Links ]
Weatherby, L. B. and Sorber, D. G. 1931. Chemical composition of avocado seeds. Industria and Engineering Chemistry. 23: 1421-1423. [ Links ]














