Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ciencias agrícolas
versão impressa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.5 no.5 Texcoco Jun./Ago. 2014
Artículos
Pérdida de tolerancia a la desecación durante la imbibición-germinación en semillas de maíz*
Loss of desiccation tolerance during imbibition-germination in maize seeds
María Alma Rangel-Fajardo1§, Leobigildo Córdova-Téllez2 y Elizabeth Cárdenas-Soriano3
1 Campo Experimental Mocochá-INIFAP. Carretera Mérida-Motul, km 25, Mérida. C. P. 97454, Mocochá Yucatán. Tel: 01 (991) 9162215. Ext. 146. §Autora para correspondencia: rangel.alma@inifap.gob.mx.
2 Programa Producción de Semillas. Instituto de Recursos Genéticos y Productividad-Colegio de Postgraduados, Campus Montecillo.
3 Programa de Fitopatología. Instituto de Fitosanidad. Colegio de Postgraduados, Campus Montecillo Carretera México-Texcoco, km. 36.5, Montecillo, Texcoco. C. P. 56230, Estado de México. (lcordova@colpos.mx; esoriano@colpos.mx).
* Recibido: diciembre de 2013
Aceptado: marzo de 2014
Resumen
Las semillas ortodoxas cerca de la madurez adquieren tolerancia a la desecación; sin embargo, durante el proceso de imbibición-germinación ésta se pierde. El tiempo en que ocurre entre especies, incluso entre lotes de la misma especie es variable. Se determinó el momento en que ocurre la pérdida de tolerancia a la desecación en semillas de maíz durante la imbibición-germinación, además se observó el comportamiento y relación de cuerpos lípidos con la pérdida de tolerancia. Semillas de maíz de la línea 231 fueron imbibidas en agua y con diferentes concentraciones de polietilenglicol 8 000. La cinética de imbibición se cuantifico en periodos de ocho horas hasta las 40 h y la pérdida de tolerancia a desecación se estimó con pruebas de germinación estándar, conductividad eléctrica y envejecimiento acelerado. Ejes embrionarios fueron procesados y observados en el microscopio electrónico de transmisión. La pérdida de tolerancia a la desecación se presentó a las 32 h de imbibición a contenidos de agua de 300 g H2O kg1 y 520 g H2O kg1 en semilla y embrión respectivamente. En este momento la conductividad aumenta de 7.26 a 15.63 µSm-1g-1 mientras la germinación y viabilidad se redujeron 27 y 84% respectivamente. El movimiento de los cuerpos lípidos durante la imbibición-germinación se presenta entre las 24 h y 32 h, provocando alteraciones a la membrana con los secados, por lo que el papel que juegan éstos, además de ser fuente de energía durante la germinación, proveen de protección a las membranas durante la desecación.
Palabras clave: contenido de agua, lípidos, membranas celulares.
Abstract
Orthodox seeds near maturity acquire desiccation tolerance, however during this imbibition-germination is lost. The time that occurs between species even between batches of the same species is variable. When the loss of desiccation tolerance in maize seeds during imbibition, germination occurs is determined, and also the behavior of lipid bodies relative to the loss of tolerance was observed. Maize seeds of line 231 were imbibed in water and with various concentrations of polyethylene glycol 8 000. The imbibition kinetics was quantified in periods of eight hours to 40 hours and the loss of tolerance to desiccation is estimated by testing standard germination, conductivity electrical and accelerated aging. Embryonic axes were processed and observed in the transmission electron microscope. The loss of desiccation tolerance was presented at 32 h of imbibition water contents of 300 g H2O kg1 and 520 g H2O kg1 seed and embryo respectively. At this time the conductivity increases from 7.26 to 15.63 g μSm-1g-1 while the germination viability decreased 27 and 84% respectively. The movement of lipid bodies during imbibition-germination occurs between 24 h and 32 h, causing changes to the membrane with dried, so the role of these, besides being a source of energy during germination, provide membrane protection during desiccation.
Keywords: water content, lipid cell membranes.
Introducción
Las semillas ortodoxas durante el desarrollo, cerca de la madurez, presentan la capacidad de reducir el contenido de agua de los tejidos sin afectar la viabilidad. A ésta característica se le conoce como tolerancia a la desecación. Se considera que ésta es una cualidad que confiere protección a los tejidos que pueden sufrir daños durante la deshidratación (Vertucci y Farrant, 1995). Bewley (1995) la define como la capacidad de las semillas para germinar después de un secado rápido. Puede reducir el contenido de agua hasta 50 g H2O kg-1 y almacenarlas por periodos mayores a un año sin tener descensos en el porcentaje de germinación (Egli y TeKrony, 1997).
Durante la adquisición de la tolerancia las células embrionarias presentan cambios en estructura, moleculares y bioquímicos, por ejemplo la movilización de cuerpos lipidicos a la periferia de la pared celular, presencia de proteínas LEA's, conformación del ADN, reacción del citoesqueleto y presencia de sistemas antioxidantes (Vertucci y Farrant, 1995; Córdova-Tellez y Burris, 2002; Buitink et al., 2000).
Durante el proceso de imbibición-germinación se pierde la tolerancia a la desecación (Oliver et al., 2000; Hoekstra et al., 2001; Bing et al., 2012). Las sustancias de reservas, como almidón y lípidos, son transformadas enzimáticamente para formar compuestos solubles que son movilizados al embrión y propiciar el crecimiento de la plántula (Egli y TeKrony, 1997). El periodo en que ocurre la pérdida de tolerancia va desde que inicia la imbibición y hasta el momento de la protusión radical (Leprince et al., 2000; Buitink et al., 2003; Faria et al., 2005) y está íntimamente ligada con la concentración de agua presente en los tejidos de la semilla (Vertucci y Ross, 1990; Walters et al., 2002; Ren y Tao, 2003). Sin embargo, el tiempo en que ésta se presenta es variable entre especies. Senaratna y McKersie (1983) encontraron que semillas de soya [Glycine max (L.) Merr cv.Maple Arrow] imbibidas por 6 h seguían manteniendo la tolerancia a secados severos, pero después de 36 horas la perdieron, mientras que en semillas de chícharo (Pisum sativum L. cv. Alaska) ésta fue entre 18 y 24 h (Koster y Leopold 1988).
Al igual que la adquisición provoca cambios en la estructura celular, la pérdida de la tolerancia, previo a un secado, trae alteraciones físicas, fisiológicas y anatómicas en las células (Farias et al., 2005) ocasionando baja viabilidad y poder germinativo de las semillas. Daws et al. (2008) reportan que la pérdida de tolerancia puede mermar hasta 50%, la germinación de lotes de semillas se encuentran en aéreas geográficas afectadas por altas humedades relativas o estaciones lluviosas. El presente trabajo determinó el momento en que ocurre la pérdida de tolerancia a la desecación en un lote de semillas de maíz durante el proceso de imbibición-germinación y se observó el comportamiento de cuerpos lipídicos asociados a la pared celular y su relación con la perdida de tolerancia a la desecación.
Materiales y métodos
Se utilizó semilla de maíz de la línea de maíz 231 proporcionada por el Dr. Aquiles Carballo Carballo y fue producida en el ciclo primavera-verano de 2002 en el campo experimental del Colegio de Postgraduados en Ciencias Agrícolas, Estado de México.
Cinética de imbibición. Con la finalidad de observar la cinética de imbibición en la semilla se realizaron dos experimentos, uno para controlar la tasa de imbibición, el grado de hidratación final y determinar la contenido de humedad en la que se presenta la pérdida de la tolerancia a la desecación y el segundo para evaluar el tiempo en horas en el que se da este fenómeno y evaluar de forma indirecta las implicaciones en las membranas celulares. Para el experimento uno se utilizaron diferentes concentraciones de polietilenglicol 8000 (PG) SIGMA. Fueron colocadas 2 000 semillas por tratamiento entre toallas de papel (24 x 23.5 cm) marca Marquis Georgia-Pacific, las cuales se humedecieron previamente con una solución de PG a concentraciones de 0 (testigo, agua destilada), 15, 20, 25 y 30 % p/v a 20 °C (Suisse, 1985). Las toallas se enrollaron en forma de taco (50 semillas por taco) y el conjunto de tratamientos se colocó a temperatura constante de 20 ± 1 °C. Durante el proceso de imbibición se extrajeron al azar muestras de 400 semillas de cada concentración a las 8, 16, 24, 32 y 40 h y se enjuagaron con agua corriente. De éstas, se usaron 100 semillas para determinar el contenido de humedad (50 en semilla completa y 50 del embrión), 100 para hacer inmediatamente pruebas de germinación estándar (sin secado) y 200 para llevarlas de nuevo a secado en condiciones de laboratorio (18 °C y 75% de humedad relativa) suspendiéndose cuando la humedad en la semilla se redujo nuevamente a niveles entre 100 - 110 g H2O kg-1. Estas semillas se emplearon para evaluar germinación y germinación en respuesta a la prueba de envejecimiento acelerado.
En un segundo experimento se imbibieron 2 000 semillas en toallas humedecidas con agua destilada, los intervalos de muestreo fueron cada 8 h hasta las 40 h de imbibición. En cada muestreo se contabilizaron semillas con radícula hidratada (hinchada), con radícula de 1 y 3 mm de longitud, de las cuales se tomaron 50 semillas de cada estado para realizar observaciones en el microscopio electrónico de transmisión (TEM). En cada intervalos de muestreo se determinó el contenido de humedad (150 semillas) como se describe posteriormente y se llevaron 200 semillas a secado por 24 h a 35 °C y 40% HR para posteriormente evaluar la pérdida de tolerancia a la desecación por medio de germinación estándar, viabilidad y conductividad eléctrica.
Contenido de humedad: se determinó mediante el método de la estufa de acuerdo con "International Seed Testing Association" (ISTA, 1996) a 103 °C por 72 h en dos repeticiones de 25 para semillas completas y embriones para cada tratamiento, las muestras fueron pesadas en una balanza analítica y el contenido de humedad se calculó con la ecuación CH= [(PI-PF)/PI]x1000 (Moreno, 1996); donde CH= contenido de humedad; PI= peso inicial antes del secado; PF= peso final después del secado. Los resultados se reportan en g H2O kg-1.
Pérdida de tolerancia a la desecación: en el experimento uno se evaluó mediante la prueba de germinación estándar (antes y después del secado) y la prueba de envejecimiento acelerado, realizada únicamente después del secado. La prueba de germinación se realizó de acuerdo con las normas de la ISTA (1996), excepto que el tamaño de la muestra consistió de cuatro repeticiones de 25 semillas, entre papel (Marquis Georgia-Pacific) enrollado (taco), el conjunto se colocó en una cámara germinadora a 25 ± 1 °C. La prueba de envejecimiento acelerado se realizó en una cámara germinadora a 45 °C por 72 h de acuerdo con la metodología propuesta por Delouche (1996), excepto que se utilizaron 4 repeticiones de 25 semillas.
En el experimento dos se realizó la prueba de germinación estándar, como se describió con anterioridad excepto que fue sólo en semillas después de secado, además de realizar la prueba de tetrazolio para evaluar la viabilidad utilizando la metodología de acuerdo con Moreno (1996), excepto que se emplearon 4 repeticiones de 25 semillas por cada tiempo de imbibición y la prueba de conductividad eléctrica para determinar de manera indirecta el daño en membranas celulares, ésta consistió en pesar 3 repeticiones de 25 semillas por cada tiempo de imbibición (0, 8, 16, 24, 32 y 40 h), se colocó cada repetición en vasos de 250 ml conteniendo 75 ml de agua desionizada y se reservaron en un cuarto de germinación a 22 ± 1 °C por 24 h, después de este tiempo se procedió a medir la conductividad eléctrica mediante un medidor marca OAKTON WD-356070-00 en micro-siemnes (µScm-1).
Comportamiento de cuerpos lipídicos: con ayuda de navaja de un filo, se extrajeron los ejes embrionarios de 5 semillas por cada uno de los tiempos de imbibición (los cuales presentaban diferentes niveles de hidratación) además extraer los ejes embrionarios a semillas con las siguientes características (1) semilla seca (0 h de imbibición); (2) semillas imbibidas- germinadas, con la presencia de radícula completamente hidratada (hinchada), semillas con 1 y 3 mm de raíz; y (3) semilla imbibida- germinada después de secado con raíz de 1 y 3 mm. Se procesaron de acuerdo a la metodología empleada por Córdova-Tellez y Burris (2002) con las siguientes modificaciones: la primer fijación se hizo con una solución compuesta por 3% de Glutaraldehido/1 mM CaCl2, un amortiguador de fosfatos a 0.05M pH de 7.2; el tiempo de fijación fue de 24 h a 4 °C y la tinción fue doble utilizando 4% de acetato de uranilo y el colorante de Reynolds (Bozzola et al., 1999).
Los ejes embrionarios fueron seccionados en forma transversal a la altura del meristemo radical, a excepción de las muestras de ejes con longitud de 1 y 3 mm los cuales fueron seccionados también por encima del meristemo, en la parte media entre el nudo cotiledonar y el meristemo. Para realizar los cortes se empleó un ultramicrótomo Reichert modelo 570 con navaja de diamante, obteniendo cortes de 60 a 90 nm. Éstos se observaron en un microscopio electrónico de transmisión Carl Zeiss EM9 y las imágenes obtenidas fueron capturadas en película Kodak electrón 4489 6.5 x 9 cm.
Análisis estadístico. El análisis estadístico se realizó independiente para el experimento uno y dos. El uno fue analizado en un diseño completamente al azar con arreglo factorial consistente en dos factores: concentración de polietilenglicol y tiempo de imbibición con cinco niveles cada factor y el dos fue analizado en un diseño completamente al azar. Se realizó análisis de varianza y comparación de medias comparación de medias Tukey con α= 0.05, empleando el programa Statistical Analysis System® (SAS) versión 9.11.
Resultados y discusión
Control de hidratación. La cinética de imbibición en las semillas de maíz se observa en la Figura 1a, se detectaron tres fases de imbibición (rápida, lenta y otra rápida) durante las 48 h que duró la prueba. La primera fase de rápida imbibición ocurrió durante las primeras 8 h, la mayor tasa de imbibición correspondió al testigo (21 g H2O kg-1 h-1) en comparación con 18.1, 18.7, 16.3 y 15.5 g H2O kg-1h-1 registrado en los tratamientos de 15, 20, 25 y 30% p/v de PG, respectivamente registrando diferencias tanto en la concentración como en el tiempo de imbibición (p< 0.05) (Cuadro 1). La fase de imbibición lenta ocurrió de 8 a 32 h. La tasa más alta fue de 2.8 g H2 O kg-1h-1 para el testigo, la de menor registro fue de 1.3 g H2O kg-1h-1 para 30% p/v de PG.

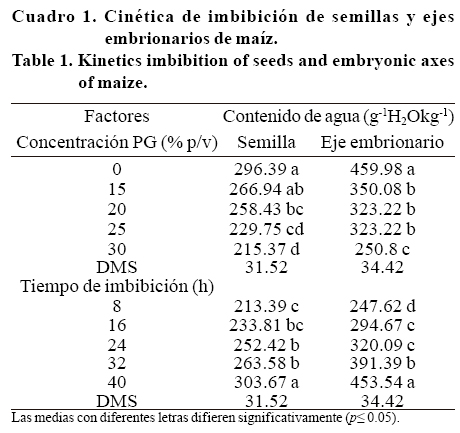
Al final de esta fase (32 h) el contenido de humedad era de 306 g H2O kg-1 para el testigo seguido del tratamiento de 15% p/v PG (282 g H2O kg-1) mientras que el resto de tratamientos no superaba los 268 g H2O kg-1. La tercera fase (32 a 48 h), nuevamente de rápida imbibición, ocurrió únicamente en el testigo con una tasa de 4 g H2O kg-1 h-1y con 4.7 g H2O kg-1 h-1 para15% p/v de PG. En ambos casos, el contenido de humedad fue superior a 350 g H2O kg-1, lo que representa más de 3 veces la humedad inicial, mientras que los tratamientos de 20, 25 y 30% p/v de PG se mantuvieron dentro de la fase de absorción lenta, con humedades inferiores a 300 g H2O kg-1 y sin lograr la emisión de radícula durante los tratamientos de imbibición.
Las tres fases de imbibición observadas ya han sido reportadas por Roberts y Ellis (1989) y Clifford (1995) en leguminosas. Éstos autores señalan que en la primera fase ocurre la imbibición o rehidratación de los tejidos de la semilla; en la segunda fase se presenta la activación de la germinación en sentido estricto, caracterizándose por un equilibrio en los potenciales hídricos de la semilla y la activación de los procesos metabólicos que desencadenan la emergencia de la radícula.
La tercera fase, Bewley y Black (1994) señalan que se caracteriza por un aumento en la demanda de agua como consecuencia del crecimiento de las estructuras del embrión debido principalmente al aumento en tamaño de las células. En la primera fase, que corresponde a un proceso físico de absorción de agua de un potencial hídrico mayor al que presenta la semilla (Egli y TeKrony, 1997), la reducción en la velocidad de imbibición en los tratamientos de PG se debió principalmente a que el PG modifica el potencial osmótico a niveles inferiores al del agua libre (Bewley y Black, 1994). Los tratamientos de PG superiores a 15% p/v PG se mantuvieron en la fase de absorción lenta con niveles de humedad inferiores a 300 g H2O kg-1 en la semilla y no lograron la emisión de radícula, tal como ocurrió en el testigo y 15% p/v PG entre las 32 y 40 h que en promedio alcanzaron 306.15 y 282.36 g H2O kg-1 respectivamente, Hunter y Erickson (1952), señalan que la concentración mínima de humedad para que ocurra la emisión de la radícula en maíz es de 305 g H2O kg-1.
En la Figura 1b se visualiza la hidratación de los ejes embrionarios de las semillas de maíz. Al igual que en semilla, los factores con sus niveles probados mostraron diferencias significativas (p< 0.05) (Cuadro 1). Durante las primeras 8 h se presentó una fase rápida de imbibición, con tasas de 26 g H2O kg-1 h-1 para el testigo y de sólo 12 gH2O kg-1h-1 para el tratamiento de mayor concentración de PG (30% p/v PG). No obstante, entre 8 y 40 h no se aprecian de manera contundente las dos fases de imbibición registradas en la semilla completa. En el testigo es notorio un incremento lineal a una tasa de 11 g H2O kg1 h-1, alcanzando una humedad de 644 g H2O kg-1 a las 40 h.
En los tratamientos de 15, 20 y 25% p/v PG se aprecia una fase lenta de imbibición de 8 a 24 h con tasas de 4 g H2O kg-1h-1 para cada tratamiento, seguida (24 a 40 h) de un ligero incremento de con tasas de 7, 5 y 4 g H2O kg-1h-1, respectivamente. En el tratamiento de 30% p/v PG la fase lenta se prolonga hasta las 32 h con una tasa de 2 g H2O kg-1h-1, seguido por un incremento de 6 g H2O kg-1h-1 durante las 8 h finales.
La emisión radical se presentó a las 32 h para el testigo y para el tratamiento de 15% p/v con humedades del eje embrionario de 526 g H2O kg-1 y 417 g H2O kg-1, respectivamente. A la fecha, no se encontraron reportes que indiquen los niveles críticos de humedad del embrión a la que ocurre la germinación y que además expliquen la diferencia en la velocidad de absorción entre los diferentes tejidos de la semilla. Sin embargo, Bradford (1990) indica que es necesario que existan potenciales hídricos en los tejidos que permitan a las radículas romper la barrera que impone el endospermo.
En este sentido, se puede decir que la cantidad de agua crítica en el tejido embrionario para que ocurra la germinación en maíz es superior a 417.24 (valor para la concentración 15% p/v PG a las 32 h) 400 g H2O kg-1. Las semillas imbibidas en las soluciones de PG de 20, 25 y 30 % p/v PG a las 40 h sólo alcanzaron contenidos de agua de 398, 370 y 340 g H2O kg1 respectivamente, no se registraron emisiones de radícula esto coincide con lo reportado por Georghiou et al. (1983) quienes observaron reducción en la formación de vacuolas y rompimiento de estructuras de almacenamiento de reservas en las células de semillas de lechuga imbibidas en soluciones osmóticas que evitaron los potenciales hídricos para la emisión de radícula.
Pérdida de tolerancia a desecación. El efecto de la concentración de polietilen glicol (PG) y tiempos de imbibición sobre la germinación puede observarse en el Cuadro 2. La germinación de las semillas evaluadas no se vio afectada por las concentraciones de PG (p≥ 0.05) manteniendo porcentajes de germinación superiores a 93%. Por otro lado, el tiempo de imbibición presento diferencias (p≤ 0.05) registrando la menor germinación a las 40 h (91.2%) en semillas húmedas. Mientras que cuando las semillas eran secadas después del tratamiento con PG se registraron diferencias (p≤ 0.05) resultando las concentraciones de 25 y 30% p/v PG las que arrojaron los mejores porcentajes de germinación (93.2 y 94.6% respectivamente).
Por otro lado, el tiempo de imbibición en semillas secadas solo registro diferencia volvió a registrar diferencias (p≤ 0.05) para el tiempo de 40 h con una germinación 69.4%. Éstos resultados indican la sensibilidad de las semillas a desecación durante de la imbibición (Dasgupta et al., 1982; Koster y Leopold, 1988; Leprince et al., 1995) resultando más afectadas las semillas con mayor tiempo de imbibición. Esto fue indudable cuando las semillas del testigo se secaron después de imbibición y la germinación se redujo considerablemente después de las 32 h. Mientras que la imbibición con PG creó protección a las estructuras celulares después de secado (Georghiou et al., 1983).
La respuesta a germinación en la prueba de envejecimiento acelerado arrojo diferencias (p≤ 0.05) para ambos factores evaluados (Cuadro 2). La concentración de 20% p/v PG registró la mayor germinación mientras que 30% p/v PG fue la más afectada, esto puede deberse a una reacción toxica del PG en la semilla durante la germinación como lo reportan varios autores (Murillo-Amador et al., 2002; Kaya et al., 2006; Ibrahim y Kazim, 2008). Mientras que la germinación en respuesta al tiempo de imbibición para el envejecimiento acelerado se observaron diferencias (p≤ 0.05) notándose más afectados los tiempo de 24, 32 y 40 h de imbibición lo que coincide con la fase dos y tres en la cinética de imbibición (Figura 1) y en éstas es donde se presenta la germinación en sentido estricto (Roberts y Ellis, 1989; Clifford, 1995) por lo que las semillas ya eran sensibles a la desecación (Leprince et al., 2000; Buitink et al., 2003; Faria et al., 2005).
De acuerdo con estos resultados se puede determinar que la pérdida de la tolerancia a la desecación se presentó poco después de las 32 h con contenidos de humedad de 371 g H2O kg1 y 644 g H2O kg1 para la semilla completa y el embrión en el tratamiento testigo respectivamente.
Por otro lado, los tratamientos de imbibición con PG, en semillas húmedas y secas, mantuvieron la germinación por arriba de 70% sugiriendo la protección a las estructuras celulares al modificar los potenciales osmóticos de la semilla y retrasar procesos propios de la germinación (Georghiou et al., 1983).
En la prueba de envejecimiento acelerado se observaron diferencias (p≤ 0.05) en todos los tratamientos; cabe resaltar, que la concentración de 20% p/v PG tuvo la mejor respuesta de germinación, mientras que el tiempo de imbibición después de las 16 h registró un baja en la germinación de aproximadamente 45%. Se puede inferir que la perdida de tolerancia se presentó en un lapso de tiempo entre las 24 y 32 h de imbibición y está fuertemente ligado a las concentraciones de humedad (Vertucci y Farrant, 1995; Walters et al., 2002); sin embargo, para la perdida de tolerancia se involucran otros factores como los son la permeabilidad de las cubiertas (Bing et al., 2012).
En la Figura 2 puede apreciarse la germinación, viabilidad y conductividad eléctrica de las semillas imbibidas con agua destilada por diferentes tiempos y secadas después de imbibición.

Dentro de todos los tiempos de imbibición se observaron diferencias (p≤ 0.05) en todas las pruebas. La germinación registro una fuerte reducción de 88 puntos porcentuales, esta disminución se hizo más evidente a partir de las 32 h de imbibición. En el caso de la viabilidad el descenso más drástico fue después de las 24 h registrando valores de 14 y 0% para las 32 y 40 h respectivamente mientras que la conductividad eléctrica se incrementó para este mismo periodo registrando valores de 127. 97 y 234 µScm-1. Con éstos resultados se sugiere que el secado después de la imbibición genero daño dentro de las membranas celulares. Éste se registró de forma gradual conforme fue avanzando el proceso de germinación (Leprince et al., 2000; Buitink et al., 2002; Faria et al., 2005).
Cuerpos lípidos vs pérdida de tolerancia a la desecación. Los cuerpos lípidos (CL) en células meristemáticas antes de la imbibición se observaron alineados y cerca de la pared celular (Figura 3a) esto coincide con lo observado por Córdova-Tellez y Burris (2002). Durante el inicio de la imbibición-germinación se observan los CL migrando al interior del citoplasma (Figura 3b) aproximadamente a las 32 h de imbibición. La principal razón de la movilización de éstos CL dentro del citoplasma, es para el desdoblamiento y ser utilizados como elementos de reserva, los cuales son necesarios durante el proceso de germinación que en este periodo de tiempo (32 h) ya se estaba presentando (Roberts y Ellis, 1989; Clifford, 1995; Egli y TeKrony, 1997).
Las células meristemáticas de semillas que aún no presentaban protusión radical (Figura 3c) a este tiempo (32 h) y que fueron secadas después de la imbibición aun presentaban algunos CL distribuidos dentro del citoplasma y cerca de la membrana plasmática, la cual comenzaba a verse con alteraciones. En células meristemáticas, de raíz con 1 mm de longitud después de secado, los CL disminuyeron en cantidad alrededor de la pared celular y las alteraciones en la membrana son apreciables (Figura 3d). Mientras células de muestras con raíz de 3 mm después de secado (Figura 3e y f) las membrana plasmática está completamente alterada y no se puede apreciar ningún órganelo dentro del citoplasma, la célula está colapsada.
El proceso de germinación inicia con la imbibición, sin embargo, existe un periodo de tiempo donde el proceso solo es físico y se puede presentar en todas las semillas aun muertas (Bewley y Black, 1994). Existe un punto donde la cantidad de agua presente en las células promueve procesos irreversibles de la germinación, como es la movilización de reservas (Leprince et al., 2000; Buitink et al., 2002; Faria et al., 2005). Muchas reservas como el caso de los CL además de suministrar energía para llevar a cabo la germinación proporcionan protección a la membrana citoplasmática durante la desecación (Leprice et al., 2000). Los resultados de las imágenes coinciden con lo obtenido en las pruebas de germinación, viabilidad y envejecimiento, en todos los casos las disminuciones en la respuesta a germinación se presentaron después de las 24 h y el incremento de solutos en la prueba de conductividad fue en respuesta a las alteraciones observadas en las membranas plasmáticas.
Conclusiones
La pérdida de tolerancia a la desecación en semillas de maíz se presentó a las 32 h de imbibición cuando se tenían contenidos de agua superiores a 300 g H2O kg1 y 520 g H2O kg1 en semilla y embrión respectivamente. Las semillas de maíz toleran desecación hasta antes de 24 h de imbibición o con contenidos de humedad inferiores a 300 g H2O kg1. El movimiento de los cuerpos lípidos durante la imbibición-germinación se presenta durante las 24 h y 32 h de imbibición. Después de la movilización de éstos de la membrana al citoplasma, las células son sensibles a la desecación, por lo que el papel que juegan, además de ser fuente de energía durante la germinación, proveen de protección a las membranas durante la desecación.
Literatura citada
Bewley, J. D. 1995. Physiological aspects of desiccation tolerance. A retrospect. J. Plant Sci. 156:393-403. [ Links ]
Bewley, J. D. and Black, M. 1994. Seed. Physiology of development and germinaton. 2nd Edition, Plenum Press. New York.421p. [ Links ]
Bing, B.; Sikron, N.; Gendler, T.; Kazachkova, Y.; Barak, S.; Grafi, G.; Khozin-Goldberg, I. and Fait, A. 2012. Ecotypic variability in the metabolic response of seeds to diurnal hydration-dehydration cycles and its relationship to seed vigor. Plant Cell Physiol. 53:38-52. [ Links ]
Bozzola, J. J. and Russell, D. L. 1999. Electron microscopy: principles and techniques for biologist. Second edition. Sudbury, Mass. Jones and Bartlett Publishers, Inc. New York. 780 p. [ Links ]
Bradford, K. J. 1990. A water relations analysis of seed germination rate. Plant Physiol. 94:840-849. [ Links ]
Buitink, J. V; Satour, B. L. P. and Leprince, O. 2003. The re-establihment of desiccation tolerance in germinated radicles of Medicago truncatula Gaertn seeds. Seed Sci. Res. 13:273-286. [ Links ]
Buitink, J.; Hoekstra, F. A. and Leprince, O. 2002. Biochemistry and biophysics of tolerance systems. In: Black, M. and Pritchard, H. W. (Eds.). Desiccation and survival in plants. Drying without dying. CABI Publishing Wallingford, Oxon. 293-318 pp. [ Links ]
Clifford, M. B. 1995. Biochemical processes during the osmopriming of seed. In: Kigel, J. and Galili, G. (Eds.).Seed development and germination. Editorial Marcel Dekker. New York. 467-789 pp. [ Links ]
Córdova-Tellez, L. and Burris, J. 2002. Alignment of lipid bodies along the plasma membrane during the acquisition of desiccation tolerance in maize seed. Crop Sci. 42:1982-1988. [ Links ]
Dasgupta, J.; Bewley, J. D. and Yeung, E. C. 1982. Desiccation tolerant and desiccation intolerant stages during the development and germination of Phaseolus vulgaris seeds. J. Exp. Bot. 13:1045-1057. [ Links ]
Daws, I. M.; Crabtree, L. M.; Dalling, J. W.; Mullins, E. C. and Burslem, D. F. R. P. 2008. Germination responses to water potential in Neotropical Pioneers suggest large-seeded species taken more risks. Ann. Bot. 102:945-951. [ Links ]
Delouche, J. C. 1996. Accelerated aging test. AOSA meeting. College of Agriculture. University of Kentucky, Lexington, KY. [ Links ]
Egli, D. B. and TeKrony, D. M. 1997 Species differences in seed water status during seed maturation and germination. Seed Sci. Res. 7:3-11. [ Links ]
Farias, R. M. J.; Buitink, J.; Van Lammeren, A. A. M. and Hilhorst, M. W. H. 2005. Changes in DNA and microtubules during loss and re-establishment of desiccation tolerance in germinating Medicago truncatula seeds. J. Exp. Bot. 418:2119-2130. [ Links ]
Georghiou, K.; Psaras, G. and Mitrakos, K. 1983. Lettuce endosperm structural changes during germination under different light, temperature and hydration conditions. Bot. Gazette 144:207-211. [ Links ]
Hoekstra, F. A.; Golovina, E. A. and Buitink, J. 2001. Mechanisms of plant desiccation tolerance. Trens Plant Sci. 6:431-438. [ Links ]
Hunter, R. J.; Erickson, E. A. 1952. Relation of seed germination to soil moisture tension. Agron. J. 44:107-112. [ Links ]
Ibrahim, D. and Kazim, M. 2008. Effect of salt and osmotic stresses on the germination of pepper seeds of different maturation stages. Brazillian Ar. Biol. Technol. 51(5):897-902. (on line) http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1516-89132008000500004&lng=en&nrm=iso>. ISSN 1516-8913. [ Links ]
International Seed Testing Association (ISTA) 1996. International rules for seed testing. Seed Sci. Technol. 24:243. [ Links ]
Kaya, M. D.; Okçub, G.; Ataka, M.; Çıkılıc, Y. and Kolsarıcıa, Ö. 2006. Seed treatments to overcome salt and drought stress during germination in sunflower (Helianthus annuus L.). Eu. J. Agron. 24(4):291-295. [ Links ]
Koster, K. L. and Leopold, A. C. 1988. Sugars and desiccation tolerance in seeds. Plant Physiol. 88:829-832. [ Links ]
Leprince, O.; Harren, F. J. M.; Buitink, J.; Alberda, M. and Hoekstra, F. A. 2000. Metabolic dysfunction and unabated respiration precede the loss of membrane integrity during dehydration of germinating radicles. Plant Physiol. 122:597-608. [ Links ]
Leprince, O.; Vertucci, W. C.; Hendry, G. A. F. and Atherton, N. M. 1995. The expression of desiccation induced damage in orthodox seeds is a function of oxygen and temperature. Physiol. Plantarum. 94:233-240. [ Links ]
Moreno, M. E. 1996. Análisis físico y biológico de semillas agrícolas. Universidad Nacional Autónoma de México (UNAM). México. D. F. 389 p. [ Links ]
Murillo-Amador, B.; López-Aguilar, R.; Kaya. C.; Larrinaga-Mayoral, J. and Flore-Hernández, A. 2002. Effecs of NaCl and polyethylene glicol on germination, emergence and seedling growth of cowpea. J. Agron. Crop Sci. 108:235-247. [ Links ]
Oliver, M. J.; Tuba, Z. and Mishler, D. B. 2000. The evolution of vegetative desiccation tolerance in land plants. Plant Ecol. 152:85-100 [ Links ]
Ren, J. and Tao, L. 2003. Effects of hydration-dehydration cycles on germination of seven Calligonum species. J. Arid Environ. 55:11-122. [ Links ]
Roberts, H. E. y Ellis, H. R. 1989. Water and seed survival. Ann. Bot. 63:39-52. [ Links ]
Senaratna, T. and McKersie, B. D. 1983. Dehydration injury in germinating soybean (Glycine max (L.) Merr.) seeds. Plant Physiol. 72:620-624. [ Links ]
Suisse, G. A. 1985. Effects of osmoconditioning corn (Zea mays L.) seed in polyethylene glycol on germanative responses at sub-optimal temperature. Master of Science Thesis, Department of Agronomy. Mississippi State University, State College. Mississippi. 63 p. [ Links ]
Vertucci, W. C. and Roos, E. E. 1990. Theorical basis of protocols of seed storage. Plant Physiol. 94:1019-1023. [ Links ]
Vertucci, W. C. and Farrant, M. J. 1995. Acquisition and loss of desiccation tolerance. In: Kigel, J. and Galili, G. (Eds). Seed development and germination. Marcel Dekker. New York. 237-271. [ Links ]
Walters, C.; Farrant, M. J.; Pammenter, N. W. and Berjak, N. 2002. Desiccation and damage. In: Black, M. and Pritchard, H. W. (Eds.). Desiccation and survival in plants. Drying without dying. CABI Publishing Wallingford, Oxon. 263-291 pp. [ Links ]














