Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ciencias agrícolas
versão impressa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.5 no.5 Texcoco Jun./Ago. 2014
Artículos
Importancia de la isoforma-1 de la sacarosa sintasa en el metabolismo del carbono durante el desarrollo de la semilla de Arabidopsis thaliana*
Importance of isoform-1 of sucrose synthase in carbon metabolism during seed development Arabidopsis thaliana
Juan Gabriel Angeles-Núñez1§, Carlos Herrera-Corredor1 y Talina Olivia Martínez-Martínez1
1 Campo Experimental Bajío- Instituto Nacional de Investigaciones Forestales y Agropecuarias (INIFAP). Carretera Celaya-San Miguel de Allende km 6.5. 38010 Celaya, Guanajuato, México. Tel. 01 461 61-15-323 Ext. 212. (herrera.corredor@inifap.gob.mx; martinez.talina@inifap.gob.mx). §Autor para correspondencia: angeles.gabriel@inifap.gob.mx.
* Recibido: enero de 2014
Aceptado: mayo de 2014
Resumen
La sacarosa sintasa (SUS) es una enzima clave en el metabolismo de la sacarosa. Esta enzima cataliza la conversión reversible de sacarosa y UDP a UDP-Glucosa y fructosa. En Arabidopsis, la familia de genes SUS consta de 6 miembros. Uno de estos, el gen SUS1 (At5g20830) se expresa durante la fase de desarrollo de la morfogénesis de la semilla, periodo que corresponde a la fase de la acumulación masiva de almidón y de hexosas, a la fecha se desconoce la función metabólica que tiene esta isoforma-1 en la síntesis de estos compuestos carbonados. Con la finalidad de aportar elementos que contribuyan a determinar las funciones de esta enzima (SUS1) en el desarrollo de la semilla, se llevó a cabo un análisis funcional, el cual comprende la caracterización bioquímica de un alelo nulo de esta isoforma. Los resultados obtenidos muestran la importancia de esta enzima (SUS1) para el metabolismo de la sacarosa en la semilla de Arabidopsis en la etapa de desarrollo. Por otro lado, la mutación SUS1 afecta principalmente el cociente hexosas/sacarosa; lo cual provoca una disminución importante en la acumulación de ácidos grasos y de almidón transitorio durante los estadios tempranos del desarrollo de la semilla.
Palabras clave: almidón, ácidos grasos, isoforma-1 de sacarosa sintasa, semillas en desarrollo.
Abstract
Sucrose synthase (SUS) is a key enzyme in the metabolism of sucrose. This enzyme catalyzes the reversible conversion of sucrose and UDP to UDP-glucose and fructose. In Arabidopsis, the family SUS of genes consists of 6 members. One of these, the SUS1 gene (At5g20830) is expressed during the development phase of the morphogenesis of the seed, which corresponds to the phase of the massive accumulation of starch and hexoses to date unknown metabolic function has this isoform-1 in the synthesis of these carbon compounds. In order to provide elements that contribute to determine the roles of this enzyme (SUS1) in seed development was carried out a functional analysis, which comprises the biochemical characterization of a null allele of this isoform. The results show the importance of this enzyme (SUS1) for sucrose metabolism in Arabidopsis seeds in the development stage. Moreover, the mutation affects mainly SUS1 hexoses/sucrose ratio; which results in a significant accumulation of fatty acids and of transitory starch in the early stages of seed development decreased.
Keywords: starch, fatty acid, isoform-1 sucrose synthase, developing seeds.
Introducción
Evolutivamente una de las estrategias de las plantas superiores fue la capacidad de formar semillas. Estas estructuras confieren propiedades intrínsecas (protección física y bioquímica a través de los tegumentos, tolerancia a la desecación, metabolismo inactivo, acumulación de compuestos de almacenamiento) que contribuyen a la supervivencia y a la dispersión. En el ciclo de vida de las plantas superiores, el desarrollo de la semilla es un proceso crucial que proporciona el enlace entre dos generaciones esporofíticas distintas. Con base en múltiples modelos de plantas, estos procesos pueden dividirse en dos etapas: morfogénesis y maduración (Manfield et al., 1992; Baud et al., 2002; Becerra-Baeza, 2007).
En Arabidopsis, la fase de morfogénesis precoz comienza después de la doble fecundación y se termina a lo largo del sexto día después de la floración (DDF). Después de esta etapa, el embrión adquiere la arquitectura de base de la planta y el albumen se desarrolla a través de divisiones celulares activas (Baud et al., 2002). Durante la etapa de maduración, los compuestos de almacenamiento son sintetizados y acumulados principalmente en el embrión (Mansfield et al., 1992; Baud et al., 2002; Fait et al., 2006; Angeles-Núñez y Tiessen, 2010, 2011, 2012). Finalmente en la fase de la maduración tardía, el embrión es metabólicamente inactivo y adquiere tolerancia a la desecación. En semillas de Arabidopsis, las fuentes de carbono y nitrógeno son almacenadas en la forma de lípidos y proteínas (Baud et al., 2002; Fait et al., 2006; Angeles-Núñez y Tiessen, 2010).
Estas reservas son la principal fuente de alimento para la plántula en la germinación temprana (Bewley y Black, 1994), por lo tanto la sacarosa representa la forma principal en la que el carbono fotosintéticamente asimilado es transportado a las plantas. Después de ser sintetizada en las hojas o en las paredes de las silicuas, la sacarosa se transporta vía floema para proveer a los órganos demanda (semillas) (Zhang et al., 2007). La degradación de la sacarosa en las plantas es catalizada por invertasas (β-D-fructofuranosilfructohidrolasa, EC 3.2.1.26) o por la sacarosa sintasa (UDP-glucosa: Transferasa 2-α-D-glucosiltransferasa EC 2.4.1.13, SUS).
Las invertasas están implicadas en diversos aspectos del ciclo de vida de la planta así como en la respuesta de la planta a los estímulos ambientales (Roitsch y Gonzalez, 2004). La actividad de degradación de la sacarosa sintasa (SUS) está correlacionada con la fuerza de demanda de los órganos de almacenamiento, ésta provee sustratos para la síntesis de almidón en embriones de maíz o de chicharos así como en tubérculos de papa (Zrenner et al., 1995; Chourey y Nelson, 1976; Déjardin et al., 1997). Weber et al. (1997) en estudios posteriores encontraron que la expresión de SUS en la semilla de Vicia faba o de tubérculos de papa (Zrenner et al., 1995) está implicada principalmente en la síntesis y almacenamiento de almidón y de proteínas. En las especies examinadas, la sacarosa sintasa está codificada por una familia de genes.
El genoma de Arabidopsis contiene seis genes que participan en la síntesis de sacarosa sintasa, los cuales poseen diferentes perfiles de expresión regulados por diversas condiciones de estrés ambiental tal como la privación de oxigeno (anoxia), deshidratación, tratamiento al frío, así como respuesta a soluciones con azucares y regulación por factores de transcripción (Baud et al., 2004; Bieniawska et al., 2007; Angeles-Núñez et al., 2008; Angeles-Núñez y Tiessen, 2010, 2012). El gen AtSUS1 (At5g20830) fue clonado por Martin et al. (1993). Un análisis del transcriptoma así como una serie de estudios, indican que este gen se expresa en diferentes órganos de la planta (http:www.genevestigator.ethz.ch/at/; Cieresko y Kleczkowski, 2002; Baud et al., 2004; Bieniawska et al., 2007).
El análisis de ciertos mutantes de SUS tales como rugosus4 en chícharo (rug4, Craig et al., 1999) o shrunken1 en maíz (Sh1, Chourey et al., 1998) indica que las semillas son severamente afectadas en la acumulación de almidón durante su desarrollo. El catabolismo de la sacarosa por la SUS apoya directamente la síntesis de la celulosa, por lo que la supresión de la SUS en la epidermis del óvulo de la semilla del algodón, reprime la liberación y la elongación de la fibra (Ruan et al., 2003). La expresión de diferentes genes de SUS es (espacio-temporal) regulada y diferencialmente modulada en respuesta a la anoxia, a bajas temperaturas y a estrés osmótico (Maraña et al., 1990; Chourey et al., 1991; Zeng et al., 1998; Déjardin et al., 1999).
Estudios sobre mutantes simples y dobles de sacarosa sintasa indican que las semillas maduras no presenta ningún fenotipo metabólico (Bieniawska et al., 2007). Sin embargo, estudios más recientes realizados durante el desarrollo de la semilla de Arabidopsis mostraron que la localización de AtSUS está correlacionada con la acumulación de almidón a nivel del tegumento durante la fase de la maduración-intermedia (15 DDF) (Fallahi et al., 2008; Angeles-Núñez et al., 2008). Ésta expresión es conforme a la acumulación de la proteína AtSUS2 y nivel de transcritos del gen AtSUS2; sin embargo, los autores(as) no descartan la posible presencia de actividades de otras isoformas de SUS, particularmente SUS3, fuertemente expresada en la semilla durante la fase de maduración (Angeles-Núñez et al., 2008; Angeles-Núñez y Tiessen, 2010, 2012).
En adición, estos hallazgos señalan que SUS2 está localizada en el tegumento, en el endospermo y embrión, y que la proteína está asociada a membranas de plastos en la semilla, durante la fase de maduración (Angeles-Núñez et al., 2008). Recientemente, los trabajos desarrollados por Angeles-Núñez y Tiessen, (2010, 2012) han mostrado que los genes SUS2 y SUS3 modulan la homeostasis metabólica de la semilla de Arabidopsis. Con base en la información presentada, se planteó la hipótesis que la enzima SUS1 al igual que las otras isoformas de sacarosa sintasa está implicada de manera activa en la vía metabólica del carbono durante el desarrollo de la semilla de Arabidopsis.
Para evaluar esta hipótesis, en este trabajo se caracterizó bioquímicamente la mutante SUS1, a través de la determinación de la actividad total de sacarosa sintasa, del contenido de carbohidratos (hexosas, sacarosa, almidón), así como del contenido de lípidos y proteínas totales durante el desarrollo de las semillas de Arabidopsis.
Materiales y métodos
Material biológico y condiciones de cultivo
Para determinar la función de la isoforma SUS1 durante el desarrollo de la semilla, se utilizó una línea de inserción T-DNA afectada en el gen At5g20830 del instituto de Salk (http://signal.salk.edu/). Un alelo nulo para esta isoforma fue utilizado para el desarrollo de los análisis de este trabajo. La mutante SUS1 (DRL 61) se encuentra en el fondo genético Wassilewskija (Ws). Utilizando el ADN genómico de plantas SUS1 los bordes derecho e izquierdo del T-DNA fueron identificados, amplificados por PCR y secuenciados, confirmando los FSTs encontrados en la base de datos de FLAGdb/FST. Se obtuvo una línea homocigota para este mutante (comunicación directa).
Las semillas fueron esterilizadas y sembradas sobre placas conteniendo medio Murashige y Skoog (MS) (M02 555, pH 5.6; Duchefa Biochemie, Haarlem, The Netherlands). Después de un tratamiento con frío (48-h a 4 °C) en obscuridad, las placas fueron transferidas a una cámara de crecimiento e incubadas a temperaturas de 20 °C/15 °C día/noche bajo un régimen de 16-h/8-h/ luz/obscuridad. Después de 15 días, las plántulas fueron transferidas a composta estéril, bajo un régimen de crecimiento de 16-h/8-h luz/obscuridad, asociado con temperaturas de 21 °C/18 °C día/ noche. Las plantas fueron regadas dos veces por semana con una solución de fertilización (Plant-prod, fertile, www.fertilpot.com).
Determinación de la actividad total de sacarosa sintasa durante el desarrollo de la semilla
Con la finalidad de evaluar la importancia de la enzima sacarosa sintasa (SUS) durante el desarrollo de la semilla de Arabidopsis, se determinó esta actividad in vitro utilizando extractos de proteínas preparadas de semillas aisladas correspondientes al alelo nulo SUS1 y del ecotipo silvestre Ws. Muestras de 200 semillas aisladas para cada estadio de desarrollo analizado (9, 12, 15, 18 días después floración (DDF)) fueron usadas para determinar la actividad total SUS en un ensayo de dos pasos descrito por Egger y Hampp (1992) con los siguientes cambios: El polyclar fue omitido y 0.2% de Triton X-100 (Sigma, Lyon, France) fue adicionado en la solución de extracción.
Determinación del peso seco de la semilla
Se determinó la evolución del peso seco en el desarrollo de la semilla de Arabidopsis thaliana a través de una balanza analítica de ultra precisión Sartorius ISO 9001 como fue descrito por Baud et al. (2002).
Análisis de carbohidratos y lípidos
Para cada análisis, se tomaron muestras de 20 semillas liofilizadas para determinar el contenido de lípidos (µg/mg PS (peso seco) y carbohidratos (hexosas y sacarosa en µg/mg PS); almidón en (ng)/semilla), como fue descrito por Baud et al. (2002); Angeles-Núñez y Tiessen, (2010).
Análisis de proteína total en el desarrollo de la semilla
Muestras de 10 semillas liofilizadas para cada estadio de desarrollo analizado fueron usadas para determinar el contenido de proteína total, como fue descrito por Baud et al. (2002); Angeles-Núñez y Tiessen, (2010). Los resultados se expresaron en µg/mg PS (peso seco).
Análisis estadístico
Con los resultados obtenidos se realizó el análisis de varianza (ANOVA) con ≤0.05. Se calcularon las medias así como el error estándar (ES), mediante el programa estadístico R (R Development Core Team 2008) y Excel® de Microsoft office 2007.
Resultados
Actividad total sacarosa sintasa (SUS)
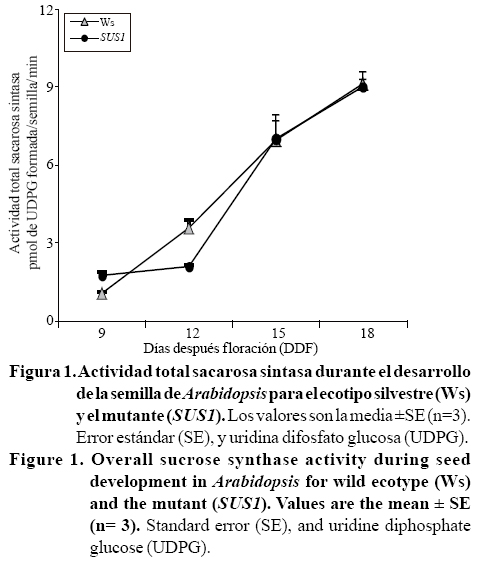
El perfil de la actividad total SUS para el mutante se modificó en estadios tempranos del desarrollo de la semilla con respecto al control (Ws). La actividad total SUS en el mutante SUS1 disminuyó 60% a los 12 días después floración (DDF) (Figura 1).
Desarrollo de la semilla
La evolución del peso seco de la semilla siguió un perfil sigmoideo con un incremento rápido entre la morfogénesis y la fase de maduración-intermedia, sin embargo a pesar de las diferencias observadas en estos estadios ninguna diferencia estadísticamente significativa en la masa de la semilla madura (21 DDF) fue detectada entre el mutante (SUS1) y el control (Ws). El periodo comprendido de 12 a 18 DDF presentó una diferencia significativa de 30% menos peso para la mutante (Figura 2).

Perfil del contenido de carbohidratos durante el desarrollo de la semilla
A fin de determinar si la mutación de sacarosa sintasa-1 tuvo un impacto sobre el contenido de carbohidratos en la semilla en desarrollo, varios parámetros fueron determinados utilizando semillas liofilizadas en desarrollo. El contenido de almidón en el mutante SUS1 se incrementó 2.5 veces con respecto al silvestre a los 15 DDF (maduración-intermedia). Sin embargo, fuera de este periodo no se detectó ninguna diferencia (Figura 3). El perfil de hexosas (fructosa y glucosa) en este mutante, fue afectado durante la fase de maduración tardía (18 DDF). El contenido en fructosa se incrementó 8 veces con respecto al silvestre (Ws). Mientras que su contenido en glucosa se incrementó 3.2 veces para el mismo periodo (Figura 4). Una disminución de 25% en sacarosa fue detectada a los 18 DDF para este mutante (Figura 4). El cociente de hexosas/sacarosa en el mutante SUS1 disminuyó 40% a los 9 DDF y 60% a los 12 DDF (Figura 4).

Síntesis de ácidos grasos durante el desarrollo de la semilla
El perfil de acumulación de ácidos grasos totales en el mutante SUS1 se modificó al comienzo de la fase de maduración (12 DDF). Durante este periodo, el contenido en ácidos grasos disminuyó 25% con respecto al control (Ws), sin embargo fuera de este periodo, ninguna diferencia fue detectada (Figura 5). El mutante presenta un perfil semejante en ácidos grasos de cadena larga (VLCFA)/C16-C18, presentando una disminución de 60% a 9 DDF y de 20% a 12 DDF (Figura 5B).
Síntesis de proteínas totales durante el desarrollo de la semilla
No fue detectada ninguna diferencia estadísticamente significativa en el contenido de proteínas totales en las semillas del mutante SUS1 durante el desarrollo de la semilla con respecto al silvestre (Ws) (Figura 6).

Discusión
En la mayoría de las plantas, una parte de carbono orgánico producido por la fotosíntesis está asignada a la síntesis de sacarosa, que es transportada a los órganos demanda, donde la sacarosa puede ser utilizada como fuente de esqueletos de carbono para la síntesis de elementos estructurales como carburante metabólico o bien puede acumularse y ser almacenado a concentraciones elevadas (Martin et al., 1993). La degradación de la sacarosa es esencial para las plantas, no sólo por el aporte de fuente de carbono, sino por la liberación de señales de azucares a partir de hexosas en las estructuras en formación. Sólo las invertasas y la sacarosa sintasa catalizan la degradación de la sacarosa en las vías metabólicas conocidas in vitro (Koch, 2004).
En este trabajo se presenta la implicación de la isoforma SUS1 en el metabolismo de la sacarosa durante el desarrollo de la semilla de Arabidopsis, a través del análisis de un alelo nulo para esta isoforma. En el mutante SUS1, la actividad total SUS está afectada principalmente al comienzo de la maduración (Figura 1). El cambio del perfil de actividad total SUS está acompañada de modificaciones importantes en el metabolismo del carbono durante el desarrollo de la semilla (Figura 2 (3, 4, 5)-6). Estos cambios metabólicos son discutidos a continuación.
La disminución del contenido de almidón en el mutante SUS1 está correlacionado con la disminución de la actividad total SUS durante la maduración.
En las semillas de Arabidopsis, el almidón se acumula transitoriamente durante la primera mitad del desarrollo, posteriormente es rápidamente degradado durante la fase tardía del desarrollo de la semilla (Baud et al., 2002; Fait et al., 2006; Angeles-Núñez y Tiessen, 2010, 2011, 2012). En colza se ha propuesto que la acumulación del almidón puede reforzar el estatus de la semilla como órgano-fuente principal antes de la síntesis de compuestos de almacenamiento (aceite) y que éste podría regular la asignación de nutrientes entre los diferentes tejidos de la semilla durante el desarrollo (da Silva et al., 1997).
En este estudio, se observó que la disminución del contenido de almidón acumulada al inicio de la maduración (12 DDF) en el mutante SUS1 está correlacionado con la disminución de la actividad de SUS (Figura 1 y 3). Este resultado sugiere que la sacarosa sintasa podría estar implicada en el suministro de esqueletos de carbono para la síntesis de almidón. Esta idea es coherente con la co-localización de la proteína SUS en gránulos de almidón observados en la semilla de Arabidopsis para este mismo periodo (Fallahi et al., 2008; Angeles-Núñez et al., 2008), así como en la disminución del contenido de almidón observado en semillas de Arabidopsis durante los estadios tempranos del desarrollo para los mutantes Atsus2 y Atsus3 (Angeles-Núñez y Tiessen, 2010, 2012).
En la maduración intermedia (15 DDF) se observó que la velocidad de la degradación del almidón disminuyó con respecto al silvestre (Ws) (Figura 3). Este resultado sugiere que durante este periodo (15 DDF), el mutante SUS1 es capaz de sintetizar los productos de almacenamiento (proteínas y lípidos) sin esta reserva de almidón, esta explicación se ajusta a los resultados obtenidos para este periodo donde la mutante no presenta diferencias en lípidos y proteínas de almacenamiento (Figura 5A y 6). Es posible que este almidón sea degradado más tarde para proporcionar los esqueletos de carbono originados de su degradación en la fase de maduración tardía de la semilla, por ejemplo, en la síntesis de sacarosa carbohidrato que se acumula en estadios tardíos del desarrollo de la semilla. Esta idea coincide con la teoría que la biosíntesis de sacarosa y de oligosacáridos deriva de la degradación de almidón a partir de una acumulación transitoria de hexosas (Yazdi-Samadi et al., 1977; Leprince et al., 1990).
El cambio de la actividad total de SUS observado en el mutante SUS1 lleva a la modificación del cociente hexosas/sacarosa en las semillas de Arabidopsis durante el desarrollo
En las plantas superiores, el metabolismo de sacarosa es esencial para el control del desarrollo de la semilla, principalmente por la regulación de la relación fuente-demanda (Herbers y Sonnewald, 1998). En Vicia faba, la fase de la división celular está caracterizada por un alto cociente de hexosas/sacarosa (Weber et al., 1997). En la semilla la transición de la fase de pre almacenamiento a la fase de maduración (almacenamiento), se caracteriza por un interruptor metabólico que modifica el cociente de hexosas/sacarosa (Baud et al., 2002; Fait et al., 2006; Angeles-Núñez y Tiessen, 2010). En el presente trabajo se muestra que la disminución de la actividad total SUS observada al inicio de la maduración (Figura 1) conduce a una disminución en el contenido de sacarosa (Figura 4C) y a un incremento del contenido de glucosa y fructosa (Figura 4A-B), lo cual tiene como resultado un cociente inferior de hexosas/sacarosa al comienzo de la maduración (12 DDF) (Figura 4D).
La sacarosa es el sacárido soluble más abundante en la semilla seca de un gran número de accesiones de Arabidopsis thaliana (Bentsink et al., 2000). Su acumulación comienza al inicio de la maduración y termina simultáneamente con la síntesis de productos de almacenamiento (Baud et al., 2002; Fait et al., 2006; Angeles-Núñez y Tiessen, 2010). En este trabajo se mostró que la disminución de la sacarosa observada a los 18 DDF en las semillas del mutante SUS1 es concomitante con la acumulación transitoria de hexosas (Figura 4A-C), sugiriendo que la acumulación de hexosas es utilizada como fuente de carbono en los procesos implicados durante la fase de maduración tardía de la semilla. Esta idea coincide con la degradación de la glucosa durante la fase de desecación (Norton et al., 1975; Yazdi-Samadi et al., 1977).
La disminución de la actividad total de SUS en el mutante SUS1 lleva a la disminución de la concentración en lípidos durante el desarrollo de la semilla
La biosíntesis de ácidos grasos y de almidón depende de la misma fuente de carbono: la sacarosa proveniente de la planta madre. La interacción bioquímica entre estas dos vías metabólicas se desconoce (Lin et al., 2006; Angeles-Núñez y Tiessen, 2010). En este trabajo se ha mostrado que el mutante SUS1 está afectado en la vía de biosíntesis de lípidos al inicio de la maduración (12 DDF), esto podría estar correlacionado con la disminución de la actividad total SUS para el mismo periodo. Éste resultado sugiere que la disminución de la actividad total de SUS en este periodo conduce a la disminución en esqueletos de carbono disponibles para la vía de biosíntesis de lípidos.
Ésta hipótesis es coherente con la co-localización de la proteína SUS2 con las membranas de plastos durante la fase de maduración, lo cual sugiere una función para SUS2 en el enrutamiento del metabolismo de la sacarosa a (glucosa-6-fosfato) G-6-P o fosfoenolpiruvato (PEP) (Angeles-Núñez et al., 2008), éstos compuestos carbonados entran en las plantas para ser utilizados como esqueleto de carbono en diferentes procesos de biosíntesis (Fox et al., 2000, Rolletschek et al., 2007; Baud et al., 2007; Angeles-Núñez y Tiessen, 2010).
Conclusiones
La mutación en la isoforma-1 de la sacarosa sintasa afecta el peso seco de la semilla al inicio de la maduración, lo cual afecta el cociente hexosas/sacarosa, provocando una disminución importante en la acumulación de ácidos grasos y de almidón transitorio en estadios tempranos del desarrollo de la semilla de Arabidopsis. Las aportaciones de este trabajo contribuyen de manera importante al entendimiento de la función metabólica que esta isoforma-1 tiene en el metabolismo del carbono durante el desarrollo de la semilla. Los resultados que se presentan son los primeros que se publican con respecto al metabolismo carbonado para esta isoforma-1 de sacarosa sintasa en la semilla de Arabidopsis.
Agradecimientos
Agradecemos al laboratorio de biología de semillas del Instituto Jean-Pierre Bourgin (IJPB), del Instituto Nacional de Investigación Agronómica (INRA-Versailles) en Francia por la facilidad otorgada para el desarrollo del presente trabajo.
Literatura citada
Angeles-Núñez, J. G. and Tiessen, A. 2010. Arabidopsis sucrose synthase 2 and 3 modulate metabolic homeostasis and direct carbon towards starch synthesis in developing seeds. Planta. 232:701-718. [ Links ]
Angeles-Núñez, J. G. and Tiessen, A. 2011. Mutation of the transcription factor LEAFY COTYLEDON 2 alters the chemical composition of Arabidopsis seeds, decreasing oil and protein content, while maintaining high levels of starch and sucrose in mature seeds. J. Plant Physiol. 168:1891-1900. [ Links ]
Angeles-Núñez, J. G. and Tiessen, A. 2012: Regulation of AtSUS2 and AtSUS3 by glucose and transcription factor LEC2 in different tissues and at different stages of Arabidopsis seed development. Plant mol. Biol. 1-16.
Angeles-Nuñez, J. G.; Kronenberger, J.; Wuillème, S.; Lepiniec, L. and Rochat, C. 2008. Study of AtSUS2 localization in seeds reveals a strong association with plastids. Plant Cell Physiol. 49:1621-1626. [ Links ]
Baud, S.; Vaultier, M. N. and Rochat, C. 2004. Structure and expression profile of the sucrose synthase multigene family in Arabidopsis. J. Exp. Bot. 55:397-409. [ Links ]
Baud, S.; Boutin, J. P.; Miquel, M.; Lepiniec, L. and Rochat, C. 2002. An integrated overview of seed development in Arabidopsis thaliana ecotype WS. Plant Physiol. Biochem. 40:151-160. [ Links ]
Baud, S.; Wuilleme, S.; Dubreucq, B.; de Almeida, A.; Vuagnat, C.; Lepiniec, L.; Miquel, M. and Rochat, C. 2007. Function of plastidial pyruvate kinases in seeds of Arabidopsis thaliana. Plant J. 52:405-419. [ Links ]
Becerra-Baeza, C. M. C. 2007. Genes Implicados en el Desarrollo de la Semilla de Arabidopsis thaliana (L.) caracterización de los genes AtAnkTm. Tesis Doctoral. Universidad Autónoma de Barcelona, España. 13-15 p. [ Links ]
Bentsink, L.; Alonso-Blanco, C.; Vreugdenhil, D.; Tesnier, K.; Groot, S. and Koornneef, M. 2000. Genetic analysis of seed-soluble oligosaccharides in relation to seed storability of Arabidopisis. Plant Physiol. 124:1595-1604. [ Links ]
Bewley, J. D. and Black, M. 1994. Seeds: physiology of development and germination 2ª (Ed.). New York: Plenum. 10-31 p. [ Links ]
Bieniawska, Z.; Paul-Barratt, D. H.; Garlick, A. P.; Thole, V.; Kruger, N. J.; Martin, C.; Zrenner, R. and Smith, A. M. 2007. Analysis of the sucrose synthase gene family in Arabidopsis. Plant J. 5:810-828. [ Links ]
Cieresko, I. and Kleczkowski, L. 2002. Glucose and mannose regulate the expression of a major sucrose synthase gene in Arabidopsis via hexokinase-dependent mechanisms. Plant Physiol. Biochem. 40:907-911. [ Links ]
Chourey, P. S. and Nelson, O. E. 1976. The enzymatic deficiency conditioned by shrunken-1 mutations in maize. Biochem. Genet. 14:1041-1055. [ Links ]
Chourey, P. S.; Talierco, E. W. and Kane, E. J. 1991. Tissue-specific expression and anaerobically induced posttranscriptional modulation of sucrose synthase genes in Sorghum bicolor M. Plant Physiol. 96:485-490. [ Links ]
Chourey, P.; Talierco, E. W.; Carson, S. J. and Ruan, Y. L. 1998. Genetic evidence that the two isozymes of sucrose synthase present in developing maize endosperm are critical, one for cell wall integrity and the other for starch biosynthesis. Mol. Gen. Genet. 259:88-96. [ Links ]
Craig, J.; Barrat, P.; Tatge, H.; Déjardin, A.; Gardner, C. D.; Barber, L.; Wang, T. L.; Hedley, C. L.; Martin, C. and Smith, A. M. 1999. Mutations at the rug4 locus alter the carbon and nitrogen metabolism of pea plants through an effect on sucrose synthase. Plant J. 17:353-362. [ Links ]
Déjandin, A.; Rochat, C.; Willeme, S. and Boutin, J. P. 1997. Contribution of sucrose synthase, ADP-glucose pyrophosphorylase and starch synthase to starch synthesis in developing pea seeds. Plant Cell Environ. 20:1421-1430. [ Links ]
Déjardin, A.; Sokolov, L. N. and Kleczkowski, L. 1999. Sugar/osmoticum levels modulate differential abscisic acid-independent expression of two stress-responsive sucrose synthase genes in Aarabidopsis. Biochem J. 344:503-509. [ Links ]
DaSilva, P. M. F. R.; Eastmond, P. J.; Hill, L. M.; Smith, A. M. and Rawsthorne, S. 1997. Starch metabolism in developing embryos of oilseed rape. Planta 203:480-487. [ Links ]
Egger, B. and Hampp, R. 1992: Invertase, sucrose synthase and sucrose phosphate synthase in lyophilized spruce needles; microplate reader assays. Trees 7:98-103. [ Links ]
Fait, A.; Angelovici, R.; Less, H.; Ohad, I.; Urbanczyk-Wochiniak, E.; Fernie, A. R. and Galili, G. 2006. Arabidopsis seed development and germination is associated with temporally distinct metabolic switches. Plant physiol. 142:839-854. [ Links ]
Fallahi, H.; Scofield, G. N.; Badger, M. R.; Chow, W. S.; Furbank, R. T. and Ruan, Y. L. 2008. Localization of sucrose synthase in developing seed and siliques of Arabidopsis thaliana reveals diverse roles for SUS during development. J. Ext. Bot. 59:3283-3295. [ Links ]
Fox, S. R.; Hill, L. M.; Rawsthorne, S. and Hills, M. J. 2000. Inhibition of the glucose-6-phosphate transporter in oilseed rape (Brassica napus L.) plastids by acyl-CoA thioesters reduces fatty acid synthesis. Biochem. J. 352:525-532. [ Links ]
Herbers, K. and Sonnewald, U. 1998. Molecular determinants of sink strength. Curr.Opin. Plant Biol. 1:207-216. [ Links ]
Koch, K. 2004. Sucrose metabolism: regulatory mechanisms and pivotal roles in sugar sensing and plant development. Curr. Opin. Plant Biol. 7:235-246. [ Links ]
Leprince, O.; Bronchart, R. and Deltour, R. 1990. Changes in starch and soluble sugars in relation to the acquisition of desiccation tolerance during maturation of Brassica campestris seeds. Plant Cell Environ. 13:539-546. [ Links ]
Lin, Y.; Ulanov, A. V.; Lozovaya, V.; Widholm, L.; Zhang, G.; Guo, J. and Goodman, H. M. 2006. Genetic and transgenetic perturbations of carbon reserve production in Arabidopsis seeds reveal metabolic interactions of biochemical pathways. Planta. 225:153-164. [ Links ]
Mansfiel, S. G. and Briarty, L. G. 1992. Cotyledon cell development in Arabidopsis thaliana during reserve deposition. Can. J. Bot. 70:151-164. [ Links ]
Maraña, C.; García-Olmedo, F. and Carbonero, P. 1990. Differential expression of two types of sucrose synthase-encoding genes in wheat in response to anaerobiosis, cold shock and light. Gene. 88:167-172. [ Links ]
Martin, T.; Frommer, W. B.; Salanoubat, M. and Willmitzer, L. 1993. Expression of an Arabidopsis sucrose synthase gene indicates a role in metabolization of sucrose both during phloem loading and in sink organs. Plant J. 4:367-377. [ Links ]
Norton, G. and Harris, J. F. 1975. Compositional changes in developing rape seed (Brassica napus L.) Planta. 123:163-174. [ Links ]
R Development Core Team R. 2008. R: a language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. http://www.R-project.org. [ Links ]
Roitsch, T.; González, M. C. 2004. Function and regulation of plant invertases: sweet sensations. Trends Plant Sci. 9:606-613. [ Links ]
Rolletschek, H.; Nguyen, T. H.; Hausler, R. E.; Rutten, T.; Gobel, C.; Feussner, I.; Radchuk, R.; Tewes, A.; Claus, B.; Klukas, C.; Linemann, U.; Weber, H.; Wobus, U. and Borisjuk, L. 2007. Antisense inhibitions of the plastidial glucose-6-phosphate/phosphate translocator in Vicia seeds shifts cellular differentiation and promotes protein storage. Plant J. 51:468-484. [ Links ]
Ruan, Y. L.; Llewellyn, D. J. and Furbank, R. T. 2003. Suppression of sucrose synthase gene expression represses cotton fiber cell initiation, elongation, and seed development. Plant Cell. 15:952-964. [ Links ]
Weber, H.; Borisjuk, L. and Wobus, U. 1997. Sugar import and metabolism during seed development. Annu. Rev. Plant Physiol. Plant Mol. Bio. 2:169-174. [ Links ]
Yazdi-Samadi, B.; Rinne, R. W.; Seif, R. D. 1977. Components of developing soybean seeds: oil, proteins, sugars, starch, organic acids and amino acids. Agro. J. 69:481-486. [ Links ]
Zeng, Y.; Wu Y.; Avigne, W. T. and Koch, E. 1998. Differential regulation of sugar-sensitive sucrose synthases by hypoxia and anoxia indicate complementary transcriptional and posttranscriptional responses. Plant Physiol. 116:1573-1583. [ Links ]
Zhan W. H.; Zhou, Y.; Dibley, K.; Tyerman, S.; Furbank, R. T. and Patrick, J. W. 2007. Nutrient loading of developing seeds. Funct. Plant Biol. 34:314-331. [ Links ]
Zrenner, R.; Salanoubat, M.; Willmitzer, L. and Sonnewald, U. 1995. Evidence of crucial role of sucrose synthase for sink strength using transgenic potato plants (Solanum tuberosum L.). Plant J. 7:97-107. [ Links ]














