Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ciencias agrícolas
versão impressa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.4 no.spe6 Texcoco Ago./Set. 2013
Artículos
Composición del medio de cultivo y la incubación para enraizar brotes de Agave*
Composition of the culture medium and incubation for rooting shoots of Agave
Maura Elisama Miguel Luna1, José Raymundo Enríquez-del Valle1§, Vicente Arturo Velasco Velasco1, Yuri Villegas Aparicio1, José Cruz Carrillo Rodríguez1 y Gerardo Rodríguez Ortíz1
1 Instituto Tecnológico del Valle de Oaxaca. Ex-Hacienda de Nazareno Xoxocotlán, Oaxaca, México. C. P. 71230. Tel. y Fax: (01951) 5170788, 5170444. (lunitastar.mar@hotmail.com; vicvel5@hotmail.com; yurivil37@yahoo.com; jcarrillo_rodriguez@hotmail.com; grodriguezortiz@hotmail.com). § Autor para correspondencia: jenriquezdelvalle@yahoo.com.
* Recibido: octubre de 2012.
Aceptado: febrero de 2013.
Resumen
En Oaxaca el Agave americana variedad oaxacensis se encuentra en estado silvestre y pequeñas plantaciones. El objetivo de la investigación fue evaluar la concentración del ácido indolbutírico (AIB) y las sales inorgánicas en el medio de cultivo, así como el ambiente de incubación, en su efecto sobre el enraizado de brotes de Agave y características de las plantas. Se trabajó en el laboratorio de cultivo de tejidos vegetales y un invernadero del Instituto Tecnológico del Valle de Oaxaca en el periodo 2011-2012. Tejidos de tallo cultivados in vitro formaron racimos de 4 a 10 brotes adventicios. Los brotes con 4-4.5 cm se separaron individualmente y para inducir su enraizado, se transfirieron a recipientes de 145 cm3 con 20 mL de diferentes medios de cultivo. El total de brotes en cada medio de cultivo se separaron en dos grupos para incubarlos durante 60 días en condiciones diferentes: laboratorio o invernadero. Todos los brotes formaron raíces adventicias aun en medios de cultivo sin auxina, pero los brotes en los medios de cultivo con 0.5 ó 1 mg L-1AIB formaron más raíces y las plantas fueron más grandes. El medio de cultivo con las sales inorgánicas a 66% fue mejor condición que las sales a 100% para que los brotes formaran más raíces. Las plantas obtenidas de cultivos in vitro incubados en invernadero y laboratorio tuvieron en promedio 7.1 y 6.5 hojas, 7 y 6.5 mm de diámetro de tallo 170 y 150 mg de peso seco total, respectivamente.
Palabras clave: Agave americana, auxina, micropropagación, raíces adventicias.
Abstract
In Oaxaca the Agave Americana var. oaxacensis is found wild and small plantations. The objective of the study was to evaluate the concentration of indole butyric acid (IBA) and the inorganic salts in the culture medium, thus as the incubation temperature, its effect on the rooting of Agave shoots and plant characteristics. The worked was conducted in the laboratory of plant tissue culture and in a greenhouse from the Technological Institute of Oaxaca Valley in 2011-2012. Stem tissues cultured in vitro formed clusters of 4 to 10 adventitious shoots. Shoots with 4-4.5 cm were separated individually and to induce rooted, were transferred to containers of 145 cm3 with 20 mL of different culture medium. The total sprouts on each culture medium were separated into two groups for incubation during 60 days under different conditions of laboratory or greenhouse. All sprouts formed adventitious roots even in culture mediums without auxin but the shoots in culture medium with 0.5 or 1 mg L-1 IBA formed more roots and the plants were larger. The culture medium containing inorganic salts to 66%, gave better condition, than the salts to 100%, for shoots producing more roots. The plants obtained in vitro cultures incubated in greenhouse and laboratory had on average 7.1 and 6.5 leaves, 7 and 6.5 mm in stem diameter, 170 and 150 mg of total dry weight, respectively.
Key words: Agave americana, auxin, micropropagation, adventitious roots.
Introducción
En México, diversas especies de agaves se han usado ampliamente para delimitar terrenos, elaborar artículos de fibra, obtención de azúcares y la elaboración de bebidas fermentadas y destiladas (Bautista-Justo et al., 2001). En Oaxaca, México durante 2006 existían más de 11 000 ha de plantaciones en las que se utilizó preferentemente el A. angustifolia Haw (Bravo et al., 2007) que al compararla con el A. americana variedad oaxacensis se tiene que: 1) la parte central de la roseta llamada piña de plantas adultas de ambas especies contienen similar cantidad de azúcares, por unidad de peso; 2) la piña de la primer especie pesa de 70 a 110 kg y la del A. americana variedad oaxacensis es ligeramente más grande; y 3) los individuos de la primer especie tardan de 7 a 9 años en llegar a la madurez, mientras que la segunda tarda de 18 a 20 años y esta ha sido una causa de que se privilegie establecer plantaciones con la primer especie, mientras que a la segunda se le propaga y cultiva en reducidas extensiones (Guillot y Meer, 2004; Valenzuela, 2003). Sin embargo, diversos grupos de agricultores muestran interés para que el A. americana variedad oaxacensis sea propagado y establecerlo en plantaciones, por lo que se propone la micropropagación in vitro para obtener gran cantidad de plantas en un corto plazo.
El cultivo in vitro de células y tejidos vegetales se puede usar para el rescate y la conservación de especies amenazadas y también para la multiplicación a gran escala de genotipos superiores, y obtener grandes poblaciones clonales a partir de plantas seleccionadas. Se ha realizado la micropropagación de Agave fourcroydes (Madrigal et al., 1990), A.cocui Trelease (Salazar et al., 2009); A. karwinskii, y A. potatorum (Domínguez et al., 2008). En Oaxaca, México, durante el periodo 1988 a 2005 el A. angustifolia se propagó mediante el cultivo de tejidos, las plantas obtenidas se aclimatizaron en invernadero durante 70 días, crecieron durante 10 a 12 meses en vivero y más de 100 mil plantas se establecieron en campo (Enríquez del Valle, 2008; Enríquez del Valle et al., 2009).
Es posible hacer modificaciones en cada una de las etapas de un procedimiento de propagación in vitro para incrementar la eficiencia de éste y la calidad de las plantas, por lo que es conveniente evaluar el efecto de variar la concentración de los componentes de un medio de cultivo como las sales minerales de Murashige y Skoog (1962) y la aplicación exógena de reguladores de crecimiento en que se incluyen las auxinas, como los ácidos indol-3-acético (AIA), ácido naftalenacético (ANA) y acido indolbutírico (AIB) que inducen en los brotes de gran número de especies la formación de raíces adventicias, así como mayor tamaño de los brotes mediante el crecimiento de las células (Gilroy y Trewavas, 2001; Soto et al., 2006).
Enríquez del Valle et al. (2005), mostraron que brotes de Agave angustifolia establecidos en medios de cultivo con 0.75 y 1 mg L-1 de AIB formaron 6.8 y 7.6 raíces adventicias en promedio, además, los brotes formaron más raíces adventicias y más largas conforme se disminuyó de 100 a 50% la concentración de sales inorgánicas en el medio de cultivo.
En algunos esquemas de micropropagación de banano Musa, se ha propuesto que los cultivos in vitro en la etapa de enraizado de brotes para su preparación para trasplante a suelo, se coloquen durante un mes en condiciones de invernadero, esto como un procedimiento de pre adaptación en que las plantas obtenidas desarrollan mayor vigor, pigmentación, actividad fotosintética, desarrollo de la cutícula cerosa, características que capacitan a las plantas para adaptarse mejor que las plantas de cultivos in vitro incubados todo el tiempo en ambiente de laboratorio, cuando se trasfieren de in vitro a contenedores con sustrato (Teixeira da Silva et al., 2005). Por lo anterior, el objetivo del presente estudio fue evaluar la concentración del ácido indolbutírico (AIB) y de las sales inorgánicas en el medio de cultivo, así como el ambiente de incubación, en su efecto sobre la formación de raíces adventicias en brotes y las características de las plantas de Agave americana variedad oaxacensis.
Materiales y métodos
La investigación se realizó en el laboratorio de cultivos de tejidos vegetales y un invernadero del Instituto Tecnológico del Valle de Oaxaca, en Xoxocotlán, Oaxaca, en las coordenadas geográficas de 17° 04' de latitud norte, 96° 46' de longitud oeste y 1550 msnm (INEGI, 2005), con material vegetal colectado en la Comunidad de Santa Catarina Minas Ocotlán, ubicada en los Valles Centrales, del estado de Oaxaca.
Explantos de tejido de tallo de A. americana var. oaxacensis se establecieron en frascos de 145 cm3 que contenían 20 mL de medio de cultivo con consistencia de gel, preparado con las sales minerales de Murashige y Skoog (1962) (MS), 0.4 mg L-1 de tiamina, 100 mg L-1 de myo- inositol, 30 g L-1 de sacarosa y 1 mg L-1 de benciladenina. El pH se ajustó a 5.8 antes de agregar 5.4 g L-1 de agar. Los cultivos se incubaron durante ocho semanas baj o luz fluorescente blanca a 100 um m.2 s1 de intensidad, fotoperiodos de 16 h y 8 h de oscuridad, temperatura en el rango de 22-28 °C. En el transcurso de ocho semanas de incubación se formaron racimos de 4 a 10 brotes adventicios en cada explanto. Para la multiplicación de propágulos, los racimos de brotes que se formaron en cada explante se separaban en racimos de dos a tres brotes y se transfirieron a un medio de cultivo y condiciones de incubación similares que en el subcultivo anterior.
Al término de un ciclo de multiplicación de propágulos se formaron racimos de 4 a 10 nuevos brotes heterogéneos en tamaño. De éstos racimos de brotes se seleccionaron aquellos brotes que tenían de 4 a 4.5 cm de longitud, los que se separaron individualmente y transfirieron a frascos de 160 cm3que contenían 25 mL de medio de cultivo para inducir su enraizado. Los diversos medios de cultivo se prepararon con: 1) agua destilada, 0.4 mg L-1 de tiamina, 100 mg L-1 de myoinositol, 25 g L-1 de sacarosa; 2) sales minerales de Murashige y Skoog (1962) en tres concentraciones diferentes (33, 66 y 100%); y 3) auxina ácido indolbutírico (AIB) en cinco concentraciones diferentes (0, 0.5, 1.0, 1.5 y 2 mg L-1).
El total de brotes en frascos con cada medio de cultivo se separaron en dos grupos para incubarlos durante 60 días en condiciones diferentes: 1) de laboratorio (iluminación fluorescente blanca, a 100 µmol m-2 s-1, fotoperiodos de 16 h y 8 h de oscuridad, temperatura de 22-28 °C) y 2) en invernadero, donde los cultivos estuvieron expuestos a radiación solar disminuida 50% mediante malla sombra.
El experimento se estableció de acuerdo a un diseño completamente al azar, con arreglo factorial 3 x 5 x 2 (concentración de sales inorgánicas, concentración de AIB, ambiente de incubación) por lo que se tuvieron 30 tratamientos. La unidad experimental fue un brote en cada frasco de cultivo y se tuvieron 12 repeticiones por tratamiento. Al término del periodo de incubación, se tomaron al azar ocho unidades experimentales de cada tratamiento para cuantificar número de hojas, área foliar (cm2) altura de la planta (cm), diámetro de tallo (mm), número de raíces, longitud de la raíz más larga (cm), volumen de la raíz (cm3), materia seca total de la planta (mg). Los datos se sometieron a análisis de varianza y comparación de medias (Tukey, a= 0.05).
Resultados y discusión
Los brotes establecidos en diversos medios de cultivo que variaban en concentración de sales inorgánicas y AIB, se incubaron en condiciones de laboratorio y otros se incubaron en invernadero; transcurridos 12 días de incubación todos los brotes ya presentaban raíces adventicias. Enríquez del Valle et al. (2005) indican que se han utilizado medios de cultivo con bajas concentraciones de sales inorgánicas (MS) y ácido indolbutírico (AIB) para propiciar la formación de raíces adventicias en diferentes especies de agave cultivadas in vitro.
Transcurridos 60 días de que los brotes de Agave americana se establecieran en las diferentes condiciones de cultivo, los análisis de varianza mostraron que las concentraciones de sales minerales en el medio de cultivo tuvieron diferencias significativas (p≤ 0.01) de efecto en número de raíces adventicias que formaron los brotes, longitud de la raíz y volumen de raíz, así como en el número de hojas que tuvieron estas plantas. Las distintas concentraciones de la auxina AIB en el medio de cultivo tuvieron diferencias significativas (p≤ 0.01) de efecto en todas las variables (Cuadros 1 y 2).
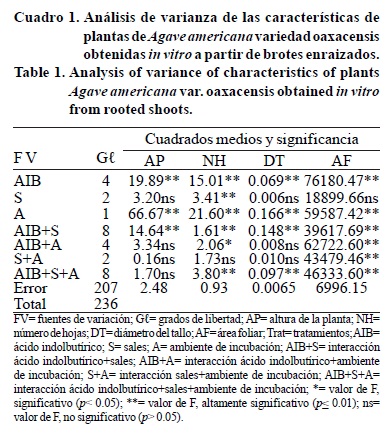
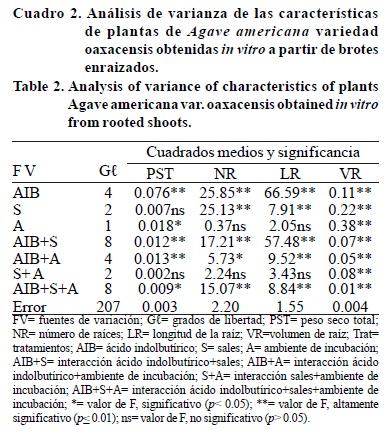
La interacción de las sales minerales y ácido indolbutírico tuvo efecto significativo (p≤ 0.01) en todas las variables. Los ambientes de incubación tuvieron diferencias significativas (p≤ 0.01) de efecto en altura de la planta, número de hojas, diámetro de tallo, área foliar, volumen de raíz y efecto significativo (p≤ 0.05) en peso seco total (Cuadros 1 y 2).
La interacción entre el ambiente de incubación y las dosis de ácido indolbutírico en el medio de cultivo tuvo efecto altamente significativo (p≤ 0.01) en el área foliar, peso seco total, longitud de la raíz y volumen de la raíz, y efecto significativo (p≤ 0.05) para el número de hojas y número de raíces. La interacción entre la concentración de sales minerales en el medio de cultivo y ambiente de incubación tuvo efecto altamente significativo (p≤ 0.01) en el área foliar y volumen de raíz. La interacción entre el ambiente de incubación, la concentración de sales minerales y la concentración de ácido indolbutírico en el medio de cultivo, tuvo efectos altamente significativos (p≤ 0.01) en número de hojas, diámetro de tallo, área foliar, número de raíces, volumen de la raíz, y longitud de la raíz, siendo significativo (p≤ 0.05) para peso seco total (Cuadro 1 y 2).
Los medios de cultivo con 1 ó 2 mg L-1 de ácido indolbutírico influyeron para que los brotes dieran origen a plantas que alcanzaron mayor altura, número de hojas y área foliar. Mientras que para las variables diámetro de tallo y volumen de raíz fue únicamente la concentración de 1 mg L-1 de AIB. Todos los brotes formaron raíces adventicias, incluso aquellos establecidos en medios sin auxina, los cuales tuvieron 7.1 raíces. Así también Blanco y Valverde (2004) mencionan que brotes de Philodendron spp. no requirieron la aplicación exógena de reguladores de crecimiento para que formaran raíces adventicias (Cuadro 3). Lo anterior pudo ocurrir, debido a que en las hojas ocurre la síntesis de auxinas (Raven et al., 1999; Azcón-Bieto y Talón, 2000).
Los brotes establecidos en medios de cultivo sin AIB formaron la menor cantidad (7.1) de raíces adventicias, que tuvieron 0.47 cm3 de volumen y la mayor longitud (9.5 cm). Conforme se aplicaron concentraciones crecientes de AIB hasta 0.5 mg L-1 los brotes formaron significativamente (Tukey, 0.05) la mayor cantidad de raíces (8.2). Los brotes establecidos en medios con concentraciones de AIB superior a 0.5 mg L-1 mostraron la tendencia a formar menor cantidad de raíces adventicias y significativamente (Tukey, 0.05) más cortas (Cuadro 3).
Los brotes establecidos en medio de cultivo con las sales minerales a 66% de concentración formaron 7.9 raíces adventicias, cantidad 15% superior y significativamente (Tukey, 0.05) diferente a la cantidad de raíces que formaron los brotes en medios de cultivo con las sales inorgánicas a 100%. Por su parte Enríquez del Valle et al. (2005) indican que brotes de Agave angustifolia formaron 4.7 raíces adventicias en el medio de cultivo con las sales inorgánicas al 50% de concentración y sin fitohormonas aunque al incorporarles 1 mg L -1 de AIB en el medio de cultivo los brotes formaron 8.5 raíces (Cuadro 3).
Las plantas originadas de brotes incubados en laboratorio alcanzaron en promedio significativamente (Tukey, 0.05) mayor altura en comparación a las plantas incubadas en el invernadero. Mientras que las plantas originadas de los brotes incubados en invernadero tuvieron significativamente (Tukey, 0.05) mayor cantidad de hojas, diámetro de tallo, peso seco de tallo y volumen de raíz, que las plantas originadas en laboratorio (Cuadro 3), esto se explica con lo investigado por Papaphotiou et al. (2003) en plantas de Callistemon sp. micropropagadas y aclimatizadas en condiciones de invernadero con 50% sombra e indican que el nivel de irradiancia fue un factor ambiental importante que influyó en el fenotipo de las plantas. Pospíšilová et al. (2007) mencionan que durante la aclimatación en invernadero de plantas micropropagadas se usan niveles de irradiancia en el rango de 50-350 µmol m2 s-1.
El efecto significativo de las interacciones sobre la formación de raíces en los brotes se podría interpretar en que, aun cuando la auxina desempeña un papel importante para inducir la formación de raíces adventicias, otras condiciones ambientales, tales como la concentración de sales en el medio de cultivo y la calidad e intensidad de iluminación influyen en la capacidad de respuesta del material vegetal al estímulo del regulador de crecimiento. De tal manera que el medio de cultivo con 66% sales inorgánicas, 0.5 mg L-1 de AIB y ambiente de incubación en invernadero fue una condición apropiada para el enraizado de los brotes de Agave y su preparación para trasplante a suelo. Las plantas obtenidas en dicha condición tuvieron 10.2 cm de altura, 7.2 hojas, 307.43 cm2 de área foliar, su tallo de 0.7037 cm de diámetro, 10.2 raíces adventicias de 7.8 cm de longitud y 0.737 cm3 de volumen; su peso seco total fue de 160.87 mg.
De manera similar a la formación de raíces en los brotes de A. americana var. oaxacensis, se ha comprobado que brotes de Paulownia elongata (Castellanos et al., 2006) formaron raíces adventicias cuando se establecieron en medio de cultivo sin auxina, y ya que se conoce que las auxinas son reguladores de crecimiento que inducen la formación de raíces adventicias, lo anterior sugiere que en los brotes ocurrió la síntesis de esta sustancia. Pero los brotes que se establecieron en medios con las dosis menores de auxina formaron mayor cantidad de raíces y en menor tiempo, lo cual sugiere que la auxina exógena fue complementaria a la auxina endógena para estimular una respuesta de formación de raíces cercana al óptimo. Así también las dosis mayores de auxina exógena superaron el nivel necesario para la respuesta óptima y causaron inhibición parcial.
Las plantas provenientes de cultivos in vitro incubadas en invernadero contrastaron en diversas características morfológicas, respecto a las plantas originadas de cultivos in vitro incubadas en laboratorio. Es necesario conocer si las características morfológicas que presentaron estas plantas micropropagadas corresponden a una condición de pre-aclimatación que sea conveniente para incrementar el porcentaje de plantas que sobrevivan en el trasplante a condiciones ex vitro y su crecimiento en invernadero o campo (Debergh y Read, 1991; Cui et al., 2000; Pospíšilová et al., 2000).
Conclusiones
El ácido indolbutírico en concentraciones de 0.5 ó 1 mg L-1 en el medio de cultivo estimuló en los brotes la formación de mayor cantidad de raíces adventicias y altura de la planta, en comparación a brotes establecidos en medios sin AIB. En el medio de cultivo las sales inorgánicas MS al 66% de concentración fue una condición que se complementó con la auxina en su efecto para que los brotes formaran mayor cantidad de raíces adventicias. Los brotes incubados en ambiente de invernadero desarrollaron más hojas, tallos de diámetro mayor y acumularon más materia seca total, pero similar cantidad de raíces que los brotes incubados en ambiente de laboratorio.
Literatura citada
Azcón-Bieto, J. y Talón, M. 2000. Fundamentos de fisiología vegetal. Mc. Graw-Hill Interamericana, Madrid, España. 522 p. [ Links ]
Bautista-Justo, M.; García-Oropeza, L.; Barboza-Corona, J. E. y Parra-Negrete, L. A. 2001(b). El Agave tequilana Weber y la producción de tequila. Acta Universitaria. 11(2):26-34. [ Links ]
Blanco, M. y Valverde R. 2004. Micropropagacion de Philodendro sp. Agronomía Costarricense. Universidad de Costa Rica, San José Costa Rica 28(1):39- 46. [ Links ]
Bravo, M. E.; Arredondo, C. y Espinosa, H. 2007. Tecnología para la producción de maguey mezcalero en Oaxaca. Instituto Nacional de Investigaciones ForestalesAgrícolas y Pecuarias (INIFAP). Libro técnico 7:160. [ Links ]
Castellanos, H. O.A.; Rodríguez, S.A.; Rodríguez, D. J. M. y Rodríguez, G. B. 2006. Organogénesis indirecta y enraizamiento in vitro de Paulowniaelongata. e-Gnosis 4(15):1-12 p. [ Links ]
Cui, Y.; Hahn, E.; Kozai, T. and Paek, K. 2000. Number of air exchanges, sucrose concentration. Photosynthetic photon flux, and differences in photoperiod and dark period temperatures affect growth of Rehmanniaglutinosa plantlets in vitro. Plant Cell Tissue Organ Cult. 62:219-226. [ Links ]
Debergh, P. C. and Read, P. E. 1991. Micropropagatión. In: micropropagatión technology and application. Debergh, P. C. and R. H. Zimmerman. (Eds.). Kluwer Academic Publisher. USA. 1-13. [ Links ]
Domínguez, R. M. S.; González, J. M. L.; Rosales, G. C.; Quilloñes, V. C.; Delgadillo, D. L. S.; Mireles, O. J. y Pérez, M. B. E. 2008 (a). El cultivo in vitro como herramienta para el aprovechamiento, mejoramiento y conservación de especies del genero Agave. Investigación y Ciencia de la Universidad Autónoma de Aguascalientes (UAA). Aguascalientes, México. 16(41 ):53-62. [ Links ]
Enríquez del Valle, J. R.; Carrillo-Castañeda, G. y Rodríguez de la O, J. 2005. Sales inorgánicas y ácido indolbutírico en el enraizamiento in vitro de brotes de Agave angustifolia. Rev. Fitotec. Mex. 28:175-178. [ Links ]
Enríquez del Valle, J. R. 2008. La propagación y crecimiento de Agaves. Fundación Produce Oaxaca A. C. Instituto Tecnológico del Valle de Oaxaca. México. 46 pp. [ Links ]
Enríquez del Valle, J. R.; Velasco, V. A.; Campos, G. V.; Hernández- Gallardo, A. E. and Rodríguez-Mendoza, M. N. 2009. Agave angustifolia plants grow with different fertigation doses and organic substrates. Acta Hort. 843:49-55. [ Links ]
Gilroy, S. and Trewavas, A. J. 2001. Signal processing and transduction in plant cells: the end of the beginning?Nat. Rev. Mol. Cell Biol. 2:307-314. [ Links ]
Guillot-Ortiz, D. and Meer, P. V. D. 2004. Agave americana var. oaxacensisand the icono of Valentini (1719). Bot. Complut. 28:101-103. [ Links ]
Instituto Nacional de Estadística, Geografía e Informática (INEGI). 2005. Principales resultados por localidad. II conteo de población y vivienda. World wide Web Electrónica publicación. http://www.inegi.gob.mx/est/contenidos/esmand/conteo2005/iter2005/selentcampo.aspx. [ Links ]
Madrigal L. R.; Pineda, F. E. and Rodríguez de la O, J. L. 1990. Agave. In: handbook of plant cell culture. Ammirato, P. V.; Evans, D. A.; Sharp, W. R. and Bajaj, Y. P. S. (Eds.) McGraw-Hill Publishing Company. New York, USA. (5):206- 227. [ Links ]
Murashige, T. and Skoog, F. 1962. A revised médium for rapid growth and bioassays with Tobacco Tissue cultures. Physiol. Plant 15:473- 497. [ Links ]
Pierick, R. L. M. 1990. Cultivo in vitro de plantas superiores. Ed. Mundi-Prensa. Madrid. 325 p. [ Links ]
Papaphotiou, M.; Hatzilazarou, S.; Syros, T.; Economou, A. and Sovatzoglou, G. 2003. Acclimatization of Callistemon sp. microplants in fog as influenced by shading. Acta Hort. 616:151-155. [ Links ]
Pospíšilová, J., Haisel, D., Synková, H., Catsky, J., Wilhelmová, N., Plzáková, S., Procházková, D., and Srámek, F. 2000. Photosynthetic pigments and gas exchange during ex vitro acclimation of tobacco plants as affected by CO2 supply and abscisic acid. Plant Cell Tissue Organ Cult. 61:125-133. [ Links ]
Pospíšilová, J.; Synková, H.; Haisel, D. and Semorádová, S. 2007. Acclimation of plantlets to ex vitro conditions: effects of air humidity, irradiance, CO2 concentration and abscisic acid (a Review). Acta Hort. 748:29-3. [ Links ]
Raven, P. H.; Evert, R. F.and Eichhorn, S. E. 1999. Biology of plants. 6a (Ed). Freedman, W. H. and company worth Publishers. New York, U.S.A 944. [ Links ]
Salazar, E.; González, P. y Hernández, C. 2009. Multiplicación in vitro de agave cocui Trelease a través de yemas axilares. Agron. Trop. 59(2):1-12. [ Links ]
Soto, E. L.; Jasso, M. J.; Vargas, H. J. J.; González, R. H. y Cetina, A. V. M. 2006. Efecto de diferentes dosis de AIB sobre el enraizamiento de Ficus benjamina L. endiferentes épocas del año. Rev. Sociedad, Cultura y Desarrollo Sustentable. 2(3):795-814. [ Links ]
Teixeira da Silva, J. A., Dam, D. T. G. and Tanaka, M. 2005. In vitro acclimatización of banana and Cymbidium. International J. Bot. 1(1):41-49. [ Links ]
Valenzuela, Z. A. G. 2003. El Agave tequilero, cultivo e industria de México. 3a (Ed.). Mundi-Prensa. México. D. F. 215 p. [ Links ]














