Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de ciencias agrícolas
Print version ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.4 n.spe6 Texcoco Aug./Sep. 2013
Artículos
Dosis de pectimorf® para enraizamiento de esquejes de guayaba var. Enana Roja Cubana*
Pectimorf® dose for rooting from cuttings of guava variety Cuban Red Dwarf
Leudiyanes Ramos Hernández1, Noel Juan Arozarena Daza2, José Lescaille Acosta1, Fidel García Cisneros1, Yonger Tamayo Aguilar1, Ernesto Castañeda Hidalgo3, Salvador Lozano Trejo3 y Gerardo Rodríguez-Ortiz3
1 Departamento Producción de Montaña, Facultad Agroforestal de Montaña, Universidad de Guantánamo, km 6í4, carretera El Salvador, municipio El Salvador, Guantánamo, Cuba. Tel: (0053 21) 29 43 23; 29 41 81. (lescaille@fam.cug.co.cu, yongertamayo@fam.cug.co.cu).
2 Instituto de Investigaciones Fundamentales en Agricultura Tropical "Alejandro de Humboldt", Calle 1 esq. 2; Santiago de las Vegas, Boyeros; Ciudad Habana, Cuba. Tel. (0053 7) 683 00 66 Ext. 139. (daza@inifat.co.cu).
3 Instituto Tecnológico del Valle de Oaxaca. Ex-hacienda de Nazareno, Xoxocotlán, Oaxaca, México. C. P. 71230. Tel. 01(951) 5 17 07 88, (casta_h50@hotmail.com). Autor para correspondencia: lramosh@fam.cug.co.cu.
* Recibido: diciembre de 2012.
Aceptado: abril de 2013.
Resumen
La investigación se desarrolló de 2009 a 2011 en la Unidad Empresarial de Base de Producciones Varias de Guantánamo (UEB-PROVARI) con el objetivo de determinar la dosis óptima de PectiMorf® para el enraizamiento de esquejes de guayaba Enana Roja Cubana. Los esquejes se sometieron a inmersión en una de seis soluciones: 1) 5 mg/L de AIA, 2) agua destilada; cuatro dosis de PectiMorf®, 3) 10, 4) 20, 5) 30 y 6) 40 mg L-1. Transcurridos 60 días se evaluó: supervivencia (%), número de raíces, biomasa radical fresca y seca (g), fracción radical e índice de eficiencia radical (%). El experimento se realizó según un diseño completamente aleatorizado, teniendo una muestra de 10 esquejes por tratamiento. Los datos se sometieron a análisis de varianza y las medias se compararon mediante la prueba de Rangos Múltiples de Duncan (p ≤ 0.05). Se realizó una prueba de F para comparar las respuestas en estacas sometidas a AIA y las sometidas a inmersión en agua. Se compararon las respuestas de las estacas sometidas a solo agua y las tratadas con las dosis de PectiMorf® y para la variable biomasa seca radical se empleó un análisis de regresión simple. Los resultados mostraron que los esquejes a los que se aplicó AIA tuvieron mejor respuesta de enraizado que aquellos a los que se aplicó PectiMorf®, pero este último en cualquiera de sus dosis estudiadas fue capaz de inducir en los esquejes la formación de raíces adventicias, y la mejor respuesta de enraizamiento ocurrió en los esquejes a los que se aplicó 20 mg L-1de PectiMorf®.
Palabras clave: ácido indolacético (AIA), posturas, propagación, raíces.
Abstract
The research was conducted from 2009-2011 in the Business Unit Base of Various Productions Guantanamo (UEB-PROVARI) in order to determine the optimal dose of Pectimorf® for rooting from cuttings of guava Cuban Red Dwarf. The cuttings were subjected to immersion in each of six solutions: 1) 5 mg / L of IAA, 2) distilled water, four doses of Pectimorf®, 3) 10, 4) 20, 5) 30 and 6) 40 mg L-1; after 60 days were evaluated: survival (%), number of roots, fresh and dry root biomass (g), root fraction and radical efficiency index (%). The experiment was conducted as a completely randomized design, with a sample of 10 cuttings per treatment. Data was subjected to analysis of variance and means were compared by Duncan's multi range test (p ≤ 0.05). An F Test was performed to compare the responses on cuttings under AIA and those subjected to water immersion. Responses were compared from cuttings under water and treated only with Pectimorf® doses and for root dry biomass variable was used a simple regression analysis. The results showed that the cuttings to which AIA was applied, had better rooting response than those were Pectimorf® was applied, but the latter in any dose studied was able to induce adventitious root formation in the cuttings and the best response of rooting occurred in cuttings were applied 20 mg L-1 of Pectimorf®.
Key words: indole acetic acid (IAA), seedlings, propagation, roots.
Introducción
La guayaba (Psidium guajava L.) es considerada la fruta más preciada del género Psidium y una de las más valiosas del trópico. Puede consumirse fresca, como materia prima para la elaboración de jugos, conservas y bocadillos (García et al, 2011). Entre los principales países productores figuran la India, Brasil, México, Sudáfrica, Jamaica, Kenya, Cuba, República Dominicana, Puerto Rico, Haití, Colombia, Estados Unidos (Hawai y Florida), Taiwán, Egipto y Filipinas. En Cuba, esta fruta goza de una gran aceptación popular, además forma parte de las nuevas tendencias y estrategias de producción frutícolas nacionales; mediante el establecimiento de áreas puras y Fincas Integrales de Frutales (MINAG, 2009).
En la actualidad las variedades 'N-2', 'N-6', 'E.E.A 1-23' y 'E.E.A 18-40' son las más extendidas a nivel nacional, pero la variedad élite en el sistema de producción es la 'E.E.A 18-40' por su notable estabilidad. Por tal razón el Instituto de Fruticultura Tropical del Ministerio de la Agricultura con el apoyo del Programa Nacional de Agricultura Urbana, patrocinan la creación de viveros e impulsan programas de extensión de sus plantaciones en todo el país (Rodríguez y Sánchez, 2005). La propagación de esta variedad se realiza fundamentalmente de forma vegetativa por dos vías; injertos, método más utilizado tradicionalmente en los viveros cubanos; y el enraizamiento de esquejes, nueva tendencia de producción de posturas (Cao-Van, 1993). Ambas vías de propagación vegetativa permiten mantener las características genéticas de la planta progenitora y transmitirla de generación en generación (Farrés et al., 2009).
La propagación vegetativa mediante enraizamiento de esquejes presenta las ventajas de obtener posturas de alta calidad, con un notable ahorro de tiempo (3.5-6 meses) y recursos humano-financieros; además, se eliminan las labores que requiere la propagación mediante injertos, como es la producción y conducción de patrones (Rodríguez et al., 2001). Pero para lograr una alta eficiencia en el enraizamiento de los esquejes, es necesario aplicar en la base de estos algún producto que contengan como ingredientes activos reguladores del crecimiento de tipo auxinas, ya sea, ácido indolacético (AIA), ácido indolbutírico (IBA) o ácido naftalenacético (ANA) (Domínguez, 2011) y que suelen ser muy costosas y difíciles de conseguir en el sistema de producción cubano (Peña et al., 2005).
De manera que en Cuba la búsqueda de alternativas que permitan la sustitución parcial o total de estos productos importados, es una necesidad imperante en el sistema de producción de posturas. En investigaciones para cumplir este propósito se obtuvo un producto de origen botánico que consiste de una mezcla de oligosacáridos pécticos, al que se dio el nombre de PectiMorf®, con potencialidades reales para este fin.
El PectiMorf® ha mostrado capacidad de inducir la formación de raíces adventicias en peciolos de violeta africana (Saintpaulia ionantha) (Falcón y Cabrera, 2007), esquejes de clavel (Dianthus caryophyllus) (Fajardo et al, 2011) y en plantas de judía o frijol de oro (Phaseolus sp.) (Kollárová et al, 2012). Sin embargo, se requiere determinar la dosis más efectiva de una sustancia promotora del enraizamiento, de acuerdo a la especie, genotipo y características de las estacas. En el caso de guayaba, Ramírez et al. (2003) demostraron que estacas pertenecientes a diversos genotipos tuvieron respuestas diferentes de enraizado. Por lo que la presente investigación se realizó con el obj etivo de determinar la dosis más efectiva de PectiMorf® para el enraizamiento esquejes de guayaba var. Enana Roja Cubana.
Materiales y métodos
Ubicación del experimento
La investigación se llevó a cabo en la Unidad Empresarial de Base de Producciones Varias (UEB-PROVARI) de Guantánamo del Ministerio del Interior, ubicada en la Carretera Guantánamo-Bayate, km 3.5, municipio "El Salvador", provincia de "Guantánamo".
Características y procedencia de los productos utilizados
Ácido indolacético (AIA) (Merck) es una hormona vegetal caracterizada por provocar alargamiento celular. Esta sustancia se puede obtener por dos vías fundamentales, la más común, es la descarboxilación y desaminación del triptófano para formar compuestos secundarios que dan origen a la hormona (Vázquez y Torres, 2006). La empleada en este trabajo tiene calidad de reactivo y fue obtenida por la empresa española PANREAC (2008) con una pureza de 98% del compuesto activo (1H-indol-3-acético).
El PectiMorf® es una mezcla de oligosacáridos de origen péctico con grado de polimerización 7-16, obtenido a partir de materias primas de la industria citrícola, específicamente el ácido péctico (Sigma, pectina cítrica) (Cabrera, 2000; Cid et al., 2006), según metodología establecida y patentada por el laboratorio de Oligosacarinas del Grupo de Productos Bioactivos del Departamento de Fisiología y Bioquímica Vegetal del Instituto Nacional de Ciencias Agrícolas (INCA), La Habana, Cuba (Montes et al., 2000). Este laboratorio se dedica desde 1992 al desarrollo de metodologías para la obtención de oligosacarinas, entre ellas el PectiMorf®, que es un monómero de ácido galacturónico (Merck) y de reconocido efecto estimulador del crecimiento en numerosos cultivos (Nieves et al, 2006 y Costales et al., 2007).
Los esquejes se obtuvieron de árboles de P. guajava L. var. Enana Roja Cubana E.E.A 18-40. Ésta variedad fue obtenida por selección a partir de una población de plantas originadas de semillas resultantes de polinización libre de la variedad Indian Pink en el año 1962, en la antigua Estación Experimental Agronómica de Santiago de las Vegas en La Habana, Cuba; hoy Instituto Nacional de Investigaciones Fundamentales en Agricultura Tropical "Alejandro de Humboldt" (INIFAT). Es un árbol de porte pequeño, que se caracteriza por presentar un follaje de color verde oscuro, sus frutos de diferentes formas y tamaño, pero generalmente son aperados y con pulpa de color roja-rosada. Es una variedad muy prolífica de alto potencial productivo, con un rendimiento de alrededor de las 70 t ha- año-1 cuando las condiciones medioambientales y tecnológicas son adecuadas, y que en condiciones experimentales ha tenido rendimientos de hasta 100 t ha-1 año-1; con rendimientos promedios de 40 t ha-1 año-1 (MINAG, 2011).
Tecnología y métodos de trabajo
El trabajo experimental se repitió en tres ocasiones (campañas) y se desarrolló según las especificaciones y normas establecidas para la propagación por enraizamiento de esquejes establecidas en la guía técnica del cultivo (Peña et al, 2005). Para ello se trabajó bajo un umbráculo que permite la reducción de 50% de la radiación solar incidente y en camas de enraizamiento de 10 m de largo por 1 m de ancho, rellenas con sustrato de arena de 25 cm de profundidad.
Entre los meses de enero - agosto de 2009, se cortaron esquejes de 12 cm en promedio, semileñosos con dos pares de hojas en su parte superior, provenientes de un banco de yemas de tres años de edad cercano al lugar de instalación. El corte de los esquejes se realizó en horas tempranas de la mañana para evitar la rápida oxidación por concentración de fenoles, ya que la influencia de altas temperaturas e intensidad luminosa aumentan la concentración de los mismos en los esquejes, y por tanto puede afectarse la eficiencia del enraizamiento, por provocar modificaciones endógenas del AIA (Piñol et al., 2000).
Las estacas se establecieron en el lecho de enraizamiento y se distribuyeron en arreglo de tres bolillo con una densidad de 100 esquejes m-2. Se aplicaron riegos intermitentes de 15 s cada 7 min, durante todo en día por cuatro semanas mediante un sistema de micro-aspersores de riego localizado, capaz de mantener a los esquejes hidratados y sus hojas turgentes.
La cantidad total de esquejes se separó en seis grupos para introducir su extremo basal, durante 15 min en recipientes que contenían 250 ml de alguna de las diferentes soluciones correspondientes a cada tratamiento. Los seis tratamientos consistieron de: 1) solución con 5 mg l-1 de ácido indolacético (AIA), que fue el tratamiento testigo de producción; 2) agua destilada, al que se denominó testigo absoluto; soluciones de PectiMorf® a diferente concentración; 3) 10 mg l-1; 4) 20 mg l-1; 5) 30 mg l-1; y 6) 40 mg l-1. El pesaje de AIA y PectiMorf® se realizó en una balanza analítica con precisión de 0.1 mg.
Variables
Sesenta días después de establecer las estacas en el sustrato se evaluó: 1) supervivencia (%) que se cuantificó sobre la base de una muestra de 5 0 esquejes por tratamiento y se determinó la proporción de esquejes vivos y muertos cada 15 días; 2) número de raíces (U), al finalizar la fase enraizamiento se tomaron 10 esquejes por tratamiento y se realizó el conteo de las raíces primarias que se formaron en cada esqueje; 3) la biomasa radical fresca y seca (g) que se evaluó al cortar las raíces y éstas se pesaron en la balanza analítica. Para obtener la biomasa seca radical, éstas se colocaron en bolsas de papel para secarlas en estufa de convección a 65 °C durante 72 h y su posterior pesaje; y 4) fracción radical (%), que se evaluó mediante la determinación de la relación porcentual de biomasa seca de las raíces entre la biomasa total del esqueje; para esta determinación se utilizó la siguiente expresión matemática Fr= (Brs/Bst)100, donde Brs= biomasa radical seca, Bst= biomasa seca total = masa radical seca + masa seca de la parte aérea. 5) índice de eficiencia radical (%), que se determinó mediante un ajuste de la fórmula propuesta por Rivera y Fernández (2003), quienes proponen calcular el Índice de eficiencia (IE), a través de la siguiente relación matemática IER= ((Brs (p)- Brs (t))/Brs (t))100, donde Brs(p)= biomasa radical seca de tratamiento tratado con PectiMorf®, Brs(t)= biomasa radical seca del tratamiento testigo.
Diseño experimental y análisis estadístico
El experimento se estableció sobre un diseño completamente aleatorizado. Se tuvieron 5 0 esquejes por tratamiento en cada campaña. Para determinar diferencias entre tratamientos se realizó un análisis de varianza de clasificación simple y la comparación de medias se realizó mediante la prueba de Rangos Múltiples de Duncan (p< 0.05). Con los promedios de las campañas, se empleó una prueba de F para determinar diferencias entre el testigo de producción y el testigo absoluto; las variables número de raíces, biomasa radical fresca y seca se procesaron mediante un análisis de regresión simple. En el análisis se utilizó el paquete estadístico Statistica 6.1 en ambiente Windows.
Resultados y discusión
En el experimento en que se evaluó la formación de raíces adventicias en estacas de guayaba en respuesta a la aplicación de ya sea, PectiMorf® o AIA, se aprecia que los esquejes a los que no se aplicó alguno de los productos citados, estos formaron raíces, lo que sugiere una capacidad intrínseca de los mismos para esta actividad fisiológica (Cuadro 1). Esto es posible debido a que en el esqueje también se encuentran órganos o centros productores de auxina, como son los ápices de las hojas, los tallos y las yemas axilares. La auxina sintetizada en estos centros puede transportarse como "auxina libre" la cual no tiene actividad fisiológica, sino que viaja por los tejidos conductores del esqueje y actúa en los lugares de mayor atención. En este momento se une a otros compuestos y se transforma en "auxina combinada", que es inmóvil y si tiene actividad fisiológica como la formación de callos, iniciación y elongación radical (Overvoorde et al., 2010).

Pero el nivel de respuesta de formación de raíces por los esquejes de guayaba var. Enana Roja Cubana fue bajo, así lo demuestra la variable fracción radical que indica que de la biomasa total del esqueje no tratado, sólo 3.92% correspondió a raíces. Mientras que los esquejes a los que se aplicó AIA sintético, las raíces que formaron fueron más grandes, pues tuvieron hasta 11.05% de la biomasa total, lo cual representa un aumento significativo del rendimiento fisiológico para ésta actividad. La prueba de F realizada muestra que existen diferencias significativas entre todas las variables evaluadas a favor del testigo de producción (AIA, 5 mg L-1), por lo que se reafirma una vez más la necesidad de aplicar AIA para obtener alta eficiencia en el proceso de enraizamiento.
Al res pecto, B alaguera et al. (20 10 ) reconoce n la importancia de la auxina en el desarrollo de las raíces, debido a su influencia en la división celular, alargamiento y diferenciación en el cultivo de Pitaya (Selenicereus megalanthus Haw.). Azcón-Bieto y Talón (2000) estudiaron el proceso de formación de raíces adventicias, y describen que las auxinas indujeron a nivel celular la respuesta de división, alargamiento y diferenciación, por lo que se propone una hipótesis para el mecanismo de acción, que se basa en su influencia en la división celular del cambium, y por otra parte, en la estimulación para la formación de traqueidas por diferenciación de las células del callo, lo cual permite la iniciación y crecimiento de las raíces. Vargas et al. (1999) demostraron que la aplicación exógena de auxinas incrementó la respuesta de formación de raíces adventicias en estacas de icaco. En estudio citado se emplearon diferentes combinaciones de auxinas con las que se pudo lograr que hasta 70% de las estacas formaran raíces.
La aplicación de hormonas como AIA o AIB es un paso importante de la tecnología de propagación por enraizamiento de esquejes actualmente en sistemas intensivos de propagación de plantas (MINAG, 2011), ya que sin ellas no se lograría un adecuado enraizamiento en las estacas de guayaba var. Enana Roja Cubana. La Figura 1 muestra las potencialidades que tiene el PectiMorf® para lograr altos índices de supervivencia, ya que en los diferentes grupos de esquejes sometidos a alguna de las dosis del producto evaluadas más de 80% de las plantas obtenidas sobrevivieron, cantidad superior a 5 6% de plantas sobrevivientes a partir de esquejes que se sometieron al testigo absoluto, y cercanas a 88% de plantas obtenidas a partir de estacas tratadas con el AIA.

Estos resultados demuestran la importancia del PectiMorf® como producto eficiente en el sistema de producción de posturas de guayaba, porque la supervivencia tiene una alta relación con la formación oportuna de raíces y evitar la abscisión de las hojas de los esquejes, y un retraso en este proceso aumentan la posibilidad de la muerte del esqueje.
González et al. (2008) evaluaron la germinación de semillas de soya variedad Incasoy-27, que antes de su siembra se sometieron a diversos tratamientos. Transcurridas 24 h después de la siembra observaron que en grupos de semillas que previamente se mantuvieron en inmersión en una solución de PectiMorf®, mayor porcentaje de éstas germinó en comparación a los grupos de semillas no embebidas en esta sustancia. Las plantas que se obtuvieron de semillas que previamente se trataron con solución, ya sea, 10 ó 100 ppm de PectiMorf®, más de 80% de éstas sobrevivió. También, Izquierdo et al. (2009) demostraron que plantas de plátano clon 'FHIA-18' micropropagadas, las que al inicio de trasplante para su aclimatación se sometieron a inmersión en soluciones con 1 ó 5 mg L-1 de PectiMorf® o se les aplicó solución de esta sustancia mediante aspersión foliar, transcurrida esta fase de aclimatación, 92 y 92.8% de las plantas sobrevivieron, respectivamente, superior a 84% de sobrevivencia de las plantas no tratadas con PectiMorf®).
En la Figura 2 se puede apreciar que los esquejes sometidos a inmersión en solución con 20 mg L-1 de PectiMorf® formaron mayor cantidad de raíces adventicias, que los esquejes no tratados con esta sustancia. Considerando que varios factores (genotipo, condición fisiológica de la estaca, temperatura y humedad relativa ambiental, características del sustrato, etc.) influyen en la respuesta de formación de raíces en estacas, el análisis de regresión mostró que en condiciones ambientales y de material vegetal similares que en este experimento, la respuesta óptima de enraizado de esquejes es cuando estos se someten a tratamiento de inmersión en solución con 23.9 mg L-1 de PectiMorf®, con la que formarían 4.15 raíces adventicias en promedio por esqueje. La dosis de 20 mg L-1 también resultó la óptima en su efecto para las variables biomasa radical fresca y seca (Figura 3).
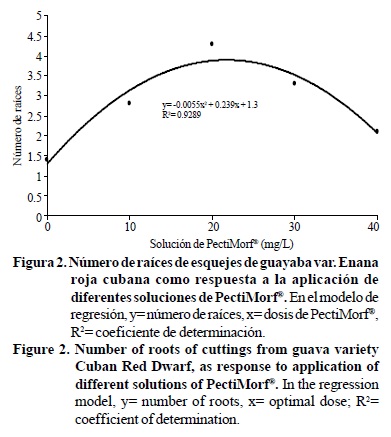

El coeficiente de determinación R2 permite asegurar que, manteniendo constantes otras condiciones en que se realizó el experimento, la ecuación representada en la figura explica 92.8% de los resultados que es aceptable desde el punto de vista matemático para variables biológicas (Di Rienzo et al, 2005). Al someter los esquejes a dosis superiores a 20 mg L-1, ocurrió la inhibición progresiva del número de raíces que formaron los esquejes, pues aquellos que recibieron las dosis de 30 y 40 mg L-1, formaron sólo 23.25 y 51.16% de la cantidad de raíces que formaron los esquejes sometidos al mejor tratamiento. Éstas respuestas divididas en dos tendencias ~una de ascenso y otra de descenso-, se ha presentado en otras investigaciones donde se han estudiado dosis de PectiMorf®, pero para cada especie vegetal esta respuesta cambia el punto máximo de expresión de los mejores resultados. Por ejemplo, Cid et al. (2006) encontraron que distintas combinaciones de AIA, GA3 y PectiMorf® generaron diferentes tendencias (aumento y disminución) en variables fisiológicas medidas en semillas artificiales de caña de azúcar.
El punto máximo de inflexión ocurrió en la combinación de 2 mg L-1 de AG3 y 10 mg L-1 de PectiMorf®, mientras que las demás combinaciones quedaron por debajo en dos sentidos. Por otro lado, Benítez et al. (2008) demostraron que la aspersión foliar de soluciones con, ya sea, 2, 10 y 20 mg L-1 de PectiMorf®, a plantas de palma areca (Dypsis lutescens H. Wendel) a los seis meses después de la emergencia, aquellas plantas a las que se aplicó la dosis de 10 mg L-1 mostraron el mayor crecimiento en altura y área foliar.
Es importante destacar que todos los esquejes tratados mostraron mejor respuesta que aquellos esquejes del grupo testigo absoluto, lo que destaca una acción benéfica del producto, aunque existan dos tendencias en el resultado; la dosis de 20 mg L-1 de PectiMorf® resulta ser la más adecuada en términos de respuesta vegetal, que coincide con resultados obtenidos por Ramírez et al. (2003) en el enraizamiento de esquejes de guayaba var. Enana Roja Cubana.
Debido a que el PectiMorf® consiste de una mezcla de oligosacáridos pécticos con grado de polimerización 7-16 y un monómero de ácido galacturónico, constituyendo una mezcla compleja, Mederos y Hormasa (2008) le atribuyen alta capacidad para causar diversos efectos de crecimiento, de defensa u hormonal, aunque no hay referencias que describan los procesos fisiológicos que se estimulan.
El análisis de regresión muestra que las estacas que recibieran entre 21.55 y 22.17 mg L-1 de PectiMorf®, mostrarían las máximas respuestas de biomasa radical fresca y seca, 0.76 y 0.232 g, respectivamente; las cuales están en estrecha relación con la dosis aplicada; cantidades que se aproximan mucho a los 0.75 y 0.231 de biomasa radical fresca y seca que tuvieron los esquejes a los que se aplicaron 20 mg L-1 de PectiMorf®. El coeficiente de determinación de 0.956 para ambas curvas, permiten asegurar que considerando similares las condiciones ambientales y de material vegetal en las que se realizó el experimento, el modelo obtenido es altamente confiable en su capacidad para predecir la acumulación de materia fresca y seca en respuesta a la dosis de PectiMorf®. Cabe puntualizar que a medida que se aumentó la dosis después del máximo punto de inflexión los esquejes formaron menos biomasa radical fresca y seca.
Los resultados del presente trabajo aportan evidencia de que el PectiMorf® podría ser una alternativa viable para utilizarse como producto promotor del enraizado de esquejes de guayaba, similares a los descritos por Fajardo et al. (2011) en el enraizamiento de Dianthus caryophyllus. Aunque también hay referencias del efecto de esta sustancia para estimular otras respuestas en las plantas.
Camejo et al. (2012), demostraron aumento de la actividad enzimática en raíces de alfalfa tratadas con PectiMorf®. Es importante señalar que el PectiMorf® está compuesto por una mezcla de oligogaracturónidos y que estas son moléculas bioactivas que resultan de la degradación de los polisacáridos pécticos de la pared celular de las plantas o proveniente de algunos microorganismos que invaden los tejidos vegetales, su relación más estrecha con el enraizamiento está explicada en los resultados de Carpita y Gibeault (1993), quienes aseguran que los polisacáridos pécticos, son moléculas superiores que están relacionadas con los xiloglucanos que sirven como conectores o cubridores de espacios de las microfibrillas de celulosa de la pared celular, una vez que la célula realiza la diferenciación y el alargamiento celular, procesos que ocurren en la iniciación radial.
Los resultados obtenidos demuestran que la dosis de 20 mg L-1 de PectiMorf® es la dosis que induce la mejor respuesta del material vegetal evaluado; sin embargo, la fracción radical muestra otro tipo de tendencia, ya que existe diferencia estadística entre las aplicaciones de PectiMorf® y el testigo absoluto (sin aplicación), pero no existe diferencias estadísticas de efecto entre las dosis de 10, 20, 30 y 40 mg L-1 de PectiMorf®; lo cual implica que existe una estrecha relación entre la aplicación del producto en éstas dosis y la cantidad de raíces que puede producir en correspondencia con el peso total del esqueje.
Otra observación importante es que las aplicación de PectiMorf® no difieren estadísticamente con la aplicación del AIA, en su efecto de estímulo de la formación de raíces. Respecto a la variable índice de eficiencia radical, que expresa la eficiencia de cada tratamiento con respecto a los testigos estudiados, muestra que todas las dosis de PectiMorf® estudiadas fueron más eficientes que el testigo absoluto, o sea que la aplicación de este producto siempre fue más beneficiosa que no aplicar y este efecto ocurrió para todas la dosis estudiadas. La mejor respuesta se obtuvo al tratar los esquejes con la dosis de 20 mg L-1, en los que se obtuvo un índice de eficiencia radical de 187.56%.
Sin embargo, a pesar de que el PectiMorf® es una alternativa viable, no es más eficiente que aplicar la hormona AIA, en la base de las estacas. En el Cuadro 2 se muestra que para ninguna de las dosis estudiadas el índice de eficiencia radical llega a ser positivo, aunque la dosis 20 mg L-1 (30.19%) de PectiMorf® es la que más se aproxima al efecto del AIA.
Estos resultados muestran la necesidad de seguir trabajando para mejorar el efecto del PectiMorf® como producto promotor del enraizado de estacas, así lo reconocen Ramírez et al. (2003) en el cultivo de la guayaba, Falcón y Cabrera (2007) en el enraizamiento de peciolos de violeta africana (Saintpaulia ionantha), Hernández et al. (2007) sobre Anthurium andreanum y se ajusta a las recomendaciones de Cabrera (2000) y Mederos y Hormasa (2008).
Conclusión
La mejor dosis de PectiMorf® para el enraizamiento de esquejes de guayaba es 20 mg L-1, ya que mostró los mejores resultados en las variables evaluadas y se recomienda la aplicación de la misma para la producción de posturas de guayaba var. Enana Roja Cubana, aunque hay que trabajar mezclas con otros productos que puedan igualar o mejorar la respuesta del AIA.
Literatura citada
Azcón-Bieto, J. y Talón, M. 2000. Fundamentos de fisiología vegetal. Editorial Universidad de Barcelona. España. 305-324 pp. [ Links ]
Balaguera, L. H.; Morales, E. I.; Almanza, M, P. J. y Balaguera, W. A. 2010. El tamaño del cladodio y los niveles de auxina influyen en la propagación asexual de pitaya (Selenicereus megalanthus Haw.). Rev. Colombiana de Ciencias Hortícolas. 4(1):34-42. [ Links ]
Benítez, B.; Núñez, M. y Yong, A. 2008. Crecimiento de plantas de palma areca (Dypsis lutescens H. Wendel) con aspersiones foliares de una mezcla de oligogalacturónidos. Cultivos Tropicales. 29(3):81-85. [ Links ]
Cabrera, J. C. 2000. Obtención de (1-4)-a-D-oligogalacturónidos bioactivos a partir de los subproductos de la industria citrícola. Universidad de La Habana, Cuba. [ Links ]
Camejo, D.; Martí, M. C.; Olmos, E.; Torres, W.; Sevilla, F. and Jiménez, A. 2012. Oligogalacturonides stimulate antioxidant system in alfalfa roots. Biología Plantarum 56(3):37-544. [ Links ]
Cao-Van, P. 1993. Multiplication du goyavier a la Martinique. CIRAD-IRFA. 1-2 pp. [ Links ]
Carpita, N. C. and Gibeaut, D. M. 1993. Structural models of primary cell walls in flowering plants; consistency of molecular structure with the physical properties of the walls during growth. The Plant Journal. 3(1):1-30. [ Links ]
Cid, M.; González, L.; Lezcano, Y. y Nieves, N. 2006. Influencia del PectiMorf* sobre la calidad de la semilla artificial de caña de azúcar (Saccharum sp.). Cultivos Tropicales. 27(1):31-34. [ Links ]
Costales, D.; Martínez, L. y Núñez, M. 2007. Efecto del tratamiento de las semillas con una mezcla de oligogaracturónidos sobre el crecimiento de plántulas de tomate (Solanum lycopersium Mill). Cultivos Tropicales. 28(1):85-91. [ Links ]
Di Rienzo, J. A.; Casanoves, F.; González, L. A.; Tablada, E. M.; Díaz, M.; Robledo, C. W. y Balzarini, M. G. 2005. Estadística para las Ciencias Agropecuarias. 6a Edición. Córdova, Argentina.345 p. [ Links ]
Domínguez, P. L. 2011. Propagación in-vitro de selecciones de guayabo (Psidium guajava, L.) y su respuesta a hormonas en periodo de subcultivo. Tesis de Maestría en Ciencias. Instituto de Enseñanza de Investigaciones en Ciencias Agrícolas, Campus Montecillo. Texcoco, Estado de México. 65 p. [ Links ]
Fajardo, R. L.; Blanco, B. Y.; Borges, G. M.; Fonseca, C. D.; Hernández, J. Y. y Arceo, E. L. 2011. Efecto de diferentes concentraciones de Pectimorf en el enraizamiento y aclimatización de Dianthus caryophyllus. Publicaciones Científicas. Revista Ciencias. Com. (consultado septiembre, 2011).
Falcón, A. B. y Cabrera, J. C. 2007. Actividad enraizadora de una mezcla de oligogalacturónidos en pecíolos de violeta africana (Saintpaulia ionantha). Cultivos Tropicales 28(2):87-90. [ Links ]
Farrés, E.; Placeres, G. J.; Rodríguez, D. A.; Peña, G. O. y Mulen, P. L. 2009. Manual sobre la propagación de frutales tropicales. Instituto de Investigaciones en Fruticultura Tropical (IIFT). Ciudad de la Habana, Cuba. 23 p. [ Links ]
García, M. C.; Cury, R. K. y Dussán, S. S. 2011. Comportamiento poscosecha y evaluación de calidad de fruta fresca de guayaba en diferentes condiciones de almacenamiento. Revista Facultad Nacional de Agronomía-Medellín. 64(2):6207-6212. [ Links ]
González, Y.; Reynaldo, I. y Utria, E. 2008. Influencia del biorregulador Pectimorf en la germinación y el enraizamiento de semillas de soya variedad INCASOY-27. In: memorias en CD-ROM del XVI Congreso Científico Internacional del Instituto Nacional de Ciencias agrícolas (INCA). Instituto Nacional de Ciencias Agrícolas. La Habana, Cuba. [ Links ]
Hernández, B.; Benítez, B.; Soto, F. y Dominí, M. 2007. Efecto de una mezcla de oligogaracturónidos en el crecimiento y desarrollo del cultivo de Anthurium andreanum. Cultivos Tropicales. 28(4):83-86. [ Links ]
Izquierdo, H.; González, M C.; Núñez M.; Proenza, R. y Cabrera, J. C. 2009. Influencia de un oligogalacturónido en la aclimatización de vitroplantas de banano (musa spp.) del clon 'FHIA-18' (AAAB). Cultivos Tropicales. 30(1):37-42. [ Links ]
Kollárová, K.; Zelko, I.; Henselová, M.; Capek, P. and Liskova1, D. 2012. Growth and anatomical parameters of adventitious roots formed on mung bean hypocotyls are correlated with galactoglucomannan oligosaccharides structure. The Scientific World Journal 1:1-7. [ Links ]
Mederos, Y. y Hormasa, J. 2008. Consideraciones generales en la obtención caracterización e identificación de los oligogaracturónidos. Revisión bibliográfica. Cultivos Tropicales. 29 (1):83-90. [ Links ]
Ministerio de la Agricultura (MINAG). 2009. Manual técnico para las fincas integrales de frutales en Cuba. Instituto de Investigaciones en Fruticultura Tropical. Ciudad de la Habana, Cuba. 13 p. [ Links ]
Ministerio de la Agricultura (MINAG). 2011. Instructivo técnico del cultivo de la guayaba var. Enana Roja Cubana. Instituto de Investigaciones en Fruticultura Tropical y Asociación Cubana de TécnicosAgrícolas y Forestales. Editorial: PALMA-PNUD. Primara edición. Ciudad de la Habana, Cuba. 44 p. [ Links ]
Montes, S.; Aldaz, J. P.; Ceballos, M.; Cabrera, J. C. y López, M. 2000. Uso del biorregulador Pectimorf en la propagación acelerada del Anthurium cubense. Cultivos Tropicales. 21(3):29-31. [ Links ]
Nieves, N.; Poblete, A.; Cid, M.; Lezcano, Y.; González-Olmedo, J. L. y Cabrera, J. C. 2006 Evaluación del Pectimorf como complemento del 2,4-D en el proceso de embriogénesis somática de caña de azúcar (Saccharum spp.). Cultivos Tropicales. 27(1):25-30. [ Links ]
Overvoorde, P.; Fukaki, H. and Beeckman, T. 2010. Auxin Control of root development. Cold Spring Harb Perspect Biol. [ Links ]
PANREAC. 2008. Tarifa 2008 reactivos y medios de cultivo. Reactivo Acido 1H-indol-3-acético, al 98%. CE: 201-748-2. Lote- 24518RBS. Castellar del Valle (Barcelona) España. [ Links ]
Peña, G. O.; Soúrd, M. D.; Farrés, E. A.; Rodríguez, D. A. y Placeres, G. J. 2005. Propagación del guayabo. In: memorias del Curso Internacional en Fruticultura Tropical. Instituto Internacional en Fruticultura Tropical. [ Links ]
Piñol, M. T.; Palazón, J. y Cusidó, R. M. 2000. Introducción al metabolismo secundario. In: Azcón-Bieto, J. y Talón, M. Fundamentos de fisiología vegetal. McGraw-Hill. Barcelona, España. 261-283 pp. [ Links ]
Ramírez, A.; Cruz, N. y Franchialfaro, O. 2003. Uso de bioestimuladores en la producción de guayaba (Psidium guajava L.) mediante el enraizamiento de esquejes. Cultivo Tropicales. 24(1):59-63. [ Links ]
Rivera, R. y Fernández, K. 2003. Bases científico-técnicas para el manejo de los sistemas agrícolas micorrizados eficientemente. In: Rivera, R. y Fernández, K. (Eds.). Manejo efectivo de la simbiosis micorrízica, una vía hacia la agricultura sostenible. Estudio de caso: el Caribe. INCA. La Habana. 166 p. [ Links ]
Rodríguez, A. y Sánchez, P. 2005. Especies de frutales cultivadas en Cuba en la Agricultura Urbana. Tercera edición (aumentada y corregida). INIFAT. La Habana. Cuba. 42-43 p. [ Links ]
Rodríguez, N.; Mas, O.; González, G.; Sánchez, P. y Santos, M. 2001. Inducción del enraizamiento en esquejes herbáceos de Psidium guajava L. Instituto de Investigaciones en Fruticultura Tropical. Boletín de Reseñas. Serie Relafrut 1:17-19. [ Links ]
Vargas, G.; Arellano, G. y Soto, R. 1999. Enraizamiento de estacas de icaco sometidas a aplicaciones de auxinas. Bioagro. 11(3):103-108. [ Links ]
Vázquez, E. y Torres, S. 2006. Fisiología vegetal 2da parte. Editorial Félix Varela. La Habana, Cuba. 315 p. [ Links ]














