Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias agrícolas
versión impresa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.4 no.5 Texcoco jun./ago. 2013
Artículos
Evaluación de resistencia a Phytophthora infestans en poblaciones silvestres de Solanum lycopersicum var. cerasiforme*
Evaluation of the resistance against Phytophthora infestans of wild populations of Solanum lycopersicum var. cerasiforme
Luis Javier Arellano Rodríguez1§, Eduardo Rodríguez Guzmán1, José Ron Parra1, José Luis Martínez Ramírez1, Héctor Lozoya Saldaña2, José Sánchez Martínez1 y Rogelio Lépiz Ildefonso1
1 Departamento de Producción Agrícola, CUCBA, Universidad de Guadalajara. Las Agujas Zapopan, Jalisco. México. A. P. 129. Tel. 0133 37 77 11 50. Ext. 33190. § Autor para correspondencia: larella@cucba.udg.mx.
2 Departamento de Fitotecnia, Universidad Autónoma de Chapingo, México.
* Recibido: septiembre de 2012
Aceptado: mayo de 2013
Resumen
El tizón tardío causado por Phytophthora infestans (Mont.) De Bary ha causado severas pérdidas en la producción de jitomate (Solanum lycopersicum) en zonas productoras como Sinaloa, donde se han reportado pérdidas hasta de 100%. Las especies silvestres son fuentes de resistencia a enfermedades. En diferentes regiones de México, como las planicies costeras del Golfo y del Pacífico y en valles intermontanos en altitudes cercanas a los 2 000 msnm se colectaron poblaciones silvestres de Solanum lycopersicum var. cerasiforme, por lo que durante los ciclos agrícolas 2008, 2009 y 2010 se evaluaron 19 poblaciones de esta variedad para determinar si presentan resistencia al patógeno. Se utilizó como testigo susceptible la variedad Río Grande y como resistente la accesión LA2533 (S. pimpinellifolium). Se estimó la severidad de la enfermedad a través de las variables: área bajo la curva de desarrollo de la enfermedad (AUDPC), AUDPC relativo, tiempo de aparición de síntomas (TAS), tasa de desarrollo de la enfermedad (bi) y evaluación final del daño (EF). Los resultados mostraron variación en las poblaciones silvestres, desde susceptibilidad hasta resistencia a la enfermedad. La respuesta de resistencia al patógeno se mostró consistente a través de años de evaluación en donde las poblaciones V115, 319, 327 y 330 se destacaron por presentar valores más bajos de AUDPC, AUDPCr, bi y EF similares a LA2533 y los síntomas aparecieron 10 días después de las demás poblaciones (TAS más largos). El testigo Río Grande manifestó daños considerables en todas las evaluaciones, que alcanzaron inclusive 100% de daño en la planta. Éstas cuatro poblaciones se constituyen como fuentes de resistencia a tizón tardío en programas de mejoramiento genético.
Palabras clave: jitomate, especies silvestres, resistencia a enfermedades, tizón tardío.
Abstract
Late blight caused by Phytophthora infestans (Mont.) de Bary has caused severe losses in the production of tomato (Solanum lycopersicum) in growing areas such as Sinaloa, where losses of up to 100% have been reported. Wild species are a source of disease resistance. Wild populations of Solanum lycopersicum var. cerasiformis were collected in different regions of Mexico, such as the Gulf and Pacific coastal plains, and in intermountain valleys at altitudes around 2000 masl. During the growing seasons of 2008, 2009 and 2010, 19 populations of this variety were evaluated to determine ifthey have resistance against the pathogen. The Rio Grande variety was used as susceptible control and the LA2533 accession (S. pimpinellifolium) as resistant. We estimated the severity ofthe disease through the variables: area under the disease progress curve (AUDPC), relative AUDPC, time of onset of symptoms (TAS), rate of disease development (bi) and final evaluation of damage (FE). The results showed variation in the wild populations, from susceptibility to disease resistance. The pathogen resistance response was consistent across the assessment years in which the populations V115, 319, 327 and 330 were noteworthy for presenting the lowest values of AUDPC, AUDPCr, bi and FE, similar to those of LA2533; also, the symptoms appeared 10 days later than in all other populations (longer TAS). The Río Grande control showed considerable damage in all evaluations, up to 100% damage to the plant. These four populations are established as sources of late blight resistance in breeding programs.
Keywords: late blight, resistance to disease, tomato, wild species.
Introducción
El jitomate (Solanum lycopersicum Mill.) es una de las hortalizas más cultivadas en el mundo. En México es la segunda especie hortícola con mayor superficie cultivada y la principal por su producción, en la década 2000-2009 ocupó el décimo lugar en el mundo en cuanto a producción, con 2, 774, 214 t (FAOSTAST, 2011). Sin embargo, las plagas y enfermedades merman la producción y elevan los costos del mismo y una de las enfermedades más importantes la constituye el tizón tardío. Para su control a nivel mundial anualmente se invierte de uno a tres billones de dólares (Grünwald et al, 2000; Judelson y Blanco, 2005; Barbosa et al, 2008).
El agente causal, Phytophthora infestans (Mont.) de Bary adquirió la habilidad de infectar las plantas de manera independiente de los hongos verdaderos (Irzhansky y Cohen, 2006). Los períodos húmedos y nublados con temperaturas frescas son propicios para el desarrollo de esta enfermedad, la infección por el patógeno es óptima en condiciones de alta humedad (80 a 100%) y bajas temperaturas (18 a 22 °C) (Henfling, 1987; Rick y Chetelat, 1995); por lo que se producen graves epifitias en zonas con clima fresco y húmedo, ocasionando pérdidas hasta de 100% (Fontem et al, 2005).
El patógeno se reproduce tanto asexual como sexualmente, es un organismo que requiere dos tipos de apareamiento denominados A1 y A2 (Tooley et al, 1985; Goodwin et al., 1998). La aparición de ambos tipos de apareamiento fuera de México ha contribuido a la rápida dispersión y presencia de razas más virulentas de P. infestans en el mundo (Niederhauser, 1991; Spielman et al, 1991; Fry et al, 1993; Goodwin et al, 1994; Bautista et al, 1997; Goodwin y Drenth, 1997; Páez et al, 2005).
En Jalisco, México, cuando se presentan las condiciones favorables para la expresión del patógeno, se impacta fuertemente la producción de jitomate en las principales áreas productoras, dado que 84% de los productores utiliza el sistema a campo abierto y 8% bajo invernadero (Cih et al., 2011). Reportes de técnicos y productores señalan que debido a la reducida o nula disponibilidad de variedades resistentes a P. infestans, para su control dependen del uso de fungicidas elevando los costos de producción del cultivo, por lo que la resistencia genética en plantas representa una alternativa viable (Brouwer y St. Clair, 2004).
De acuerdo a reportes sobre resistencia a P. infestans en especies silvestres de jitomate, actualmente se han identificado cinco genes en S. pimpinellifolium que condicionan la resistencia a razas especificas contra P. infestans, denominados Ph7, Ph2, Ph3, Ph4 y Ph5 (Moreau et al, 1998; Chunwongse et al, 1998; Kole et al, 2006; Foolad et al, 2008). En el caso de P. infestans, esta resistencia cualitativa no es durable debido a la rápida evolución de razas compatibles del patógeno. Y recientemente se ha señalado en Solanum habrochaites la existencia de resistencia en la accesion LA1033 (Scott y Gardner, 2007) y LA1777 (Li et al, 2011); en tanto que en L. pennellii se encontró resistencia cuantitativa (Smart et al, 2007).
En México, es muy poca la información científica que se puede encontrar respecto a generación o descubrimiento de variedades resistentes de jitomate. Sin embargo, existe un gran potencial en S. lycopersicum var. cerasiforme, cuya dispersión se da mayormente en altitudes entre 0 y 1 200 m (Sánchez et al., 2006; Álvarez et al., 2009). Reportes de investigación y publicaciones formales hechas en México señalan que este tomate silvestre se distribuye desde Sinaloa hasta la Península de Yucatán (Chávez et al, 2011). Por lo anterior, el objetivo de esta investigación fue identificar fuentes de resistencia en condiciones naturales aP infestans en poblaciones de Solanum lycopersicum var. cerasiforme colectadas en México.
Materiales y métodos
Material vegetal
Se incluyeron 19 poblaciones silvestres de S. lycopersicum var. cerasiforme colectadas en México entre los años 20022006 (Cuadro 1). Durante el ciclo primavera-verano de los años 2008, 2009 y 2010 se evaluaron estas poblaciones, y durante el primer año se compararon con la variedad de polinización libre Río Grande, como testigo comercial susceptible. En las evaluaciones realizadas durante 2009 y 2010 se adicionó la accesión LA2533 de la especie S. pimpinellifolium con resistencia a P. infestans razas 0 y 1, proporcionada por Tomato Genetics Resource Center (TGRC) de la Universidad de California, Davis (Chetelat y Rick, 1998).
Ubicación
Los experimentos se llevaron a cabo en el Campo Experimental del Centro Universitario de Ciencias Biológicas y Agropecuarias (CUCBA) de la Universidad de Guadalajara, ubicado en Nextipac, Zapopan, Jalisco, México, a 20° 44' 42.5" latitud norte y 103° 30' 52.5" longitud oeste, con una altitud de 1 650 m, y con un clima templado semiseco, con temperatura media anual de 23.5 °C y una precipitación media anual de 906 milímetros con régimen de lluvia en los meses de junio a octubre.
Experimentos
La producción de plántula se realizó bajo invernadero, depositando las semillas en charolas de poliestireno de 200 cavidades rellenas con una mezcla de peatmoss (Sphagnum) y fibra de coco 50-50% vol/vol. Al inicio se regó con agua simple (una semana) y después de emergidas las plántulas se adicionó al riego la solución nutritiva Universal de Steiner (Steiner, 1984) a 0.3 atm de concentración hasta su trasplante, aproximadamente a los 35 a 40 días. Distribuyéndose bajo un diseño de bloques completos al azar, con dos repeticiones. La parcela experimental fue de 10 plantas separadas a 0.4 m en línea y surcos a 1 m de ancho. Se aplicó fertirriego (riego por goteo), con una solución nutritiva de Steiner a 0.72 atm, desde el trasplante hasta cosecha, complementado con aspersiones de micronutrientes (Fertilizante foliar Gro-Green 25 ml L-1) rociados semanalmente. No se hicieron aplicaciones de fungicidas.
Variables medidas
En los tres ciclos de evaluación el tizón tardío se presentó a finales de agosto y durante los meses de septiembre y octubre en donde predominaron temperaturas mínimas durante 2008 de 16.5, 15.6 y 13.6 °C, y humedades relativas a 83, 81 y 74%, respectivamente. Para 2009 se presentaron temperaturas mínimas de 15.7, 14.6 y 12.7 ° C, y humedades relativas de 77, 84 y 81% respectivamente. En 2010 durante éstos meses se registraron temperaturas mínimas de 17.1, 14 y 9.1 °C y lecturas de humedad relativa de 84, 86 y 60%.
En todas las plantas de cada parcela, cada siete días se tomaron lecturas visuales del porcentaje de severidad de tizón tardío de acuerdo a la escala del Centro Internacional de la Papa (Henfling, 1987): 1=0%, 2= 0-5%, 3=5-15%, 4= 15-35%, 5=45-65%, 6= 65-85%, 7= 85-95%, 8= 95-100%, y 9= 100%. Para cada ciclo la evaluación final del daño al follaje se hizo cuando la variedad Río Grande alcanzó 95% del área foliar dañada por P. infestans (Frías et al., 2001). Con el fin de comparar el comportamiento de cada material, con los datos obtenidos cada semana se calculó el área bajo la curva de desarrollo de la enfermedad (AUPDC por sus siglas en inglés) utilizando la fórmula propuesta por Shaner y Finney (1977) aplicando el método de integración trapezoidal (Campbell y Madden, 1990) y usando la ecuación:
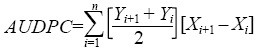
Donde: n es el número de mediciones de la enfermedad en el tiempo; el término (Yi y Yi+1) / 2 es el punto medio entre (Y i y Yi+1) que representa la cantidad de enfermedad en un intervalo de tiempo, correspondiente a la altura de cada rectángulo; y el término (Xi+1 - Xi) representa el tiempo (d) entre dos evaluaciones de la enfermedad e indica la anchura de cada rectángulo.
Además se estimó la variable área relativa bajo la curva de desarrollo de la enfermedad (rAUDPC), para lo cual se dividió el valor promedio deAUDPC de cada genotipo por el máximo potencial deAUDPC de cada experimento (el valor registrado para el genotipo testigo susceptible); el valor se calculó como: número de días entre la última lectura menos número de días de la primera lectura por 100 (Fry, 1978) de tal manera que su valor no tiene unidades al ser un valor estandarizado.
A la par se incluyeron otras variables indicadoras de resistencia: a) tiempo de aparición de síntomas (TAS), número de días desde el establecimiento del cultivo hasta la aparición de los primeros síntomas; b) tasa de desarrollo de la enfermedad, definida por el coeficiente de regresión (bi) del porcentaje del follaje dañado observado en cada lectura sobre el número de días transcurridos en cada lectura por medio de un análisis de regresión lineal simple (Fry, 1978); y c) evaluación final (EF) de la enfermedad o porcentaje de daño cuando ya no se observó progreso de la enfermedad (Zúñiga et al, 2000).
Análisis de datos
En la variable AUDPC se realizaron pruebas de normalidad utilizando el procedimiento Univariate de SAS 8.1 y la opción NORMAL que usa la prueba Shapiro-Wilks, y cuando los análisis de normalidad de los datos fueron significativos, se procedió a realizar una serie de transformaciones en los datos de AUDPC, en donde la raíz cuadrada de AUDPC+1 fue la que logró que los valores fueran normales. Se realizaron análisis de varianza por experimento (año) de los tres años para todas las variables estimadas. Los valores promedio de cada variable observada se compararon mediante una prueba múltiple de medias de Tukey al 5% de probabilidad.
Adicionalmente se realizó un análisis de correlación utilizando la prueba de Spearman entre las variables estimadas para estimar su asociación a la variable AUDPC como indicadoras del grado de resistencia de campo. Se utilizó el paquete estadístico SAS versión 8.1 (SAS Institute, 1999).
Resultados y discusión
La parcela experimental se ubica aproximadamente a 120 km de la zona papera de Tapalpa, Jalisco, considerada como fuente de inoculo primario de P.infestans. En este lugar, las condiciones climáticas favorecen su reproducción vegetal o la reproducción sexual, lo que permite incrementar la variabilidad del patógeno y su patogenicidad (Jaime et al, 2001). El micelio presente en los tubérculos infectados bajo condiciones ambientales favorables, produce esporangios, los que son transportados por la neblina, las nubes y el viento a distancias considerables (CIP, 2002). Y a la par, durante el desarrollo de las evaluaciones se presentaron condiciones favorables para la expresión del patógeno, ambiente húmedo (> 80%) y baja temperatura durante la noche y primeras horas del día (12 a 16 °C).
Se encontraron diferencias significativas (p< 0.01) entre genotipos sometidos a infecciones naturales de Phytophthora infestans en los tres años de evaluación para las variable AUDPC, rAUDPC, TAS, bi y EF (Cuadro 2 y 3).
Las poblaciones V115, 319 y 327 demostraron los valores más bajos de AUDPC, seguidas por el testigo LA2533 en los dos años en que se incluyó, seguida de la población 330 (Cuadro 4). El testigo comercial Río Grande en los tres años de evaluación mostró alta susceptibilidad al patógeno y como lo consigna CIP (2010), el AUDPC es una variable que calcula el área bajo la curva de infección real. Cuanto más alto es el AUDPC, más susceptible es la variedad.
Las demás poblaciones no fueron consistentes, ya que presentaron variación entre los ciclos evaluados con valores de AUDPC inferiores a la variedad Río Grande. El genotipo 114, presentó valores bajos en la variable AUDPC en 2008, valores altos en 2009 y valores intermedios en 2010 (Cuadro 4). Como lo indican Pérez et al. (2001) la resistencia y la variabilidad expresada en la resistencia sugieren también la presencia de genes mayores. Esta variación de la severidad en la infección de tizón tardío entre individuos es típica de las especies silvestres, independientemente de su nivel de resistencia al patógeno (Barbosa et al, 2008).
Los valores de AUDPC, rAUDPC, TAS, bi y EF, estimados en las 19 poblaciones silvestres y en los dos testigos (Cuadro 4), claramente permiten separar los grupos con resistencia, tolerancia y susceptibilidad. Las colectasV115, 319, 327 y 330, se manifestaron como poblaciones de alta resistencia por las calificaciones inferiores obtenidas en estas variables, comparadas con el testigo. Y como se observa en el Cuadro 1, estas poblaciones fueron colectadas en Veracruz y Nayarit; en donde el clima predominante es de tipo cálido húmedo, con condiciones climáticas favorables para qué tizón tardío se presente; originando que las poblaciones silvestres convivan con el patógeno y desarrollen genes de resistencia para lograr sobrevivir (Goodwin et al, 1994; Grünwald et al, 2000).
Y en el caso específico de las poblaciones que mostraron mayor susceptibilidad o resistencia baja, el clima predominante en las áreas donde fueron colectadas es de tipo seco y semiseco, lo que posiblemente genere que el patógeno tenga un comportamiento irregular durante los ciclos agrícolas, no permitiendo una convivencia específica de planta-patógeno que favorezca la acumulación de genes de resistencia durante la evolución de las poblaciones silvestres.
La variable TAS, apoya el comportamiento de las poblaciones resistentes, dado que los valores obtenidos indican que en este grupo los síntomas iniciales en respuesta al ataque de P. infestans se presentaron 10 días más tarde, con respecto de los otros genotipos incluyendo al testigo Río Grande. Esto puede indicar que se pueden tratar de poblaciones con resistencia no específica, de campo o resistencia horizontal. En general, la resistencia horizontal no evita que las plantas sean infectadas, sino que retarda el desarrollo de cada uno de los loci de infección en la planta, y por lo tanto, retrasa la propagación de la enfermedad y el desarrollo de epifitias en el campo (Lemus, 2009).
Al comparar el porcentaje de severidad reflejado en la AUDPC mostrada a través de los tres años de evaluación por el ataque de P. infestans, se observó que durante 2008 los genotipos presentaron los valores más altos de severidad por el ataque de tizón tardío (Figura 1). En este año la mayoría de genotipos iniciaron con un porcentaje de severidad mayor al 50% en el primer muestreo realizado, y en la última evaluación alcanzaron una severidad promedio 80%. Mientras que en 2010 se inició con porcentajes de severidad promedio menores de 10% y mayores al 50%. En 2009 la mayoría de genotipos tuvieron una disminución de la severidad menor 10% durante el primer muestreo y 50% en el segundo muestreo; y a partir del tercer muestreo los genotipos susceptibles tuvieron una severidad mayor a 80%.
En este año se registraron precipitaciones durante el mes de agosto de 37.4 mm, en septiembre de 159.8 y en octubre de 39.6; mientras que en 2008 en estos mismos meses se tuvieron precipitaciones de 130.2, 226 y 50.2 respectivamente y en 2010, la precipitación fue de 143, 178 y 7.20 mm respectivamente. Por lo que, estas diferencias en cantidad de lluvia, pueden haber influenciado para 2009 la severidad mostrada por los genotipos fueran menores en las primeras fechas de muestreo (Figura 1). Y debido a que en este año el bloqueo del experimento se hizo en forma perpendicular a la entrada del patógeno (orientación sur-norte), permitió que la mayor severidad del patógeno se observara primeramente dentro de los surcos borderos, y una vez establecido el inoculo, el patógeno se fue dispersando a los bloques del experimento.
En tanto que, en 2008 y 2010, las precipitaciones registradas durante estos meses favoreció la presencia de mañanas lluviosas y frías, creando un ambiente propicio para el desarrollo de tizón tardío y una mayor producción y diseminación de esporangios del patógeno (CIP, 2002).
Lo anterior, se justifica al encontrarse diferencias significativas entre bloques (repeticiones), así como el error experimental y coeficiente de variación más altos que los ciclos 2008 y 2010 (Cuadro 2). Al respecto Horneburg y Becker (2011), señalan que en pruebas de campo cuando las condiciones climáticas son desfavorables para P. infestans tiene un comportamiento irregular.
Análisis de correlación
La variable AUDPC presentó correlaciones positivas y altamente significativas con las variables rAUDPC, y bi (Cuadro 5); con TAS y EF correlacionó con signo negativo y de manera significativa. Se presentó una alta correlación positiva entre rAUDPC y bi, confirmando alta asociación entre el área bajo la curva y el coeficiente de regresión lineal, por lo que ambas variables indican el comportamiento de la enfermedad y la respuesta de la planta, mientras que el patógeno y planta conviven hasta que el testigo susceptible muere.
Las correlaciones de TAS con AUDPC, rAUDPC y bi, son altamente significativas pero de valor negativo lo que indica alto grado de asociación entre el desarrollo de la enfermedad y el tiempo en que los genotipos comienzan a presentar síntomas. Así TAS largos implican valores bajos deAUDPC, rAUDPC y bi. La TAS funciona como indicador de aquellos genotipos susceptibles a la enfermedad. La variable EF, presentó un valor de alta significancia y negativa con AUDPC, rAUDPC y bi por lo que no hubo asociación estrecha entre porcentaje final de daño alcanzado y desarrollo de la enfermedad, posiblemente porque el desarrollo de la enfermedad no se da a la misma velocidad en el testigo susceptible que en las poblaciones, y de acuerdo a lo observado, la enfermedad avanza rápidamente en el testigo susceptible; mientras que en las poblaciones silvestres se presento más paulatinamente.
Entre las variables EF y TAS no se encontró correlación, esto indica que el inicio de aparición de síntomas (TAS) no tiene una relación directa con la severidad final mostrada por los genotipos, ya que durante las evaluaciones se presentan un amplio rango de condiciones ambientales, deteniendo la enfermedad en la primera etapa y favoreciéndola cuando las condiciones sean favorables al desarrollo del patógeno.
Conclusiones
En el presente estudio se demostró que S. lycopersicum var. cerasiforme es una especie que posee una amplia gama de poblaciones con bajo, medio y alto potencial de resistencia a P. infestans.
En las 19 poblaciones silvestres sometidas a infecciones naturales a P. infestans, las poblaciones V115, 319, 327 y 330 obtuvieron los niveles mas altos de resistencia, las tres primeras alcanzaron los TAS más largos y valores menores en las otras variables, comparados con el testigo resistente LA2533. Dichas poblaciones identificadas como resistentes representan nuevas fuentes de resistencia para ser usadas en programas de mejoramiento genético de la especie.
Agradecimientos
Los autores agradecen al Sistema Nacional de Recursos Fitogenéticos (SINAREFI) por el apoyo y confianza depositados a la red de jitomate. Al Tomato Genetics Resource Center University of California, Davis por facilitar la accesión LA2533.
Literatura citada
Álvarez, H. J. C.; Cortez, M. H. y García, R. I. 2009. Exploración y caracterización de poblaciones de jitomate (Solanaceae) en tres regiones de Michoacán, México. Polibotánica. 28:139-159. [ Links ]
Barbosa, A. F.; Henriques da S, D. J.; Damiano, C. C. and Gomide, M. E. S. 2008.Inheritance of resistance to Phytophthora infestans (Peronosporales, Pythiaceae) in a new source of resistance in tomato (Solanum sp. (formerly Lycopersicon sp.), Solanales, Solanaceae). Genetics and Molecular Biology. 31(2):493-497. [ Links ]
Bautista, L. J.; Márquez, M. E.; Jaramillo, S.; Zapata, J. L.; Mazo, J. J. y Patiño, L. F. 1997. Determinación de Razas Fisiológicas y tipo de apareamiento de aislamientos de Phytophthora infestans (Mont) De Bary. Revista Latinoamericana de la Papa. 9(10):156-170. [ Links ]
Brouwer, D. J. and St. Clair, D.A. 2004. Fine mapping of three quantitative trait loci for late blight resistance in tomato using near isogenic lines (NILs) ans sub-NILs. Theor Appl Genet. 108:628-638. [ Links ]
Campbell, C. L. and Madden, L.V.1990. Introduction to plant disease epidemiology. John Wiley and Sons. New York, USA. 532 p. [ Links ]
Cih, D. I. R.; Jaramillo, V. J. L.; Tornero, C. M.A. y Schwentesius, R. R. 2011. Caracterización de los sistemas de producción de tomate (Lycopersicum esculentum Mill) en el estado de Jalisco, México. Tropical and Subtropical Agroecosystems. 14(2):501-512. [ Links ]
Centro Internacional de la Papa (CIP). 2002. Manual de las enfermedades más importantes de la papa en el Perú. International Potato Center, Lima, Perú. 5-13 pp. [ Links ]
Centro Internacional de la Papa (CIP). 2010. Procedimientos para pruebas de evaluación estándar de clones avanzados de papa. Guía para Cooperadores Internacionales. International Potato Center, Lima, Perú. 48-52 pp. [ Links ]
Chávez, S. J. L.; Carrillo, R. J. C.; Vera, G.A. M.; Rodríguez, G. E. y Lobato, O. R. 2011. Utilización actual y potencial del jitomate silvestre en México. Subsistema Nacional de Recursos Fitogenéticos para la Alimentación y la Agricultura (SINAREFI), Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación, CIIDIR-Unidad de Oaxaca del Instituto Politécnico Nacional e Instituto Tecnológico del Valle de Oaxaca, Oaxaca, México. 72 p. [ Links ]
Chetelat, R. T. and Rick, C. M. 1998. Wild species stock list. Rep Tomato Genetics Coop. 48:71-92. [ Links ]
Chunwongse, J.; Chunwongse, C.; Black, L. and Hanson, P. 1998. Mapping ofthe Ph-3 gene for late blight from L. pimpinellifolium L 3708. TGC Reports. 48:13-16. [ Links ]
Estadísticas de producción de cultivos. (FAOSTAT). 2011. http://faostat.fao.org/site/567/DesktopDefault.aspx?PageID=567 (consulta mayo, 2011). [ Links ]
Fontem, D. A.; Olanyab, O. M.; Tsopmbeng.; G. R. and Owona, M. A. P. 2005. Pathogenicity and metalaxyl sensitivity of Phytophthora infestans isolates obtained from garden huckleberry, potato and tomato in Cameroon. Crop Protection. 24:449-456. [ Links ]
Foolad, M. R.; Merk, H. L. and Ashrafi, H. 2008. Genetics, genomics and breeding of late blight and early blight resistance in tomato. Crit. Rev. Plant. Sci. 27(2):75-107. [ Links ]
Frías, T. G. A.; Muñiz, V. J. A.; Parga. T. V. M. y Flores, O. A.2001. Reacción de 18 genotipos de papa (Solanum tuberosum) a los tizones tardío y temprano y evaluación de la diversidad de razas de Phytophthora infestans en Coahuila y Nuevo León. Rev. Mex. Fitopatol. 19:19-22. [ Links ]
Fry, W. E.1978. Quantification of general resistance of potato cultivars and fungicide effects for integrated control of potato late blight. Phytopathology. 68:1650-1655. [ Links ]
Fry, W. E.; Goodwin, S. B.; Dyer, A. T.; Matuszak, J. M.; Drenth, A.; Tooley, P. W.; Sujkowski, L. S.; Koh, Y. J.; Cohen, B. A.; Spielman, L. J.; Deahl, K. L.; Inglis, D. A. and Sandlan, K. P. 1993. Historical and recent migrations of Phythophthora infestans, chronology, pathways, and implications. Plant Dis. 77:653-661. [ Links ]
Goodwin, B. S.; Cohen,A. B.; Deahl, K. L. and Fry, W. E. 1994. Migration from Northerm México as the probable cause of recent genetic changes in populations of Phythophthora infestans in the United States and Canada. Phytopathology. 84:553-558. [ Links ]
Goodwin, B. S. and Drenth, A. 1997. Origin of the A2 mating type of Phytophthora infestans outside México. Phytopatholgy. 87(10):992-999. [ Links ]
Goodwin, B. S.; Smart, C. D.; Sandrock, R. W.; Deahl, K. L.; Punja, Z. K. and Fry, W. E. 1998. Genetic change within populations of Phytophthora infestans in the United States and Canada during 1994 to 1996: role of migration and recombination. Phytopathology. 88:939-949. [ Links ]
Grünwald, N. J.; Rubio, C. O. A. and Fry, W. E. 2000. Potato late-blight management in the Toluca Valley: Forecasts and resistant cultivars. Plant Dis. 84:410-416. [ Links ]
Henfling, J. W. 1987. Late Blight of potato: Phytophthora infestans. Technical Information Bulletin 4. International Potato Center, Lima, Peru. 25 p. [ Links ]
Horneburg, B. and Becker, H. C. 2011. Selection for Phytophthora infestans field resistance in the F2 generation oforganic outdoor tomatoes. Euphytica. 180:357-367. [ Links ]
Irzhansky, I. and Cohen, Y. 2006. Inheritance against Phytophthorainfestans in Lycopersicon pimpenellifolium L3707. Euphytica. 149:309-316. [ Links ]
Jaime, G. R.; Oru, T.V.; Félix, G. R.; Trinidad, C. H.; Van Etten, D. and Nelson, M. R. 2001. Spatial analysis of Phytophthora infestans genotypes and late blight severity on tomato and potato in the Del Fuerte Valley using geostatistics and geographic information systems. Phytopathology. 91:1156-1165. [ Links ]
Judelson, H. S. and Blanco, F. A. 2005. The spores of Phytophthora: weapons ofthe plant destroyer. Nature Rev. Microbiol. 3:47-58. [ Links ]
Kole, C.; Ashrafi, H. and Foolad, M. 2006. Identification and molecular mapping of new R gene, Ph-4, conferring resistance to late blight in tomato. Solanaceae Conference, University of Wisconsin, Madison. Abstract 449. [ Links ]
Lemus, I. Y. 2009. Genética de la resistencia a las enfermedades en plantas hortícolas. Temas de Ciencia y Tecnología. 39(13):41-44. [ Links ]
Li, J.; Liu, L.; Bai, Y.; Finkers, R.; Wang, F.; Du, Y.; Yang, Y.; Xie, B.; Visser, G. F. R. and Van Heuden, W. A. 2011. Identification and mapping of quantitative resistance to late blight (Phytophthora infestans) in Solanum habrochaites LA1777. Euphytica. 179:427-438. [ Links ]
Moreau, P.; Thoquet, P.; Olivier, J.; Laterrot, H. and Grimsley, N. 1998. Genetic mapping of Ph-2, a single locus controlling partial resistance to Phytophthora infestans in tomato. Molecular Plant-Microbe Interactions. 11:259-269. [ Links ]
Niederhauser, J. S. 1991. Phytophthora infestans: The Mexican connection. In: Phythophthora. J. A. Lucas, R.C. Shattock, D.S. Shaw, and L.R. Cooke (eds.). Cambridge University Press, Cambridge. 24-45 pp. [ Links ]
Páez, O.; Valverde, R.; Gómez, L. y Brenes.A. 2005. Diversidad genética de aislamientos de Phytophthora infestans en plantaciones de papa en Costa Rica con el uso de RAPDS. Agronomía Costarricense. 29:41-55. [ Links ]
Pérez, W.; Salas, A.; Raymundo, R.; Huaman, Z; Nelso, R. and Bonierbale, M. 2001. Evaluation of wild potato species for resistance to late blight. Lima, Peru. CIP Program report 1999-2000. 49-62 pp. [ Links ]
Rick, C. and Chetelat, R.1995. Utilization of related wild species for tomato improvement. Acta Hort. 412:21-38. [ Links ]
Sánchez, P. P.; Oyama, K.; Nuñez, F.; Formoni, J.; Hernández, V. S.; Márquez, G. J. and Garzón, T. J. A. 2006. Sources of resistance to whitefly (Bemisia spp.) in wild populations of Solanum lycopersicon var. cerasiforme (Dunal). Spooner, G. J. and Anderson, R. K. Jansen in Northwestern in México. Genetic Res. Crop Evol. 53:711-719. [ Links ]
Statistical Analysis System (SAS) Institute. 2001. SAS Institute, Inc. 2001. Statistical Analysis System for window. Release 8.1. Cary, N.C. USA. [ Links ]
Scott, J. W. and Gardner, R. G. 2007. Breeding for resistance to fungal pathogens. In: Razdan, M. K. and Mattoo, A. K. (eds.). Genetic Improvement of Solanaceous Crops. 2:422-485. [ Links ]
Shaner, G. and Finney, R. E. 1977. The effect of nitrogen fertilization on the expression of slow-mildewing resistance en Knox wheat. Phytopathology. 67:1051-1056. [ Links ]
Smart, C. D.; Tanksley, S. D.; Mayton, H. and Fry, W. E. 2007. Resistance to Phytophthora infestans inLycopersicon pennellii. Plant Dis. 91:1045-1049. [ Links ]
Spielman, L. J.; Drenth, A.; Davidse, L. C.; Sujkowski, L. J.; Gu, W.; Tooley, P. W. and Fry, W. E. 1991. A second worldwide migration and population displacement of Phythopthorainfestans. Plant Pathology. 40:422-430. [ Links ]
Steiner,A. A. 1984. The universal nutrient solution. In: Proc 6th Int. Cong. Soilless Cult. 633-649 pp. [ Links ]
Tooley, P. W.; Fry, W. E and Villareal, M. J. 1985. Isozyme characterization of sexual and asexual Phytophthora infestans population. J. Hered. 76: 431-435. [ Links ]
Zúñiga, L. N. L.; Molina, G. J. D.; Cadena, H. M. A. y Rivera, P. A. 2000. Resistencia al tizón tardío de la papa (Phytophthora infestans) en cruzamientos de cultivares y clones de papa (Solanum tuberosum L.). Rev. Mex. Fitopatol. 18:1-9. [ Links ]














