Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias agrícolas
versión impresa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.4 no.4 Texcoco may./jun. 2013
Artículos
Rendimiento de Jatropha curcas L. inoculada con micorriza y aplicación de composta de caña*
Yield of Jatropha curcas L. inoculated with mycorrhiza and fertilized with sugarcane compost
Brenda Gabriela Díaz-Hernández1, Juan Francisco Aguirre-Medina2§ y Víctor Hugo Díaz-Fuentes3
1 Campo Experimental Cotaxtla, INIFAP. Carretera Veracruz-Córdoba, Municipio de Medellín de Bravo, Veracruz, km 34.5 (diaz.brenda@inifap.gob.mx).
2 Universidad Autónoma de Chiapas. Facultad de Ciencias Agrícolas. Entronque carretera costera y Estación Huehuetán. C. P. 30660. Fax (964)6270439. Huehuetan, Chiapas, México. (juanf56@prodigy.net.mx). §Autor para correspondencia: juanf56@prodigy.net.mx.
3 Campo Experimental Rosario Izapa. Carretera Tapachula Cacaohatán, Municipio de Tuxtla Chico, Chiapas, km 18.5 (diaz.victor@inifap.gob.mx;) (ruiz.pablo@inifap.gob.mx).
*Recibido: agosto de 2012
Aceptado: marzo de 2013
Resumen
Con el objetivo de identificar la influencia de Glomus intraradices y la composta de caña sobre rendimiento de Jatropha curcas L. en condiciones de campo, se estableció el presente experimento en un suelo de baja fertilidad en Cotaxtla Veracruz durante el invierno de 2008. El piñón se propagó en vivero con semilla colectada en el estado de Veracruz. Se trasplantaron al terreno cuando tenían 20 cm de altura en plantación de marco real a distancia de 3 x 3 m. Se establecieron cuatro tratamientos distribuidos en bloques al azar con cuatro repeticiones; testigo, 40 g de Glomus intraradices por planta, 1 kg de composta de caña, y 40 g Glomus intraradices + 1 kg de composta de caña, en diseño de bloque al azar con cuatro repeticiones. La aplicación de tratamientos fue al momento del trasplante a campo. La unidad experimental se conformó de diez plantas. Se evaluó grosor de tallo y otras variables fisiológicas del rendimiento a los 6, 12, 20 y 26 meses, que corresponden a 180, 365, 680 y 780 días después de la siembra (dds). Los resultados indican diferencias estadísticas significativas en todas las variables para los tratamientos micorrizados con y sin la adición de composta de caña. Se concluye que la inoculación de Jatropha curcas L. con Glomus intraradices promueve mayor número de frutos y peso de semillas. La combinación del hongo micorrízico y composta de caña, son una base para incrementar el rendimiento de Jatropha.
Palabras claves: Jatropha curcas L., Glomus intraradices, rendimiento.
Abstract
With the aim of identifying the influence of Glomus intraradices and of sugarcane compost on the yield of Jatropha curcas L. under field conditions, we established the present experiment in a low fertility soil in Cotaxtla Veracruz during the winter of 2008. The "piñon" was propagated in a greenhouse with seeds collected in the state of Veracruz. They were transplanted to the field when they were 20 cm tall in a real frame system at a distance of 3 x 3 m. We developed four treatments distributed in random blocks with four replicates witness; control, 40 g of Glomus intraradices per plant, 1 kg of sugarcane compost, and 40 g of Glomus intraradices + 1 kg of sugarcane compost in randomized block design with four replicates. The treatments were applied when the plants were transplanted to the field. The experimental unit comprised ten plants. Stem thickness was evaluated, as well as other physiological variables of yield, at 6, 12, 20 and 26 months, which correspond to 180, 365, 680 and 780 days after sowing (DAS). The results indicate statistically significant differences in all variables for mycorrhizal treatments with and without the addition of sugarcane compost. It is concluded that the inoculation of Jatropha curcas L. with Glomus intraradices promotes the production of a greater number of fruits and seed weight. The combination of the mycorrhizal fungus and the sugarcane compost is a basis for increasing the yield of Jatropha.
Key words: Glomus intraradices, Jatropha curcas L., yield.
Introducción
Jatropha curcas L., conocida en México como "piñón", crece en las regiones tropicales y subtropicales del mundo. Produce semillas con alto contenido de aceite, y tiene potencial para utilizarse en la producción de biodiesel y sustituir a los combustibles fósiles (Heller, 1996). En los últimos años, el conocimiento relacionado con la extracción de aceite de sus semillas, con buenas características para la combustión directa en motores de encendido por compresión, o para la producción de biodiesel (van der Putten, 2010) ha favorecido su cultivo, y la producción y cosecha de semillas puede ser además, una oportunidad para generar empleos en el medio rural.
En la actualidad, la especie es utilizada como cerco vivo para delimitar los predios y con fines medicinales y alimenticios en algunas regiones de México (Díaz y Díaz, 2009). En su sistema radical, Jatropha curcas L. es colonizada por los hongos endomicorrízicos y ésta relación favorece la capacidad de absorción de nutrientes y agua del suelo a la planta (Brittaine y Lutaladio, 2010; van der Putten, 2010). En la Costa de Chiapas, se ha encontrado abundante colonización micorrízica en las raíces del piñón establecido en los cercos vivos y esta presencia representa un importante mecanismo para maximizar el uso de fertilizantes químicos sintéticos en explotaciones comerciales, mediante su efecto físico en la extensión del sistema de absorción de las plantas. Se favorece la mineralización y solubilización de nutrientes de la rizosfera, además de aumentar la eficiencia en el transporte de los nutrientes por la planta (Wright et al., 2005).
La asociación de Jatropha curcas con hongos micorrízicos ha demostrado que aumenta significativamente la absorción de fósforo y otros micronutrientes (Jamaluddin y Singh, 2006) y cuando existe la deficiencia nutrimental en suelos marginales, induce aborto de flores y frutos (Jongschaap et al., 2007). Jatropha es conocida por su capacidad de sobrevivir en suelos muy pobres para la agricultura (Brittaine y Lutaladio, 2010; Balota et al., 2011), pero la corrección de la acidez en los suelos tropicales y la adición de fertilizantes son esenciales para lograr plantas altamente productivas (Balota et al., 2011). La capacidad de supervivencia Jatropha en suelos de baja fertilidad no significa alta productividad. La falta de humedad y la nutrición, invariablemente se refleja en su producción de semillas (Kant y Wu, 2011). Se requieren los nutrientes para su productividad y para que los hongos micorrízicos los puedan transportar a la planta.
Los niveles óptimos de fertilizantes inorgánicos se ha visto que varían con la edad del árbol (Achten, 2008). En el caso de la fertilización inicial y de manteniendo de Jatropha, Franken y Flemming (2009) mencionan la importancia de combinar las aplicaciones de fertilizantes químicos sintéticos y compostas, como un mecanismo para mejorar el rendimiento (Meelu, 1996). Al respecto, Ashwani et al. (2009) cita incremento en altura de la planta, diámetro del tallo, el número de ramas por planta, número de semillas por planta y el contenido de aceite, con la aplicación de vermicomposta y de abono de estiércol de ganado a Jatropha en comparación con el control sin aplicar. Cuevas (2009) utilizó composta de residuos orgánicos de mercados y los aplicó a Jatropha y observó un efecto significativo en el desarrollo en altura y en el peso seco de raíz en comparación con las plantas cultivadas sin la aplicación de la composta. La nutrición de Jatropha requiere la combinación de diversas estrategias, que van a depender del tipo de suelo y del sistema de producción.
Por lo anterior, el objetivo de la presente investigación fue, identificar la influencia que tienen la aplicación de Glomus intraradices y composta de caña de azúcar en el rendimiento de Jatropha curcas L. en condiciones de campo.
Materiales y métodos
Sitio experimental, suelo y material biológico
El experimento se estableció en diciembre de 2008, en terrenos del Campo Experimental Cotaxtla, Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias (INIFAP), ubicado en el km 34.5 de la Carretera Veracruz-Córdoba en el Municipio de Medellín de Bravo, Veracruz, a 18° 55' 59'' latitud norte y 96° 11' 37'' longitud oeste, altitud de 18 msnm.
El clima es cálido húmedo Aw"1(w) (i'), con temperatura media anual de 25 °C, la precipitación media anual menor de 1,400 mm y se distribuyen durante el periodo junio a septiembre y una época seca que comprende de febrero a mayo (García, 1973).
El suelo es franco, con 18.8% de arcilla, 30% de limo y 51.20% de arena; 3.22% de materia orgánica y pH de 6.39 en el estrato de 0 a 20 cm. Nitrógeno inorgánico (trazas), 29 ppm de fósforo (Bray-1), 309 ppm de K, 380 ppm de magnesio, 46 ppm de Fierro (DTPA), 2.4 ppm Cobre (DPTA), 2.5 ppm de zinc (DPTA) y 34 ppm de manganeso (DTPA). En general es un suelo de baja fertilidad. Para el establecimiento del experimento se propagó la planta de piñón en vivero a partir de semilla colectada en el estado de Veracruz. Las plantas se trasplantaron al terreno cuando tenían 20 cm de altura. El diseño de plantación fue de marco real con una distancia de 3 x 3 metros entre plantas y líneas respectivamente.
Se utilizó G. intraradices desarrollado en suelo como sustrato y Brachiaria decumbens L. como planta hospedera con 40 esporas por gramo de suelo y el nivel de colonización en el sistema radical del 95%. La composta fue elaborada con material de caña de azúcar en la misma región.
Tratamientos y su aplicación
Se establecieron los siguientes tratamientos: testigo, 40 g de Glomus intraradices por planta a la siembra, 1 kg de composta de caña y 40 g de Glomus intraradices + 1 kg de composta de caña. El diseño experimental utilizado fue de bloque al azar con cuatro repeticiones. La unidad experimental se conformó de diez plantas. Las aplicaciones de los productos se realizaron al momento del establecimiento de las plantas en campo. Para el caso de la micorriza, ésta se impregnó espolvoreándola alrededor del interior del hoyo y en el cepellón húmedo de la planta. La composta de caña se aplicó en el fondo del hoyo, en ambos casos, al momento del trasplante al terreno.
Durante los primeros 5 meses después del establecimiento las plantas recibieron un riego de 10 L/planta, cuando el sustrato se observó completamente seco. La maleza se controló en forma manual. A los 5 meses después de establecido el experimento, se realizó una poda de formación, a 20 cm de altura a partir del suelo, lo anterior para inducir ramificación. Posteriormente, a los 17 meses después de establecido se realizó otra poda a 90 cm de altura.
Variables
Se evaluó el diámetro del tallo y otras variables fisiológicas del rendimiento a los 6, 12, 20 y 26 meses, que corresponden a 180, 365, 680 y 780 días después de la siembra (dds).
Diámetro del tallo
El diámetro del tallo principal se cuantificó a 20 cm de altura a partir del suelo con Vernier.
Número de frutos y semillas
Se cuantificó el número de frutos y semillas totales por planta durante cada muestreo, tratamiento y repetición.
Peso de frutos y semillas
El peso de frutos y semilla se cuantifico utilizando una balanza analítica.
Análisis estadístico
El análisis estadístico se realizó mediante un análisis de varianza, con el procedimiento PROC ANOVA, posteriormente se aplicó la comparación de medias Tukey con un α= 0.05 con el programa SAS versión 9.0.
Resultados y discusión
Diámetro del tallo
En condiciones de campo el diámetro del tallo de Jatropha no presentó diferencias estadísticas los primeros seis meses de evaluación (Figura 1). Esto permite sugerir, que durante el periodo inicial de crecimiento de la planta, se establece un flujo de fotosintatos de la parte aérea al sistema radical, como lo consigna Wright et al. (2005) en raíces micorrizadas y, ésta demanda de carbohidratos del simbionte pudo haber sido durante los primeros seis meses. Una vez establecida la simbiosis, el beneficio a la planta se expresó en mayor crecimiento vegetal y reproductivo de la planta huésped.
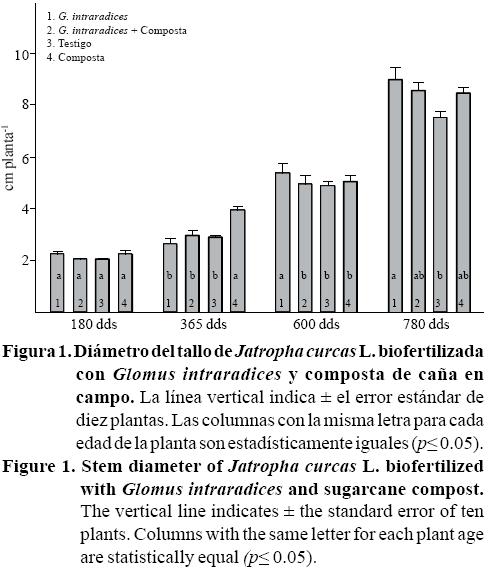
Un año después de establecido, si hubo diferencias estadísticas a favor del tratamiento adicionado de composta. A los 20 y 26 meses dds, el tratamiento inoculado con G. intraradices presentó el diámetro del tallo más grueso en comparación con los otros tratamientos. La respuesta anterior puede estar relacionada con el transporte de nutrientes y agua a la planta, una vez que se estableció la simbiosis Glomus-Jatropha. En otros cultivos perennes, la simbiosis micorrízica logra mayor inducción en el desarrollo vegetal después de los 90 días de su siembra en vivero (Aguirre-Medina, 2006; Aguirre-Medina et al., 2011). El diámetro del tallo tiene importancia con la sobrevivencia y el crecimiento de Jatropha en el campo y en general, en las plantas inoculadas fue 10 % mayor en comparación con las plantas testigo. En condiciones de vivero, Balota et al. (2011) encontró, que las plantas de Jatropha micorrizadas presentan mayor altura y diámetro de tallo, en cotejo con las plantas no micorrizadas a bajos niveles de fósforo. Este hecho sugiere, que el incremento en el desarrollo de la planta hospedera, puede deberse a un incremento en la toma de nutrientes (Balota et al., 2011).
En otros cultivos como las plantas de café, el diámetro del tallo también se incrementa en las plantas inoculadas con G. intraradices y cuando se inocularon las semillas con dos microorganismos, A. brasilense y G. intraradices. (Aguirre- Medina et al., 2011). En papaya, Vázquez-Hernández et al. (2011) citan que la inoculación con G. mosseae incrementó significativamente la altura de planta respecto al testigo, en 11.4, 3.3 y 3.4% a los 30, 120 y 210 días después del trasplante (ddt) y el diámetro del tallo se incrementó en 15 y 6.6% a los 30 y 120 ddt, respectivamente. Este mismo resultado ha sido consignado, para esta variable, por varios autores en cultivos perennes como cacao (Aguirre-Medina et al., 2007) y en cafeto (Aguirre-Medina et al., 2011).
Número de frutos
Se registraron al año de establecido el ensayo y en el mismo se encontraron diferencias estadísticas significativas a favor de los dos tratamientos biofertilizados con Glomus intraradices, cuando se aplicó sola, y en combinación con la composta (Figura 2).

Los resultados anteriores confirman la importancia del establecimiento de la simbiosis micorrízica en Jatropha, que permite favorecer el transporte de nutrientes y agua a la planta. La simbiosis a través del tiempo, incrementa el crecimiento de la hifa hacia profundidades no rizosfericas, de perfiles del suelo más distantes, como se ha demostrado en plantaciones de café (Cardoso et al., 2003) mejorando la nutrición y el transporte hacia la raíz de la planta (Schweiger y Jakobsen, 2000) y de esta manera, no solo se favorece la nutrición, sino también el transporte da agua (Augé, 2004), en comparación con una planta sin micorrizar. La nutrición y el abastecimiento de agua a la planta de Jatropha mediante la micorrización induce aumento de 30% en la tasa fotosintética con niveles de fósforo de 200 y 400 mg kg-1 de suelo, en comparación con las plantas no micorrizadas (Balota et al., 2011). En tomate de cáscara, inoculado con Glomus intraradices y Azospirillum brasilense más vermicomposta, Velasco et al. (2001) citan el incremento en la actividad fotosintética en la etapa de floración en comparación con el testigo, y esta condición la refieren a la ventaja de la nutrición de la planta.
La condición nutrimental de las plantas micorrizadas no solo se refleja en el aumento en la tasa fotosintética, sino además, en la disminución de la conductancia estomática (Manjarréz-Martínez et al., 2009; Aguirre-Medina et al., 2005) y este hecho se expresa en mayor número de flores y de frutos. Al respecto, Kant y Wu (2011) mencionan que la época de floración y el número de eventos de floración en Jatropha, dependen de la falta de humedad y la nutrición de la planta y su deficiencia se refleja invariablemente en la producción de semillas. En papaya cv maradol, también se incrementó el número de frutos en plantas micorrizadas, inoculadas con G. mosseae 41.5% frutos por planta respecto al testigo, y con la inoculación con E. colombiana aumentó 22% (Vázquez-Hernández et al., 2011). En chile serrano Manjarréz-Martínez et al. (1999), citan que las plantas con G. intraradices produjeron más frutos en combinación con todas las dosis de vermicomposta.
Las experiencias de incrementos en rendimiento en condiciones de campo han sido muy evidentes en cultivos anuales (Dobbelaere et al., 2001; Aguirre-Medina, 2006).
Peso fresco de frutos
El peso de los frutos también presenta diferencias estadísticas significativas a favor de los tratamientos donde se inoculó Glomus intraradices (Figura 3). Este efecto se debe posiblemente a que la planta, al no tener deficiencias de nutrimentos, produce mayor área foliar fotosintéticamente activa (Balota et al., 2011) y favorece el desarrollo de los frutos de Jatropha. En otros cultivos, como chile serrano (Manjarrez-Martínez et al., 1999) y tomate de cáscara (Velasco et al., 2001) observaron efecto sinérgico en la producción con la combinación de vermicomposta + G. intraradices. Lo anterior sugiere, que la simbiosis micorrízica logra mantener un abastecimiento más uniforme de agua a la planta y reducir de esta manera, la posibilidad de que la raíz genere algún mensaje por estrés hídrico y, como consecuencia, el cierre de las estomas.

El efecto de la micorriza-arbuscular en la modificación de la conductancia estomática en frijol ha sido citada (Aguirre-Medina et al., 2005). El cierre estomático puede dispararse cuando el sistema radical detecta baja humedad disponible (Valladares et al., 2004; Aguirre-Medina et al., 2005).
Peso de semillas
El peso de semillas de Jatropha con biofertilizate y composta en condiciones de campo se presenta en la Figura 4.

Esta variable, como las anteriores, refleja el incremento del rendimiento de Jatropha asociada a Glomus intraradices con y sin composta de caña. La composta de caña seguramente favoreció el mayor tamaño de las semillas. Las plantas adquieren mayor cantidad de fósforo y éste elemento estimula la formación de las semillas (Vance et al., 2003).
Kant y Wu (2011) citan que en Jatropha, la humedad disponible, así como la temperatura, son factores que afectan la producción de semillas. El desarrollo del micelio externo del hongo micorrízico, según Hodge et al. (2001) se incrementa por la presencia de materiales orgánicos naturales y esta situación se puede presentar con la combinación de los hongos micorrizicos más la aplicación de la composta y en consecuencia, el incremento en el peso promedio de las semillas de Jatropha. Los beneficios iniciales de los hongos micorrízicos en el desarrollo vegetal y reproductivo de Jatropha son de importancia agronómica, pero a través del tiempo, las plantaciones deben de ser abastecidas de todos los nutrimentos, especialmente las establecidas en suelos marginales. En las regiones tropicales el fósforo limita el crecimiento vegetal en la mayoría de los suelos, aun cuando está presente en grandes cantidades, su accesibilidad a las raíces para ser absorbido es incierta, debido a las interacciones con los coloides, a reacciones de precipitación con aluminio, hierro, calcio, o bien, a su reducida difusión, que favorece el desarrollo de zonas de agotamiento alrededor de las raíces absorbentes (Siqueira, 1998).
Las transformaciones biológicas del fósforo no presentan la peculiaridad de transitar por la atmósfera, como lo es el ciclo del nitrógeno. Se rige por la circulación del suelo a la planta, al animal, a los microorganismos y nuevamente al suelo, y es en esta condición, que los hongos endomicorrízicos forman parte sustantiva en la simbiosis con las plantas. La micorrización representa un importante mecanismo para maximizar el uso eficiente de las aplicaciones de los fertilizantes químicos sintéticos mediante su efecto físico en la extensión del sistema de captura y absorción de los mismos para las plantas. Con estas ventajas, es posible mejorar el uso eficiente de los fertilizantes y disminuir las cantidades requeridas para el crecimiento de las plantas (Andrade et al., 2009).
Los hongos micorriízcos, además del transporte de nutrientes a la planta, se ha demostrado que son capaces de solubilizar minerales (Crowley et al., 1991), producir substancias reguladoras del crecimiento (Arshad y Frankenberger, 1991), y en consecuencia, incrementar el volumen de la biomasa radical (Roveda y Polo, 2007). En otros casos, se ha beneficiado la inducción de resistencia sistémica a patógenos (Van Peer et al., 1991), inhibición del crecimiento de algunos organismos patógenos (Utkhede et al., 1999). En la tolerancia a sequía, se mejora el mejor aprovechamiento del agua (Augé et al., 2001 y Aguirre-Medina et al., 2005).
Se ha comprobado que la aplicación de los hongos micorrízicos en diferentes cultivos, tienen efecto sinérgico en la nutrición de la planta huésped y su concomitante beneficio en el desarrollo vegetativo y reproductivo (Aguirre-Medina, 2009; Barrer, 2009), como en el caso la adición de vermicomposta, ya sea sola o combinada con G. intraradices y A. brasilense en tomate de cáscara, que mostró efecto positivo sobre la tasa fotosintética, acumulación de materia seca y rendimiento (Velasco et al., 2001).
Milthorpe y Moorby (1982) agregan, que el aumento de una hoja se da por un aumento en el tamaño medio de las células del mesófilo, el peso específico foliar y la cantidad de cloroplastos por unidad de área, y por lo general, hay una relación positiva entre el suministro de nutrimentos minerales y la tasa de fotosíntesis, las cuales influyen en todo el complejo fotosintético. En otros cultivos como el café, se ha demostrado la alta dependencia micorrízica, especialmente en etapas de vivero y los efectos positivos se prolongan después del trasplante en campo (Siqueira et al., 1998).
Conclusión
La inoculación de Jatropha curcas L. con Glomus intraradices promueven mayor desarrollo de plantas vigorosas en su tallo, número de frutos y el peso de las semillas. La combinación del hongo micorrízico junto con la composta de caña, son una base para incrementar el rendimiento de Jatropha.
Literatura citada
Achten, W. M. J.; Verchot, L.; Franken, Y. J.; Mathijs, E.; Singh, V. P.; Aerts, R. and Muys, B. 2008. Jatropha bio-diesel production and use. Bio. Bioenergy. 32:1063-1084. [ Links ]
Aguirre-Medina, J. F.; Kohashi-Shibata, J.; Trejo-López, C.; Acosta Gallegos, J. A. y Cadena-Iñiguez, J. 2005. Inoculación de Phaseolus vulgaris l. con tres microorganismos y su efecto en tolerancia a sequía. Agric. Téc. Méx. 31(2):125-137. [ Links ]
Aguirre-Medina, J. F. 2006. Biofertilizantes microbianos: experiencias agronómicas del programa nacional del INIFAP en México. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. Centro de Investigaciones Regionales Pacífico Sur. Campo Experimental Rosario Izapa. Libro técnico Núm. 2. 201 p. [ Links ]
Aguirre-Medina, J. F.; Mendoza-López, A.; Cadena-Iñiguez, J. y Avendaño-Arrazate, C. 2007. La biofertilizaciòn del cacao (Theobroma cacao) L. en vivero con (Azospirillum brasilense) Tarrand, Krieg et Döbereiner y (Glomus intraradices) Schenk et Smith. Interciencia. 32(8):1-6. [ Links ]
Aguirre-Medina, J. F. 2009. Rendimiento y desarrollo de cultivos anuales y perennes con biofertilizantes microbianos en Chiapas. In: Cadena, I. P.; López, B. W. y Morales, G. M. (Eds.). Primer encuentro Estatal de Productores Exitosos. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP). Centro de Investigación Regional Pacifico Sur. Campo Experimental Centro de Chiapas, Ocozocuautla de Espinosa, Chiapas, México. Publicación especial Núm. 4. 60-77 pp. [ Links ]
Aguirre-Medina, J. F.; Moroyoqui-Ovilla, D. M.; Mendoza-López, A.; Cadena-Iñiguez, J.; Avendaño-Arrazate, C. H. y Aguirre-Cadena, J. F. 2011. Aplicación de A. brasilense y G. intraradices a Coffea arabica en vivero. Agronomía Mesoamericana. 22:(1):1-10. [ Links ]
Andrade, S. A. L.; Mazzafera, P.; M. A. Schivinato, M. A. and Silveira, A. P. D. 2009. Arbuscular mycorrhizal association in coffee. Review. J. Agric. Sci. 147:105-115. [ Links ]
Arshad, M. and W. T. Frankenberger. 1991. Plant growth-regulating substances in the rhizosphere: Microbial production and functions. Advances in Agronomy. 62: 45-151. [ Links ]
Ashwani, K. S.; Satyawati, S. and Saroj, M. 2009. Application of farmyard manure and vermi-compost on vegetative and generative characteristics of Jatropha curcas. J. Phytol. 1 (44):206-211. [ Links ]
Augé, R. M.; Stadola, A. J.; Tims, J. E. and Saxton, M. 2001. Moisture retention properties of a mycorrhizal soil. Plant Soil. 230:87-97. [ Links ]
Augé, R. M. 2004. Arbuscular mycorrhizae and soil/plant water relations. Canadian J. Soil Sci. 84:373-381. [ Links ]
Balota, E. L.; Machineski, O.; Truber, P. V.; Scherer, A. and de Souza, F. S. 2011. Physic nut plants present high mycorrhizal dependency under conditions of low phosphate availability. Braz. J. Plant Physiol. 23(1):33-44. [ Links ]
Barrer, E. S. 2009. El uso de hongos micorrizicos arbusculares Como una alternativa para la agricultura. Revista Facultad de Ciencias Agropecuarias. Universidad Industrial de Santander. 7(1):123-132. [ Links ]
Brittaine, R. and Lutaladio, N. 2010. Jatropha: a smallholder bioenergy crop. The potential for pro-poor development. integrated crop management. Chapter 3. Jatropha cultivation. Plant Production and Protection Division. FAO, Rome, Italy.114 p. [ Links ]
Cardoso, I. M.; Boddington, C.; Janssen, B. H.; Oenema, O. and Kuyper, T. W. 2003. Distribution of mycorrhizal fungal spores in soils under agroforestry and monocultural coee systems in Brazil. Agro System. 58:33-43. [ Links ]
Crowley, D. E.; Wang, Y. C.; Reid, C. P. P. and Szaniszlo, P. J.1991. Mechanisms of iron acquisition from siderophores by microorganisms and plants. Plant Soil 130:179-198. [ Links ]
Cuevas, C.V. 2009. Growth Performance of Jatropha curcas L. Seedlings and some properties of acidic, low fertility grassland soil amended with biowaste compost. Philipp Agric SCientist. 92(3):15-319. [ Links ]
Díaz, H. B. G. y Díaz, V. H. 2009. Características físicas y contenido de aceite de 29 ecotipos de Jatropha curcas colectados en el estado de Veracruz, México. Memoria del IV Encuentro Internacional sobre Desarrollo Forestal Sostenible. FAO. IUFRO. La Habana, Cuba. 1277-1287 pp. [ Links ]
Dobbelaere, S.; Croonenborghs, A.; Thys, A.; Ptacek, D.; Vanderleyden, J.; Dutto, P.; Labandera-González, C.; Caballero-Mellado, J.; Aguirre-Medina, J. F.; Kapulnik, Y.; Brener, S.; Burdman, S.; Kadouri, D.; Sang, S. and Okon, J. 2001. Responses of agronomically important crops to inoculation with Azospirillum. Aust. J. Plant Physiol. 28(9):871-879. [ Links ]
Franken, Y. J. and Flemming, N. 2009. Establecimiento y manejo de plantaciones. In: manual de Jatropha. FACTS (Fuels from Agriculture in communal technology). FACT Foundation. The Netherlands. 230 p. [ Links ]
García, E. 1973. Modificaciones al sistema de clasificación climática de Köppen (para adaptarlo a las condiciones de la República Mexicana). Instituto de Geografía. Universidad Autónoma de México (UNAM). 2ª (Ed.). México D. F. 246 p. [ Links ]
Heller, J. 1996. Physic nut. Jatropha curcas L. Promoting the conservation and use of underutilized and neglected crops. 1. Institute of plant genetics and crop plant research. Gatersleben- International Plant Genetic Resources Institute. Rome. 66 p. [ Links ]
Hodge, A.; Campbell C. D. and Fitter, A. H. 2001. An arbuscular mycorrhizal fungus accelerates decomposition and acquires nitrogen directly from organic materials. Nature. 413: 297-299. [ Links ]
Jamaluddin, A. and Singh, K. 2006. Studies on arbuscular mycorrhizal fungi associated with Jatropha curcas L. Mycorrhiza News. 18(3):12-14. [ Links ]
Jongschaap, R. E. E.; Corré, W. J.; Bindraban, P. S. and Brandenburg, W. A. 2007. Claims and facts on Jatropha curcas L. Global Jatropha curcas evaluation, breeding and propagation programme. Report 158. Plant Research International, B.V. Wageningen, Holland. 65 p. [ Links ]
Kant, P. and Wu, S. 2011. The extraordinary collapse of Jatropha as a global biofuel. Environ. Sci. Technol. 45:7114-7115. [ Links ]
Manjarrez-Martínez, M. J.; Ferrera-Cerrato R. y González-Chávez M. C. 1999. Efecto de la vermicomposta y la micorriza arbuscular en el desarrollo y tasa fotosintética de chile serrano. Terra. 17(1):9-15. [ Links ]
Meelu, O. P. 1996. Integrated nutrient management for ecologically sustainable agriculture. J. Indian Soc. Soil Sci. 44:582-592. [ Links ]
Milthorpe, F. L. y Moorby, J. 1982. Introducción a la fisiología de los cultivos. Ed. Hemisferio Sur. Argentina. 188-192 pp. [ Links ]
Roveda, G. y Polo, C. 2007. Mecanismos de adaptación de maíz asociado a Glomus spp. en suelos con bajo fósforo disponible. Agronomía Colombiana 25(2):349-356. [ Links ]
Saggin, Jr.; Siqueira, O. J.; Colozzi-Filho, J. O. e Oliveira, A. E. 1992. A infestaςao do solo com fungos micorrízicos no crescimento post- transplante de mudas de cafeiro nao micorrizadas. Rev. Bras. Cienc. Solo. 16:39-46. [ Links ]
Schweiger, P. and Jakobsen, I. 2000. Laboratory and field methods for measurement of hyphal uptake of nutrients in soil. Plant Soil. 226:237-244. [ Links ]
Siqueira, J. O.; Saggin-Junior, O. J.; Flores-Aylas, W. W. and Guimaraes, P. T. G. 1998. Arbuscular mycorrhizal inoculation and superphosphate application influence plant development and yield of coffee in Brazil. Mycorrhiza. 7:293-300. [ Links ]
Utkhede, R. S.; Koch, C. A. and Menzies, J. G. 1999. Rhizobacterial growth and yield promotion of cucumber plants inoculated with Phytium aphanidermatum. Can. J. Plant Pathol. 21:265-271. [ Links ]
Van Peer, R.; Niemann G. J. and Schippers B. 1991. Induced resistance and phytoalexin accumulation in biological control of Fusarium wilt of a carnation by Pseudomonas sp. Strain WCS417r. Phytopathology 81:728-734. [ Links ]
Van der Putten, E. 2010. Datos generales de la Jatropha. In: manual de Jatropha. FACTS (Fuels from Agriculture in communal technology). FACT Foundation. The Netherlands. 230 p. [ Links ]
Vázquez-Hernández, M. V.; Arévalo-Galarza, M. L.; Jaén-Contreras, D. y Escamilla-García, J. L. 2011. Evaluación del efecto de micorrizas en la producción y calidad de papaya maradol Carica papaya. Agroproductividad. 4(2):27-32. [ Links ]
Velasco V., J.; Ferrera-Cerrato, R. y Almaraz Suárez, J. J. 2001. Vermicomposta, micorriza arbuscular y Azospirillum brasilense en tomate de cáscara. Terra. 19 (3): 241-248. [ Links ]
Valladares, F.; Vilagrosa, A.; Peñuelas, J.; Ogaya, R.; Camarero, J. J.; Corcuera, L.; Sisó, S. y Gil-Pelegrín; E. 2004. Estrés hídrico: ecofisiología y escalas de la sequía. In: Valladares, F. 2004. Ecología del bosque mediterráneo en un mundo cambiante. Ministerio de Medio Ambiente, EGRAF, S. A., Madrid. 163-190 pp. [ Links ]
Vance, C. P.; Uhde-Stone, C. and Allan, L. D. 2003. Phosphorus acquisition and use: critical adaptations by plants for securing a nonrenewable resource. New Phytologist. 157:423-447. [ Links ]
Wright, D. P.; Scholes, J. D.; Read, D. J. and Rolfe, S.A. 2005. European and African maize cultivars differ in their physiological and molecular responses to mycorrhizal infection. New phytologist. 167:881-896. [ Links ]














