Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias agrícolas
versión impresa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.4 no.2 Texcoco feb./mar. 2013
Artículos
Estrés hídrico en la germinación y crecimiento de plántulas de genotipos de albahaca Ocimum basilicum L.*
Water stress on germination and seedling growth of genotypes of sweet basil Ocimum basilicum L.
Carlos Michel Ojeda-Silvera1, Bernardo Murillo-Amador1, Inés María Reynaldo-Escobar2, Enrique Troyo-Diéguez1, F. Higinio Ruiz-Espinoza3 y Alejandra Nieto-Garibay1§
1Centro de Investigaciones Biológicas del Noroeste S.C, Instituto Politécnico Nacional 195, Col Playa Palo de Santa Rita, AP, 128, La Paz, Baja California Sur, México. (cojedas1979@gmail.com); (bmurillo04@cibnor.mx); (etroyo04@cibnor.mx). §Autor de correspondencia: anieto04@cibnor.mx.
2Instituto Nacional de Ciencias Agrícolas, Mayabeque, Cuba. (ireynaldo@yahoo.com.ar).
3Universidad Autónoma de Baja California Sur, México. (fruiz@uabcs).
* Recibido: mayo de 2012
Aceptado: enero de 2013
Resumen
El estrés hídrico es considerado un estrés abiótico y es la condición más común y desfavorable para los cultivos, por tal motivo se estudió el efecto del estrés hídrico simulado con soluciones de PEG-8000 con potenciales hídricos de 0, -0.75 y -1.50 MPa. Se determinó el porcentaje de germinación (a los 9 días), altura de la plántula, largo de la raíz y acumulación de biomasa fresca y seca (a los 15 días) en plántulas de 20 genotipos de albahaca (Ocimum basilicum L.). Los resultados mostraron una respuesta diferencial significativa ante el estrés, en la medida que se incrementa la concentración de PEG-8000. La germinación, altura de la planta, longitud de la raíz, biomasa fresca de la parte aérea y biomasa fresca de raíz, fueron las variables de mayor diferenciación, destacándose el genotipo Dolly, Italian Large Leaf, Spacy Glove y Dark Opal con mayor tolerancia en la germinación y en el crecimiento de las plantas en condiciones de estrés (-1.50 MPa). Los genotipos de mayor producción de biomasa fresca de la parte aérea sin estrés hídrico fueron Sweet Dani, Lectuce Leaf y Napoletano, bajo condiciones de estrés moderado (-0.75 MPa) el genotipo Sweet Dani y el genotipo Dolly, en condiciones de estrés severo (-1.50 MPa) fueron de mayor producción de biomasa fresca de la parte aérea y raíz.
Palabras clave: sequía, tolerancia, PEG-8000.
Abstract
Water stress is considered an abiotic stress and is the most common condition and unfavorable for crops, for that reason we studied the effect of water stress simulated by PEG-8000 solutions with water potential of 0, -0.75 and -1.50 MPa. We determined the percentage of germination (after 9 days), seedling height, root length, fresh and dry biomass accumulation (at 15 days) in seedlings of 20 genotypes of basil (Ocimum basilicum L.). The results showed a significant differential response to stress, as it increases the concentration of PEG-8000. Germination, plant height, root length, fresh biomass of shoot and root fresh biomass, were the variables of greater differentiation, highlighting the genotype Dolly, Italian Large Leaf, Spacy Glove and Dark Opal, with higher tolerance during germination and growth of plants in stress conditions (-1.50 MPa). Genotypes with higher production of fresh biomass of shoots without water stress were Sweet Dani, Lectuce Leaf and Napoletano, under conditions of moderate stress (-0.75 MPa) the genotypes Sweet Dani and Dolly, in severe stress conditions (-1.50 MPa) were higher in fresh biomass production of shoot and root.
Key words: drought, tolerance, PEG-8000.
Introducción
Las regiones áridas y semi-áridas de México constituyen 60% del territorio nacional, el desarrollo de los cultivos se enfrenta a la sequía limitando su crecimiento (Fereres y Soriano, 2007; Nieto-Garibay et al, 2010). Desde las etapas tempranas las plantas cultivadas deben enfrentar condiciones de estrés abióticos como es el caso de la sequía, los procesos que se dan durante estas etapas, la germinación, emergencia y la plántula para su adaptación a condiciones ambientales y edáficas adversas, son la clave en su sobrevivencia en campo (Mokhberdoran et al, 2009).
Existen diversos estudios acerca de la respuesta de plantas cultivadas bajo estrés hídrico en etapas tempranas con el fin de conocer los mecanismos de adaptación a esta condición de estrés. El uso de substancia osmo-reguladoras como el polyetilen glicol de pesos moleculares 6000 y 8000 (PEG-6000, PEG-8000) han resultado buenas herramientas para provocar condiciones de sequía durante la germinación de semillas (Mokhberdoran et al, 2009; Nieto-Garibay et al, 2010; Sayar et al, 2010).
Los resultados de dichos estudios han permitido conocer que los bajos potenciales de agua causados por condiciones de estrés hídrico, retrasan la germinación, la emergencia y afectan a la plántula, en asociación con un establecimiento en campo más deficiente y una baja producción (Barroso y Jeréz, 2000; Wenrao et al., 2011). A excepción de la salvia escasa atención ha recibido el estudio de la respuesta de especies aromáticas y su adaptación a un ambiente con bajos déficit hídrico.
Su uso medicinal así como en la alimentación, ha tenido gran relevancia en el mundo, principalmente por el contenido de aceites esenciales. Debido a esto, la mayor parte de los estudios relacionados con las especies aromáticas han abordado el tema de la caracterización, extracción y uso de los aceites esenciales que producen (El-Beshbishy; 2012; Yeşiloğlu y Şit, 2012). Sin embargo, poca atención se ha puesto en conocer la respuesta de estas especies y su adaptación a zonas áridas y semi-áridas en condiciones climáticas y edáficas adversas para su desarrollo.
Baja California Sur (BCS), México, se produce la mayor parte de albahaca orgánica en el mundo, con altos precios en el mercado comercializándose principalmente en fresco (SIAP-SAGARPA, 2009). La producción se reduce a unos cuantos genotipos, sin embargo, se cuenta con más de 24 genotipos en el mundo de los cuales existe escasa información acerca de su adaptación a condiciones adversas durante su desarrollo.
Debido a lo anterior, el presente trabajo tuvo como objetivo, evaluar el efecto del estrés hídrico simulado en condiciones de laboratorio, sobre la germinación y el crecimiento de plántulas de 20 genotipos de albahaca, con el propósito de establecer posibles diferencias entre ellos que permitan considerarlos como criterio en la selección de genotipos tolerantes y sensibles al déficit hídrico. Con el conocimiento generado se busca aportar escenarios en donde se ofrezca al productor la diversificación del cultivo de esta especie con genotipos con mayores oportunidades de producción en estas zonas áridas y semi-áridas.
Materiales y métodos
El experimento se realizó en el laboratorio de fisiotecnia vegetal del Centro de Investigaciones Biológicas del Noroeste, México. Se utilizaron genotipos de albahaca, Lemon, Sweet Dani, Sweet Genovese, Siam Queen, Red Rubin, Thai, Dark Opal, Spicy Glove, Mrs Burns, Cinnamon, Licorice, Purple Ruffles, Italian Large Leaf, Lettuce Leaf, Emily, Dolly, Genovese, Genovese Italian, Dolce Vita y Napoletano. Previamente se realizó una prueba de germinación de la semilla de todos los genotipos, utilizando la metodología propuesta por ISTA (1999).
El experimento se estableció en un diseño completamente al azar con arreglo factorial considerando los genotipos como factor A y los tratamientos de sequía como factor B, con cuatro repeticiones de 30 semillas cada una. El experimento se inició al humedecer las semillas según el método de Michel y Kauffman (1973). Los tratamientos de sequía aplicados durante la investigación, se simularon con soluciones de polyetilen glycol, Peso Molecular 8000 con potencial hídrico de -0.75 MPa (estrés moderado) y -1.5 MPa (estrés severo) calculados con la fórmula de Emmerich y Hardegree (1991) y corroborados con el medidor de potencial (Dewpoint PotentiaMeter modelo WP4-T). Como control se utilizó agua destilada con un valor despreciable de presión osmótica (sin estrés). Las cajas se incubaron en una cámara de germinación (Lumistell, modelo IES-OS, serie 1408-88-01) en condiciones controladas de temperatura (25±1° C), humedad (80 %) y luz (12 h continuas) durante nueve días. La germinación se registró diariamente y el valor final se determinó a los nueve días. La tasa de germinación se calculó utilizando la ecuación de Maguire (1962): M= n1/ t1 + n2/t2 +...n 30/t9; donde n1, n2,...n 30 son el número de semillas germinadas en los tiempos t1, t2,... t9 (en días).
Los tratamientos de déficit hídrico se mantuvieron hasta los 15 días cuando se seleccionaron al azar 10 plántulas por tratamiento/repetición, a las que se les midió longitud de radícula y de parte aérea, peso fresco y peso seco de radícula y de parte aérea. Se realizaron análisis de varianza y comparaciones múltiples de medias (Scheffe, p= 0.05). Los datos de porcentaje de germinación se transformaron mediante arcoseno (Little y Hills, 1989; Steel y Torrie, 1995). Todos los análisis se realizaron con el programa estadístico Statistica, v. 10.0 para Windows (StatSoft, Inc., 2011).
Resultados y discusión
Tasa y porcentaje de germinación
Se presentaron diferencias significativas entre genotipos para tasa de germinación (F19,180= 199.8, p= 0.00000) y la interacción genotipos*niveles de potencial hídrico, para la tasa (F38,180= 127.85; p= 0.00000) y porcentaje de germinación (F38,180=16.60; p= 0.00000). Los genotipos como Sweet Dani, Thai, Dark Opal, Spicy Glove y Dolly mantuvieron valores superiores al 85% que es el valor mínimo establecido para este cultivo bajo un potencial hídrico de -0.75 MPa (aunque más bajo que su grupo control). En esta condición alcanzaron los porcentajes de germinación más altos Italian Large Leaf, así como los genotipos Dark Opal, Spicy Glove y Dolly.
Las semillas tratadas con agua destilada (grupo control) no mostraron diferencias entre genotipos, mantuvieron porcentajes altos de germinación y conforme se incrementó la concentración de PEG-8000 con potencial hídrico de -0.75 MPa, se redujo el porcentaje de germinación. Se observaron diferencias significativas por el genotipo Sweet Genovese con el valor más bajo que unido a otros genotipos como Genovese, Genovese Italian, Dolce Vita y Napoletano lograron valores entre 40 y 65% de germinación. Lo anterior se demostró cuando el potencial hídrico fue de -1.50 MPa donde no lograron germinar (Cuadro 1). Si bien, no se presentaron diferencias estadísticamente significativas para el resto de los genotipos, se observa la tendencia a disminuir el porcentaje de germinación en relación a los controles respectivos de cada genotipo con forme disminuye el potencial hídrico. Esta disminución fue significativa (F2,180= 2485.5; p= 0.00000) cuando se analizaron los datos por tratamientos observando la mayor disminución del porcentaje de germinación en el tratamiento más negativo de potencial hídrico (Cuadro 2).

El porcentaje de germinación se manifestó como una característica altamente dependiente de las condiciones del estrés hídrico, ya que resulta evidente que la disponibilidad de agua es una condición esencial para la activación de los procesos metabólicos que dan lugar a la aparición de la radícula como inicio de la germinación (Dubrencq et al, 2000).
Resultados análogos reportaron Mohammadkhani y Heidari (2008) al estudiar la respuesta de la germinación al estrés inducido por PEG-6000 (-0.15; -0.49; -1.3 y -1.76 MPa) en dos cultivares de maíz, encontrando que la germinación fue inversamente proporcional a las concentraciones de PEG.
Por su parte, Gholami et al. (2010) encontraron respuestas similares al evaluar el efecto del estrés inducido por diferentes concentraciones de PEG (0.0; -0.05; -0.1 y -0.5 MPa) sobre la germinación de cuatro especies de Prunus.
La tasa de germinación (Cuadro 2) mostró diferencias significativas entre los diferentes potenciales hídricos (F2,180= 2485.5, p= 0.00000) misma que se redujo un 65% en -0.75 MPa y 85% en -1.5 MPa. Esto se explica por la insuficiencia hídrica simulada por el PEG-8000, que le impide a las semillas una mayor eficiencia en los eventos involucrados en el proceso de germinación. El PEG no sólo retrasa la germinación, sino también afecta los porcentajes de germinación final, porque es una sustancia osmótica no penetrante que previene la absorción de agua por las células vegetales y alarga la duración de la fase de latencia entre la imbibición y el crecimiento radicular, puesto que la absorción del agua por la semilla procede lentamente en este periodo (Aparecida y Zambillo, 2003).
Variables morfométricas
En la longitud de la radícula se encontraron diferencias significativas entre los genotipos (F19,2340=637; p= 0.00000), entre los diferentes potenciales hídricos (F2,2340=7679; p= 0.00000) y entre la interacción de genotipos*niveles de potencial hídrico (F38,2340)= 466.2; p= 0.00000). Los genotipos Lemon y Sweet Dani mostraron una respuesta estadísticamente significativa frente a la condición de -0.75MPa (Cuadro 3), cuyo crecimiento es la respuesta biológica que induce el estrés moderado de esa condición, coincidiendo con los resultados reportados por Sharp et al. (1988) y Blum (2005), ellos encontraron que la longitud de la raíz principal se incrementa en condiciones de estrés hídrico, debido a que la planta necesita una zona de exploración mayor para buscar agua y desarrollar sus procesos fisiológicos.
Resultados similares se encontraron en estos trabajo para los genotipos Emily y Dolly que mostraron una tendencia al crecimiento de la radícula en niveles de sequía severo (-1.50 MPa) como respuesta adaptativa, superando los valores del grupo control (0 MPa). El resto de los genotipos disminuyeron la longitud de su raíz ante los tratamientos de potencial hídrico (Cuadro 3). La altura de plántula mostró diferencias significativas entre genotipos (F19,2339= 350.8; p= 0.00000), entre los diferentes potenciales hídricos (F2, 2339= 12114, p=0.00000) y entre la interacción de genotipos*potenciales hídricos (F38,2339= 163.52, p= 0.00000).
El genotipo Sweet Dani mostró una respuesta significativamente diferente a esta variable en el control y en -0.75 MPa (Cuadro 3), su crecimiento fue nulo con un potencial hídrico de -1.50 MPa, demostrando incapacidad de desarrollarse en estas condiciones. Otro grupo de genotipos disminuyeron la altura y toleraron un estrés de -1.5 MPa (Sweet Queen, Red Rubin, Thai, Dark Opal, Spicy Glove, Mrs Burns, Licorice, Purples Ruffles, Italian Large Leaf, Lectuce Leaf, Emily y Dolly). Resultados similares fueron encontrados por Nagafabadi et al. (2003) y (González et al. 2005) donde el efecto detrimental del PEG puede explicarse por el déficit hídrico que produce en los tejidos en crecimiento, al disminuir la turgencia de las células y por cambios en la permeabilidad de las membranas.
También Méndez et al. (2010) demostró que el proceso de elongación y de síntesis de la pared celular son altamente sensibles a la deficiencia de agua disminuyendo la turgencia de las células y el crecimiento. Otra hipótesis plausible puede ser la de Hamayun et al. (2010) quienes analizaron el crecimiento de variedades de soya y señalan que los efectos por el PEG conducen a la disminución significativa del crecimiento debido a una disminución de la actividad enzimática (enzimas hidroliticas), tales como la α-amilasa, proteasas y lipasas responsables de hidrolizar las reservas de los cotiledones requeridas para proveer energía en las primeras etapas del crecimiento (Figura 1A y B).
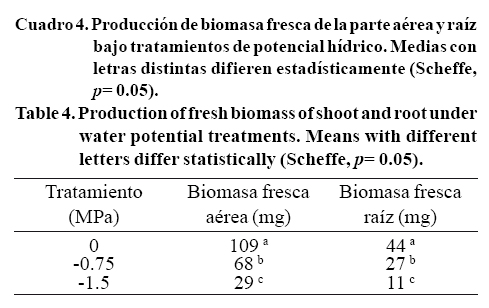
Los resultados mostraron diferencias significativas entre genotipos para biomasa fresca de parte aérea (F19,180= 75.7, p= 0.00000), raíz (F19,180=178.4, p= 0.00000), asi como para la interacción para la interacción genotipos*potenciales hídricos para las variables biomasa fresca de parte aérea (F38, 180= 35.13, p= 0.00000) y raíz (F38, 180=31.0, p= 0.00000). El genotipo Sweet Dani en -0.75 MPa y el genotipo Dolly en -1.5 MPa los de mayor biomasa fresca de parte aérea (Figura 1A), mostrando tolerancia en ambos. Los genotipos que mostraron una mayor biomasa fresca de raíz con el tratamiento de -0.75 MPa fueron Italian large leaf, Emily y Dolce Vita; para el tratamiento de -1.50 MPa los genotipos con mayores valores fueron, Licorice, Purple Rufles, Italian Large Leaf (Figura 1B).
Los genotipos Sweet Dani en -0.75 MPa y Red Rubin en -1.50 MPa mostraron mayor producción de biomasa fresca de raíz a 0 MPa (Figura 1B) disminuyendo conforme los potenciales hídricos fueron más negativos. Se observaron diferencias significativas entre los diferentes niveles de potencial hídrico al analizar la biomasa fresca de parte aérea (F2, 180= 1824.3, p= 0.00000) y biomasa fresca de raíz (F2, 180= 828.9, p= 0.00000) independientemente de los genotipos (Cuadro 4). Por lo anterior, se infiere que el aumento de la biomasa es inversamente proporcional a las concentraciones de PEG, ya que la biomasa fresca disminuyó 35% en -0.75 MPa y 70% en -1.5 MPa, probablemente por la afectación de la turgencia y elongación celular (Martin de Santa Olalla et al., 2005)
Se presentaron diferencias significativas entre genotipos para biomasa seca de parte aérea (F19, 180=1.9, p= 0.01353) y su interacción con los genotipos (F38,180= 2.7, p= 0.00000), donde lo genotipos Sweet Genovese y Spicy Glove mostraron los valores máximos para el tratamiento de -0.75 MPa (Figura 2A). En el tratamiento de -1.5 MPa los genotipos Slam Queen, Red Rubin, Thai y Dark Opal presentaron los valores más altos (Figura 2A). Diferencias estadísticas se presentaron entre genotipos y tratamientos (F38,180=12.27, p= 0.00000) y su interacción (F19,180=81.9, p= 0.00000).
Esta respuesta parece obedecer más al tratamiento con potencial hídrico de -1.5 MPa ya que la respuesta de la mayor parte de los genotipos bajo potencial hídrico de -0.75 MPa tiende a ser similar al del grupo control correspondiente a cada genotipo (Figura 2B). A excepción de los genotipos Sweet Dani, Dark Opal y Spicy Glove parecieron no verse afectados por los tratamientos de déficit hídrico en cuanto a la producción de biomasa seca de raíz, aunque fue baja comparada a los genotipos Lectuce leaf y Dolly, tanto bajo el tratamiento de -0.75 MPa, como del grupo control (Figura 2B).
Dolly presentó también una mayor valor de producción de biomasa seca de raíz bajo el tratamiento más severo de potencial hídrico (-1.5MPa) comparado con el resto de los genotipos. La biomasa seca de parte aérea mostró diferencias significativas entre los diferentes potenciales hídricos (F2,180=18.8, p= 0.00000) con valores mayores en -0.75 MPa (Cuadro 5). Observando los resultados del Cuadro 4 (producción de biomasa fresca) el grupo control parece tener un mayor contenido de agua, ya que la disminución de biomasa al ser sometidos al secado se pierde hasta 93% (Cuadro 4 y 5).

En el caso de los tratamientos de -0.75MPa la disminución fue 70% (Cuadro 4 y 5) y para -1.5 MPa una disminución del 67%. La mayor producción de biomasa seca correspondió al tratamiento de -0.75 MPa. La variable biomasa seca de raíz mostró diferencias significativas entre potenciales hídricos (F2,180= 198.17, p= 0.00000); observándose igualdad estadística de esta variable entre los tratamientos de 0 y -0-75 MPa (Cuadro 5). Pudiéndose deber al crecimiento de las raíces en condiciones de estrés como respuesta de la planta para explorar un área mayor en busca de agua como lo han encontrado diversos autores (Jerez et al., 2004; Nieto-Garibay et al., 2010).
Lo anterior puede ser explicado por un mayor tejido lignificado guardando más agua, sin expresarse como biomasa fresca. De acuerdo a los Cuadros 4 y 5, la disminución de la biomasa fresca a seca de plantas del grupo control fue de 86% y para el tratamiento de -0.75 MPa fue 78%; es decir, 10% de menos pérdida de agua que el grupo control.
En el tratamiento de -1.5 MPa, esta variable disminuyó más el crecimiento de la raíz limitando una posible respuesta adaptativa. De forma general la respuesta diferencial observada entre genotipos en las diferentes condiciones de estrés en la etapa de germinación y el crecimiento de las plántulas, indican la utilidad Potencial que pueden tener estos en la selección de genotipos tolerantes o susceptibles al estrés hídrico.
Conclusiones
Uno de los aspectos más importantes en los aspectos aplicados de estos resultados, es la aportación para mejorar la producción de este tipo de cultivos, en este sentido, en el presente trabajo se observó que bajo condiciones óptimas de humedad (0 MPa), los genotipos de mayor producción de biomasa fresca de la parte aérea fueron Sweet Dani, Lectuce Leaf y Napoletano. Sin embargo, en condiciones de estrés moderado (-0.75 MPa) el genotipo Sweet Dani y el genotipo Dolly, en condiciones de estrés severo (-1.50 MPa) fueron de mayor producción de biomasa fresca de la parte aérea y raíz. Lo cual permite pensar en la selección de genotipos como el Sweet Dani que con estrés o con un moderado estrés se obtendrían buenos resultados de producción de biomasa y Dolly cuando se trate de un mayor estrés hídrico. Las variables de crecimiento y germinación representan indicadores complementarios para la evaluación de la tolerancia y susceptibilidad de los diferentes genotipos de albahaca estudiados.
Agradecimientos
Al Centro de Investigaciones Biológicas del Noroeste (CIBNOR), y al Programa de Agricultura en Zonas Áridas (PAZA), al proyecto SAGARPA-CONACYT: Innovación tecnológica de sistemas de producción y comercialización de especies aromáticas y cultivos élite en agricultura orgánica protegida con energías alternativas de bajo costo, que financió el presente estudio. A las técnicas Ma. Del Carmen Mercado Guido y Lidia Hirales del laboratorio de Fisiotecnia Vegetal por su apoyo.
Literatura citada
Aparecida, M. E. and Zambillo, P. S. 2003. Germination of Senra occidentales link: seed at different osmotic potential levels. Brazilian Archiv. Biol. Technol. 2:38-43. [ Links ]
Barroso, L. y Jerez, E. 2000. Comportamiento de las relaciones hídricas en la albahaca blanca (Ocimum basilicum L.) al ser irrigadas con diferentes volúmenes de agua. Cultivos Tropicales. 3:57-59. [ Links ]
Blum, A. 2005. Drought resistance, water use efficiency, and yield potential- are they compatible, dissonant, or mutually exclusive. Australian J. Agric. Res. 56:1159-1168. [ Links ]
Bradford, K. J. 1986. Manipulation of seed water relations via osmotic priming to improve germination under stress conditions. HortScience. 21:1105-1112. [ Links ]
Dubrencq, B.; Bergen, N.; Vincent, E.; Borsson, M.; Caboche. M. and Lepiniec, L. 2000. The Arabidoposis AT EDRI entensin-like gene is speerficolly expressed in endosperm duvisg seed germination. Plant J. 23:643-652. [ Links ]
El-Beshbishy, H. A. and Bahashawn, S. A. 2012. Hypoglycemic effect of basil (Ocimum basilicul) aqueous extract is mediated through inhibition of α-amylase activities: an in vitro study. Toxicology and Industrial Health. 28:42-50. [ Links ]
Emmerich, W. and Ey Hardegree, S. P. 1991. Seed germination in polyethylene glycol solution: effects of filter paper exclusion and water vapor loss. Crop Sci. 31:454-458. [ Links ]
Fereres, E. and Soriano, Ma. A. 2007. Deficit irrigation for reducing agricultural water use. J. Exp. Bot. 58:147-159. [ Links ]
Gholami, M.; Rahemi, M. and Kholdebarin, B. 2010. Effect of drought stress induced by polyethylene glycol on seed germination of four wild almond species. Australian J. Basic Appl. Sci. 4:785-791. [ Links ]
González, L. M.; Argentel, L.; Zaldívar, N. y Ramírez, R. 2005. Efecto de la sequía simulada con PEG-6000 sobre la germinación y el crecimiento de las plántulas de dos variedades de trigo. Cultivos Tropicales. 4:49-52. [ Links ]
Hamayun, M.; Afzal Khan, S.; Khan Shinwari, Z.; Latif Khan, A.; Ahmad, N. and In-Jung, L. 2010. Effect of polyethylene glycol induced drought stress on physio-hormonal attributes of soybean. Pakistan J. Bot. 42:977-986. [ Links ]
International Seed Testing Association (ISTA). 1999. International Rules for Seed Tesing. Zurich, Switzerland. 321p. [ Links ]
Jackson, R. B.; Sperry, J. S. and Dawson, T. E. 2000. Root water uptake and transport: using physiological processes in global predictions. Trends in Plant. 5:482-488. [ Links ]
Jerez, E.; Barroso, L. y Cartaya, O. 2004. Efectos de periodos cortos de estrés e inoculación micorrízica en el comportamiento de la albahaca blanca (O. basilicum L.). Cultivos Tropicales. 2:29-35. [ Links ]
Little, T. M. y Hills, F. J. 1989. Statistical methods in agricultural research. Versión en español. Métodos estadísticos para la investigación en la agricultura. Ed. Trillas. México. 128 p. [ Links ]
Maguire, J. D. 1962. Speed of germination aid in selection and evaluation for seedling emergence and vigor. Crop Sci. 2:176-177. [ Links ]
Martin de Santa Olalla, M. F.; Fuster, P. L. y Belmonte, A. C. 2005. Agua y agronomía. Universidad de Castilla- La Mancha. Edit. Mundi Prensa. España. 606 p. [ Links ]
Méndez, N. J.; Ybarra, F. y Merazo, P. J. 2010. Germinación y desarrollo de plántulas de tres híbridos de maíz bajo soluciones osmóticas. VI. Comparación entre cinco soluciones osmóticas. Tecnológica ESPOL-RTE. 1:55-60. [ Links ]
Michel, B. F. and Kauffman, M. R. 1973. The osmotic potential of polyethylene glycol-6000. Plant Physiol. 51:914-916. [ Links ]
Mohammadkhani, N. and Heidari, R. 2008. Water stress induced by polyethylene glycol 6000 and sodium chloride in two maize cultivars. Pakistan J. Biol. Sci.11:92-97. [ Links ]
Nagafabadi, M. F.; Ghanadha, M. R.; Zali, A. A. y Yazdi, B. 2003. Inheritance of bread wheat seed germination at drought conditions. (consultado en: <http//www.treebuotech 2003.noonod. se/s10-p.htm> [ Links ]).
Nieto-Garibay, A.; Murillo-Amador, B.; Troyo-Diéguez, E.; García-Hernández, J. L. and Ruíz-Espinoza, F. H. 2010. Water stress in two capsicum species with different domestication grade. Tropical and Subtropical Agroecosystems. 12: 353-360. [ Links ]
Sayar, R.; Bchini, H.; Mosbahi, M. and Exxine, M. 2010. Effects of salt and drought stresses on germination, emergence and seedling growth of Durum wheath (Triticum durum Desf). J. Agric. Res. 5:2008-2016. [ Links ]
Sharp, R. E.; Silk, W. and Hsiao, T. H. 1988. Growth of the maize primary root at low water potentials. Plant Physiol. 87:50-57. [ Links ]
Secretaría de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación (SAGARPA). Servicio de Información Agroalimentaria y Pesquera Servicio (SIAP) 2009. www.siap.gob.mx. [ Links ]
StatSoft Inc. 2011. Statistica. System reference. StatSoft, Inc., Tulsa, Oklahoma, USA. 1098 p. [ Links ]
Steel, G. D. R. y Torrie, J. H. 1995. Bioestadística. Principios y procedimientos. Ed. McGraw Hill. México. 92 p. [ Links ]
Wenrao, L; Zhang, S; Shan, L and Eneji A., E. 2011. Changes in root characteristics, gas exchange and water use efficiency following water stress and rehydration of Alfalfa and Sorghum. Australian J. Crop Sci. 5:1521-1532. [ Links ]
Yeşiloğlu, Y. and Şit, L. 2012. Antioxidant properties of various solvent extracts from purple basil. Spectrochimica Acta Part A: Mol. and Biomol. Spectroscopy. 95:100-106. [ Links ]














