Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ciencias agrícolas
versão impressa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.3 no.spe4 Texcoco Nov./Dez. 2012
Caracterización de suelos en una localidad tipo que alberga cactáceas priotarias para su conservación
Adriana Luna Olvera1, Monserrat Espino Armendáriz1, Laura Luna Martínez1 y Juan Ramiro Pacheco Aguilar1§
1 Laboratorio de Suelos de la Facultad de Química. Universidad Autónoma de Querétaro. Cerro de las campanas s/n. Colonia, Las Campanas. Querétaro, Querétaro. C. P. 76010. Tel: (442)-1921200. Ext. 5531. Fax: (442) 1921302. (anairda_vack@hotmail.com; monse_1605@hotmail.com; lunamartla@yahoo.com.mx). § Autor para correspondencia: ramiro.pacheco@uaq.mx.
Resumen
El 60% del territorio mexicano está constituido por zonas áridas y semiáridas, cuya vegetación de matorral xerófilo y pastizales se caracteriza por la presencia de cactáceas y plantas arbustivas. En el estado de Querétaro se tiene registrado la presencia de 112 especies de cactáceas, algunas endémicas como Mammillaria mathildae Kraehenb. et Krainz. Sin embargo, algunos agentes de disturbio, como el saqueo de especies y el cambio en uso de suelo entre otros, han contribuido a la disminución de individuos que afectan en general a la mayoría de las poblaciones de cactáceas. El conocimiento de las condiciones ambientales en las cuales se desarrollan estás plantas es determinante para establecer estrategias encaminadas a la conservación de su hábitat. En el presente trabajo se determinaron la fertilidad de los suelos, las poblaciones microbianas y las actividades enzimáticas de la rizósfera de cuatro cactáceas: Ferocactus latispinus, Mammillaria mathildae, Coryphantha radians y Mammillaria magnimamma, que crecen en la localidad de "La Cañada" perteneciente al municipio El Marqués, Querétaro. Encontrando que son suelos de origen volcánico clasificados como franco-arenosos, con bajo contenido de materia orgánica y nitrógeno, donde la mayor parte del carbono está constituido por cenizas. No se encontraron diferencias significativas en cuanto a las poblaciones microbianas en los suelos rizosféricos con respecto a los suelos desnudos sin vegetación, pero si existió una mayor actividad enzimática en la rizósfera de las cactáceas, lo que indica un recambio constante de nutrientes generado por el metabolismo de los microorganismos que se desarrollan in situ.
Palabras clave: deshidrogenasa, fosfatasa, nutrientes, rizósfera, ureasa.
Introducción
Una gran parte del territorio mexicano está constituido por zonas áridas y semiáridas (60%), donde las lluvias son escasas, y la evapotranspiración supera a la precipitación, con poca cobertura vegetal, y condiciones de suelo que favorecen la erosión. Su presencia se extiende a los siguientes estados de la República: Baja California, Baja California Sur, Durango, Coahuila, Chihuahua, Nuevo León, San Luis Potosí, Sonora, Zacatecas y Tamaulipas, Hidalgo, Oaxaca, Puebla y Querétaro. Estas zonas albergan gran parte de la biodiversidad de México cuyas condiciones ambientales favorece también la presencia de especies endémicas (Montaño y Monroy, 2000).
La vegetación característica de estas zonas incluye la familia etnobotánica de las cactáceas, cuya diversidad se ha reportado que alcanza los 63 géneros y 669 especies. En Querétaro la diversidad de especies de cactáceas está cuantificada entre 93 y 112 especies, la mayoría de ellas distribuidas en la zona árida ubicada entre los estados de Querétaro e Hidalgo, la cual también ha sido catalogada como una de las áreas con mayor número de cactáceas amenazadas (Chávez et al., 2006), encontrando quince especies enlistadas en la NOM-059-SEMARNAT-2001, con riesgo de extinción y seis especies con bajas poblaciones, que las colocan en riesgo similar a las señaladas por la norma ambiental (Chávez et al, 2007). Otra zona que amerita atención similar es La Cañada en el municipio del Márques, una localidad cercana a la ciudad de Querétaro en la cual se han registrado 21 especies endémicas de cactáceas (Cabrera y Gómez, 2005; Martínez et al, 2008).
Algunos agentes de disturbio identificados en una o ambas zonas son el saqueo de especies para su comercialización, la destrucción del hábitat por cambio de uso de suelo, la extracción de cantera, la contaminación del Río Querétaro, la agricultura y la ganadería no planeada, todo esto ha provocado una disminución generalizada en las poblaciones de cactáceas en el estado (Chávez et al, 2007; Hernández et al, 2007; Martínez et al, 2008), tal es el caso de Mammillaria mathildae, una especie catalogada en peligro de extinción (NOM-059-ECOL-2001), cuyo hábitat ha sido reducido a poco más de 1 ha.
Otras especies que ameritan atención especial en la Cañada son Mammillaria magnimamma Haw. Briton et Rose, Stenocactus dichroacanthus (Mart. Ex Pfeiff.), A. Berger ex Backeb. et F. M. Kunth y Stenocereus queretaroensis (F. A. C. Weber) Buxb, aunque sus poblaciones son relativamente numerosas son objeto de explotación con fines ornamentales y de consumo. Especies como Coryphantha radians, Burseri palmeri, Echinocactus platyacanthus y Ferocactus latispinus, requieren de estudios de distribución y conservación en la región de El Bajío y en el estado de Querétaro que aclaren su aparente extinción (Cabrera y Gómez, 2005).
Los suelos áridos presentan baja fertilidad, en los cuales las poblaciones microbianas que se desarrollan in situ son indispensables para el desarrollo de la plantas. Particularmente, las actividades enzimáticas que se presentan en la rizósfera son de vital importancia ya que contribuyen a la disponibilidad de nutrientes como el nitrógeno (N) y el fósforo (P). La rizósfera es la porción de suelo directamente influenciada por las raíces de las plantas, siendo el rizoplano la superficie de la raíz, que incluye además las partículas de suelo adheridas a las raíces. La rizósfera es una zona de interacción dinámica entre las raíces de las plantas y los microorganismos del suelo, donde se presenta una alta actividad biológica caracterizada también por un aumento en la biomasa microbiana. Dicha actividad se ve altamente influenciada por los exudados radicales, los cuales sirven de nutrientes para el desarrollo de las poblaciones microbianas rizosféricas (Calvo et al., 2008).
Otros parámetros del suelo que se ve influenciados por la rizósfera son las actividades enzimáticas que interviene en la mineralización y adquisición de nutrientes para las plantas. Actividades como la deshidrogenasa (ADH) es considerada un parámetro clave para determinar la fertilidad del suelo. Dicha actividad es un indicador del sistema redox microbiano (Mirás et al., 2007), la cual ha sido empleada para evaluar suelos degradados y suelos de cultivo, así como también ha sido utilizada para evaluar la incorporación de residuos orgánicos y el impacto de la contaminación por metales pesados, plaguicidas y lluvia ácida (Chanders y Brooker, 1991; Acosta y Paolini, 2005; Zamora et al., 2005).
La mineralización del fósforo proveniente de la materia orgánica, es llevada a cabo por un grupo de enzimas conocidas como fosfatasas; las cuales catalizan la hidrólisis de ésteres y de anhídridos de ácido fosfórico. Las fosfatasas ácidas se encuentran principalmente en suelos ácidos, mientras que las alcalinas predominan en suelos con pH básico (Fernández, 2008). La ureasa es una enzima que lleva a cabo la hidrólisis de uniones peptídicas de amidas lineales generando amonio como producto, su actividad está relacionada con la mineralización de la urea proveniente de residuos orgánicos y de fertilizantes químicos (Quintero et al., 2003).
El objetivo del presente trabajo es conocer las fertilidad del suelo donde crecen las cactáceas Mammillaria mathildae, Coryphantha radians, Mammillaria magnimmama y Ferocactus latispinus, en la localidad de "La Cañada" perteneciente al municipio El Marqués, y determinar el efecto de la rizósfera sobre las poblaciones microbianas y las actividades enzimáticas del suelo.
Materiales y métodos
Área de estudio y fertilidad de suelos
Los suelos de estudio en este trabajo fueron obtenidos de "La Cañada", El Marqués en marzo de 2010. Para lo cual se muestrearon 14 transectos de 25 m2, las muestras fueron etiquetadas como MRCI a MRCXIV. "La Cañada" se localiza a 3.5 km al sureste de la ciudad de Santiago de Querétaro (20° 36', 20° 38' latitud norte y 100° 18', 100° 20' longitud oeste). Su altitud oscila entre 1 850 y 2 030 m. El clima se considera semiseco templado con lluvias entre los meses de mayo a septiembre. La temperatura media anual es de 18 °C, con una máxima de 22 °C durante el mes de mayo (Chávez et al, 2006).
En esta localidad crecen las cactáceas: M. mathildae, C. radians, M. magnimmama y F. latispinus entre otras, las cuales son objeto de estudio en el presente trabajo (Figura 1). Las muestras de suelo fueron analizadas de acuerdo a la Norma Oficial Mexicana NOM-021-RECNAT-2000, que establece las especificaciones de fertilidad, salinidad y clasificación de suelos, muestreo y análisis.
Actividades enzimáticas
Para la determinación de las actividades enzimáticas fueron obtenidos suelos de la rizósfera de las cactáceas: M. mathildae (suelo 1), C. radians (suelo 2), M. magnimmama (suelo 3) y F. latispinus (suelo 4), también se empleo un suelo testigo desnudo sin vegetación (suelo G).
La actividad deshidrogenasa en las muestras fue medida por la reducción del sustrato trifeniltetrazolio (TTC) a trifenilformazán (TPF), la mezcla de reacción fue incubada por 24 hrs a 37 °C y el TPF producido fue leído en un espectrofotómetro a 485 nm. La concentración fue determinada empleando una curva estándar de 0.01 a 0.08 μΜ de TPF (Tabatabai, 1999).
Para determinar la actividad ureasa se empleo el método descrito por Tabatabai (1994), el cual se basa en la incubación de la muestras con una solución de urea 0.2 M por 2 h a 37 °C. El amonio resultante se determino mediante el método del azul de indofenol, el complejo colorido fue medido en un espectrofotómetro a 640 nm, y la concentración de amonio fue determinada empleando una curva estándar de 1 μΜ a 5 μΜ N-NH4 (Calvo et al, 2008; Tabatabai, 1999).
La determinación de la actividad fosfatasa ácida y alcalina se realizó mediante el método descrito por Tabatabai y Bremner, el cual está basado en la acción de las fosfatasas sobre el sustrato p-nitrofenol fosfato (PNP), empleando una solución amortiguadora a pH 6.5 u 11, dependiendo la actividad a medir, fosfatasa acida o alcalina respectivamente. Las muestras fueron incubadas a 37 °C por 1 h y el nitrofenol liberado fue medido en un espectrofotómetro a 410 nm, su cuantificación fue determinada empleando una curva estándar de 10 a 50 μg de p-nitrofenol (Tabatabai, 1999).
Análisis microbiológicos
Para cuantificar las poblaciones cultivables de bacterias, hongos y actinomicetos, se emplearon alícuotas de diluciones decimales de los suelos, las cuales fueron sembradas en placas conteniendo agar nutritivo para bacterias, rosa de bengala para hongos y agar almidón-caseína-nitrato para actinomicetos. Las placas fueron incubadas a 30 °C durante tres días para bacterias, cinco días para hongos y 10 días para actinomicetos, al término del tiempo fueron contadas las colonias y expresadas como unidades formadoras de colonias por gramo de suelo (Mora, 2010).
Resultados y discusión
El análisis fisicoquímico que se presenta en el Cuadro 1, nos indica que los suelos rocosos donde crecen las cactáceas son de textura franco arenoso, los cuales además poseen una conductividad hidráulica media que permite la retención de humedad. De acuerdo al pH son considerados como fuertemente a moderadamente ácidos con efectos despreciables de salinidad. Por su origen volcánico poseen bajo contenido de materia orgánica donde la mayor parte del carbono estaría constituido por cenizas (Pajares et al, 2010). La capacidad de intercambio catiónico (CIC) es variable, ya que se encontraron lugares con mediana y alta capacidad.
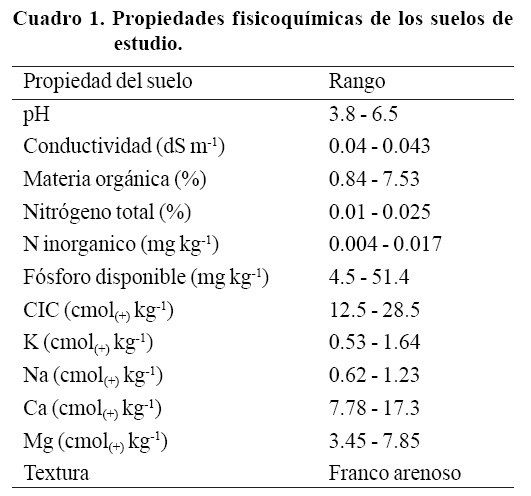
En cuanto al nitrógeno total, se encontró que los suelos poseen un bajo contenido, correlacionado también con el muy bajo contenido de nitrógeno inorgánico. En cuanto al contenido de fósforo disponible se encontraron cuadrantes donde se registraron valores bajos de 6.2, hasta valores altos de 51.4 mg kg-1 de suelo. Esto indica una heterogeneidad en cuanto a disponibilidad de fósforo, el cual fue correlacionado de manera positiva con el pH del suelo.
Las bases intercambiables en los suelos como el sodio (Na) y magnesio (Mg) y calcio (Ca) se encontraron en valores dentro de los normales en la mayoría de los sitios de muestreo. El potasio fue la única base intercambiable que se encontró en altas concentraciones, característico de suelos volcánicos (andisoles) jóvenes (Pinochet et al, 2005).
El Cuadro 2 muestra que la abundancia de poblaciones bacterianas fueron constantes en todos los suelos, mientras que para las poblaciones de hongos, el suelo 3 presenta una mayor abundancia que los suelos restantes, a diferencia de las poblaciones de actinomicetos la cuales se mantuvieron del orden de cinco, solo para el suelo 4 fue detectada una menor población.

La fertilidad de un suelo involucra no solo la parte mineral sino también las poblaciones microbianas que mejoran la disponibilidad de nutrientes en las plantas (Reyes y Valery, 2007). Comparando los resultados de las poblaciones microbianas con un suelo agrícola arcilloso del rancho "El Colmenar" en Querétaro, Querétaro, se pueden comentar que la abundancia de las poblaciones de bacterias se mantuvieron en un mismo orden, mientras que las poblaciones de actinomicetos fueron menores en un orden, contrario a lo que ocurrió con los hongos los cuales se vieron aumentados en un orden (Mora, 2010).
La Figura 2 muestra la actividad enzimática deshidrogenasa encontrada en las muestras de suelo, podemos apreciar que en la rizósfera de M. mathildae, se presenta mayor actividad con respecto a las demás muestras, la rizósfera de M. magnimamma fue la que mostró menor actividad junto con el suelo testigo (G). Los valores encontrados en esta actividad enzimática son similares cuando son comparados con actividades obtenidas de suelos enmendados con carbón orgánico al 1% o aquellos donde se realizan prácticas de rotación de cultivos hortícolas (Acosta y Paolini, 2005; Zamora et al, 2005).

En la Figura 3 se muestran las actividad enzimática ureasa, la rizósfera de M. mathildae fue la que presento mayor actividad; mientras que la de menor actividad fue la rizosféra de M. magnimamma, pudiera correlacionarse con la actividad deshidrogenasa, donde también la rizosféra de M. magnimamma, presento los índices más bajos en las muestras de suelos ensayadas. Los valores encontrados en estos ensayos son menores con respecto a los reportados para los suelos de cultivo y pudiera estar correlacionado con la poca cantidad de materia orgánica y nitrógeno, que se encontró en los análisis químicos del suelo (Wyszkowska et al., 2006; Lichner et al., 2007; Shahinrokhsar et al., 2008), aunque reportes de actividad ureasa en suelos áridos indican que los resultados encontrados en este estudio son mayores tanto en la rizósfera como en el suelo control (García et al., 2009).

Finalmente en la Figura 4 y 5 se muestran los resultados de la medición de la actividad fosfatasa ácida y alcalina respectivamente. Para ambas fosfatasas la rizósfera de M. mathildae presento la mayor actividad, mientras que para la fosfatasa ácida, la rizósfera de C. radians, mostro los menores valores, y para la actividad fosfatasa alcalina, la rizósfera de M. magnimamma fue la que presento los valores más bajos. Los valores encontrados en este ensayo son semejantes a los reportados en suelos agrícolas, donde se ha evaluado la labranza convencional y el efecto del encalado del suelo (Barroti y Nahas, 2003; Balota et al., 2004). En general en la rizósfera de M. mathildae se presentó la mayor actividad enzimática, lo que muestra su adaptación al sitio como especie endémica.


En todas las determinaciones, la rizósfera de las cactáceas tuvo un efecto positivo incrementando las actividades enzimáticas.
Conclusiones
Aunque la fertilidad de los suelos donde crecen las cactáceas, presenta bajo contenido de nitrógeno y materia orgánica, la rizósfera de las cactáceas provee exudados que incrementan el metabolismo de las poblaciones microbianas, reflejado también por un incremento en la actividad enzimática. Las relaciones planta-microorganismos que se establecen en la rizósfera dependen del género y especie de la planta, estas modifican la estructura de la comunidad microbiana y las actividades enzimáticas.
Literatura citada
Acosta, Y. y Paolini, J. 2005. Actividad de la enzima deshidrogenase en un suelo calciorthids enmendado con residuos orgánicos. Agron. Trop. 55(2):217-232. [ Links ]
Balota, E.; Kanashiro, M.; Colozzi, A.; Souza, D. and Dick, R. 2004. Soil enzime activities under long-term tillage and crop rotation systems in subtropical agro-ecosistems. Braz. J. Microbiol. 35:300-306. [ Links ]
Barroti, G. y Nahas, E. 2003. El fósforo y el encalado sobre las fosfatasas y la producción de Braquiaria ruziziensis y Cajanus cajanl. Agron. Trop. 53(2):209-225. [ Links ]
Cabrera, L. J. A. y Gómez, S. M. 2005.Análisis floristico de la cañada, Querétaro México. Boletín de la Sociedad Botánica de México. 77:35-50. [ Links ]
Calvo, P.; Meneses, L. y Zúñiga, D. 2008. Estudio de las poblaciones microbianas de la rizósfera del cultivo de papa (Solanum tuberosum) en zonas altoandinas. Ecol. Apl. 7(1-2):141-148. [ Links ]
Chander, K. and Brookes, P. C. 1991. Is the dehydrogenase activity assay invalid as a method to estimate microbial activity in copper-contaminated soils. Soil Biol. Biochem. 23:909-915. [ Links ]
Chávez, M. R. J.; Sánchez, M. E.; Hernández, M. M.; Hernández, O. J. y Hernández, M. R. 2006. Propagación de especies amenazadas de la familia Cactaceae del semidesierto queretano. Boletín de la Sociedad Latinoamericana y del Caribe de Cactáceas y otras Suculentas. 3:9-14. [ Links ]
Chávez, M. R. J.; Hernández, O. J. y Sánchez, M. E. 2007. Documentación de factores de amenaza para la flora cactológica del semidesierto querétano. Bol. Nakari. 18:89-95. [ Links ]
Fernández, L. 2008. Estudio de la fosfatasa ácida y alcalina en suelos de la región Pampeana Norte del área sojera Argentina. Ci suelo. 26(1):35-40. [ Links ]
García, C.; Batisda, F. and Hernández, T. 2009. Organic wastes as amendments to avoid soil degradation in semiarid zones. 1st national conference on advanced in materials recycling and eco-energy. Madrid, España. 213-216. [ Links ]
Hernández, O. J. G.; Chávez, R. y Sánchez, E. 2007. Efecto del disturbio crónico en Echinocereus Schmollii (Weing.) In : Taylor, N. P. Una cactácea en peligro de extinción en el semidesierto queretano, México. 10:59-73. [ Links ]
Lichner, L.; Hernández, T.; Mataiz, J.; Stekaurova, V.; Zaujec, A. and García, C. 2007. Assessing the microbiological, biochemical, soil-physical and hydrological effects of amelioration of degraded soils. International Scientific Conference. Polana nad Detvou, Slovakia. 1-6. [ Links ]
Martínez, M.; Hernández, S. L.; Gómez, S. M.; Bárcenas, L. R.; Pantoja, H. Y.; Díaz, P. D. y Salinas S. P. 2008. Diversidad de plantas nativas en Querétaro y el área conurbada. Extensión nuevos tiempos: Biodiversidad en Querétaro. 10:22-25. [ Links ]
Mirás, J.; Sande, P. y Vidal. E. 2007. Actividad deshidrogenasa en dos posiciones topográficas de un suelo de cultivo. Cadernos Lab. Xeolóxico de Laxe. 32:151-163. [ Links ]
Montaño, A. N. y Monroy, A. A. 2000. Conservación ecológica de suelos en zonas áridas y semiáridas en México. Ciencia y Desarrollo. 154:26-37. [ Links ]
Mora, M. 2010. Aislamiento y caracterización de rizobacterias de suelos agrícolas con potencial de ser empleadas como "biofertilizantes" en la producción de hortalizas. Querétaro, Querétaro. Universidad Autónoma de Querétaro. Tesis de licenciatura en Biología. 13-16 pp. [ Links ]
Norma Oficial Mexicana NOM-021-RECNAT-2000. Que establece las especificaciones de fertilidad, salinidad y clasificación de suelos. Estudios, muestreo y análisis. [ Links ]
Norma Oficial Mexicana NOM-059-ECOL-2001. Protección ambiental-especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-lista de especies en riesgo. [ Links ]
Pajares, M. S.; Gallardo, L. J. y Etchevers, B. J. 2010. Indicadores bioquímicos en suelos de un transecto altitudinal en el eje neovolcánico mexicano. Agrociencia. 44:261-274. [ Links ]
Pinochet, T. D.; Azúa, G. P. y Macdonald, H. R. 2005. Dinámica del potasio en un transecto de suelos derivados de materiales volcánicos y metamórficos. Informaciones agronómicas. 25:1-4. [ Links ]
Quintero, R.; Ferrera, R.; Etchevers, J.; García, N.; Rodríguez, R.; Alcántar, G. y Aguilar, A. 2003. Enzimas que participan en el vermicompostaje. Terra Latinoamerica. 21(1):73-80. [ Links ]
Reyes, I. y Valery, A. 2007. Efecto de la fertilidad del suelo sobre la microbiota y la promoción del crecimiento del maíz (Zea mays L.) con Azotobacter spp. 19(3): 117-126. [ Links ]
Shahinrokhsar, P.; Shokri, H. and Haghdadi, A. 2008. Evaluation of some paddy soils properties on urease enzyme activity. In: Conference on international research on food security, natural resource management and rural development. University ofHohenheim, Iran. 1-4 pp. [ Links ]
Tabatabai, M. A. 1999. Soil enzymes. Methods of soil analysis Part. 2 Microbiological and Biochemical properties. Soil science society of America, Inc. USA. 778-826 pp. [ Links ]
Wyszkowska, J.; Kucharski, M. y Kucharski, J. 2006. Application of the activity of soil enzymes in the evaluation of soil contamination by diesel oil. Polish J. Environ. Stud. 3:501-506. [ Links ]
Zamora, F.; Pastor, J. y Rodríguez, N. 2005. Cambios en la biomasa microbiana y la actividad enzimática inducidos por la rotación de cultivos en un suelo bajo producción de hortalizas en el estado Fálcon, Venezuela. Multiciencias. 5(1):62-70. [ Links ]














