Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias agrícolas
versión impresa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.3 no.6 Texcoco nov./dic. 2012
Artículos
Desarrollo floral del maíz in vitro durante la inducción y multiplicación de brotes*
Maize floral development in vitro during the induction and shoot multiplication
Mónica Beatriz López Hernández1§, Ma. Cristina Guadalupe López Peralta2, Víctor Arturo González Hernández3 y Elizabeth Cárdenas Soriano4
1 Campo Experimental Edzná. INIFAP. Carretera Campeche-Pocyaxum, km 15.5 San Francisco de Campeche, Campeche. C. P 24520. Tel. 01 9818139748. §Autora para correspondencia: lopez.monica@inifap.gob.mx.
2 Fisiología Vegetal, Campus Montecillo. Colegio de Postgraduados. Carretera México-Texcoco, km 36.5. Montecillo, Texcoco, Estado de México. C.P. 56230. Tel. 01 5959520200. (cristy@colpos.mx)
3 Genética, Campus Montecillo. Colegio de Postgraduados. Carretera México-Texcoco, km 36.5. Montecillo, Texcoco, Estado de México. C.P. 56230. Tel. 01 5959520200. (vagh@colpos.mx)
4 Fitosanidad. Campus Montecillo. Colegio de Postgraduados. Carretera México-Texcoco, km 36.5. Montecillo, Texcoco, Estado de México. C.P. 56230. Tel. 01 5959520200.
* Recibido: enero de 2011
Aceptado: agosto de 2012
Resumen
El cultivo in vitro para la inducción floral presenta una ventaja por la facilidad de aplicar diversos estímulos que induzcan o inhiban este fenómeno sin involucrar factores ambientales (Scorza, 1982). Los altos rendimientos en maíz como en muchos cultivos depende principalmente del número de granos producidos por planta y se ha observado que el número de mazorcas está determinado por reguladores de crecimiento endógenos (Leal-León et al, 2002). Durante la organogénesis directa del maíz in vitro obtenida a partir de la base del coleóptilo se generan estructuras reproductivas femeninas de manera precoz, lo cual es un problema en la inducción y multiplicación in vitro de brotes de maíz debido a la competencia por la asimilación de los componentes del medio de cultivo (Iracheta et al, 2003). En el Colegio de Postgraduados en Ciencias Agrícolas, en 2006 se estudió la función de las fitohormonas en el desarrollo floral de líneas de maíz en la inducción y multiplicación de brotes probando diferentes citocininas en diferentes dosis y en combinación con dos dosis de ácido indól acético. Las líneas evaluadas difirieron en su capacidad morfogénica, siendo las líneas de maíz L13 y L14 las que mostraron la mayor capacidad de inducción de brotes. La iniciación floral se detectó entre 10 y 15 d a partir de la siembra de explantes. El desarrollo de inflorescencias femeninas dependió del tipo de citocininas (de mayor a menor respuesta): BAP > KIN > TDZ. Con ZEA y 2iPA sólo se inducen y multiplican brotes vegetativos.
Palabras clave: Zea mays L., auxinas, citocininas, inflorescencias femeninas, tipo y dosis hormonal.
Abstract
In vitro culture for floral induction has an advantage because of the ease of applying various stimuli that induce or inhibit this phenomenon without involving environmental factors (Scorza, 1982). High yields in maize as in many crops depend primarily on the number of grains per plant produced and has been observed that the number of ears is determined by endogenous growth regulators (Leal-Leon etal, 2002). During direct organogenesis in vitro of corn obtained from the base of the coleoptile female reproductive structures are generated at an early stage, which is a problem in the induction and in vitro multiplication of shoots of corn due to competition for the assimilation of components of the culture medium (Iracheta et al, 2003). In the Graduate College in Agricultural Sciences in 2006 studied the role of phytohormones in floral development of maize lines in the induction and shoot multiplication trying different cytokinins at different doses and in combination with two doses of indole acetic acid. The lines tested differed in their morphogenic capacity, being the maize lines L13 and L14 which showed the highest shoot induction capacity. Floral initiation was detected between 10 and 15 d from seeding explants. The development of female inflorescences depended on the type of cytokinin (highest to lowest response): BAP> KIN> TDZ. With ZEA and 2iPA only induce and multiply vegetative shoots.
Key words: Zea mays L., auxins, cytokinins, female inflorescences, type and hormonal dose.
Introducción
Las técnicas del cultivo de tejidos vegetales in vitro se usan en la agricultura para la producción masiva de clones sanos, y para estudios bioquímicos, fisiológicos, anatómicos, de selección in vitro, entre otros (Roca y Mroginski, 1991). El éxito reproductivo de una planta depende de que complete su ciclo hasta la floración (Montero y Jiménez, 2009). Durante el proceso de inducción floral, a nivel meristemo, ocurren una serie de eventos que afectarán el hábito de crecimiento vegetativo, incluyendo pérdida de la dominancia apical, alargamiento del tallo, cambios en la filotaxia y la forma de la hoja (Galoch et al, 2002).
El inicio de la floración está fuertemente regulado por cambios ambientales relacionados con factores estacionales tales como el fotoperiodo, la temperatura y el estado de desarrollo de la planta (Bernier et al., 1993). El cultivo in vitro para los estudios de inducción floral presentan una ventaja por la facilidad de aplicar diversos estímulos que induzcan o inhiban este fenómeno sin involucrar factores ambientales (Scorza, 1982). Dichos estudios han buscado establecer un modelo eficiente, reproducible y simple para la inducción floral; lo anterior con el fin de facilitar estudios a nivel molecular y bioquímico de los procesos involucrados como: inactivación, sobreexpresión, interacción entre genes y factores de trascripción, avances en la producción de híbridos entre otros estudios (Nadgauda et al., 1990; Roldan et al, 1999; Rohit et al, 2009).
En maíz, los altos rendimientos dependen principalmente del número de granos producidos por cada planta y se ha observado que el número de mazorcas por plantas está determinado por reguladores de crecimiento endógenos (Leal-León et al, 2002). Por tanto, este sistema puede ser de mucha utilidad para estudiar los diferentes procesos involucrados en el desarrollo de las inflorescencias de maíz; debido a que muchos procesos de desarrollo vegetal son complejos de estudiar in vivo. En la organogénesis del maíz, el tiempo de obtención de regenerantes se reduce considerablemente con el empleo de ápices de brotes como explantes. La organogénesis directa, permite evadir los problemas de variación somaclonal que se presentan al tratar de regenerar plántulas vía cultivo de células y callos (Nadhi y de Wet, 1995).
De manera general, el factor principal en el desarrollo de estructuras reproductivas son las fitohormonas las cuales son compuestos orgánicos sintetizados por las plantas y que influyen sobre su desarrollo; son consideradas como las principales señales de estímulo para la inducción floral. Su relación tanto a nivel de la inducción como de morfogénesis de la flor, indica que su acción es multifactorial (Bernier et al., 1993; Perillelux y Bernier, 1997; Williams, 2004).
A nivel fisiológico las citocininas han sido determinantes en la inducción floral de muchas especies de plantas; en cultivos in vitro las citocininas pueden inducir el desarrollo floral a partir de varios órganos. Al respecto, explantes nodales de Ocimunm basilicum L. mostraron proliferación de brotes después de 7 a 10 d cultivados en medio basal MS (Murashige y Skoog, 1962) suplementado con 1.5 mg L-1 de Kinetina; 90% de estos brotes se diferenciaron en flores al ser subcultivados sobre medio basal MS (Murashige y Skoog, 1962) suplementado con 5 mg L-1 de Bencil aminopurina y 1 mg L-1 de ácido indól acético (Sudhakaran y Sivasankari, 2002). Leal et al. (2002) encontraron que el crecimiento de inflorescencias femeninas de maíz fue promovido porAIA a 1.5 mg L-1 y Zeatina a 1 mg L-1. Rohit et al. (2009) observaron el desarrollo de inflorescencias femeninas generadas de brotes apicales en Medio MS suplementado con 2 mg L-1, después de 42 d de incubación.
De acuerdo a los antecedentes mencionados, el objetivo de esta investigación fue estudiar el desarrollo de inflorescencias durante la inducción y multiplicación in vitro de brotes de maíz en presencia de diferentes dosis y tipos de fitohormonas. También se presenta evidencia sobre la histología y desarrollo de las inflorescencias usando la técnica de microscopía de barrido.
Materiales y métodos
Material vegetal, medio de cultivo y condiciones ambientales de incubación. El experimento se llevó a cabo en el laboratorio de biotecnología agrícola del Campus Montecillo del Colegio de Postgraduados en Ciencias Agrícolas. Se usaron semillas sanas y de tamaño uniforme de diez líneas endogámicas experimentales: LE13, LE14, LE15, LE16, LE20, LE29, LE30, LE46, LE48, y LE78, generadas en el programa de genética del Campus Montecillo, Colegio de Postgraduados en Ciencias Agrícolas, a través del proyecto "formación de arquetipos de maíz". Se usó el medio de cultivo básico de Murashige y Skoog (1962), 30 g L-1 sacarosa, 6.5 g L-1 agar Merck®, y las fitohormonas según los tratamientos a evaluar. El pH fue ajustado a 5.7 y 5.8, según la etapa de evaluación con un potenciómetro (Orion Research Digital pH/milivoltimeter 611). El medio de cultivo se esterilizó en una autoclave vertical (AESA, modelo 300) a 121 °C y 1.1 kg cm-2 presión durante 20 min. Los frascos y tubos con el material sembrado se colocaron en un cuarto de incubación con fotoperiodo de 16/8 h luz/oscuridad proporcionado por lámparas de luz blanca fría fluorescente de 75 W, (irradiancia fotosintética de 45 μmol m-2 s-1), temperatura de 26 ± 2 °C y humedad relativa de 30%.
Análisis estadístico. Todos los análisis estadísticos se hicieron con el paquete estadístico SAS (Institute Inc., N.C. USA, 2000); para la comparación de medias se utilizó la prueba de tukey con un nivel de significancia de p≤ 0.05.
Germinación in vitro. Semillas de diez líneas experimentales de maíz se desinfectaron de acuerdo a Iracheta et al. (2003). Las semillas desinfectadas fueron colocadas en tubos de ensayo de 75 mL con 10 mL del medio basal Murashige y Skoog (1962) pH a 5.7. El periodo de incubación fue de 12-15 d.
Evaluación de la respuesta genotípica y de la posición del explante en la inducción de brotes. Las diez líneas experimentales mencionadas anteriormente fueron comparadas en cuanto a su capacidad organogénica para formar brotes. De cada plántula se escindió el primer centímetro basal del coleóptilo, del cual se cortaron los primeros cinco discos (explantes) de 1 mm de grosor, conservando la posición del explante en la planta. Los explantes asépticos fueron colocados en frascos de 250 mL con 30 mL de medio de cultivo para la inducción de brotes; constituido por el medio básico MS (1962), y suplementado con 6.6 uM de BAP y 5.7 μM de AIA, pH de 5.8. A los 21 d de incubación se registró el número de explantes con brotes (NEB), número de brotes por explante (NBE), número de hojas por brotes (NHB), longitud del brote (LB) y porcentaje de supervivencia de explantes (SE). Las variables se analizaron con un diseño completamente al azar con 12 repeticiones.
Efecto de diferentes tipos y dosis hormonales en la iniciación floral durante la de inducción de brotes. De plántulas asépticas de la línea experimental L13, se extrajeron los dos primeros segmentos (discos de 1 mm grosor cada uno) de la parte basal del tallo, y se incubaron en el medio básico MS (1962) pH de 5.8 y combinaciones factoriales según tratamientos (Cuadro 1). A los 21 d de incubación se registró el NEB y el NBE. Los datos se analizaron mediante un diseño completamente al azar con arreglo factorial (5 x 3 x 2) con 12 repeticiones, correspondiente a las combinaciones de cinco citocininas entres dosis y dos dosis de AIA.

Efecto de diferentes tipos y dosis hormonales en la iniciación floral durante la multiplicación de brotes. Brotes obtenidos en la etapa de inducción se transfirieron a un medio de multiplicación de brotes donde se usó el mismo medio, tipos y concentraciones hormonales empleados en la fase de inducción. Al terminar el periodo de incubación se registró la tasa de multiplicación de brotes TMB (número de brotes producidos a partir del brote inicial o tasa de multiplicación de brotes) y el número de inflorescencias por brote (NIB). Las variables se analizaron en un diseño completamente al azar con arreglo factorial 5 x 3 x 2 con 12 repeticiones.
Análisis microscópico de la iniciación floral in vitro a partir de brotes. Para identificar el tiempo de inicio de los primordios florales por brote, se tomaron muestras de brotes por tratamiento (Cuadro 1) de la línea experimental L13 a los 10, 15 y 20 d después de la siembra de explantes en el medio de inducción. Los brotes se diseccionaron y observaron en un microscopio estereoscópico para observar el estado de desarrollo.
Análisis histológico de inflorescencias de maíz obtenidas in vitro. Muestras tomadas durante las fases de inducción y multiplicación se fijaron en FAA (alcohol etílico absoluto, ácido acético glacial, formaldehido y agua destilada, en proporción 50:5:10:35 v/v) por un periodo de 72 h y se deshidrataron en alcohol etílico (50,70, 96 y 100%) e incluyeron Paraplast Sigma®. Los cortes histológicos de 12 μm de grosor se hicieron con un micrótomo rotatorio (Spencer 820), se colocaron en un baño de flotación (agua y grenetina) a 60 °C, se adherieron a portaobjetos y se tiñeron con safranina-verde rápido. Finalmente los cortes se montaron en resina sintética, se observaron y fotografiaron con un microscopio III Carl Zeiss con una cámara digital Pixera Profesional integrada.
Observación del desarrollo floral in vitro mediante microscopía el ectrónica de barrido. Muestras de inflorescencias menores de 1 cm de tamaño y provenientes de la fase de multiplicación de brotes fueron fijadas por 24 h en gluteraldehído 3% y una solución amortiguadora de fosfatos 0.2 M, pH 7.4. Posteriormente las muestras fueron lavadas con agua destilada y deshidratadas mediante inmersiones consecutivas en soluciones de 30%, 40%, 50%, 60%, 70%, 80% y 90% de alcohol, durante 15 min cada una. Después de la deshidratación las muestras se secaron a punto crítico con CO2 en una secadora Sandri-780A® y se recubrieron con oro durante 4 min en una ionizadora JFC-1100®. Las muestras se observaron en un microscopio electrónico de barrido JSM-35C®.
Resultados y discusión
Evaluación de la respuesta genotípica y de la posición del explante en la inducción de brotes. Se detectaron diferencias estadísticas entre las diez líneas de maíz en NEB, NBE y SE. Las líneas L13 y L14 mostraron la mayor capacidad organogénica en NEB, mientras que L29 y L30 presentaron la menor capacidad en NEB (Cuadro 2). En el NBE los genotipos L13, L14, L46, L48 y L78 mostraron los mayores valores. La máxima supervivencia de brotes fue 40% y ocurrió en las líneas L13 y L14. Por tanto, las variaciones en la capacidad organogénica se atribuyen a la variabilidad genética entre las líneas, asociada con variaciones en la concentración endógena de fitohormonas (López et al., 1992). Otros autores (Armstrong y Green, 1985; Pareddy y Petolino, 1990) han señalado que la iniciación y el mantenimiento del cultivo de células y tejidos de maíz y la exitosa regeneración de las plantas, dependen del genotipo, además de factores fisiológicos y ambientales.
Efecto de la posición del explante. De los cinco discos consecutivos (1 a 5) cortados de la base del coleóptilo que se utilizaron como explante, sólo los dos primeros discos cercanos a la parte basal (2 mm) mostraron respuesta organogénica, esto debido a que la base del coleóptilo presenta una zona meristemática (Figura 1A) y; los discos más alejados de la base del coleóptilo, por no contener tallo, fueron incapaces de regenerar brotes, se oscurecieron y senescieron (Iracheta et al, 2003) (Figura 1B). Esto también, fue reportado por Zhong et al. (1992 a, b) al observar que los explantes de brotes de maíz con mayor capacidad organogénica fueron las secciones del coleóptilo más cercanas al mesocótilo, generando brotes adventicios y brotes laterales de los entrenudos.

Efecto de diferentes tipos y dosis hormonales en la iniciación floral durante la inducción de brotes. En este experimento se probaron 31 tratamientos resultantes de cinco citocininas (BAP, ZEA, KIN, 2iPA y TDZ), cada una en tres dosis (2.2, 4.4 y 6.6 μM), combinadas con dos dosis (5.7 y 7.4 μM) de la auxina AIA, en cuanto a su efecto en la inducción y multiplicación de brotes, y en el desarrollo de estructuras reproductivas de la línea de maíz L13 la cual presentó la mejor respuesta organógenica del resto de las líneas experimentales de maíz.
Se detectaron diferencias estadísticas entre tratamientos en el NEB y NBE por efecto de los tres factores: citocinina (CK), dosis de citocininas (DCK) y dosis de AIA (DA) y de las interacciones citocininas x dosis de citocininas (CKxDCK) y citocininas x dosis de auxinas (CKxDA) lo que evidencia fuertes efectos hormonales durante la inducción de brotes; para NBE sólo hubo diferencias estadísticas entre DCK. BAP fue la mejor citocinina para la inducción de brotes y 2iPA tuvo el menor efecto (p≤ 0.05). La inducción se incrementó conforme aumentó la dosis de citocininas de 2.2 a 6.6 μM, en NEB y en NBE; para AIA, 5.7 μM fue mejor dosis que 7.4 μM respecto a NEB (p≤ 0.05) (Cuadro 3).

Aunque para todas las citocininas se logro un incremento en el número de brotes al incrementar las dosis hasta 6.6 uM, el máximo número de brotes se logro con 6.6 μM BAP (Figura 2). Similarmente Wenbin et al. (2002) reportaron un incremento en el desarrollo de brotes de maíz in vitro en medio basal MS (Murashige y Skoog, 1962) con 3.5 mg L-1 BAP y 1.5 mg L-1 2,4-D, indicando que BAP juega un papel crítico durante el desarrollo floral de maíz; esto lo confirman Jana y Gyan (2011) en la floración in vitro en callos embriogénicos de Anethum graveolens en medio MS (Murashige y Skoog, 1962) suplementado con 0.5 mg 1-1 de BAP.

De acuerdo con Raman et al. (1980), el número de brotes axilares de maíz cultivado in vitro se incrementa con la aplicación kinetina en comparación con otras fitohormonas y con ZEA y BAP se indujeron estructuras reproductivas. Brotes in vitro de bambú (Bambusa edulis) derivados de espigas, desarrollados por embriogénesis somática, fueron inducidos para florecer sobre medio MS con 0 30 g L-1 de sacarosa, diferentes hormonas fueron añadidas al medio de cultivo: 0.5 μM TDZ, 23.2 μM KIN, 16.2 μM BAP y 22.8 ZEA y varias concentraciones de ácido naftalen acético (ANA):0, 2.7, 5.4, 26.9 y 53.8 μM, para probar sus efectos sobre la floración in vitro. Los resultados mostraron que ANA fue un regulador negativo dependiente de citocinina para la floración in vitro; TDZ incrementó la tasa de floración 47% al igual que BAP con 42.9%. ANA incrementó el enraizamiento pero inhibió el crecimiento reproductivo inducido por el TDZ así como el número de brotes reproductivos. Al incrementar la concentración de ANA a 53.8 uM, declinó la floración in vitro (Chuon et al, 2003).
El efecto de cada citocinina en las dos dosis de AIA fue diferente (Figura 3). Por ejemplo el número de explantes con brotes inducido por TDZ y 2iPA se redujo considerablemente al aumentar la dosis de AIA, mientras que para BAP, ZEA y KIN la dosis de AIA no afectó su desempeño en inducción de brotes (Figura 3); además, en ambos niveles de AIA, BAP produjo la mayor tasa de organogénesis. Britto et al. (2003; Willams, 1991) mencionan que el efecto de citocininas y auxinas en la morfogénesis in vitro varía entre especies y variedades, y principalmente depende del nivel endógeno de tales fitohormonas en la planta. Joshi y Nadgauda (1997) probaron el efecto de varias citocininas: AdS, BAP, 2iPA, KIN y ZEA en la floración in vitro de bambú; de todas ellas, BAP fue la que indujo floración in vitro al igual que KIN y AdS en combinación con BAP. 2iPA y ZEA presentaron un efecto antagonista.

Efecto de tipos y dosis hormonales sobre la iniciación floral durante la multiplicación de brotes. Los brotes generados en la fase de inducción se incubaron en el mismo medio de cultivo con sus respectivos tratamientos hormonales (Cuadro 1) usado para la inducción de brotes. Se detectaron diferencias estadísticas (p≤ 0.05) entre CK y entre DCK tanto en TMB como en NIB, también hubo efecto de las interacciones CKxDCK para la TMB. En general, las citocininas BAP, ZEA, KIN y 2iPA mostraron mayores tasas de multiplicación de brotes que TDZ. Todas las citocininas probadas mostraron mayores tasas de multiplicación de brotes (número de brotes/brote inicial). Estos resultados fueron similares a los observados durante la inducción de brotes respecto a los diferentes tipos y dosis de citocininas (Figura 4).
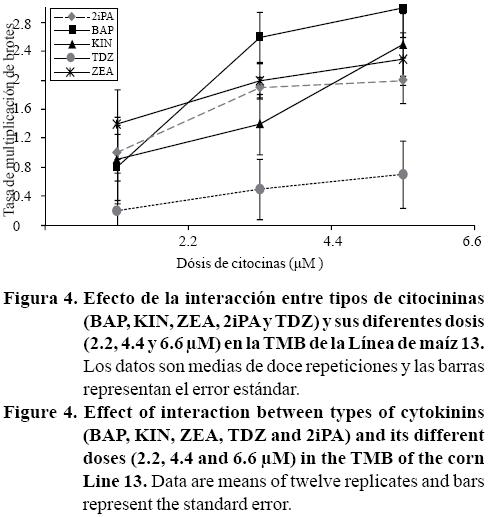
El NIB también fue fuertemente influenciado por la interacción entre tipo de citocininas y sus dosis. Para esta variable, 6.6 uM BAP indujo el mayor número de inflorescencias en relación a las otras citocininas evaluadas (Figura 5). Al incrementar las dosis hasta 6.6 uM de las citocininas BAP, KIN y TDZ, se incrementó el número de inflorescencias inducidas por brotes y se redujo el número de brotes vegetativos. Con ZEA y 2iPA no hubo desarrollo floral (Figura 5) lo que indica que estas hormonas estimulan la inducción y multiplicación de brotes en maíz, pero no están involucradas en inducción de floración. Nuestros resultados también indican que BAP estimula tanto el desarrollo de brotes como el desarrollo floral. Esto concuerda con lo encontrado por Sudarshana et al. (2008) con BAP a 2 mg L-1 la mayor tasa de floración in vitro de Boerhaavia diffusa fue más evidente en comparado con otras fitohormonas; indicando que BAP es una hormona determinante para la floración in vitro.

De manera similar Xiong yYazawa (1995) para la inducción y desarrollo floral in vitro de brotes de Phalaenopsis en medio MS (1962), con 2.2, 4.4, 5.7 y 7.8 μM de BAP; con BAP a 2.2 μM no se formaron brotes florales pero con 5.7 y 7.8 μM 70 % de los brotes formaron flores a los 121 días de cultivo. Según Patil et al. (1993) los niveles exógenos de BAP y kinetina estimulan floración in vitro al activar los contenidos endógenos de citocininas. Sin embargo, altas concentraciones de varias citocininas pueden inhibir la inducción florar y ocasionar un efecto en la brotación de yemas vegetativas (Kachonpadungkitti et al., 2001; Galoch et al, 2002, Taylor et al, 2005).
En la presente investigación también se estudio la interacción entre los diferentes tipos de citocinina y dos dosis de AIA, en el desarrollo de inflorescencias por brotes; KIN estimuló el desarrollo de inflorescencias por brote, al aumentar la dosis de 5.7 a 7.4 μMAIA; en cambio, con BAP el desarrollo floral disminuyó al incrementar la dosis de AIA. (Figura 6). Con ZEA y 2iPA no se encontró desarrollo de inflorescencias, lo que indica que estas hormonas estimulan la inducción y multiplicación de brotes en maíz, pero sin causar floración. Virupakshi et al. (2002) describieron la respuesta de callos derivados de explantes juveniles de Sacccharum officinarum L. Var. CoC671 en la floración in vitro, a partir de hojas jóvenes cultivadas en medio MS suplementado con 3% de sacarosa, 3 mg L-1 de 2,4-D y 1 mg L-1 ANA. La floración fue observada después de 180 días de cultivo y la iniciación de la floración fue explicada por la presencia de brotes florales iniciales en la región embriogénica y por la adición de BAP. De manera similar Zhong et al. (1992), observaron el mismo comportamiento en medio de cultivo suplementado con BAP. Srinivasan y Mullins, (1978) encontraron en Vitis vinifera L. que el desarrollo de flores fue dependiente de la combinación de BAP y ZEA conAIA, la formación de brotes aumentó de 30% a 75% al aumentar BAP de 2.0 a 5.4 μM.

Análisis microscópico de la iniciación floral in vitro a partir de brotes. A los 10 d se detectaron solamente brotes en estado vegetativo. Sin embargo, a los 15 d se observaron yemas axilares en los nudos (Figura 7A) en (T4, T22, T25 y T24) de los 31 tratamientos evaluados. Algunas yemas mostraron la iniciación de flores femeninas lo cual evidencia el inicio de la etapa reproductiva (Figura 7B). A los 20 d se observaron primordios de estructuras reproductivas femeninas (Figura 7 C, D) en estados tempranos y avanzados del desarrollo floral en los tratamientos (T4, T22, T25 y T29).

Análisis histológico de las inflorescencias de maíz obtenidas in vitro. En los cortes histológicos de brotes de maíz in vitro se observaron células meristemáticas probablemente originando las inflorescencias en la región del parénquima adyacente a los haces vasculares (Figura 8A). Las inflorescencias observadas en los cortes histológicos presentaron varios de los órganos típicos de las inflorescencias femeninas de maíz tales como megasporas, glumas internas y externas, primordio de carpelo y estambre (Figura 8B y C). Los cortes histológicos también mostraron regiones con aspecto meristematico (células pequeñas, redondas y con contenido citoplasmático denso) de células de procambium. Las células de las regiones meristemáticas presentaron gran actividad mitótica y núcleos prominentes (Figura 8D). Mediante este análisis se puede inferir que las inflorescencias se originaron directamente de las yemas laterales de los brotes vegetativos inducidos previamente a partir de discos de tallo de maíz in vitro. Vasil et al. (1985) y Fransz y Schel (1994) mencionaron que la presencia de centros proembriogénicos cercanos al procambium puede estar relacionada con los altos niveles de fitohormonas y flujo de nutrientes en estos sitios. Esto podría explicar el origen histológico de las inflorescencias femeninas en el presente estudio.

Observación del desarrollo floral in vitro mediante microscopía electrónica de barrido. Para una mejor descripción de las estructuras reproductivas femeninas encontradas in vitro de hizo uso de la microscopía electrónica de barrido, los resultados indican una morfología similar de inflorescencias desarrolladas a partir de brotes vegetativos cultivados in vitro a la observada in vivo, (Figura 9A). Se pudo observar diferentes estructuras que componen a la inflorescencia femenina del maíz como son: Meristemos de espiguillas (me), el cual da inicio al desarrollo primordios de glumas (Figura 9B); Meristemo de espiguilla (me) que desarrolla un meristemo de florecillas (mf); a su vez se desarrollan los primordios de glumas; gluma externa (ge) (Figura 9C); también se observó el desarrollo de órganos florales incluyendo tres anteras (an) y primordio de pistilo (pp) (Figura 9D).

Conclusiones
La capacidad organogénica en inducción de brotes vegetativos fue expresada de manera diferencial en ocho líneas experimentales de maíz (L13, L14, L15, L16, L20, L46, L48 y L78). Las líneas L13 y L14 mostraron la mayor capacidad organogénica expresada como brotes vegetativos, mientras que las líneas L29 y L30 presentaron la más baja capacidad. Durante la inducción de brote s en la línea L13, el número de explantes con brotes varió dependiendo del tipo de citocininas y de sus dosis, y así la respuesta hormonal en orden decreciente fue: BAP > ZEA > KIN y TDZ > 2iPA, siendo la mejor dosis 6.6 uM de todas las citocininas en combinación con AIA (7.4 μM).
El desarrollo de inflorescencias femeninas de maíz ocurrió durante la inducción in vitro de brotes a partir de la base del coleóptilo (3 mm). La formación de inflorescencias varió en función del tipo y dosis hormonal. El desarrollo de inflorescencias femeninas del maíz in vitro, observada durante la etapa de multiplicación de brotes, varió entre tipos de citocininas (de mayor a menor respuesta): BAP > KIN > TDZ. Con las citocininas ZEA y 2iPA no hubo desarrollo de inflorescencias femeninas in vitro. as inflorescencias femeninas del maíz se originaron de las yemas axilares del tallo.
Literatura citada
Armstrong, C. L. and Green, C. E. 1985. Establishment and maintenance of friable, embryogénie maize callus and the involvement of L-proline. Planta 164:207-214. [ Links ]
Bernier, G.; Havelange, A.; Houssa, C.; Petitjean, A. and Lejeune, P. 1993. Physiological signals that induce flowering. Plant Cell 5:1147-1155. [ Links ]
Britto, S; Natarajan, J. E. and Arockiasamy, D. I. 2003. In vitro flowering and shoot multiplication from nodal explants of Ceropegia bulbosa. Taiwania 48:106-111. [ Links ]
Chuon, S.; Chung, C. and Ching, W. 2003. In vitro flowering ofBambusa edulis and subsequent plantlet survival. Plant Cell Tissue Organ Cult. 72:71-78. [ Links ]
Fransz, P. F. and Schel, H. 1994. Ultraestructural studies on callus development and somatic embryogenesis in Zea mays L. In: Bajaj, Y. P. S. (ed). Biotechnology in agriculture and forestry: maize. Springer-Verlag, Berlin. 25:50-65. [ Links ]
Galoch, E.; Czaplewska, J.; Burkacka, L. E and Kopcewicz. E. J. 2002. Induction and stimulation of in vitro flowering of Pharbitis nil by cytokinin and gibberellin. Plant Growth Regul.37:199-205. [ Links ]
Iracheta, D. L.; López, P. M.; González, H. V. A. and Cárdenas, S. E. 2003. In vitro characterization of organogenic capacity in maize: induction, maintenance, rooting and histological origin of shoots. Agrociencia 37:451-465. [ Links ]
Jana, S. and Gyan, S. 2011. Plant growth regulators, adenine sulfate and carbohydrates regulate organogenesis and in vitro flowering ofAnethum graveolens. Acta Physiol Plant. 33(2):305-311. [ Links ]
Joshi, M. S. and Nadgauda, R. S. Cytokinin and vitro induction of flowering in bamboo: Bambusa rundinacea. Current Sci. 73:523-526. [ Links ]
Kachonpadungkitti, Y.; Romchatngoen, S.; Hasegaw, K. and Hisajima, S. 2001. Efficient flower induction from cultured buckwheat (Fagopyrum esculentum L.) node segments in vitro. Plant Growth Regulation 35:37-45. [ Links ]
Leal, L. V.; López, P. M. and González, H. V. In vitro development of young maize ears. 2002. Plant Cell Tissue Organ Cult. 71:133-139. [ Links ]
López, P. M.; Sánchez, C. I. y Muñoz L. S. 1992. Propagación in vitro de jitomate. In: Memorias del XIV Congreso Nacional de Citogenética. UNACH. Tuxtla Gutiérrez, Chiapas, México. 17 p. [ Links ]
Montero, C. W. y Jiménez, V. M. 2009. Floración in vitro. Revisión de literatura. Biotecnología Vegetal. 9(1):3-18 p. [ Links ]
Murashige, T. and Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plantarum 15:473-497. [ Links ]
Nadgauda, R. S.; Parasharami, V. A.; and Mascarenhas, A. F. 1990. Precocious flowering and seeding behavior in tissue cultured bamboos. Nature 344:335-336. [ Links ]
Nadhi, S. and De Wet, J.M. 1995. In vitro regeneration of Sorghum bicolor lines from shoot apices. Int. Sorghum and Millets Newsletter 36:88-90. [ Links ]
Pareddy, D. R. and Petolino, J. F. 1990. Somatic embryogenesis and plant regeneration from immature inflorescences of several elite inbreds of maize. Plant Sci. 67:211-219. [ Links ]
Patil, M.; Ramaswamy, N. M. and Rangasgamy, S. R. 1993. In vitro flowering in sun flower H. annus L. Current Sci. 65:565-569. [ Links ]
Perilleux, C. and Bernier, G. 1997. Leaf carbohydrate status in Lolium temulentum during the induction of flowering. New Phytologist 135:59-66 [ Links ]
Raman, K, D.; Walden, B. and Greyson, R. I. 1980. Propagation of Zea mays L. by shoot tip culture: A feasibility study. Annal Bot. 45:183-189. [ Links ]
Roca, W. y Mroginski, L. 1991. Cultivo de tejidos en la agricultura. Fundamentos y aplicaciones. Regeneración de plantas en cultivo de tejidos, embriógenesis somáticas y organogénesis. CIAT. Colombia. 970 p. [ Links ]
Rohit, J.; Alok, S. and Pramod, K. 2009. In vitro flowering hill maize: a novel technique for future. Indian J. Plant Physiol. 14(3):299-302. [ Links ]
Statistical Analysis System (SAS Institute) 2000. SAS/STAT User' Guide. Release 6.03.Cary, N.C USA. [ Links ]
Scorza R. 1982. In vitro flowering. Horticultural Reviews 4:106-127. [ Links ]
Srinivasan, C. and Mullins, M. G. 1978. Control of flowering in the gravepine (Vitis vinifera L.). Formation of inflorescences in vitro by isolated tendrils. Plant Physiol. 61:127-130. [ Links ]
Sudarshana, M. S.; Niranjan, M. H. and Girish S. T. 2008. In vitro flowering somatic embryogenesis and regeneration in Boerhaavia diffusa L. Global J. Biotechnol. Biochem. 3(2):83-86. [ Links ]
Sudhakaran, S. and Sivasankari, V. 2002. In vitro flowering response of Ocimum basilicum L. J. Plant Biotech. 4:181-183. [ Links ]
Taylor, N. J.; Light, M. E.; and Staden, J. 2005. In vitro flowering of Kniphofia leucocephala: influence of cytokinins. Plant Cell Tissue Organ Cult. 83:327-333. [ Links ]
Vasil, V.; Lu, C.; and Vasil, I. K. 1985. Histology of somatic embryogenesis in cultured inmature embryos of maize (Zea mays L.). Protoplasma 127:1-8. [ Links ]
Virupakshi, S.; Manjunatha, B. and Naik, R. 2002. In vitro flower induction in callus from ajuvenile explant of suarcane, Saccharum officinarum L., Var. CoC671. Current Sci. 83:1195-1197. [ Links ]
Wenbin, L. I.; Masilamany, P.; Kasha, and Pauls, P. 2002. Developmental, Tissue culture and genotipic factors affecting plant regeneration from shoot apical meristems of germinated Zea mays L., seedlings. In vitro Cellular and Devevelopmental Biology- Plant. 38:285-292. [ Links ]
Williams, M. A. 2004. Hormonal regulation ofplant growth and development. Acta Hortic. 53:36-39. [ Links ]
Williams, R. R. 1991. Factors determining mineral uptake in vitro. Acta Hortic. 289:165-166. [ Links ]
Xiong, D. and Yazawa, C. 1995. Floral induction and development in Phalaenopsis in vitro. Plant Cell Tissue Organ Cult. 43:71-74. [ Links ]
Zhong, H.; Srinivasan, C. and Sticklen, M. B. 1992A. In vitro morphogenesis of corn (Zea mays L.). Differentiation of ear and tassel cluster from cultured shoot apices and inmature inflorescences. Planta 187:483-489. [ Links ]
Zhong, H.; Srinivasan, C. and Sticklen, M. B. 1992B. In vitro morphogenesis of corn (Zea mays L.). Differentiation of multiple shoots clumps and somatic embryos from shoot tips. Planta 187:490-495. [ Links ]














