Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias agrícolas
versión impresa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.3 no.4 Texcoco jul. 2012
Artículos
Crecimiento y contenido de prolina y carbohidratos de plántulas de frijol sometidas a estrés por sequía*
Growth and, proline and carbohydrate content of bean seedlings subjected to drought stress
Teresa Susana Herrera Flores1§, Joaquín Ortíz Cereceres2†, Adriana Delgado Alvarado3 y Jorge Alberto Acosta Galleros4
1 Colegio de Postgraduados- Campus Montecillo. Carretera México-Texcoco km 36.5 C. P. 56230. Montecillo Texcoco. Estado de México. §Autora para correspondencia: susyherrera75@yahoo.com.mx.
3 Colegio de Postgraduados-Campus Puebla. Carretera Federal México-Puebla km 125.5, Santiago Momoxpan, Municipio de San Pedro Cholula, Puebla. C. P. 72760. Tel. 01 595 9520200 Ext. 2012. (adah@colpos.mx).
4 Campo Experimental Bajío (CEBAJ). km6.5. Carretera Celaya-San Miguel de Allende. C. P. 38010. Celaya, Guanajuato. Tel. 01 461 6115323. Ext. 164. (acosta.jorge@inifap.gob.mx).
*Recibido: septiembre de 2011
Aceptado: abril de 2012
Resumen
El estrés por sequía en el altiplano de México, es un factor limitante en el rendimiento del frijol. En el presente trabajo se estudiaron las respuestas fisiológicas (crecimiento) y bioquímicas (carbohidratos solubles y prolina) en la radícula de plántulas de frijol resistente, Pinto Villa, y susceptible a la sequía Bayo Madero, ambas de la raza Durango, para identificar características rápidas de medir que sean confiables para selección por resistencia a estrés por sequía. La radícula de las plántulas se sometió a cuatro potenciales de humedad: -2.07, -0.52, -0.27 megapascales (MPa) y un testigo -0.16 MPa. Para las determinaciones de carbohidratos solubles y prolina se eliminó el potencial de -0.16 MPa, ya que provocó la pudrición del hipocótilo en el punto de unión con el cotiledón, en este caso el potencial de -0.27 se consideró como testigo. La radícula de ambas variedades tuvo mayor longitud en los tratamientos de menor estrés. En el potencial más crítico, -2.07 Mpa, Pinto Villa, acumuló mayor cantidad de prolina y sacarosa que Bayo Madero, mientras que los niveles de almidón fueron similares. Se observó correlación altamente significativa entre la elongación de la radícula con la acumulación de prolina, glucosa y fructosa (r= 0.99 respectivamente). La acumulación de solutos compatibles (glucosa, fructosa, sacarosa y prolina) en la radícula desarrollada en condiciones de estrés, favorece su crecimiento en etapas tempranas de desarrollo. Los solutos compatibles son apropiados como indicadores bioquímicos de selección de variedades resistentes al estrés de humedad durante los primeros tres días de la germinación.
Palabras clave: Phaseolus vulgaris L., carbohidratos, prolina, solutos compatibles.
Abstract
Drought stress in the highlands of México is a limiting factor in bean yields. In this work we studied the physiological responses (growth) and biochemical (soluble carbohydrates and proline) in the radicle of seedlings resistant beans, Pinto Villa and, susceptible to drought Bayo Madero, both of Durango race, in order to identify quick features to measure their reliability for selection of resistance to drought stress. The radicle of the seedlings were subjected to four moisture potentials: -2.07, -0.52, -0.27 megapascals (MPa) and a control -0.16 MPa. For determining the soluble carbohydrates and proline, the potential -0.16 Mpa was removed, since it caused the hypocotyl rot at the junction with the cotyledon, in this case the potential of-0.27 was considered as control. The radicle of both varieties had greater length in the treatments with less stress. In the most critical potential, -2.07 MPa, Pinto Villa, accumulated more proline and sucrose than Bayo Madero, while starch leveis were quite similar. Highly significant correlation was observed between the elongation of the radiocle with the accumulation of proline, glucose and fructose (r= 0.99 respectively). The accumulation of compatible solutes (glucose, fructose, sucrose and proline) in the radicle developed under conditions of stress, favors its growth in early stages of development. Compatible solutes are suitable as biochemical indicators for selection of varieties resistant to moisture stress during the first three days of germination.
Key words: Phaseolus vulgaris L., carbohydrates, proline, compatible solutes.
Introducción
El frijol es uno de los cultivos de mayor importancia en México, representa para la economía de los productores una fuente importante de ocupación e ingreso y una garantía de seguridad alimentaria. Se cultiva en todas las regiones del país, entre las que destaca la región del Altiplano del Centro-Norte con clima templado-semiárido, que comprende los estados de Chihuahua, Durango, Zacatecas, San. Luis. Potosí, y Guanajuato, donde en el ciclo primavera- verano se siembra 68% de la superficie nacional con este cultivo. La principal limitante para su producción es la escasa disponibilidad de humedad, situación que se agudiza en regiones con régimen pluvial restringido como en Zacatecas, Durango, San Luis Potosí y Chihuahua, donde la precipitación fluctúa entre 400 y 450 mm anuales. Para disminuir los efectos negativos de la escasa disponibilidad de humedad, es conveniente y práctico seleccionar especies vegetales o genotipos dentro de ellas que posean indicadores distintivos de tolerancia al estrés hídrico (Munns, 2002). Los indicadores fisiológicos como la concentración de prolina, carbohidratos y enzimas antioxidantes proporcionan información precisa sobre la capacidad que muestran las especies vegetales de adaptarse a ambientes limitantes de humedad y con ello cumplir con su ciclo biológico, por ello son superiores, en relación a los indicadores agronómicos (altura de planta, longitud de raíz y área foliar) cuando se hace selección para componentes de tipo complejo como la tolerancia a la sequía (Yeo, 1994). A pesar de que existe un gran número de investigaciones relacionadas con el estrés hídrico, orientadas principalmente hacia relaciones hídricas, fotosíntesis y acumulación de diferentes metabolitos orgánicos, aún no se conocen bien los sitios metabólicos en los que dicho estrés daña a la planta, ni los mecanismos adaptativos utilizados por las plantas para sobrevivir a esas condiciones adversas (Munns, 2002; Hieng et al., 2004).
Se han descrito diferentes indicadores bioquímicos relacionados con la tolerancia al estrés por déficit hídrico, inclusive hay evidencias de que los aminoácidos glicina, betaina y prolina juegan un papel adaptativo al mediar el ajuste osmótico y proteger los órganos de las plantas bajo estrés. El ajuste osmótico es un mecanismo involucrado en la tolerancia al estrés osmótico el cual es disminuido por la acumulación neta de solutos. Los principales solutos que se acumulan son iones potasio (K) (Gnanasiri et al., 1995), azúcares (Yakushiji et al., 1996) y aminoácidos como la prolina (Verslues y Sharp, 1999). Estos solutos son conocidos como ''solutos compatibles'' y no interfieren con la función metabólica normal de las plantas aún a altas concentraciones. Por ejemplo, en una línea de sorgo tolerante a la sequía se mostró la capacidad para acumular iones de potasio en el grano y mantener un alto contenido relativo de aguay presión de turgencia en condiciones de estrés, en comparación con una línea susceptible (Gnanasiri et al., 1995). Mientras que en el fruto de mandarina ''satsuma'' (Citrus unshiu Marc.) se evidenció que las concentraciones de sacarosa, glucosa y fructosa incrementaron en condiciones de estrés de humedad debido al ajuste osmótico (Yakushiji et al., 1996). El ajuste osmótico también ocurre debido al incremento en la acumulación de prolina en la zona de crecimiento de la raíz primaria en plántulas de maíz, lo cual juega un papel importante en el mantenimiento de la elongación de la raíz a bajos potenciales de agua (Voetberg y Sharp, 1991).
La energía radiante captada por las plantas, transforma el agua y el CO2 en compuestos orgánicos (azúcares) y es necesaria para la síntesis y transporte de solutos para el ajuste osmótico (Munns, 2002). Sin embargo, la excesiva acumulación de iones puede alterar el balance entre la absorción y la función de otros iones en la célula. Cuando la acumulación de solutos compatibles es necesaria en condiciones críticas de estrés, se espera que los azúcares y aminoácidos, que no afectan el metabolismo a pesar de tener un alto peso molecular, sean usados como solutos compatibles. De tal forma que la contribución relativa de cada soluto al ajuste osmótico puede variar con la intensidad del estrés (Ogawa y Yamauchi, 2006). Por otra parte se sabe que a pesar de que existen indicadores morfológicos, fenológicos, fisiológicos, y bioquímicos de la tolerancia al déficit hídrico, utilizados por los fitomejoradores con el propósito de optimizar la selección de plantas tolerantes al estrés en diferentes cultivos agrícolas, la expresión de estos indicadores varía, dependiendo de las características de la especie, de la etapa en que se aplica el estrés y de su intensidad y duración (Hieng et al., 2004).
Con base en lo anterior, el presente estudio tuvo como objetivo evaluar el efecto del déficit de humedad sobre el crecimiento y el nivel de carbohidratos solubles y prolina en la radícula de plántulas de frijol resistente a la sequía (Pinto Villa) y susceptible a la sequía (Bayo Madero), para identificar indicadores rápidos y confiables para selección por resistencia a estrés de humedad. Bajo las siguientes hipótesis de que la concentración de los carbohidratos sacarosa y almidón, así como de prolina, será mayor en la variedad resistente que en la susceptible. La concentración de glucosa y fructosa se presentará en menor proporción en ambas variedades por efecto del estrés por sequía.
Materiales y métodos
Material vegetal
Se utilizaron dos variedades mejoradas de frijol (Phaseolus vulgaris L.) Pinto Villa, resistente a la sequía y Bayo Madero susceptible a la sequía, ambas pertenecientes a la Raza Durango (Singh et al., 1991). Pinto Villa es una variedad de hábito de crecimiento indeterminado III, con tallos y ramas débiles semierectas, con guías cortas sin habilidad para trepar (CIAT, 1987). Alcanza la floración alrededor de los 43 días después de la siembra y la madurez fisiológica se presenta entre los 90 y 104 días después de la siembra, en Chihuahua (Acostaba et al., 1995). Esta variedad ha mostrado plasticidad fenológica en respuesta a factores ambientales adversos, como falta de humedad y bajas temperaturas en la etapa de llenado de grano, la que se manifiesta en un aceleramiento de la madurez y plasticidad fisiológica en parte debido a su sensibilidad al fotoperiodo, lo que le permite tener una amplia adaptación (Acosta y White, 1998), alcanza rendimientos de 1 723 kg ha-1 en temporal y 2 5 00 kg ha-1 en riego (Rosales et al., 2004).
Bayo Madero, es una variedad de hábito de crecimiento indeterminado III, con tallos y ramas débiles semierectas, las guías son cortas sin habilidad para trepar (CIAT, 1987). Para llevar a cabo la experimentación se pusieron a germinar 200 semillas de cada variedad en una cámara obscura (Oven Termacron mr, Wisconsin), a temperaturas entre 25 y 27 °C. Después de 3 ó 4 días, cuando la radícula de ambas variedades alcanzó una longitud de 3 a 5 cm, ésta se marcó con tinta china 2 mm arriba del ápice. Las plántulas se trasplantaron a tubos de PVC de 10 cm de largo y 6 cm de diámetro, con capacidad de 20 g de vermiculita grado 1 como sustrato, que funciona como un aislante mineral. Los tubos se cubrieron con polietileno negro para mantener la condición de oscuridad y favorecer sólo la longitud de la radícula.
Tratamientos de sequía
Se aplicaron cuatro tratamientos de humedad del sustrato 6, 10, 12 y 100% que correspondieron a potenciales de agua en Megapascales (MPa) de -2.07, -0.52, -0.27 y -0.16 respectivamente, determinados con cámaras psicrométricas (modelo C-52, Wescor) y con un micro voltímetro de punto de rocío (modelo HR-33T, Wescor). Las cámaras se calibraron con una solución de cloruro de sodio (NaCl) de una molaridad conocida en aumento. La humedad de 6% fue el tratamiento de mayor estrés, mientras que la de 100% se consideró como el testigo. Se hicieron cuatro muéstreos de la radícula de ambas variedades, a las 24,48,72 y 144 h después del trasplante.
Las determinaciones bioquímicas (prolina, glucosa, fructosa, sacarosa y almidón) se realizaron en la radícula, la cual se obtuvo de los tratamientos de humedad en la forma descrita anteriormente, excepto que se eliminó el tratamiento 100% de humedad (-0.16 MPa), ya que provocó la pudrición del hipocótilo en el punto de unión con el cotiledón, por lo que para este propósito sólo se tuvieron tres tratamientos de humedad (6, 8 y 12%); en este caso el tratamiento de 12% (-0.27 MPa), se consideró como el testigo.
Crecimiento
Con una cinta métrica con aproximación de 1 mm, se midió la longitud de la radícula, a partir de la marca hecha, posteriormente se separaron las siguientes estructuras de la plántula: testa, cotiledones + hojas primarias + hipocótilo y radícula, las cuales se colocaron para su secado en una estufa de circulación de aire durante 72 h a 70 °C.
Prolina
La extracción y determinación de prolina, se llevó a cabo siguiendo el método descrito por Bates (1973), que consistió en una determinación colorimétrica en la solución, después de la reacción con ninhidrina acida se midió la absorbancia a 520 nm de los productos disueltos en tolueno en un espectrofotómetro UV7VIS (Evolution 300, Thermo), con una curva de calibración utilizando L-prolina (Sigma).
Azúcares solubles y almidón
Los azúcares se extrajeron con etanol al 80% (v/v) y se determinaron enzimáticamente siguiendo la ruta de la glicólisis, de acuerdo con Scholes et al. (1996). Las lecturas se realizaron en un lector de microplacas Multiskan (Ascent®, Thermo Electrón Co., Finland) a 340 nm, frente a curvas patrón de glucosa, fructosa y sacarosa. Una vez extraídos los azúcares solubles de la radícula, los residuos sólidos se utilizaron para la determinación de almidón a través de la medición de glucosa.
Se utilizó un diseño experimental completamente al azar y para determinar la significancia estadística para cada una de las variables medidas, se hizo un análisis de varianza con una distribución factorial. Las fuentes de variación consideradas fueron variedades (Var), tratamientos de humedad (Trat Hum), la interacción Var x Trat Hum, el error experimental y el total. Se utilizó la prueba de comparación de medias de Tukey con una a= 0.05. Para conocer su grado de asociación se hizo un análisis de correlación entre la longitud de la radícula (LR) y las acumulación de prolina (PRO), glucosa (GLU), fructosa (FRU), sacarosa (SAC) y almidón (ALM), en la radícula de cada variedad; los análisis se realizaron con el paquete SAS® 8.0.
Resultados y discusión
La Figura 1 muestra que en las dos variedades estudiadas, Pinto Villa y Bayo Madero, las características longitud de radícula (Figuras 1A y 1B), biomasa total (Figuras 1C y 1D) y biomasa de radícula (Figuras 1E y 1F),tuvieron una respuesta similar en los cuatro potenciales de agua estudiados durante el periodo de evaluación. Por ejemplo, en las primeras 24 h los tratamientos de mayor tensión mostraron efecto negativo sobre las tres características. En ambas variedades en la tensión más negativa, por ejemplo, sequía severa (-2.07 MPa ó 6% de humedad) no se detectaron diferencias en las respuestas en ninguna de las variables a través del tiempo de exposición a los tratamientos. En las dos variedades, después de las 48 h de tratamiento la longitud (Figuras 1A y 1B) y la biomasa de la radícula (Figuras 1E y 1F)mostraron incrementos, particularmente la biomasa de la radícula alcanzó el valor máximo en el tratamiento de -0.27 MPa (12% de humedad), con una declinación posterior, debido posiblemente a la pudrición observada en el tratamiento -0.16 MPa (100% de humedad). La longitud (Figuras 1A y 1B) y la biomasa de la radícula (Figuras 1E y 1F) alcanzaron sus valores máximos a los 144 horas en el tratamiento de -0.27 MPa (12% humedad) en las dos variedades. Los resultados obtenidos en la longitud de la radícula coinciden con lo observado por Akmal e Hirasawa (2004) en plántulas de trigo desarrolladas en vermiculita, en donde la mayor longitud de la radícula se observó en los potenciales de humedad de -0.03 MPa (menor estrés), mientras que en potenciales hídricos entre -0.4 y -0.5 MPa (mayor estrés), la longitud disminuyó a la mitad de lo observado en -0.03 MPa. De la misma manera que lo observado por Ogawa y Yamauchi (2006) donde la longitud de la radícula de maíz se vio significativamente afectada por el potencial de agua de -0.13 MPa. En maíz, potenciales de humedad de -0.40 ó -0.80 MPa no influyeron sobre el crecimiento de la raíz; sin embargo, el crecimiento disminuyó significativamente cuando el potencial de agua fue de -1.60 MPa; lo que revela que la región de mayor división celular que es la punta de la raíz, es afectada por pavos potenciales de agua reduciendo su crecimiento (Shimazaki et al., 2005).
Es importante mencionar que la disminución de la humedad del suelo se puede reflejar en las plantas en varios aspectos, como la reducción del crecimiento celular que es el indicador más sensible al estrés de agua en las plantas; de la expansión de la hoja y de la tasa fotosintética, así como en el cierre de los estomas y en la acumulación de algunos solutos en las células (Taiz y Zeiger, 2002).
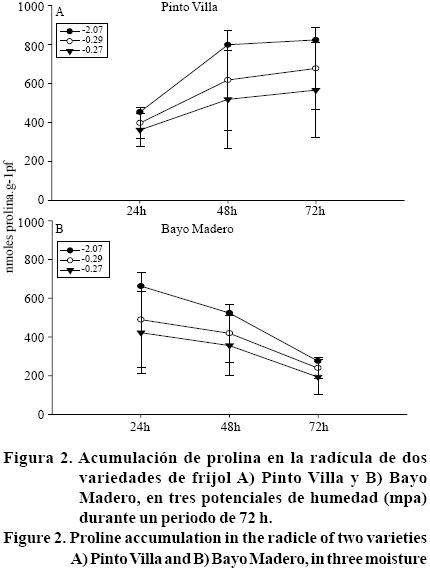
El aminoácido prolina es uno de los metabolitos que se acumulan con mayor frecuencia en las plantas cuando estas se encuentran en condiciones de estrés de agua y de salinidad, por lo que se considera que está involucrado en un mecanismo de resistencia al estrés (Lutts etal, 1999). En el presente estudio se encontró que la acumulación de prolina en la zona de elongación de la raíz fue significativamente superior en Pinto Villa en relación a Bayo Madero, con una media de 481.69 nanomoles de prolina por gramo de peso fresco (nmol g-1 pf), mientras que en Bayo Madero sólo se acumularon 323.55 (nmol g-1 pf). Durante las 72 h del periodo de evaluación en las dos variedades de frijol, la cantidad y tendencia de acumulación de prolina en las dos variedades fue diferente en los tres potenciales de agua establecidos (Figura 2). Por ejemplo, Pinto Villa, en el potencial de agua de -0.27 MPa (12% de humedad) mantuvo el contenido de prolina sin cambio significativo (Figura 2A), mientras que en los otros dos potenciales de humedad la prolina tendió a incrementarse, conforme transcurrió el periodo de estudio y la mayor cantidad de este soluto se detectó en el potencial de agua de -2.07 MPa que corresponde al 6% de humedad. Estos resultados coinciden con lo reportado en raíces de plántulas de maíz cultivadas en vermiculita con bajos potencialesde agua, donde el incremento en la concentración de prolina (1200 nmol g-1 pf) fue progresivo con la disminución del potencial de agua (-1.6 MPa) (Voetberg y Sharp, 1991). La prolina es uno de los solutos compatibles que se acumula en mayor cantidad en condiciones de estrés, comparado con otros aminoácidos, lo que indica que en estas condiciones la prolina es sintetizada en ''células fuente'' y se transporta a ''tejido de demanda'', conocido como zona de elongación, usando energía proporcionada por compuestos orgánicos (Haré y Cress, 1997).
A este respecto se ha documentado (Voetberg y Sharp, 1991; Verslues y Sharp, 1999) que como respuesta a algún tipo de estrés (sequía, salinidad o frío), las células no vacuoladas de la punta de la raíz acumulan altos niveles de prolina en el estroma del cloroplasto y en el citoplasma, mientras que otros solutos (azúcares, ácidos orgánicos, potasio) se acumulan en la vacuola. Debido a que el citoplasma representa una pequeña fracción del volumen celular, las concentraciones locales de la prolina en el citoplasma pueden ser mucho más altas que a nivel de la masa del tejido (Versleus y Sharma, 2010). Por otra parte también se ha reconocido que las funciones de protección de la prolina pueden ser compartidas con solutos compatibles especializados que se acumulan durante el estrés, tales como la glicina betaína y alcoholes de azúcar (Versleus y Sharma, 2010), y se sugiere que la acumulación de prolina puede depender de los niveles de carbohidratos como la sacarosa (Haré y Cress, 1997).
Recientemente un estudio de metabolómica demostró que inclusive en Arabidopsis existen muchos carbohidratos complejos adicionales que se acumulan bajo estrés, pero que no han sido identificados (Wilson et al., 2009). En este trabajo se mostró que en la acumulación de carbohidratos solubles en el nivel de humedad de -2.07 MPa, la variedad Pinto Villa tuvo valores numéricamente mayores que Bayo Madero, particularmente en el contenido de glucosa (Figuras 3A y 3B), fructosa (Figuras 3C y 3D) y sacarosa (Figuras 3E y 3F), pero en el caso de almidón (Figuras 3G y 3H) Bayo Madero superó a Pinto Villa. Esta respuesta coincide con lo detectado en dos variedades de maíz, donde la concentración de azúcares solubles aumentó en la raíz y en el vastago, mientras que el almidón disminuyó cuando se tuvo un potencial hídrico de -1.76 MPa (Nayer y Reza, 2008), lo que se atribuye a que la alta concentración de azúcares puede ser el resultado de la degradación del almidón, debido a que éste juega un papel muy importante en la acumulación de azúcares en la célula (Patakas y Noitsakis, 2001). Los resultados observados en la acumulación de los azúcares, coinciden también con lo que reportan Hoesktra y Butink (2001) quienes mencionan que la presencia de azucares solubles como la sacarosa, glucosay fructosa, está relacionada con la adquisición de la tolerancia a sequía en las plantas; además, en hojas de plantas de papas transgénicas, el incremento de glucosa y fructosa en la pared celular de las vacuolas, está asociado con la acumulación de prolina y almidón, con la inhibición de la fotosíntesis y con el incremento de la respiración, respuestas que fueron asociadas con síntomas del estrés de agua (Scholes et al., 1996).
Los carbohidratos constituyen el principal componente de la reserva de muchas semillas e incluyen azúcares solubles de bajo peso molecular, oligosacáridos, polisacáridos de la pared celular y almidón. En general la glucosa, fructosa y sacarosa alcanzaron su máximo nivel a las 48 h de aplicado el tratamiento y después permanecieron sin cambio o tendieron a incrementarse a las 72 h; aunque en ningún caso hubo diferencias estadísticas significativas entre las dos variedades. Particularmente en la variedad Pinto Villa en los tratamientos de humedad de -0.27 MPa, y de -1.29 MPa, los niveles de glucosa, fructosa, sacarosa y almidón fueron fluctuantes, aunque superiores (en distinto grado) en el tratamiento más húmedo (-0.27 MPa) en relación al intermedio (-1.29 MPa). Lo anterior coincide con lo observado por Mayer y Poljak Off Mayber (1989) que muestra que los carbohidratos solubles incrementaron en todas las estructuras de la plántula de Vigna sesquipedalis después de 48 h de germinación.
El estrés de agua induce varias modificaciones tempranas en el metabolismo de carbono y carbohidratos. En maíz expuesto al estrés de humedad el contenido de carbohidratos se llega a incrementar hasta 42%, debido a que el déficit de agua puede inducirun aumento en el contenido de sacarosa, glucosa y fructosa en la hoja y en algunos casos pueden ser solamente la sacarosa o las hexosas (Pelleschi et al., 1997). Los azúcares solubles, especialmente la sacarosa se deposita en semillas, polen y en tejidos vegetativos en las variedades tolerantes a sequía; así en hojas deshidratadas de Crasterostigma plantagineum, la 2-octulosa acumulada se convierte a sacarosa, la que comprende 40% de la biomasa (OliveryBewley, 1997).
En plántulas de dos años de edad de dos especies de árbol de judea (Cercis canadienses var. canadienses y var. mexicana), se observó que la sacarosa fue el carbohidrato soluble que tuvo la mayor concentración en las hojas, en condiciones de sequía y humedad con relación a glucosa y fructosa, aun cuando la concentración disminuyó en el tratamiento de sequía, además de que se acumularon otros osmolitos como mioinositol, ononitol y pinitol, lo cual indica que la acumulación de diferentes osmolitos en plantas desarrolladas en estrés de sequía es común (Griffin et al., 2004). El incremento en la acumulación de sacarosa y hexosas se puede deber al aumento en la hidrólisis del almidón, que consiste en el rompimiento de los enlaces glucosídicos por una molécula de agua, para producir glucosa que después es utilizada en la respiración celular para producir energía y para la síntesis de sacarosa; además se sabe que la acumulación de sacarosa y hexosas tiene un papel importante en el ajuste osmótico en las especies vegetales (Westgate y Boyer, 1985).
Lo cual sustenta los resultados obtenidos en este trabajo en la variedad de frijol re sistente a la sequía, Pinto Villa, la cual a partir de las 48 h de estrés al potencial de humedad de -2.7 MPa presentó los niveles más bajos de almidón en relación con humedades más altas (-0.27 y -1.29 MPa) (Figura 3G), en contraste con la variedad susceptible Bayo Madero, donde el contenido de almidón a ese mismo potencial de humedad (-2.7 MPa) tendió a incrementarse y ser superior respecto a los potenciales más bajos (Figura 3H), lo que indica que durante este periodo crítico de inicio de la germinación en condiciones de un estrés de humedad de 6%, el almidón disponible en la variedad de frijol resistente (Pinto Villa), se hidroliza para generar azucares solubles disponibles que en conjunto con la prolina participan como solutos compatibles de protección contra el estrés de humedad.
Con base en los resultados de este trabajo se puede sugerir que la acumulación de prolina, y de azúcares solubles (glucosa, fructosa y sacarosa), producidos por la degradación del almidón, se expresaron en mayor cantidad en la variedad de frijol resistente a la sequía, Pinto Villa, con respecto a Bayo Madero que es una variedad susceptible, por lo que se pueden considerar como indicadores bioquímicos confiables para ser utilizados como métodos de selección a nivel de germinación durante las primeras 72 h de desarrollo de la radícula.
Conclusiones
En Pinto Villa y Bayo Madero, el potencial de menor estrés (-0.27 MPa) favoreció la elongación de la radícula con respecto a los potenciales de mayor estrés. En la acumulación de biomasatotal y entre los tratamientos de humedad en Pinto Villay Bayo Madero no se detectaron diferencias estadísticas significativas. La mayor acumulación de prolina en Pinto Villa tuvo un papel importante en el mantenimiento de la elongación de la radícula en estas condiciones ambientales de desarrollo. La baja concentración de almidón en la radícula de Pinto Villa disminuyó por el proceso de degradación y dio lugar a la síntesis y acumulación de azúcares solubles, sacarosa, fructosa y glucosa, en el potencial de estrés de humedad de -2.07 MPa. Los solutos compatibles glucosa, fructosa, sacarosa y prolina evaluados en la zona de elongación de la radícula de frijol se pueden utilizar durante las primeras 72 h de la germinación como indicadores bioquímicos de selección de variedades resistentes al estrés de humedad.
Literatura citada
Acosta, G. J. A.; Ochoa, M. R.; Arrieta, M. M. P; Ibarra, P R; Pajarito, R. A. and Sánchez, V.l. 1995. Registration of ''Pinto Villa''. Commom Bean. Crop Sci. 35:1211. [ Links ]
Acosta, G. J. A. and White, J. W. 1998. Phenological plasticity as an adaptation by common bean to rainfed environments. Crop Sci. 35:199-204. [ Links ]
Akmal, M. and Hirasawa, T. 2004. Growth responses of seminal roots of wheat seedlings to a reduction in the water potential of vermiculite. Plant Soil. 267:319-328. [ Links ]
Bates, L. S. 1973. Rapid determination of free proline for waterstress studies. Plant Soil 39:205-207. [ Links ]
Centro Internacional de Agricultura Tropical (CIAT). 1987. Sistema estándar para la evaluación de germoplasma de frijol. Aart Van Shoonhoven, P.; Pastor- Corrales, J. y Marcial, A. Cali, Colombia. 56 p. [ Links ]
Gnanasiri, S. P; Hahn, D. T; Rhodes, D. and Joly, R J. 1995. Leaf water relations and solute accumulation in two grain sorghum lines exhibiting contrasting drought tolerance. J. Exp. Bot. 46:1833-1841. [ Links ]
Griffin, J. J.; Ranney, T. G. and Pharr, D. M. 2004. Heat and drought influence photosynthesis, water relations, and soluble carbohydrates of two ecotypes f redbud (Cercis Canadensis). J. Ame. Soc. Hortic. Sci. 129:497-402. [ Links ]
Haré, P. D. and Cress, W. A. 1997. Metabolic implications of stress-induced proline accumulation in plants. Plant Growth Regulation 21:79-102. [ Links ]
Hieng, B.; Ugrinovic, K.; Sustar-Vozlic J. and Kidric, M. 2004. Different classes of proteases are involved in the response to drought of Phaseolus vulgaris L. cultivars differing in sensitivity. J. Plant Physiol. 161(5):519-30. [ Links ]
Hoekstra, F. A.; Golovina, E. A. and Butinik, J. 2001. Mechanism of plant desiccation tolerance. Trends Plant Sci. 6:431-438. [ Links ]
Lutts, S.; Majerus, V. and Kinet, J.M. 1999. NaCl effects on proline metabolism in rice (Oriza sativa) seedlings. Physiol. Plantarum. 105:450-458. [ Links ]
Mayer, A. M. and Poljak Off-Mayber, A. 1989. The germination of seeds. Fourth edition. 270 p. [ Links ]
Munns, R. 2002. Comparative physiology of salt and water stress. Plant Cell Environ. 25:239-250. [ Links ]
Nayer, M. and Reza, H. 2008. Drought-induced accumulation of soluble sugars and proline intwo maize varieties. World App. Sci. J. 3(3):448-453. [ Links ]
Ogawa,A. and Yamauchi, A. 2006. Root osmotic adjustment under osmotic stress in maize seedlings. 2. Mode of accumulation of several solutes for osmotic adjustment in the root. Plant Produc. Sci. 9(1): 39-46. [ Links ]
Oliver, M. J. and Bewley, J. 1997. Desiccation-tolerance of plants tissues: a mechanistic over view. Horticultural Reviews. 18:171-214. [ Links ]
Patakas, A. and Noitsakis, B. 2001. Leaf age effects on solute accumulation in water-stressed grapevines. Plant Physiol. 158:63-69. [ Links ]
Pelleschi, S.; Rocher, J. P and Prioul, J. L. 1997. Effects of water restriction on carbohydrate metabolism and photosynthesis in mature maize leaves. Plant Cell Environ. 20: 493-503. [ Links ]
Rosales, S. R.; Acosta, G. J. A.; Muruaga, M. J. S.; Hernández, C. J. M.; Esquivel, E. G. y Pérez, H. P. 2004. Variedades mejoradas de frijol del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. Libro técnico Núm. 6. 148 p. [ Links ]
Scholes, J. Bundock, N.; Wilde, R. and Rolfe, S. 1996. The impact of reduced vacuolar invertase activity on the photosynthetic and carbohydrate metabolism of tomato. Planta. 200:265-272. [ Links ]
Shimazaki, Y.; Ookawa, T. and Hirasawa. T 2005. The root tip and accelerating region suppress elongation of the decelerating región without any effects on cell turgor in primary roots of maize under water stress. Plant Physiol. 139:458-465. [ Links ]
Singh, P. S.; Gepts, P. and Debouck, D. G. 1991. Races of common bean (Phaseolus vulgaris, Fabaceae). Econ. Bot. 45(3): 379-396. [ Links ]
Taiz, L. and Zeiger, E. 2002. Ed. 3. Sinauer Associates. Sunderland. M. A. Plant Physiol. 591-623 pp. [ Links ]
Verslues, P. E. and Sharp, R. E. 1999. Proline accumulation in maize (Zea mays L.) primary roots at low water potentials. II. Metabolic source of increases proline deposition in the elongation zone. Plant Physiol. 119:1349-1360. [ Links ]
Verslues, P. E. and Sharma, S. 2010. Proline metabolism and its implications for plant-environment interaction. The arabidopsis book 8:e0140. doi:10.1199/ tab.0140. [ Links ]
Voetberg, G. S. and Sharp, R. E. 1991. Growth of the maize primary root at low water potentials. Role of increased proline deposition in osmotic adjustment. Plant Physiol. 96: 1125-1130. [ Links ]
Westage, M. E. and Boyer, J. S. 1985. Osmotic adjustment and the inhibition of leaf, root, stem and silk growth and low water potentials in maize. Planta. 164: 540-549. [ Links ]
Wilson, P B.; Estavillo, G. M.; Field, K. J.; Pornsiriwong, W.; Carroll, A. J. ;Howell, K. A.; Woo, N. S.; Lake, J. A.; Smith, S. M.; Millar, A. H.; Von Caemmerer, S. and Pogson, B. J. 2009. The nucleotidase/phosphatase SAL 1 is a negative regulator of drought tolerance in Arabidopsis. Plant J. 58: 299-317. [ Links ]
Yakushiji, H.; Nonami, H.; Fukuyama, T; Ono, S.; Takagi, N. and Hashimoto, Y. 1996. Sugar accumulation enhaced by osmo regulation in Saluma mandarin firuit. J. Am. Soc. Hort. Sci. 121: 466-472. [ Links ]
Yeo, A. R. 1994. Physiological criteria in screening and breeding. In: Yeo, A. R. and Flowers, T. J. (Eds.). Soil Mineral Stresses. Approaches to crop improvement. Springer-Verlag, Berlin. 37-60 pp. [ Links ]














