Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias agrícolas
versión impresa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.2 no.3 Texcoco may./jun. 2011
Artículos
Biofertilización de café orgánico en etapa de vivero en Chiapas, México*
Biofertilizer of organic coffee in stage of seedlings in Chiapas, Mexico
María de Lourdes Adriano Anaya1, Ramón Jarquín Gálvez2§, Carlos Hernández Ramos1, Miguel Salvador Figueroa1 y Clara Teresa Monreal Vargas2
1 Centro de Biociencias. Universidad Autónoma de Chiapas. Carretera a Puerto Chiapas, km 1.5. Tapachula, Chiapas. C. P. 30700. Tel. 01 962 6427972. (rodalvas2000@yahoo.com.mx), (msalvad@hotmail.com).
2 Facultad de Agronomía. Universidad Autónoma de San Luis Potosí. Carretera San Luis-Matehuala, km 14.5. Soledad de Graciano Sánchez, S. L. P. Tel. 01 444 8524056. Ext. 6. §Autor para correspondencia: ramón.jarquin@uaslp.mx.
* Recibido: septiembre de 2010
Aceptado: mayo de 2011
Resumen
En Chiapas, la producción de plántulas de café, se realiza convencionalmente con la aplicación de fertilizantes químicos. La producción de café orgánico, requiere la nutrición de plántulas con biofertilizantes y por ello el objetivo fue evaluar el efecto de algunos de éstos en el desarrollo de plántulas de café (Coffe arábica) variedad Bourbon en vivero. El experimento se realizó durante 2007 y 2008 en Cacahohatan,Chiapas. Los inoculantes fueron una cepa Glomus intraradices Schenck y Smith, cepas PACHAZ08 de Azotobacter y 11B de Azospirillum. Se utilizó el diseño factorial 23 con ocho tratamientos y 100 repeticiones por tratamiento. En las platulas inoculadas, se efectuaron 4 muestreos con intervalos de 28 días, midiendóse la altura, longitud de hojas, longitud de raíz, peso seco de hojas y raíces, contenido de clorofila y nitrógeno, y colonizacion de raíz por los inoculantes. Los datos se sometieron al análisis de varianza y comparacion de medias por Tukey p≤ 0.05. Las mejores características morfológicas y bioquímicas de las plántulas, se obtuvieron con Azospirillum sóla o coinoculada con Glomus y Azotobacter y estadísticamente fueron los mejores tratamientos. Azospirillum modificó la arquitectura de la raíz y estimuló la micorrización. Los diazotrofos en conjunto fueron antagónicos pero esta fue inhibida por Glomus. La interacción de los tres microorganismos indujo en las plántulas un mejor aprovechamiento de nutrimentos, agua, capacidad fotosintética y mayor acumulación de biomasa carbonada.
Palabras claves: Azospirillum sp., Azotobacter sp., Coffea arabiga L., Glomus intraradices Schenck y Smith.
Abstract
In Chiapas, c offee seedlings product ion is conventionally done with chemical fertilizers. Organic coffee production requires see dlings nutrition with biofertilizers and therefore the objective was to evaluate the effect of some of these in coffee seedlings development (Coffee arabica) Bourbon variety in a nursery. The experiment was conducted during 2007 and 2008 in Cacahohatan, Chiapas. Inoculants were a strain of Glomus intraradices Schenck and Smith and strains of PACHAZ08 of Azotobacter and Azospirillum 11B. Factorial designs 23 were used with eight treatments and 100 repetitions per treatment. In inoculated seedlings, 4 samples were made at intervals of 28 days, measuring height, leaves length, root length, dried leaves and roots weight, chlorophyll and nitrogen content, and root colonization by inoculants. Data were subjected to variance analysis and means comparison by Tukey p≤ 0.05. Best morphological and biochemical characteristics of seedlings were obtained with Azospirillum alone or coinoculated with Glomus and Azotobacter and were statistically the best treatments. Azospirillum modified root architecture and stimulated mycorrhization. Diazotrophics were antagonistic, but it was inhibited by Glomus. The three organisms' interaction induced a better use of nutrients, water, photosynthetic capacity and greater accumulation of carbon biomass in seedlings.
Key words: Azospirillum sp., Azotobacter sp., Coffea arabica L., Glomus intraradices Schenck and Smith.
INTRODUCCIÓN
Chiapas es el principal productor de café en México, y uno de los primeros a nivel mundial en la producción orgánica, con aproximadamente 243 667 ha y un promedio de 175 000 productores (COMCAFE, 2007). El café es una planta que se puede propagar por semilla en viveros, estacas y por embriogénesis somática, siendo la primera la más usada en todo el mundo (PROCAFE, 2005). En Chiapas, la producción de plantas de cafeto en viveros, se realiza a partir de semilleros. El trasplante a bolsas de polietileno que contiene suelo del cafetal, se efectúa en la etapa de emergencia del primer par de cotiledones (mariposa), seleccionando las plántulas con una adecuada formación y calidad fitosanitaria. Las plantas se colocan a una distancia de 20*20 cm y permanecen de 4 a 6 meses en vivero antes de ser llevadas a campo. En esta etapa, las plántulas se fertilizan con productos químicos, aplicados periódicamente (ICAFE, 2004).
El café orgánico se cultiva mediante una estrategia productiva orientada a la obtención de café con calidad y protección del ambiente, sin la aplicación de insumos de síntesis química, que se rige por normas de producción y procesamiento, mismas que son vigiladas mediante un proceso de certificación, que garantiza al consumidor la adquisición de alimentos de calidad sin residuos químicos, como son fertilizantes y plaguicidas. México ha sido pionero en la exportación de café orgánico y es el líder mundial en comercio justo (Sosa et al., 2004; Giovannucci y Juárez, 2006).
Para que el café de Soconusco se introduzca en los mercados orgánicos, se debe producir con prácticas agroecológicas desde el semillero hasta su cosecha. En la fase de producción de plantas en vivero se pueden utilizar biofertilizantes en sustitución de productos de síntesis química. Los biofertilizantes están constituidos por microorganismos vivos; los cuales, cuando se aplican a semillas, superficies de plantas o suelos, colonizan la rizósfera o el interior de la planta, y promueven el crecimiento al incrementar el suministro o la disponibilidad de nutrientes primarios a la planta huésped, no contaminan los productos vegetales, ni el suelo; por el contrario, son regeneradores de éste, además algunos inducen el desarrollo de mecanismos de defensa de las plantas y generan ambientes adversos a patógenos (Vessey, 2003).
Entre los microorganismos de mayor importancia usados como biofertilizantes, destacan bacterias como los rhizobios, Azotobacter y Azospirillum, hongos formadores de micorrizas arbusculares (HMA) y rizobacterias como Pseudomonas y Bacillus.
Varios autores han obtenido resultados favorables con la aplicación individual o con la combinación de microorganismos benéficos. La aplicación de Azotobacter chroococcum y bacterias solubilizadoras de fósforo (Fosforina), tuvo un efecto favorable sobre el crecimiento y desarrollo de posturas de cafeto hasta 33%, en un suelo ferralítico rojo lixiviado típico de montaña (Díaz-Medina et al., 2004).
En suelos con baja fertilidad, los HMA y las bacterias promotores del crecimiento de plantas ejercen efectos benéficos en la nutrición, crecimiento y en la producción de granos de café (Rivera et al., 1997). A pesar de esto, los HMA y los inóculos bacterianos no son comúnmente empleados por los viveristas de la región, por lo que se planteó como hipótesis que los cafeticultores de la región de Soconusco utilizarán algunos inoculantes, debido a que éstos favorecen la nutrición de las plántulas de cafeto, lo que se expresa en un buen desarrollo de raíz, vigor y mayor tolerancia a trasplante. El objetivo del proyecto fue evaluar el efecto de Glomus intrarradices, Azospirillum sp. (cepa 11B) y Azotobacter sp. (cepa PACHAZ 08), sólos y en combinación, sobre el crecimiento y desarrollo de plántulas de café (Coffe arabica variedad Bourbon) en etapa de vivero.
MATERIALES Y MÉTODOS
Localización del área de estudio y material biológico
El trabajo se realizó en los terrenos del ejido "El Águila" del Municipio de Cacahoatán Chiapas, México, teniendo como antecedente los trabajos de capacitación desarrollados en años anteriores, a través del modelo de Escuelas de Campo y Experimentación para Agricultores (ECEA) en la localidad (Jarquín, 2005).
El vivero se construyó en los terrenos del Sr. Plutarco Muñoz, promotor de la ECEA, usando hoja de plátano como techo. Se utilizaron bolsas de 17*23 cm que se llenaron con suelo procedente de la rizósfera del cafetal y composta hecha a partir de residuos de la cosecha del café (3:1). Se seleccionó 1 kg de semilla de café (Coffea arabica L.) de la variedad Bourbon procedentes de parcelas del mismo lugar. La semilla se eligió tomando en consideración los criterios del promotor de la ECEA. Las semillas se pregerminaron en una cama de suelo del cafetal. Cuando las plántulas alcanzaron la etapa de mariposas, se retiraron y se lavaron con agua. Se seleccionaron plántulas de tamaño similar, sanas y bien formadas; y se sembraron en las bolsas de polietileno.
Inoculación microbiana y tratamientos
Se usó la cepa de Glomus intrarradices cultivada en raíces transformadas de zanahoria y dos cepas de bacterias diazotróficas, Azospirillum sp. (11B) y Azotobacter sp. (PACHAZ08), las cuales se cultivaron en medio nutritivo a 28 ºC y 200 rpm por 12 h. Las plántulas seleccionadas fueron inoculadas con 1 ml del cultivo bacteriano que contenía 1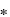 108 ufc y con 1cm2 de medio gelificado con raíces que contienen esporas y micelio de HMA.
108 ufc y con 1cm2 de medio gelificado con raíces que contienen esporas y micelio de HMA.
Se utilizó un diseño factorial 23 y la matriz respectiva se muestra en el Cuadro 1, considerando los niveles de ausencia y presencia de los microorganismos. Fueron ocho tratamientos que implicaron efectos simples de los inoculantes y las combinaciones de los mismos con 100 repeticiones, y la unidad experimental fue una planta.

Variables evaluadas
Se midieron los siguientes parámetros: altura total de la planta (cm), longitud de raíz (cm), longitud de hoja (cm), peso seco de la raíz (secado a 60 ºC por 3 días), peso seco del área foliar (secado a 60 ºC por 3 días), concentración de clorofila (unidades SPAD), nitrógeno total de la área foliar (método de micro kjendahl al inicio y al final del experimento). El porcentaje de colonización del HMA se realizó con el método de Giovanneti y Mosse (1980), previa tinción de las raíces mediante la técnica de Phillips y Hayman (1970). El nivel de colonización bacteriano interno de la raíz se efectuó con la técnica de Döbereiner (1992). Estos parámetros se evaluaron a 10 plantas por tratamiento y se repitió el proceso cada cuatro semanas hasta la 16 semana después de la inoculación.
Análisis estadístico
Los resultados se sometieron a un análisis de varianza (ANOVA), y cuando existieron diferencias en los tratamientos se efectuó comparación de medias por la prueba de Tukey con p= 0.05.
RESULTADOS Y DISCUSIÓN
Variables anatómicas de las plántulas
Las plantas biofertilizadas presentaron mejores características anatómicas después de 16 semanas de establecido el vivero. El análisis de varianza de los datos de altura de las plantas, longitud de las hojas y raíz (Cuadro 2), indicó que existe diferencia significativa entre los tratamientos, siendo el tratamiento ocho (aplicación de los tres microorganismos) el mejor. Las plantas fueron en promedio 32.8% más altas que los testigos (Figura 1), y los mismos resultados se obtuvieron para las inoculadas con el diazótrofo 11B (tratamiento 2). La longitud de las hojas de las plantas testigo fueron 73% menores que las que recibieron el tratamiento ocho.

La longitud de la raíz fluctuó entre 14.7 y 18.2% más larga que la de las plantas testigo y las inoculadas exclusivamente con el HMA (Tratamiento 5). Los tratamientos ocho y dos además promovieron un cambio en la arquitectura de la raíz (Figura 2).
Peso seco de hojas y raíz
En relación al peso seco de hojas y raíces, únicamente las plantas con los tratamientos 8 y 2 fueron estadísticamente diferentes respecto a los demás (Cuadro 2). El incremento en promedio fue de 41.3 y 17.3% más peso de raíz y hojas, respectivamente.
Contenido de clorofila
La mayor cantidad de clorofila se registró en las hojas de las plántulas de café que fueron inoculadas con el tratamiento ocho, y el contenido fue 37.9% mayor que las plántulas de los tratamientos 1, 3, 4, 5 y 6 (Cuadro 2).
Contenido de nitrógeno
Las plantas inoculadas con los tratamientos T8, T5 (HMA) y T3 (PACHAZ08), tuvieron el mayor contenido de nitrógeno en las hojas. Este fue en promedio 58.5% mayor que el de las plantas con la menor concentración registrada (Cuadro 2).
Colonización de la raíz por HMA y por bacterias diazotróficas
La colonización de las raíces de las plantas por HMA, con los diferentes tratamientos fluctuó de 6.6 a 16.3% (Cuadro 2). El mayor grado de colonización se encontró en las plántulas inoculadas con los tres microorganismos, y el menor en las plántulas de los tratamientos T1, T3, T4 y T5.
Respecto a la población de bacterias diazotróficas presentes en la raíz de las plántulas de café, la mayor población de éstas se encontró en aquellas que fueron inoculadas con el diazótrofo 11B y las inoculadas con los tres microorganismos. La menor población se encontró en las plántulas testigo y las que fueron inoculadas con la cepa PACHAZ08 y con ambos diazótrofos. La detección de HMA y diazótrofos en la raíz de las plantas testigo se debe que el suelo empleado en este trabajo no fue previamente esterilizado, por lo que las poblaciones microbianas cuantificadas representan las naturales.
En estudios previos, se ha comprobado que la aplicación de diversas combinaciones de hongos y bacterias utilizadas como biofertilizantes en diferentes plantas, generalmente tiene efecto sinérgico en la nutrición de la planta y su concomitante beneficio en el desarrollo vegetativo y reproductivo (Irizar-Garza et al., 2003). Esto concuerda con el desarrollo de las mejores características anatómicas y los valores más altos de los diversos parámetros, que se midieron en las plantas de cafeto inoculadas simultáneamente con los tres biofertilizantes. También se obtuvieron resultados estadísticamente superiores al testigo únicamente en cinco parámetros de los nueve evaluados, con las combinaciones conformadas entre los HMA y cada diazótrofo. Sin embargo, esta situación no se presentó entre la interacción de las dos bacterias, la cual parece ser antagónica y por ello, los resultados fueron estadísticamente iguales al testigo.
El cafeto es un cultivo que de forma natural establece simbiosis con los HMA, lo cual se puso en evidencia en las plantas testigo; sin embargo, las cepas nativas no siempre pueden establecer una simbiosis eficiente; por ello para los cultivos que inicialmente se propagan en viveros, ésta es una fase adecuada para efectuar la inoculación con cepas de HMA que sean eficientes y altamente competitivas (Rivera et al., 2003). Sánchez et al. (2006) encontraron que de 15 cepas de HMA inoculadas en plántulas de cafeto, las cepas más eficientes fueron Glomus fasciculatum, Glomus mosseae ecotipo1 y Glomus intraradices.
Esta eficiencia micorrízica, según señalan Barea et al. (1991) se explica por el incremento del área de exploración radical de las plantas y sus consiguientes incrementos en la absorción de nutrimentos, lo que implica que en una misma condición de disponibilidad de éstos, se presenten mayores coeficientes de aprovechamiento y crecimiento de las plantas en el caso de una micorrización eficiente. En nuestro trabajo los resultados obtenidos únicamente con el inoculante HMA, son similares a los del testigo, lo cual indica que la cepa se comportó como la nativa y no estableció una simbiosis eficiente.
La cepa 11B de Azospirillum (T2) tuvo un efecto positivo en ocho de los nueve parámetros, con resultados semejantes a T8; fue el segundo mejor tratamiento y siempre superior al testigo. Además estimuló tanto la colonización micorrízica, como el incremento de la población de diazotrófos. Azospirillum es uno de los géneros de rizobacterias promotoras del crecimiento vegetal más estudiados en la actualidad, debido a su capacidad de mejorar significativamente el crecimiento y desarrollo, así como el rendimiento de numerosas especies vegetales de interés agrícola. Se ha utilizado con éxito como biofertilizante en trigo, maíz, sorgo, arroz, cebada, avena, cítricos, y caña de azúcar entre otros (Bashan et al., 2004).
Jiménez (2008) integró un cepario de 200 bacterias de Azospirillum aisladas del cultivo de café, provenientes de las principales regiones productoras de México y con las más eficientes formuló un biofertilizante. El producto tiene la propiedad de disminuir las etapas fenológicas del crecimiento del cultivo, produce una mayor densidad radicular de la planta, lo que significa un crecimiento más abundante de su raíz, hecho que le permite mejor capacidad para absorber los nutrientes disponibles en el suelo y lograr un mejor desarrollo. Este trabajo es acorde con los resultados obtenidos y señalan a Azospirillum como una buena opción para utilizarse como biofertilizante en cafeto, tanto en vivero como en campo abierto.
Los primeros mecanismos propuestos para la promoción bacteriana del crecimiento vegetal han sido relacionados con el metabolismo del nitrógeno, a través de la fijación biológica en condiciones de vida libre o por el incremento de la actividad nitrato reductasa en condiciones endofíticas. Sin embargo, en la actualidad se considera que la promoción del crecimiento vegetal, está relacionado con la capacidad de este microorganismo para producir o metabolizar compuestos del tipo fitohormonas, como ácido indol acético, citocianinas (Tien et al., 1979); giberelinas (Bottini et al., 1989) y etileno (Strzelczyk et al., 1994), así como otras moléculas reguladoras del crecimiento vegetal, tales como el ácido abscísico (ABA) (Perrig et al., 2007) y la diamina cadaverina (CAD) (Cassán et al., 2003).
Existe evidencia circunstancial de la interacción de fitohormonas producidas por el microorganismo con el background hormonal de las plantas inoculadas. Fulchieri et al. (1993) encontraron que plántulas de maíz (Zea mays L.) inoculadas con tres cepas de Azospirillum lipoferum mejoraron significativamente el crecimiento de la raíz y de la parte aérea. En estos ensayos GA3 fue identificada en la fracción ácida libre del extracto vegetal y estos resultados permitieron especular sobre la capacidad bacteriana de incrementar in vivo el pool de giberelinas con actividad biológica sobre el crecimiento vegetal en las raíces de plantas inoculadas.
Ross y O'Neill (2001) sugieren que las auxinas podrían promover, al menos en parte, la elongación del tallo por incrementar los niveles de endógenos de giberelinas 3ß-hidroxiladas, lo cual podría tener relación directa con los resultados obtenidos por Fulchieri et al. (1993). Otro factor a considerar sería que por lo menos dos de las cepas utilizadas para la inoculación (A. lipoferum Op 33, A. lipoferum iaa 320) eran productoras de AIA lo que permite especular, que al menos en parte, el aumento en el contenido endógeno de GA3 en la raíz puede deberse al cross-talk del AIA sobre el pool de GAs de la raíz y que parte de la respuesta del crecimiento observado en la porción aérea y subterránea se debería al efecto de las GAs producidas por las diferentes cepas de Azospirillum lipoferum o por las GAs producidas por las plántulas inducidas por el AIA bacteriano,como describen Yaxley et al. (2001) y Ford et al. (2002) para otras especies vegetales.
Krumpholz et al. (2006) evaluaron la respuesta de crecimiento de plántulas de tomate inoculadas con Azospirillum brasilense FT326 (superproductora de IAA), correlacionando el fenotipo vegetal (incremento del peso fresco de la raíz, aumento en la longitud de los pelos radicales y aumento en el número de raíces laterales) con la producción vegetal de etileno, resultó que el aumento en la producción de etileno fue significativamente superior a los controles y los cambios morfológicos fueron acompañados de un aumento de actividad de la aminociclopropano-1-ácido carboxílico (ACC)-sintasa tisular. De acuerdo con Peck y Kende (1995), el paso limitante para la biosíntesis de etileno es la conversión de la S adenosilmetionina a ACC catalizada por la ACC sintasa; y la expresión como la actividad de esta enzima, así como la producción de etileno, se incrementa por la adición de AIA exógeno. Estos antecedentes indicarían que el aumento de etileno, al menos en parte se debería a un cross-talk entre el AIA producido por la bacteria en la vía de síntesis del etileno como sugieren Rahman et al. (2002). Podemos decir que un inoculante a base de Azospirillum sp. no debería sólo considerarse como un formulado a base de microorganismos, sino como un «complejo biológico» resultante de la biotransformación bacteriana de los componentes del medio (rizosfera o tejidos), en metabolitos con actividad sobre la planta, y que la actividad biológica de mucha de las fitohormonas producidas por este microorganismo, tiene influencia directa sobre procesos clave del desarrollo vegetal, tales como la germinación, crecimiento temprano de plántulas, colonización rizosférica y el establecimiento bacteriano en los tejidos.
En relación a la interacción Azospirillum-HMA, se obtuvo una respuesta positiva sobre el crecimiento y desarrollo de las plántulas de café. A pesar de no ser el mejor tratamiento, la respuesta fue similar con Aguirre-Medina et al. (2007), en plántulas de cacao inoculadas con Azospirillum brasilense y Glomus intraradices, quienes favorecieron el desarrollo y la asignación de materia seca de los componentes morfológico y fisiológicos del rendimiento de las plantas, y en general en los tejidos vegetales de estas plantas se cuantificaron los valores más altos de N2, P y Ca.
Las plantas inoculadas con la cepa de Azotobacter PACHAZ08, se comportaron prácticamente igual que las testigos, y no tuvo efecto sobre las variables de colonización micorrizica y diazotrófica, además cuando se inoculó en conjunto con Azospirillum (tratamiento cuatro), ésta nulificó el efecto estimulador de la cepa 11B. Azotobacter es una bacteria cuya efectividad como biofertilizante depende de la capacidad de adaptación a distintos tipos de suelo. Los resultados obtenidos podrían inferir que la cepa PACHAZ08, no tuvo las condiciones adecuadas para establecerse, reproducirse, y tener un estado fisiológico óptimo (González y Lluch, 992); al igual que en los HMA, también se identifican cepas eficientes y cabría la posibilidad de que PACHAZ08 sea una cepa ineficiente.
Delgado et al. (2003) encontraron solamente dos cepas eficientes de las siete cepas de Azotobacter que evaluaron, y con ellas aceleraron el porcentaje de germinación de semillas de café entre 61.7 y 55% en los primeros 50 días; además de producir los mayores valores morfológicos de las plántulas en vivero. Es indudable que Azotobacter ha sido el género de bacterias nitrofijadoras más estudiado hasta nuestros días. La inoculación de este diazotrófo ha sido positiva, observándose notables incrementos en los rendimientos en diferentes cultivos, principalmente en cereales.
Las especies más utilizadas ha sido Azotobacter chroococcum y Azospirillum brasilense, y su efecto en las plantas no deben atribuirse exclusivamente a la ganancia de N2 , sino también a la capacidad de solubilizar fosfatos y sintetizar sustancias estimuladoras del crecimiento vegetal, tales como, vitaminas (vitamina B-1, ácido nicotínico, ácido pantoténico) y hormonas vegetales que intervienen directamente sobre el desarrollo de las plantas. La producción de estas sustancias por Azotobacter, se ve influenciada por el estado fisiológico de la bacteria y por la edad de los cultivos, habiéndose demostrado que la presencia de nitrógeno combinado modifica la producción de auxinas y giberelinas.
Concretamente la presencia de nitrato inhibe la liberación de auxinas, mientras que en sentido contrario incrementa la producción de giberelinas. La adición de exudados radicales de ciertos cereales colonizados por Azotobacter, determinan aumentos significativos en la producción de auxinas, giberelinas y citocininas, siendo este efecto más evidente cuando los exudados se obtienen de plantas de más de 30 días de crecimiento (González y Lluch, 1992).
Las interacciones microbianas en la rizósfera no siempre son mutualistas y por ende no se obtiene un efecto sinérgico que favorezca el crecimiento y desarrollo de las plantas. Existen investigaciones donde se ha podido comprobar la potenciación de la estimulación en el crecimiento y demás parámetros en las plantas, con la aplicación de Azotobacter conjuntamente con HMA, y de Azospirillum también con HMA (Miyasaka y Habte, 2003); pero en otras los resultados no han sido favorables debido que la coinoculación de los microorganismos necesita de condiciones adecuadas para su establecimiento e interacción positiva que conduzca a la efectividad de la simbiosis micorrízica; y a su vez que ésta garantice una absorción de nutrientes suficientes para satisfacer las exigencias de la estimulación. Estas condiciones pueden derivarse del microhabitat que implica tipo de suelo, influido por la especie y variedad del cultivo.
Fernández (1999) estudió la coinoculación de Azotobacter chrooccocum con cepas eficientes de HMA en plántulas de café, en Acrisoles háplicos de muy baja fertilidad; los resultados fueron negativos y siempre inferiores a las aplicaciones simples de los microorganismos, explicable en base a una competencia por la baja disponibilidad de nutrientes en estos suelos, limitando incluso las estructuras fúngicas en las posturas micorrizadas.
Por otro lado, en la interacción de Azospirillum, Azotobacter y los HMA en la variedad de algodón Guazuncho 3, ambos tratamientos promovieron una mayor micorrización con respecto al testigo; sin embargo, en la variedad Guazuncho 2000, el testigo presentó mayor micorrización que los tratamientos con coinoculaciones (Cossoli e Iglesias, 2008). Contrario a estos resultados, en esta investigación, la interacción de los tres microorganismos fue mutualista y favoreció el mejor crecimiento y desarrollo de las plántulas de café.
Para explicar el efecto que tuvieron los tres inoculantes en las plántulas de cafeto, se puede asumir que la cepa de Azospirillum interaccionó con la raíz de las plántulas y generó el desarrollo de raíces laterales, pelos absorbentes, y modificaron su fisiología, induciendo la secreción de exudados, mismos que a su vez favorecieron una simbiosis eficiente de la raíz con los HMA para desarrollar la micorrizosfera.
Esta condición posiblemente generó cambios cualitativos y cuantitativos en la liberación de exudados radicales y además promovió la secreción de exudados por las hifas del hongo, lo cual crea un nuevo espacio físico en la rizósfera de las plántulas de café; de tal manera, que se instauraron las condiciones favorables para el establecimiento de Azotobacter. Además es factible que los HMA impidieran la relación antagónica entre Azospirillum y Azotobacter, propiciando que ambos diazótrofos sumaran sus características de microorganismos promotores del crecimiento e incrementaron en la rizósfera la cantidad de fitohormonas y vitaminas; las que a su vez aumentaron el número de raíces laterales y el tamaño de los pelos absorbentes.
Los HMA mejoran el transporte de minerales, principalmente fósforo y agua, mientras que los diazótrofos participan en el ciclo del nitrógeno, incrementan el nivel endógeno de fitohormonas e inducen mecanismos de defensa contra patógenos radicales. Esto permitió que las plantas tuvieran un mejor aprovechamiento de los nutrimentos y agua, lo que se tradujo en una mejor capacidad fotosintética, acumulación de mayor biomasa carbonada, resultando un mayor crecimiento y acortamiento de las etapas fenológicas en vivero.
Terry y Leyva (2006) refieren que las plantas coinoculadas con HMA y rizobacterias tienen mayor crecimiento y contenido de proteínas totales solubles en las hojas. Estas proteínas les permiten una mayor actividad metabólica, efecto asociado a un mejor estado nutricional y a un contenido de nitrógeno foliar mayor, y como consecuencia las plantas tienen mayor vigor.
CONCLUSIONES
La aplicación de tres biofertilizantes en las plántulas de café en vivero, tuvieron un efecto positivo en el crecimiento y desarrollo de éstas, además de promover la síntesis de clorofila y de compuestos nitrogenados.
La cepa 11 B de Azospirillum, sola o en conjunción con el HMA y Azotobacter (PACHAZ08), fue el mejor inoculante. Asimismo, promueve interacciones mutualistas entre HMA, la raíz de las plántulas y Azotobacter.
LITERATURA CITADA
Aguirre-Medina, F. A.; Mendoza-López, A.; Cadena-Iñiguez, J. y Avendaño-Arrazate, C. H. 2007. Efecto de la biofertilización en vivero del cacao (Theobroma cacao L.) con Azospirillum brasilense Tarrand, Kriegk et Döbereiner y Glomus intraradices Schenck et Smith. Interciencia. 32(8):541-546. [ Links ]
Barea, J. M.; Azcon-Aguilar, C. y Ocampo, J. A. 1991. Morfología, anatomía y citología de las micorrizas vesículo-arbusculares. In: fijación y movilización de nutrimentos II. Fijación de nitrógeno y micorrizas. Madrid. 150-173 pp. [ Links ]
Bashan, Y.; Holguin, G. and Bashan, L. 2004. Azospirillum-plant relationship: physiological, molecular, agricultural, and environmental advances (1997-2003). Can. J. Microbiol. 50:521-577. [ Links ]
Bottini, R.; Fulchieri, M.; Pearce, D. and Pharis, R. 1989. Identification of gibberellins A1, A3, and Iso-A3 in cultures of A. lipoferum. Plant Physiol. 90:45-47. [ Links ]
Cassán, F.; Piccoli, P. and Bottini, R. 2003. Plant growth promotion by Azospirillum sp. Through gibberellin production. An alternative model to increase crop yield? Microbiología agrícola: un aporte de la Investigación Argentina para la Sociedad. (2003) Editorial de la Universidad Nacional de Santiago del Estero. 143-158 pp. [ Links ]
Comisión para el Mejoramiento del Café de Chiapas (COMACAFE). 2007. La cafeticultura chiapaneca. Tuxtla Gutiérrez, Chiapas. El campo en hechos. 2:28-29. [ Links ]
Cossoli, M. R. e Iglesias, M. C. 2008. La biofertilización con Azospirillum y Azotobacter, su interacción con la infección de hongos micorrícicos en el cultivo de algodón (Gossypium hirsutuni). XIII Jornadas Argentinas de Microbiología organizadas por la Asociación Argentina de Microbiología Filial. Rosario. 67 p. [ Links ]
Díaz-Medina, A.; Almaguer-López, J.; Suárez-Pérez, C; Albelo, N.; González-Reboso, A. y López, Y. 2004. Efecto de la aplicación de Azotobacter chroococcum y bacterias solubilizadoras de fósforo sobre el desarrollo de posturas de cafeto (Coffea arábica L.). Centro Agrícola. 31(1):1-3. [ Links ]
Delgado, Y.; Cupull, R.; Pérez, C; Sánchez, A. y Vilchez, M. 2003. Efecto de Azotobacter spp. en la estimulación de la germinación y el desarrollo de posturas de Coffea arábica L. Centro Agrícola. 30(1):26-31. [ Links ]
Döbereiner, J. 1992. History and new perspectives of diazotrophs in association with non legumenous plants. Symbiosis. 13:1-13. [ Links ]
Fernández, F. 1999.Manejo de las asociaciones micorrízicas arbusculares sobre la producción de posturas de cafeto (C. arabica L. var. Catuaí) en algunos tipos de suelos. Tesis en Ciencias Agrícolas. INCA. 102 p. [ Links ]
Ford, Y. ; Taylor, J.; Blake, P. and Marks, P. 2002. Gibberellin A3 stimulates adventitious rooting of cuttings from cherry (Prunus avium). J. Plant Growth Regul. 37 (2):127-133. [ Links ]
Fulchieri, M.; Lucangeli, C. and Bottini, R. 1993. Inoculation with A. lipoferum affects growth and gibberellin status of corn seedlings roots. Plant Cell Physiol. 34:1305-1309. [ Links ]
Giovannucci, D. y Juárez, C. R. 2006. Análisis prospectivo de política cafetalera. México, Proyecto Evaluación Alianza para el campo 2005. FAO. SAGARPA. 74 p. [ Links ]
Giovanneti, M. y Mosse, B. 1980. An evaluation of techniques for measuring vesicular arbuscular micorrhizal infection in roots. New Phytol. 84:489-500. [ Links ]
González, J. y Lluch, C. 1992. Biología del Nitrógeno. Interacción Planta-Microorganismo. Editorial Rueda. Madrid. España. 280 p. [ Links ]
Instituto Costarricense del Café (ICAFE). 2004. El manejo de almacígales de café en bolsa. Boletín informativo. San José Costa Rica. 4(2):1-12. [ Links ]
Irizar-Garza, M. B. G.; Vargas-Vázquez, P.; Garza-García, D.; Tut-Couoh, C.; Rojas-Martínez, I.; Trujillo-Campos, A.; García-Silva, R.; Aguirre-Montoya, D.; Martínez-González, J. C.; Alvarado-Mendoza, S.; Grajeda-Cabrera, O.; Valero-Garza, J. y Aguirre-Medina, J. F. 2003. Respuesta de cultivos agrícolas a los biofertilizantes en la región central de México. Agr. Téc. Méx. 29(2):213-225. [ Links ]
Jarquín, G. R. 2005. Las escuelas de campo y experimentación para agricultores y su impacto en la formación de promotores comunitarios. Trópico Rural. 1(2):38-48. [ Links ]
Jiménez, S. T. 2008. Crea BUAP biofertilizante, acelerador de crecimiento de la planta de café. Proyecto 5. URL: http://www.proyectocinco.com. [ Links ]
Krumpholz, E.; Ribaudo, C.; Cassán, F.; Bottini, R.; Cantore, M. and Curá, A. 2006. Azospirillum sp. promotes root hair development in tomato plants through a mechanism that involves ethylene. J. Plant Growth Regul. 25(2):175-185. [ Links ]
Miyasaka, S. and Habte, M. 2003. Plant mecanisms and mycorrhizal symbiosis to increase phosphorus uptake efficiency. College of tropical Agriculture and Human resources, Hawaii, Honolulu. Journal Series. Núm. 4468. 1101-1133 pp. [ Links ]
Peck, S. and Kende, H. 1995. Sequential induction of the ethylene biosynthetic enzymes by indole-3-acetic acid in etiolated peas. Plant. Mol. Biol. 28:298-301. [ Links ]
Perrig, D.; Boiero, L.; Masciarelli, O.; Penna, C.; Cassán, F. and Luna, V. 2007. Plant growth promoting compounds produced by two agronomically important strains of Azospirillum brasilense, and their implications for inoculant formulation. Appl. Microbiol. Biotechnol. 75:1143-1150. [ Links ]
Phillips, J. M. and Hayman, D. S. 1970. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular micorrhizal fungi for assessment of infection. Trans. Brit. Micol. Soc. 5(1):158-160. [ Links ]
Programa del Mejoramiento del Café (PROCAFE). 2005. Cultivo de tejidos vegetales. La libertad, República del Salvador. Hoja técnica. 13:1-3. [ Links ]
Rahman, A.; Hosokawa, S.; Oono, Y.; Amakawa, T.; Goto, N. and Tsurumi, S. 2002. Auxin and ethylene response interactions during Arabidopsis root hair development diss. Plant Physiol. 130(4):1908-17. [ Links ]
Rivera, R.; Fernández; F. y Hernández, A. 2003. El manejo efectivo de la simbiosis micorrízica, una vía hacia la agricultura sostenible, estudio de caso. El Caribe, Ciudad de La Habana. 160 pp. [ Links ]
Rivera, R.; Fernandez, F.; Sánchez, C. y Bustamante, C. 1997. Efecto de la inoculación con HMA y bacterias rizosfericas sobre el crecimiento del cafeto. Cultivos Tropicales. 18(3):15-23. [ Links ]
Ross, J. and O'Neill, D. 2001. New interactions between classical plant hormones. Trends Plant Sci. 6:2-4. [ Links ]
Sánchez, C.; Montilla, E. y Rivera, R. 2005. Comportamiento de 15 cepas de hongo micorrizogenos sobre el desarrollo de postura de cafeto en un suelo pardo gleyzoso. Revista Forestal Latinoamericana. 38:83-95. [ Links ]
Sosa, M. L.; Escamilla, P. E. and Díaz, C. S. 2004. Organic Coffee. In: Wintgens, J. E. (ed.). Coffee: growing, processing, sustainable production. Weinheim, DE, WILEY-VCH Verlag GmbH & Co. KGaA. 339-354 pp. [ Links ]
Strzelczyk, E.; Kamper, M. and Li, C. 1994. Cytocinin-like-substances and ethylene production by Azospirillum in media with different carbon sources. Microbiol. Res. 149:55-60. [ Links ]
Terry, A. E. y Leyva, G. A. 2006. Evaluación de agrobiológica de la coinoculación micorrizas- Rizobacterias en tomate. Agronomía Costarricense. 30(1):65-73. [ Links ]
Tien, T. M.; Gaskins, M. H. and Hubbell, D. H. 1979. Plant growth substances produced by Azsopirillum brasilense and their effect on the growth of pearl millet (Pennisetum americanum L.). Appl. Environ. Microbiol. 37:1016-1024. [ Links ]
Vessey, J. K. 2003. Plant growth promoting rhizobacteria as biofertilizers. Plant and Soil. 255:571-586. [ Links ]
Yaxley, J.; Ross, J.; Sherriff, L. and Reid, J. 2001. Gibberellin biosynthesis mutations and root development in pea. Plant Physiology. 125:627-633. [ Links ]














