Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista mexicana de ciencias agrícolas
Print version ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.1 n.4 Texcoco Oct./Dec. 2010
Artículos
Etiología y efecto en genotipos del pardeamiento y la brotación anormal asociado con fitoplasmas en tubérculos de papa*
Etiology and effect in genotypes of browning and abnormal sprout associated to phytoplasmas in potato tubers
Margarita Díaz-Valasis1, Mateo Armando Cadena-Hinojosa1§, Reyna Isabel Rojas-Martínez2, Emma Zavaleta-Mejía2, Daniel Ochoa-Martínez2 y Rafael Bujanos-Muñiz3
1Campo Experimental Valle de México. CIRCE-INIFAP. Carretera Los Reyes-Lechería, km 18.5. Texcoco, Estado de México. A. P. 307. C. P. 56230. Tel. 01 595 9212738. Ext. 130. (maggy-diaz@yahoo.com). §Autor para correspondencia: machgg2@yahoo.com.mx.
2Instituto de Fitosanidad. Colegio de Postgraduados. Carretera México-Texcoco, km 35.5. Montecillo, Estado de México. C. P. 56230. Tel. 01 595 9520200. Ext. 1625. (rojas@colpos.mx), (zavaleta@colpos.mx), (ldaniel@colpos.mx).
3Campo Experimental Bajío. CIRCE-INIFAP. Carretera Celaya-San Miguel de Allende, km 6.5. Celaya, Guanajuato, México. A. P. 112. C. P. 38000. Tel. 461 6115323. (bujanos@att.net.mx).
* Recibido: julio de 2010
Aceptado: diciembre de 2010
Resumen
La punta morada de la papa afecta el rendimiento y la calidad de los tubérculos por el pardeamiento y la brotación anormal asociados con ésta. Esta enfermedad es considerada de origen fitoplásmico, aunque los postulados de Koch no han sido debidamente probados. Esta investigación intenta determinar la etiología del pardeamiento y la brotación anormal en papa; para ello, se transmitieron mediante injerto, aislamientos procedentes de 19 genotipos de papa de campo con cuatro variedades: Sangema que tuvo 52.63% de transmisión, Michoacán que tuvo 42.1%, Norteña con 31.57% y NAU-6 que alcanzó 65.2%. Los esquejes de papas de invernadero con síntomas de punta morada transmitidos por semilla-tubérculo, indujeron síntomas de "popotillo" en jitomate; sin embargo, al volver a injertar en papa no se observaron síntomas en el follaje, tampoco pardeamiento en los tubérculos y no se detectó fitoplasma mediante la técnica de reacción en cadena de la polimerasa. El porcentaje de transmisión para la punta morada de la papa en invernadero fue de 37%. El pardeamiento y la brotación anormal en los tubérculos fueron inducidos por un patógeno infeccioso, trasmitido hasta por seis injertos sucesivos en invernadero. El porcentaje de detección de fitoplasma con polimerasa en follaje y tubérculo de las variedades utilizadas NAU-6, Norteña, Michoacán y Alpha fue de 37.5, 10, 35.7 y 28.6 respectivamente. En chile manzano y mixquic, éste fue de 70.83% y 66.6%, en tomate no se registraron fitoplasmas. Las plantas de chile, puede actuar como hospedante intermediario en la transmisión del patógeno involucrado con esta enfermedad.
Palabras clave: enrollamiento apical, fitoplasmas, punta morada de la papa.
Abstract
Potato purple top affects yield and tubers quality by browning and the abnormal sprout associated with it. This disease is considered of phytoplasmic origin, although Koch postulates have not been properly proven. This investigation tries to determine etiology for browning and abnormal sprouting in potato; taking this into account isolations coming from 19 genotypes of field potato with four varieties were transmitted by means of graft: Sangema that had 52.63% transmission, Michoacán that had 42.1%, Norteña with 31.57% and NAU-6 that reached 65.2%. The greenhouse potatoes cuttings with symptoms of purple tip transmitted by seed-tuber, induced symptoms of "popotillo" in red tomato; however, when grafting again in potato symptoms were not observed in the foliage, neither browning in the tubers and phytoplasma was not detected by means of reaction technique in polymerase chain. The transmission percentage for potato purple tip in greenhouse was of 37%. The browning and the abnormal sprouting in tubers were induced by an infectious pathogen, transmitted until for six successive grafts in greenhouse. The percentage of phytoplasma detection with polymerase in foliage and tuber of used varieties NAU-6, Norteña, Michoacán and Alpha were of 37.5, 10, 35.7 and 28.6 respectively. In chili manzano and mixquic, this was of 70.83% and 66.6%, in tomato there were not recorded phytoplasmas. In chili plants, it can act as intermediary host in transmission of pathogen involved with this disease.
Key words: apical roll, phytoplasmas, potato purple tip.
INTRODUCCIÓN
La papa es afectada por una enfermedad, que induce pardeamiento y brotación anormal en el tubérculo; existen evidencias que un miembro del género fitoplasma está asociado con la punta morada de la papa (PMP) (Lee et al., 2006). Los principales síntomas en el follaje son la disminución del crecimiento, crecimiento erecto de brotes terminales, enrollamiento de las hojas, clorosis, coloración roja o púrpura de nuevas hojas, proliferación de brotes axilares con hinchamientos en la base y formación de tubérculos aéreos.
Esta enfermedad induce un pardeamiento en los haces vasculares de los tubérculos, deteriorando su calidad industrial y los tubérculos afectados presentan brotación anormal. Cuando estos se siembran producen plantas débiles o no brotan (Cadena-Hinojosa, 1974; 1993), por lo tanto, la PMP es considerada un problema fitopatológico de importancia internacional (Maramorosch, 1998b; Cadena-Hinojosa et al., 2003). En los EE.UU., se tiene reporte de la presencia de PMP desde 1939 (Leach, 1939); recientemente se ha reportado la PMP como una enfermedad devastadora que se presenta en varias regiones de Estados Unidos de América y México.
En 2002 y 2003 se presentó una epidemia de PMP en papa (Solanum tuberosum), en la región de la cuenca de Columbia en Washington y Oregon, causando pérdidas económicas fuertes en la industria papera (Lee et al., 2004). En México se presenta en las principales zonas productoras de papa, se ha reportado en los valles y sierras del eje neovolcánico en donde, en algunos lugares de ésta zona, se presentan altas incidencias y es una amenaza seria a la producción nacional de este cultivo (Cadena-Hinojosa, 1974, 1987, 1993,1996, 1999; Zavala y Cadena, 1998).
En el Campo Experimental Valle de México (CEVAMEX), se presentan todos los años incidencias altas de la PMP, situación que se ha utilizado para establecer en esta localidad, estudios enfocados a su control (Cadena-Hinojosa, 1999). Inicialmente, varios investigadores consideraron que el agente causal de la PMP en los EE.UU., era el mismo que causaba los amarillamientos en plantas de áster (Kunkel, 1926; Leach y Bishop, 1944; Self y Darling, 1953), el cual es transmitido por la chicharrita Macrosteles quadrilineatus Forbes (Hirumi y Maramorosh, 1968; Maramorosh et al., 1968).
En un estudio conjunto entre el Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP) de México y el Departamento de Agricultura de Estados Unidos de América (Cadena-Hinojosa, 1974; Maramorosh, 1998a), se observaron fitoplasmas al microscopio electrónico en ultra cortes de tejido enfermo de plantas con síntomas de punta morada, procedentes de transmisión seriada por injerto, por lo cual se propuso que este patógenos pudiera ser el agente causal de esta enfermedad. Posteriormente se presentó evidencia adicional de la asociación de fitoplasmas con la PMP (Cárdenas et al., 1992; Almeyda et al., 1999).
Almeyda et al. (1999) encontraron que es posible la detección de fitoplasmas asociados con la PMP, en etapas tempranas de la enfermedad, aún en plantas asintomáticas. En investigaciones subsecuentes, se han determinado por lo menos dos grupos de fitoplasmas asociados con la PMP (Almeyda et al., 1999; Leyva López, 2002). A la fecha, esta enfermedad es considerada de origen fitoplásmico, a pesar que los postulados de Koch no han sido debidamente probados. No obstante, los esfuerzos que se han realizado para tratar de esclarecer al agente causal de la PMP, aún quedan muchas interrogantes sobre la etiología de esta enfermedad, por lo tanto, el objetivo de la presente investigación fue determinar la etiología del pardeamiento y la brotación anormal en los tubérculos de papa en la región central de México.
MATERIALES Y MÉTODOS
En el año 2004 a 2006 se colectaron en el campo muestras de papa con síntomas de PMP, las cuales se mantuvieron en invernadero mediante el injerto de tejido enfermo en chile manzano. Para estudiar la transmisión de PMP bajo condiciones de invernadero, se colectó material de tres localidades del Estado de México: faldas del Nevado de Toluca, Calimaya y Chapingo. Se marcaron tres plantas de 19 genotipos de papa con síntomas de PMP en el Campo Experimental Valle de México (CEVAMEX). Se tomaron tres esquejes de cada genotipo y se injertaron en papa de invernadero de un mes de edad, libre de los principales virus (PLRV, PVX, PVY, PVS y PVA). Los genotipos injertados fueron: Michoacán, Norteña, NAU-6 y Sangema.
Se realizaron pruebas de PCR en follaje de los genotipos muestreados en campo e injertados en invernadero, para corroborar que se trataba de un agente patogénico infeccioso después que se observaron síntomas en el follaje; se hicieron injertos sucesivos (desde dos hasta seis), transfiriendo el patógeno de una planta a otra. Para esto, se injertaron 83, 72, 9 y 6 plantas de las variedades Norteña, Michoacán, Zafiro y Lupita susceptibles al pardeamiento y en la cuales se inducen síntomas evidentes tanto en el follaje como en tubérculo; también se consideraron 34 y 10 plantas de los genotipos tolerantes NAU-6 y Lady Rosetta que expresan síntomas de pardeamiento leves o nulos en campo.
Otros genotipos que se injertaron serialmente fueron: Alpha (72 plantas), Bintje (4), Gigant (6), Granola (8), Marciana (2), Mondial (3), Montserrat (9), Mosca B (12), Sancal (9), Sangema (45), San José (4), clon 4-11(5) y 676008 Roja (5). Cada planta proveniente de campo con síntomas de PMP injertada en invernadero con material de ambos ciclos, representó inicialmente un aislamiento y algunas fueron analizadas en laboratorio con la técnica de PCR, para determinar la presencia o ausencia del fitoplasma.
Cuando los síntomas eran evidentes en el follaje o en los tubérculos, se procedió a realizar PCR utilizando iniciadores específicos para fitoplasmas. En el primer ciclo de amplificaciones se usó el par de iniciadores P1/Tint y en el segundo los pares de iniciadores universales R16mF2/R16mR1 y R16F2/R16R2 (Gundersen y Lee, 1996).
El número de muestras procesadas varió de 1 a 16 en los genotipos : Alpha (7), Gigant (4), Lady Rosetta (10), Michoacán (14), Mondial (1), NAU-6 (8), Norteña (10), Sangema (3) y Zafiro (16); sin embargo, el síntoma de pardeamiento en el tubérculo fue el criterio que se consideró para determinar si hubo o no transmisión del patógeno y con esta información se estimó el porcentaje de transmisión del total de injertos realizados. En 2006, los tubérculos procedentes de campo de clones con síntomas de PMP, fueron sembrados en el invernadero y se seleccionaron tres plantas (clones) con síntomas de la enfermedad.
A partir de las ramas con acortamiento de entrenudos, reducción de foliolos, amarillamientos y coloración purpúrea, se seccionaron esquejes de genotipos Zafiro, Norteña, Michoacán y Lupita, susceptibles al pardeamiento, estos fueron injertados en chile manzano y criollo mixquic, y en jitomate Rio Grande. Se tuvieron un total de 43 aislamientos, considerando cada injerto procedente de una planta con síntomas típicos de PMP, de campo o invernadero, como un aislamiento independiente.
Monitoreo de fitoplasmas en plantas de papa, chile y jitomate, mediante prueba de PCR
Las muestras de tejido de plantas de papa con síntomas en el follaje, tubérculos con pardeamiento y chile manzano en donde se mantuvo cada aislamiento, fueron sometidos a la prueba de PCR para detectar fitoplasmas. Las extracciones de ADN se realizaron por el método de Lee et al. (1993) y se hicieron PCR' s secuenciales o anidadas con los iniciadores universales R16F2n (5'- GAA ACG ACT AAG ACT GG-3') y R16R2 (5'-TGA CGG GTG TGT ACA CCC G-3'), con los cuales se obtiene un fragmento de 1 200 pares de bases (pb) de longitud (Lee et al., 1993; Gundersen y Lee, 1996).
Análisis por RFLP y secuenciación
El producto amplificado procedente de tubérculo fue digerido con endonucleasas de restricción AluI, HhaI, Hpall, Msel, Tsp 5091 y KpnI (Gibco BRL, Beverly, MA). Se agregaron 2 µl de buffer, 0.2 µl de cada enzima, 5 µl de producto de PCR y se aforó a un volumen final de 20µl. Para las enzimas Alu I, HhaI, Hpall, Msel se consideró una temperatura de digestión a 37 °C y para Tsp 5091 a 65 °C. Con la idea de asegurar una completa digestión de los productos se utilizó más tiempo del recomendado por el fabricante (24 h).
Los fragmentos de restricción fueron separados por electroforesis en gel de poliacrilamida al 8%, se tiñeron con bromuro de etidio (0.5 µg ml-1) y se observaron en fotodocumentador (Gel-Doc 2000, BIO-RAD). Para conocer los pesos moleculares de los patrones de bandeo obtenidos con la digestión, se colocó en gel de agarosa un marcador de peso molecular ØX174 ADN (promega symbios). La longitud de los fragmentos de ADNr se comparó con patrones electroforéticos propuestos por Davis et al. (1997); Lee et al. (1998).
Para corroborar los resultados obtenidos, el ADNr del fitoplasma (aproximadamente 1.2 pb) producto de la amplificación por PCR con los iniciadores R16 F2n y R16R2, se limpió con el sistema de purificación en columnas (Qiagen Co., Hilden Alemania). Los productos purificados se enviaron a secuenciar al laboratorio de bioquímica molecular, Facultad de Estudios Superiores Iztacala (FES-Iztacala), de la UNAM. Las secuencias obtenidas se compararon con la base de datos GenBank y con el paquete BLAST.
RESULTADOS
Colección de aislamientos y transmisión seriada por injerto de punta morada de la papa
En el año 2005 y 2006, no hubo transmisión de síntomas con los brotes (tejido de injerto) obtenidos de Sancal y Sangema, pero el resto de los aislamientos se obtuvieron altos porcentajes de transmisión, lográndose ésta desde 2 a 6 generaciones. De cuatro genotipos utilizados como portainjertos, Sangema mostró mayor porcentaje de transmisión (52.63%), Michoacán (42.10%), Norteña (31.57%) y NAU-6 (5.2%) (Cuadro 1).
En la transmisión seriada de las muestras procedentes de follaje, 1 de 7 fueron positivas para fitoplasma y de tubérculo 8 de 9. Esto indica que dicho patógeno fue transferido secuencialmente hasta la tercera transferencia y los síntomas inducidos y observados tanto en follaje como en tubérculo estuvieron asociados a este agente infeccioso (Cuadro 2). De 448 plantas injertadas con esquejes sintomáticos procedentes originalmente de campo y después de invernadero, 164 presentaron síntomas de pardeamiento y brotación anormal en el tubérculo y 284 sin síntomas; por lo tanto, se obtuvo un porcentaje de transmisión de 37. De las pruebas de PCR realizadas en follaje y tubérculo de algunas plantas del último genotipo injertado en las pruebas de transmisión seriada, la mayor detección se presentó en los tubérculos de NAU-6, Norteña, Michoacán y Alpha (Cuadro 2).
Detección y monitoreo de fitoplasmas mediante PCR
En tubérculos de Norteña y Michoacán, se tuvieron con mayor frecuencia detecciones positivas mediante PCR y también en muestras de follaje de la variedad Lady Rosetta, NAU-6 y Norteña; Michoacán en la segunda transferencia y en la quinta transferencia Michoacán y Zafiro, después de haber sido injertados en chile manzano; sin embargo, no se observó el pardeamiento típico en los tubérculos para el caso de Norteña y Michoacán (Cuadro 3).
De 116 plantas de papa con síntomas de PMP analizadas mediante PCR en follaje o tubérculo 19 fueron positivas, lo cual equivale a una detección de 16.37%. Para el caso de chile manzano y criollo mixquic la detección fue de 70.83% y 66.6% respectivamente (Cuadro 4). En jitomate no se detectó al fitoplasma (Cuadro 4 y Cuadro 5).
Se detectaron fitoplasmas en las tres localidades muestreadas del Estado de México: faldas del Nevado de Toluca, Calimaya y Chapingo, Texcoco; de donde se tomaron los aislamientos para injertar dentro del invernadero, donde también se detectaron casos positivos (Cuadro 5). Para los genotipos NAU-6 y Michoacán, sembrados en campo durante 2004 y 2005 la detección de fitoplasmas fue positiva (Figura 1).

En la Figura 1 se observa lo siguientes carriles: a) carrill M, marcador de peso molecular λ Sty I; b) carril 1, testigo positivo de vinca (Catharanthus roseus) infectado con el fitoplasma del amarillamiento del áster; c) carril 2, muestra de follaje de campo con síntomas de PMP en el genotipo Zafiro; d) carril 3, muestra de follaje de campo con síntomas de PMP en el genotipo NAU-6; e) carril 4, muestra de follaje de campo con síntomas de PMP en el genotipo Lady Rosetta; f) carril 5, muestra de follaje de campo con síntomas de PMP en el genotipo Norteña; g) carril 6, testigo positivo de vinca (Catharanthus roseus) infectado con el fitoplasma del amarillamiento del áster; h) carril 7, muestra de follaje de campo con síntomas de PMP en el genotipo Zafiro; i) carril 8, muestra de follaje de campo con síntomas de PMP en el genotipo NAU-6; j) carril 9, muestra de follaje de campo con síntomas de PMP en el genotipo Lady Rosetta; k) carril 10, muestra de follaje de campo con síntomas de PMP en el genotipo Norteña; estos fragmentos fueron amplificados aproximadamente 1.2 pb.
Los síntomas observados fueron la disminución en el crecimiento, enrollamiento de las hojas, clorosis, coloración roja o púrpura de nuevas hojas y proliferación de brotes axilares con hinchamientos en la base; en los tubérculos de NAU-6 el pardeamiento fue leve y en Michoacán moderado.
Pardeamiento y brotación anormal en genotipos de papa
Se pueden distinguir patrones de comportamiento de la severidad del pardeamiento de tubérculos; a) los genotipos Mosca B, NAU-6, Lady Rosetta, Gigant y Alpha tuvieron lecturas que fluctuaron de nulo a leve (N-L) hasta muy leve a leve moderado (ML-LM) y generalmente presentaron brotes finos; b) los genotipos Bintje, Atlantic, 08 Roja, 4-11, Zafiro, San José, Sangema, Sancal, Malinche, Marciana, Lupita y Granola presentaron lecturas desde moderado hasta moderado fuerte (M-MF) y generalmente no presentaron brotes; y c) Mondial, Michoacán, Montserrat y Norteña variaron de moderado a moderado fuerte (M-MF) a moderado fuerte a fuerte (MF-F) y la mayoría de las veces no presentaron brotes.
Los tubérculos de los 19 genotipos evaluados en campo, de los cuales se tomaron esquejes para injertar en invernadero, dieron positivo para fitoplasma mediante PCR. Por otra parte, no todos los tubérculos con pardeamiento obtenidos en el invernadero por injerto seriado, fueron positivos para fitoplasma con prueba de PCR-anidada (Figura 2). En este gel la banda observada para NAU-6, cuyo grado de pardeamiento va de OL a L, fue más gruesa y definida comparada con las obtenidas a partir de los tubérculos de Norteña y Michoacán con pardeamiento.

En este caso los carriles de la Figura 2 muestran lo siguiente: a) carril M, marcador de peso molecular 1pb ADN; b) carril 1, testigo positivo de vinca (Catharanthus roseus) infectada con un aislamiento de fitoplasma que induce amarillamiento del áster: c) carril 2-7, muestras de follaje de papa de invernadero (41, 42 y 43) con síntomas de PMP; d) carril 8, testigo positivo de vinca (Catharanthus roseus) infectada con un aislamiento de fitoplasma que induce amarillamiento del áster; e) carril 9-10, muestras de follaje de papa de invernadero con síntomas de PMP (44); f) carril 11-12, muestras de tubérculos de invernadero con síntomas de pardeamiento (31 y 1); g) carril 14, muestra de tubérculo de invernadero con síntomas de pardeamiento; i) carril 15, muestra de tubérculo de invernadero con síntomas de pardeamiento (32); j) carril 16-19, muestras de tubérculo de invernadero con pardeamiento; k) carril 20-21, muestras de follaje de campo con síntomas de PMP en el genotipo San José; l) carril 22, testigo negativo de follaje de invernadero sin síntomas.
Análisis por RFLP de productos amplificados por PCR y secuenciación
El patrón de restricción obtenido mediante las enzimas AluI, HhaI, Hpall, Msel, Tsp 5091 y KpnI (Gibco BRL, Beverly, MA) en tubérculo con pardeamiento del genotipo NAU-6 (muestra 41) corresponde al grupo áster yellows (Lee et al., 1998). En la Figura 3, se muestra el análisis de polimorfismos de la longitud de los fragmentos de restricción de la secuencia 16S ADNr amplificado por PCR, con los iniciadores R16F2n/R2, del tubérculo de papa clon NAU-6 con síntomas leves de pardeamiento. El ADN fue digerido con las enzimas de restricción MseI, HpaII, Tsp5091, HhaI, AluI, KpnI, separado por electroforesis en gel de poliacrilamida 8%; el carril MPM es el marcador del fago FX174 HaeII.
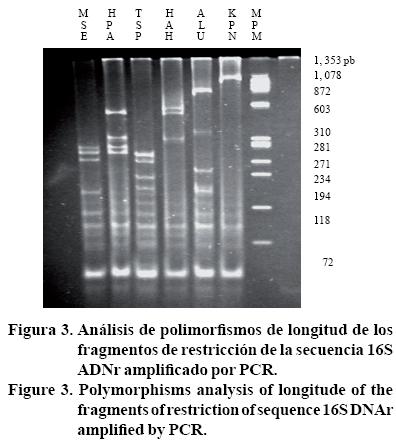
Al comparar la secuencia parcial de nucleótidos, obtenida de tubérculo con pardeamiento leve del genotipo NAU-6 (M41), con las secuencias depositadas en el GenBank, se encontró homología 98% con el fitoplasma Cirsium white leaf phytoplasma, Spiraea stunt phytoplasma y Walnut witches' broom phytoplasma, pertenecientes al grupo 16SIII, números de acceso AF373 1060, AF190228 y AF190227, respectivamente. Se obtuvo otra secuencia de nucleótidos proveniente de una muestra de follaje de papa de invernadero con síntomas de PMP, la cual indicó una homología 97% con el fitoplasma del grupo 16S I amarillamiento del áster y números de accesos DQ164213, AY37754, AY081817, AY737547, y AY733745.
DISCUSIÓN
La transmisión seriada por injerto que oscilo de dos a seis generaciones, por lo general fue baja. Hay varias explicaciones por la deficiente transmisión por injerto: 1) la misma naturaleza infectiva del fitoplasma que ocasiona necrosis en el floema (McCoy et al., 1989; Siddique et al., 2001), lo cual puede bloquear el intercambio de la savia infectada del injerto al portainjerto, que impide la diseminación del patógeno y el consecuente desarrollo de síntomas; 2) que la distribución y concentración de los fitoplasmas en los distintos tejidos de la planta no es uniforme (Siddique et al., 2001); de tal manera que el tejido usado como injerto puede o no tener al patógeno o tenerlo en muy baja concentración; esto también explicaría la variación en el periodo de incubación y manifestación de los síntomas en las plantas; 3) la variabilidad genética de cada una de las plantas que sirvieron de hospedante; 4) las condiciones ambientales que prevalecieron en las distintas fechas que se realizaron las pruebas de transmisión (Ploaie, 1981); y 5) que injertos realizados entre plantas de la misma especie no desarrollan tejidos de unión debido a la producción de sustancias inhibidoras (Dabek, 1983).
Sin embargo, en la presente investigación el injerto y portainjerto de papa llegaron a permanecer vivos durante un mes, incluso el injerto siguió desarrollándose y generando nuevos tejidos y brotes sintomáticos; lo mismo se observó en injertos de papa a chile y viceversa.
Estos resultados contradictorios pudieran deberse a las condiciones de campo, que permitieron un mejor desarrollo del follaje de las plantas de papa y de tubérculos producidos y por ende a condiciones fisiológicas de la planta más favorables para el establecimiento y multiplicación del fitoplasma. Una explicación posible para detección errática del patógeno, pudiera ser que esté distribuido irregular o heterogéneamente en la planta, lo cual dificulta su detección mediante esta prueba o bien que las concentraciones son tan bajas que no se detectan.
Es importante mencionar, que los positivos para fitoplasma con PCR en este trabajo siempre se obtuvieron mediante PCR anidada (Figura 1); indicando esto bajas concentraciones del mismo. Se han reportado resultados similares en cuanto a fallas en la detección por concentración de fitoplasmas pertenecientes al grupo amarillamiento del áster en plantas ornamentales del género Tagetes (Kaminska y Dziekanowska, 2001; Rojas et al., 2003).
Por otra parte, además de la concentración e infectividad del fitoplasma, las condiciones ambientales prevalecientes en diferentes épocas del año y susceptibilidad del hospedante (estado fisiológico y fenológico de la planta, época del año en que se colecta la muestra), son factores que intervienen en la expresión y severidad de los síntomas (Guthrie et al., 1998) dificultando en este caso, la detección del mismo.
En cuanto a severidad de los síntomas en el tubérculo, los resultados obtenidos coinciden con lo reportado en campo para las mismas variedades (Cadena et al., 2003). Síntomas similares fueron inducidos bajo condiciones de invernadero, por Bactericera cockerelli. (Diaz-Valasis et al., 2008). Hubo genotipos que presentaron pardeamiento de muy leve a leve y ocasionalmente no lo presentan pero alcanzaron a producir brotes finos como fueron los cultivares Alpha, Gigant, Lady Rosetta y NAU-6. Estos últimos también mostraron una respuesta similar en los tubérculos, cuando fueron expuestos a B. cockerelli en invernadero (Diaz-Valasis et al., 2008).
Sin embargo, esta última posibilidad podría descartarse dado que en las reacciones se consideró la detección del gen endógeno de cloroplasto, que siempre resultó positivo obteniéndose una banda de 315 pb. En cambio en NAU-6, que presenta pardeamiento leve, tanto en campo como en invernadero, la detección en follaje y en tubérculo fue más frecuente. Por los resultados obtenidos bajo condiciones de invernadero en diferentes genotipos, se considera que el pardeamiento en los tubérculos fue inducido por un patógeno infeccioso transmitido mediante injertos sucesivos (hasta 6 injertos seriados). La frecuencia de detección del fitoplasma mediante PCR tanto en tubérculo como en follaje fue baja; sin embargo, comparada con ésta última, la detección en tubérculo y brote fino fue ligeramente mayor.
En el caso de resultados positivos en follaje de la variedad Lady Rosetta y Michoacán en la segunda transferencia, Michoacán y Zafiro en la sexta después de haber sido injertados en chile manzano, no se observó el pardeamiento típico en los tubérculos, esto se debió a la presencia de una variante asintomática de fitoplasma. Lo anterior coincide con lo reportado en infecciones mixtas por fitoplasmas en una misma planta o a variantes presentes en follaje y tubérculo (Leyva-López y Martínez-Soriano, 2002), que pudieran estar expresando diferente sintomatología en la misma.
El patrón de RFLP's (Figura 3), procedente de un tubérculo de papa de invernadero (muestra 41) del clon NAU-6 con síntomas leves de pardeamiento, sugiere que este patógeno presumiblemente pudiera ser un fitoplasma asociado al grupo amarillamiento del áster. La evidencia experimental en este trabajo, indica que la sintomatología típica de PMP en el follaje y el pardeamiento en el tubérculo es inducida por un agente infeccioso, posiblemente un fitoplasma ya que logró ser transmitido hasta por seis generaciones mediante injertos seriales a través de diferentes genotipos de papa y chile.
CONCLUSIONES
El pardeamiento y la brotación anormal en los tubérculos fueron inducidos por un patógeno infeccioso, que logró ser transmitido mediante injertos sucesivos bajo condiciones de invernadero hasta seis veces en diferentes genotipos de papa.
La detección de fitoplasmas asociados con el pardeamiento y la brotación anormal de la papa, en follaje, tallo y tubérculo mediante PCR, fue errática e inconsistente en plantas mantenidas en invernadero. Sin embargo, en el campo fue consistente.
Las plantas de chile manzano pueden ser hospedantes intermediarias o alternas en la transmisión del patógeno involucrado en el pardeamiento y la brotación anormal del tubérculo.
Los genotipos Alpha, Gigant, Lady Rosetta y NAU-6, presentaron un pardeamiento de muy leve a leve; por lo tanto, pudieran ser utilizados para obtener variedades tolerantes a PMP, en los programas de mejoramiento genético.
LITERATURA CITADA
Almeyda-León, I. H.; Rubio, C. O.; Cadena-Hinojosa, M. A.; Díaz-Valasis, M.; Zavala, T. E. y Rocha, M. A. 1999. Implementación de técnicas moleculares para la detección del agente causal de la punta morada de la papa en plantas e insectos vectores. Laboratorio de patología molecular. INIFAP. Avances. 19 p. [ Links ]
Cadena-Hinojosa, M. A. 1974. Estudios sobre la punta morada de la papa. Tesis de Maestría. Centro de Fitopatología. Colegio de Postgraduados. Chapingo, Estado de México. 70 p. [ Links ]
Cadena-Hinojosa, M. A. 1987. Efecto de genotipos de plantas, aplicaciones de antibióticos e insecticidas en el control de la punta morada de la papa. Agric. Téc. Méx. 13:3-13. [ Links ]
Cadena-Hinojosa, M. A. 1993. La punta morada de la papa en México: incidencia y búsqueda de resistencia. Agrociencia. 4:247-256. [ Links ]
Cadena-Hinojosa, M. A. 1996. La punta morada de la papa en México: II efecto de cubiertas flotantes, cultivares y productos químicos. Rev. Mex. Fitopatol. 14:20-24. [ Links ]
Cadena-Hinojosa, M. A. 1999. Potato purple top in Mexico: effects of plant spacing and insecticide application. Rev. Mex. Fitopatol. 17:91-95. [ Links ]
Cadena-Hinojosa, M. A. y Galindo, A. J. 1986. Reducción de la incidencia de la punta morada de la papa por medio de fechas de siembra, genotipo de planta y aplicación de insecticidas. Rev. Mex. Fitopatol. 3:100-104. [ Links ]
Cadena-Hinojosa, M. A.; Guzmán-Plazola, R.; Díaz-Valasis, M.; Zavala Quintana, T. E.; Magaña-Torres, O. S.; Almeyda-León, I. H. y Rubio-Covarrubias, O. 2003. Distribución, incidencia y severidad del pardeamiento y la brotación anormal en los tubérculos de papa (Solanum tuberosum L.) en valles altos y sierras del Estado de México, Tlaxcala y Distrito Federal. Rev. Mex. Fitopatol. 21:248-259. [ Links ]
Cárdenas, S. E.; Valdovinos, P. G.; Cadena-Hinojosa, H. M. y Estañol, B. E. 1992. Detección de organismos tipo micoplasmas en plantas de papa con los síntomas de "punta morada". XXI Congreso Nacional de la Sociedad Mexicana de Fitopatología. Cuernavaca, Morelos, México. Memorias. 62 p. [ Links ]
Dabek, A. J. 1983. Leafhopper transmission of Rhynchosia little leaf, a disease associated with mycoplasma-like organisms in Jamaica. Ann. Appl. Biol. 103:431-438. [ Links ]
Davis, R. I.; Schneider, B. and Gibb, K. S. 1997. Detection and differentiation of phytoplasmas in Australia. Aust. J. Agric. Res. 48:535-544. [ Links ]
Díaz-Valasis, M.; Cadena-Hinojosa, M. A.; Rojas-Martínez, I.; Zavaleta-Mejía, E.; Ochoa-Martínez, D. and Bujanos, M. R. 2008. Responses of potato cultivars to the psyllid (Bactericera cockerelli) under greenhouse conditions. Agric. Téc. Méx. 34:471-479. [ Links ]
Gundersen, D. E. and Lee, I. M. 1996. Ultrasensitive detection of phytoplasmas by nested-PCR assays using two universal primer pairs. Phytopathol. Mediterranea. 35:144-151. [ Links ]
Guthrie, J. N.; White, D. T.; Walsh, K. B. and Scott, P. T. 1998. Epidemiology of phytoplasma-associated to papaya diseases in Queensland, Australia. Plant Dis. 82:1107-1111. [ Links ]
Hirumi, H. and Maramorosh, K. 1968. Mycoplasma like bodies in the salivary glands of insect vectors carring the Aster Yellow Agent. J. Virol. 3:82-84. [ Links ]
Kaminska, M. and Dziekanowska, D. 2001. Detection of aster yellows phytoplasma in Tagetes patula plants with two types of symptoms. Phytopathol. Polonica. 21:81-92. [ Links ]
Kunkel, L. O. 1926. Studies on Aster Yellows. Am. J. Bot. 13:646-705. [ Links ]
Leach, J. G. and Bishop, C. F. 1944. Further studies on the nature and cause of purple top wilt of potatoes. Phytopathol. 34:1006-1007. [ Links ]
Lee, I. M.; Hammond, R.; Davis, R. E. and Gunderson, D. E. 1993. Universal amplification and analysis of pathogen 16S rDNA for classification and identification of mycoplasma-like organisms. Phytopathol. 83:834-842. [ Links ]
Lee, I. M.; Gundersen-Rindal, D. E.; Davis, R. E. and Bartoszyk, I. M. 1998. Revised classification scheme of phytoplasmas based on RFLP analyses of 16S rRNA and ribosomal protein gene sequences. Int. J. System. Bacteriol. 48:1153-1169. [ Links ]
Lee, I. M.; Bottner, K. D.; Munyaneza, J. E.; Secor, G. A. and Gudmestad, N. C. 2004. Clover proliferation group (16srvi), subgroup a (16srvi-a) phytoplasma is probable causal agent of potato purple top disease in Washington and Oregon. Plant Dis. 88:429. [ Links ]
Lee, I.; Bottner, K. D.; Secor, G. and Rivera-Varas, V. 2006. "Candidatus phytoplasma americanum", a phytoplasma associated with a potato purple top wilt disease complex. Int. J. System. Evol. Microbiol. 56:1593-1597. [ Links ]
Leyva-López, N. E. y Martínez-Soriano, J. 2002. Diagnóstico diferencial de fitoplasmas en papa y su aplicación en la búsqueda de vectores. Taller internacional sobre punta morada de papa y Paratrioza cockerelli. INIFAP. México. Memoria. 34-51 pp. [ Links ]
McCoy, R. E.; Caudwell, A.; Chang, C. J.; Chen, T. A.; Chikowski, L. N.; Cousin, M. T.; Dale, J. L.; Leeuw de G., T. N.; Golino, D. A.; Hackett, K. J.; Kirkpatrick, B. C.; Marwitz, R.; Petzol, H.; Sinha, R. C.; Sugiura, M.; Whitcomb, R. F.; Yang, I. L.; Zhu, B. M. and Seemuller, E. 1989. Plant diseases associated with mycoplasma-like organisms. 545-640. pp. In: the mycoplasmas. Whitcomb, R. F. and Tully, J. G. (eds). Vol. 5. Academic Press. Unites States of America. 780 p. [ Links ]
Maramorosch, K. 1998a. Potato purple top wilt. Segundo Simposio Internacional sobre el cultivo de la Papa. Toluca, Estado de México, México. Memorias. 21-31 pp. [ Links ]
Maramorosch, K. 1998b. Current status of potato purple top wilt. Int. J. Trop. Plant. Dis. 16:61-72. [ Links ]
Maramorosch, K.; Shikata, E. and Granados, R. 1968. Structures resembling mycoplasma in diseased plants vectors. Transactions of the New York Academy of Sciences. 30:841-855. [ Links ]
Ploaie, P. G. 1981. Mycoplasma like organisms and plant diseases in Europe. In: Maramorosh, K. and Harris, K. F. (eds). Plant diseases and vectors: ecology and epidemiology. Academic Press. New York, USA. 368 p. [ Links ]
Rojas-Martínez, R. I.; Zavaleta-Mejía, E.; Lee, I. M.; Martín, M. and Aspiroz, H. S. 2003. Detection and characterization of the phytoplasma associated with marigold phyllody in Mexico. J. Plant Pathol. 85:81-86. [ Links ]
Self, R. L. and Darling, H. M. 1953. Purple top disease of the potato in Wisconsin. Research Bulletin 184. University of Wisconsin. Madison, Unites States of America. 24 p. [ Links ]
Siddique, A. B. M.; Agrawa, G. K.; Alam, L. N. and Krishna-Reddy, M. 2001. Electron microscopy and molecular characterization of phytoplasmas associated with little leaf disease of brinjal (Solanum melongena L.) and periwinkle (Catharanthus roseus) in Bangladesh. J. Phytopathol. 149: 237-244. [ Links ]
Zavala Quintana, T. E. y Cadena-Hinojosa, M. A. 1998. Punta morada de la papa. Tecnología de cultivo de papa. CONPAPA. INIFAP. Toluca, Estado de México. Resúmenes. 17-19 pp. [ Links ]














