Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias agrícolas
versión impresa ISSN 2007-0934
Rev. Mex. Cienc. Agríc vol.1 no.4 Texcoco oct./dic. 2010
Artículos
Análisis espacio-temporal de aislamientos del Citrus tristeza virus de Yucatán y Tamaulipas*
Spatio-temporal analysis of Citrus tristeza virus isolates from Yucatán and Tamaulipas
Patricia Rivas-Valencia1§, Emiliano Loeza-Kuk2, Gustavo Mora-Aguilera3, Noé Ruiz-García3, Daniel Leobardo Ochoa-Martínez3, Alejandra Gutiérrez-Espinosa4 y Vicente Febres5
1 Campo Experimental Valle de México. INIFAP. Carretera Los Reyes-Lechería, km 18.5. Chapingo, Estado de México. C. P. 56230. Tel. 01 595 9212738. Ext. 129. §Autora para correspondencia: rivas.patricia@inifap.gob.mx.
2 Campo Experimental Mocochá. INIFAP. Carretera Mérida-Motul, km 25. Mococha, Yucatán. C. P. 97457. Tel. 01 991 9162215. (loeza.emiliano@inifap.gob.mx).
3 Fitopatología. Colegio de Postgraduados. Carretera México-Texcoco, km 35.5. Montecillo, Estado de México. C. P. 56230. Tel. 01 595 9520200. Ext. 1620 y 1629. (morag@colpos.mx), (ldaniel@colpos.mx).
4 Fruticultura. Colegio de Postgraduados. Tel. 01 595 9520200. Ext. 1123. (alexge@colpos.mx).
5 University of Florida. EUA.
* Recibido: mayo de 2010
Aceptado: diciembre de 2010
Resumen
Se estudiaron huertas comerciales de cítricos (Citrus sinensis L.), ubicadas en las principales regiones productoras de Yucatán de 2003 a 2006 y en Tamaulipas en 2004. En Yucatán se realizó un estudio espacio-temporal de la dispersión de la tristeza de los cítricos, ocasionada por el Citrus tristeza virus, en presencia de Toxoptera citricida Kirkaldy. La incidencia inicial (X0) fue de 4.41% y la final (Xf) de 39.33%. Los índices de agregación de Morisita y Lloyd dependientes del tamaño óptimo de cuadrante, mostraron un patrón agregado con valores entre 1.41 y 2.39. Además, se caracterizaron molecularmente aislamientos del Citrus tristeza virus, para examinar la diversidad del virus presente. Se analizaron aislamientos del virus con single-strand conformation polymorphism, observándose hasta dos haplotipos por aislamiento y tres tipos de patrones en Yucatán. En Tamaulipas, con la caracterización molecular, se identificaron tres haplotipos por aislamiento y siete patrones. El coeficiente de similaridad calculado para estas dos poblaciones de aislamientos fue de 0.7, asumiéndose un origen común de ambas poblaciones. El análisis de varianza molecular, indicó mayor variabilidad dentro de las poblaciones (69%) y entre ellas (31%), comprobando que ambas regiones citrícolas, comparten variantes caracterizadas como de tipo moderado, mismo que puede justificar la ausencia de sintomatología atribuible a tristeza. Los análisis realizados para identificar el patrón de dispersión de los aislamientos en campo no evidenciaron la dispersión entre árboles e hileras.
Palabras clave: autocorrelación, coeficiente de simililaridad, estructura poblacional, haplotipo.
Abstract
Citric (Citrus sinensis L.) commercial vegetable gardens were studied, located in the main producing regions of Yucatán from 2003 to 2006 and in Tamaulipas in 2004. In Yucatán it was carried out a space-time study of dispersion of citric tristeza, caused by Citrus tristeza virus, in presence of Toxoptera citricida Kirkaldy. The initial incidence (X0) was of 4.41% and the final (Xf) was of 39.33%. The aggregation indexes of Morisita and Lloyd dependent of the optimum size of quadrant showed an added pattern with values between 1.41 and 2.39. Also, isolations of Citrus tristeza virus were molecularly characterized to examine the diversity of current virus. Virus isolations were analyzed with single-strand conformation polymorphism, being observed up to two haplotypes by isolation and three types of patterns in Yucatán. In Tamaulipas, with the molecular characterization, three haplotypes were identified by isolation and seven patterns. The similarity coefficient calculated for these two populations of isolations was of 0.7, being assumed a common origin for both populations. The analysis of molecular variance indicated bigger variability inside the populations (69%) and between them (31%), proving that both citric regions share variants characterized as of moderate type, which can justify the absence of symptoms attributable to tristeza. The analyses carried out to identify dispersion pattern of the isolations in field didn't evidence the dispersion between trees and rows.
Key words: autocorrelation, coefficient of simililarity, populational structure, haplotype.
INTRODUCCIÓN
En el cultivo de cítricos en México, el portainjerto predominante es el naranjo agrio (Citrus aurantium L.), susceptible al Citrus tristeza virus (CTV); patógeno responsable de epidemias de la tristeza de los cítricos; sin embargo, a diferencia de otros países, no se han presentado los síntomas típicos de tristeza como decaimiento rápido de los árboles y disminución importante de la producción (Garnsey et al., 1987). En México desde 2003, se estudian aspectos poblacionales del CTV, el cual está presente en casi todas las regiones citrícolas excepto en los estados de Sinaloa, Querétaro y Chiapas (SENASICA, 2010).
Este virus se transmite de forma natural por diversas especies de áfidos, entre las que sobresalen por su aparente eficiencia de selección y transmisión de aislamientos, en orden de importancia y presencia en México: Toxoptera citricida Kirkaldy, Aphis gossyppi Glover, A. spiraoecola Patch, A. fabae Scopoli y T. auranti Boyer de Fonscolombe (Gaona et al., 2000; Silva et al., 2001). T. citricida ingresó el año 2000, a través de la península de Yucatán (Michaud y Álvarez, 2000) y actualmente se encuentra en Tabasco, Chiapas, Veracruz, Puebla, Hidalgo, San Luis Potosí, Oaxaca y Guerrero (SENASICA, 2010), representa un factor de riesgo importante para la citricultura nacional, debido a su aparente eficiencia de transmisión de aislamientos que causan sintomatología de tipo severo (d'Urso et al., 2000; Powell y Lin, 2005).
En los estados de Nuevo León, Colima, Baja California, Veracruz (Silva et al., 2001; Mendoza et al., 2003; Herrera, 2004) y Tamaulipas (Loeza et al., 2005), se han detectado y caracterizado molecularmente aislamientos de CTV, que inducen síntomas con alto grado de severidad. Poco se conoce sobre la estructura poblacional del CTV (composición y frecuencia de aislamientos) existente en un contexto espacial y temporal en México, por tanto resulta indispensable su estudio para el diseño de estrategias de control de epidemias, que permitan determinar el riesgo de cambios en su intensidad por el incremento en la frecuencia de aislados de tipo severo.
Este estudio planteó la hipótesis que la presencia de T. citricida en Yucatán determinaría una estructura poblacional compleja, heterogénea y dinámica de aislamientos de CTV, con prevalencia a aislamientos de tipo severo, caracterizados molecularmente y dispuestos espacialmente en agregados, que provocarían epidemias intensas. En el caso de Tamaulipas ante la ausencia de T. citricida y la presencia de otras especies de áfidos vectores como A. gossypii, la estructura poblacional del CTV, estaría compuesta predominantemente por aislamientos de tipo moderado, caracterizados molecularmente y menor complejidad, distribuidos espacialmente en agregados de menor intensidad.
El objetivo de esta investigación fue realizar un estudio poblacional y epidemiológico de aislamientos de CTV con técnicas clásicas y moleculares, para identificar la prevalencia diferencial de los aislamientos y detectar temporalmente cambios en la estructura poblacional y el comportamiento espacial del CTV, derivado de la presencia de T. citricida, que sustente la implementación de acciones de predicción, prevención y control de la enfermedad.
MATERIALES Y MÉTODOS
Ubicación del área de estudio. En 2003 y 2004, se realizaron muestreos y colectas de material propagativo de árboles positivos a CTV, en huertas comerciales ubicadas en el municipio de Ticul en el estado de Yucatán y en el estado de Tamaulipas en los municipios de Mante, Padilla, Güemez y Llera (Cuadro 1). Para realizar los análisis espaciales y temporales, se seleccionaron las huertas con mayor incidencia histórica de árboles infectados por CTV, aún y cuando éstos fueron erradicados (NOM-031-FITO 2001), como ocurrió en el caso de Yucatán, en el cual el estudio se continuó en 2004 y 2006 (Cuadro 1). En Tamaulipas, la huerta contaba con los árboles positivos a CTV en pie.
Diagnóstico. Para la detección de árboles positivos a CTV se realizó con DAS-ELISA, utilizando los reactivos y protocolo de Agdia Inc. y con el kit de inmunoimpresión ELISA-directo (Plant Print Diagnostics SL.), que utilizan los anticuerpos 3DF1 y 3CA5, de acuerdo al procedimiento de Ruiz et al. (2009) y considerando la sensibilidad de cada una de las técnicas.
Muestreo de material vegetal. El material vegetal que se colectó consistió de varetas, brotes y hojas jóvenes tomados de los cuatro puntos cardinales del dosel del árbol, a una altura promedio de 1.5 m.
Conservación de material propagativo. Las varetas colectadas de los árboles positivos a CTV, se sumergieron en oxicloruro de cobre al 2.5% para desinfección y se envolvieron en papel dentro de bolsas de plástico, almacenándose en refrigeración a 4 °C.
Análisis espacio-temporal. En Yucatán los datos de incidencia de árboles positivos a CTV, se seleccionó la huerta identificada como C2, se construyó un mapa de dispersión de la tristeza de los cítricos con el programa Surfer® 6.04. Se calcularon, para cada fecha de muestreo, los índices de agregación de Morisita (Morisita, 1959) y Lloyd (Lloyd, 1967) dependientes del tamaño óptimo de cuadrante (TOC) propuesto por Greig (1952) y se llevó a cabo un análisis de autocorrelación espacial para determinar la intensidad y orientación de agregación usando el programa LCOR© (Gottwald et al., 1992).
Caracterización de la estructura poblacional de CTV. Se realizó la extracción de RNA y RT-PCR para la amplificación parcial del gen que codifica la capa proteica (CP) del CTV. Se usó Trizol® Reagent (Invitrogen™), para la extracción de RNA total de cada muestra (100 mg de hoja fresca), según protocolo del fabricante (Cat. Núm. 15596-018) RT-PCR. Se amplificó una parte del gen p25 que codifica a la CP en el extremo 3' (273 pb) por RT-PCR de un paso, utilizando 5 µL de RNA total precalentado por 5 min a 65 oC, mezclado en un volumen final de 50 µL usando 10x PCR buffer, 2.5 mM de MgCl2, 0.1 mM de DDT, 200 Mm de DNTP's, 0.5 µL (100 ng µL-1) de los iniciadores específicos CPKF 5' AACGCCCTTCGAGTCTGGGGTAGGA3' y CPKR 5'TCAACGTGTGTTGAATTTCCCAAGC 3' (Kong et al., 2000), 20 unidades de RNAseout (Invitrogen™), 50 unidades de M-MLV transcriptase reversa (Invitrogen™) y 1.25 unidades de Taq DNA Polymerase (Promega™).
El programa de amplificación constó de 35 ciclos de 2 min a 94 °C, 2 min a 55 °C y 2 min a 72 °C seguido de un periodo de extensión de final de 10 min a 72 °C. El producto de la amplificación se analizó en gel de agarosa a 1% teñido con bromuro de etidio. Se utilizó single-strand conformation polymorphism (SSCP), para detectar mutaciones y cambios puntuales de bases en fragmentos de ADN del mismo tamaño (polimorfismo), que permita la identificación de patrones (Kong et al., 2000), se realizó según metodología descrita en Rivas et al. (2008).
PCR selectiva. Adicionalmente, las muestras se sometieron a RT-PCR de dos pasos (síntesis de cADN y PCR) con los iniciadores RF 137 5' CCG TAR AGG GAC KAT CGG C 3'/PM 34 5'TGG TGT AAA TCC CAA CCA GAC GGT TG 3' y RF 137/PM 35 5'ATC GCG CAT CTG GCG CAA AC 3', que amplifican un segmento de 229 y 115 pb de la región terminal 5' no traducida (UTR); que diferencian aislamientos de tipo T-385 (moderado) y T-36 (severo), respectivamente (Ayllón et al., 2001).
Epidemiología molecular. En Yucatán y Tamaulipas, se construyeron mapas de dispersión de los patrones electroforéticos con el programa Surfer 6.04© y se realizó el análisis de la distancia al árbol positivo más cercano (Ruiz, 2008) y dinámica de dispersión de focos (Jesus y Bazanessi, 2004), para examinar y establecer el comportamiento espacial de éstos con y sin presencia de T. citricida. Se determinó la frecuencia de los patrones electroforéticos caracterizados en el tiempo y se construyeron gráficas de frecuencias.
Análisis de poblaciones. Fueron utilizadas vectores de presencia (1) y ausencia (0) de bandas SSCP, para construir matrices del cuadrado de la distancia Euclidiana definida como E= ξ2xy= n[(1-2nxy)/2n]; donde, 2nxy= número de marcadores compartidos por dos individuos; n= número total de bandas polimórficas. Con cada una de las matrices se generaron dendrogramas por el método de promedio aritmético de grupos de pares no ponderados (UPGMA) con el programa NTSYSpc ver. 2.10L. Así, el análisis de las variaciones del perfil de SSCP del gen p25 de la capa proteica obtenidas de plantas asintomáticas de las dos regiones geográficas estudiadas, fueron sometidas a un análisis de varianza molecular (AMOVA) con el programa GenAlEx6 (Peakall y Smouse, 2006).
RESULTADOS Y DISCUSIÓN
En Yucatán, la incidencia inicial de tristeza fue 4.41% y se incrementó hasta 39.33%. La exploración del mapa de dispersión de la tristeza de los cítricos de 2003 a 2006 (Figura 1), mostró una agregación intensa, lo cual puede estar asociado al hábito colonizador de T. citricida por un lado y por otro a la composición de la huerta de naturaleza mixta (presencia de otros árboles frutales) que en general, podría causar un efecto confinamiento de los áfidos presentes, que en condiciones de monocultivo, no tienen el hábito de permanecer en los árboles de cítricos (Aphis gossypii).
La diversidad de hospedantes afecta la incidencia de la enfermedad en dos formas: 1) cambios en la población de los insectos vectores, afectando la colonización, migración, reproducción o mortalidad; y 2) la tasa de transmisión del patógeno puede cambiar como efecto del comportamiento o hábito alimenticio del vector (Powell, 1991).
Los índices de Morisita y Lloyd dependientes del tamaño óptimo de cuadrante mostraron para el 2003, 2004 y 2003-2006 un comportamiento de tipo agregado con valores entre 1.41-2.03 y 1.54-2.39, respectivamente (Cuadro 2). Lo anterior confirmó de manera cuantitativa, la disposición espacial en agregados de árboles con CTV en presencia de T. citricida, identificada también en el mapa de dispersión para la huerta C2 (Figura 1). Este comportamiento fue identificado en Costa Rica y República Dominicana por Gottwald et al. (1998).
El patrón uniforme que se presentó en 2006, con valores de 0.93 y 0.91 para Morisita y Lloyd, respectivamente (Cuadro 2), pudo ser consecuencia de la disponibilidad limitada de árboles de cítricos sanos, así como la presencia de otros áfidos vectores como Aphis gossypii, segundo vector con mayor importancia (Yokomi et al., 1994).
Los análisis de autocorrelación para esta misma huerta, mostraron dependencia espacial continua (agregación) de hasta 21 árboles (dirección oeste-este) y una dependencia discontinua de orden cinco, seis y 12 (dirección norte-sur), durante las tres evaluaciones (Cuadro 2). Sin embargo, considerando la naturaleza mixta de la huerta, estos análisis pueden no ser concluyentes.
Caracterización molecular y epidemiología
En las tres huertas de Yucatán estudiadas en 2003, se caracterizaron tres patrones electroforéticos por SSCP; donde, I= tres bandas; II= dos bandas; III= tres bandas con diferente migración al patrón I; Mm= marcador molecular, utilizado sólo como referencia de distancia de migración (Figura 2).
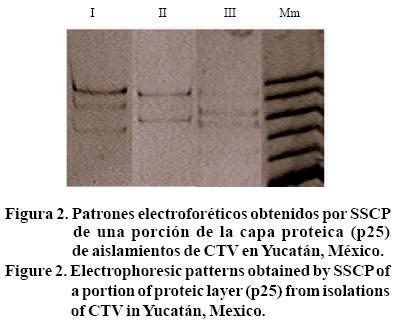
En la huerta C2 se identificaron dos patrones electroforéticos de dos y tres bandas, si consideramos que una banda corresponde a una cadena de ADN dúplex, existe entonces una combinación de hasta dos haplotipos en cada aislamiento. Una estructura poblacional simple comparada con la encontrada en aislamientos de CTV en otros países; por ejemplo, en Brasil se encontraron hasta siete haplotipos interactuando en un aislamiento (Rivas et al., 2008). La PCR selectiva amplificó únicamente un segmento de 229 pb, que caracteriza a aislamientos con una severidad moderada tipo T-385.
El comportamiento temporal de los patrones identificados en la huerta C2 (patrones I y II), determinado por su frecuencia en campo (Figura 3), indica los siguientes eventos: 1) presencia de dos patrones electroforéticos, I= patrón con tres bandas y II= patrón con dos bandas; 2) la prevalencia del patrón I se presentó en 2003 y 2006; y 3) el patrón II prevaleció en el 2004 y se mantuvo en 2006; esto es una evidencia de cambios en la estructura poblacional, ligados a procesos de aloinfección; es decir, de infecciones provenientes de otros árboles.

Los eventos antes descritos, muestran un comportamiento dinámico de la población de los aislamientos de CTV, determinados por la relación entre la planta y el vector (Sentandreu et al., 2006; Nolasco et al., 2007), las propiedades biológicas y poblacionales del virus (Moya et al., 1999), además de otros factores del entorno, como son la áfido-fauna presente, en especial T. citricida (Gaona et al., 2000; Silva et al., 2001), el clima, manejo, entre otros. La ausencia del patrón III en esta huerta pero identificado en la región puede deberse a diversos factores como son: el periodo del estudio, el origen del material vegetal propagativo e inóculo inicial asociado a éste; eventos de segregación, recombinación o cuellos de botella poblacional de los haplotipos presentes en la planta (Rubio et al., 2001; Nolasco et al., 2007) o procesos de autoinfección (múltiples infecciones en un mismo árbol). La menor frecuencia del patrón II, puede ser consecuencia de la capacidad limitada para permanecer o mantenerse en la naturaleza.
El mapa de dispersión de los aislamientos de CTV en la huerta C2 de la Figura 4, los espacios en blanco, son árboles positivos a CTV cuyo aislamiento no fue caracterizado molecularmente; en la cual se muestra que la disposición espacial del patrón electroforético I (circulo claro) está mayormente distribuido; sin embargo, no es evidente si la dispersión de este patrón se lleva a cabo entre árboles o entre hileras. Otra situación relevante es que en torno a los árboles erradicados en 2002 (Figura 4, cuadro con cruz interna), sólo están presentes los patrones electroforéticos I y II, el patrón electroforético III observado en otra huerta, parece no estar relacionado con los anteriores, por lo que es muy posible que pueda provenir de una fuente diferente.

Adicionalmente, estudios previos sobre la estructura poblacional de aislamientos que porta un áfido vector (T. citricida) en campo, han demostrado que los haplotipos de CTV poseen baja diversidad nucleotídica y en consecuencia esto causa que la dispersión del CTV en la huerta mantenga una estructura poblacional característica (Albiach et al., 2000). Lo anterior se puede explicar por la poca variabilidad detectada.
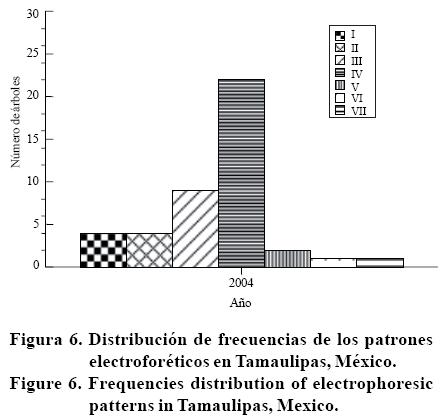
En Tamaulipas, los patrones electroforéticos obtenidos con SSCP en la huerta E1; donde, I= cuatro bandas; II= tres bandas; III= tres bandas; IV= dos bandas, V= tres bandas; VI= cuatro bandas; VII= cinco bandas; Mm= marcador de peso molecular (utilizado sólo como referencia de distancia de migración), mostraron una conformación de hasta cinco bandas, encontrándose en un aislamiento al menos tres haplotipos, categorizados en siete tipos de patrones (Figura 5).

Las frecuencias de los patrones promedio en campo fueron las siguientes: patrón I 4/43, II 4/43, III 9/43, IV 22/43, V 2/43, VI 1/43 y VII 1/43. La frecuencia más alta correspondió al patrón IV (dos bandas, un haplotipo) de la Figura 5 y en la Figura 6 donde, I= cuatro bandas; II= tres bandas; III= tres bandas; IV= dos bandas; V= tres bandas; VI= cuatro bandas; VII= cinco bandas. Esto puede ser evidencia de que la población se está diversificando o el haplotipo predominante tiene características particulares que le confiere ventaja sobre los demás, con tendencia a mantenerse en la naturaleza.
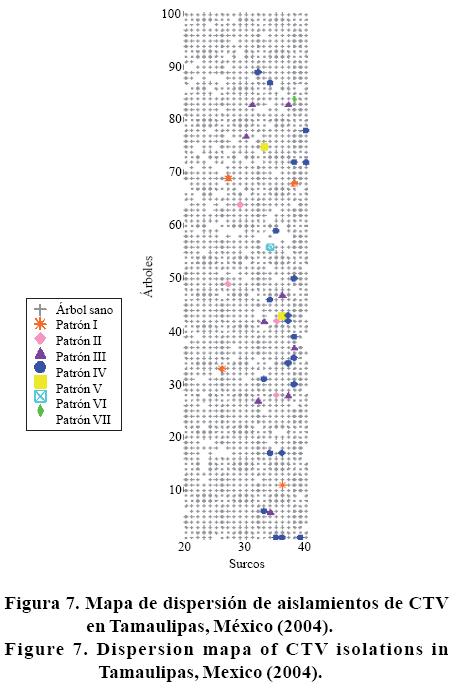
El la Figura 7 se muestra el mapa de dispersión de aislamientos de CTV en Tamaulipas, donde los espacios en blanco indican árboles positivos sin caracterización molecular del aislamiento. En esta se observa una agregación a partir de la hilera (árboles) 30 a 50, con una aparente dispersión gradual en dirección de las hileras. El patrón prevalente (IV) se distribuye a lo largo del área de estudio y aparentemente se asocia con el patrón III.
El análisis de la distancia al árbol positivo más cercano y la dinámica de dispersión de focos no fue concluyente, ya que no todos los árboles positivos se caracterizaron a nivel molecular; sin embargo, en Yucatán la mayor proporción en la dispersión de haplotipos fue a los árboles vecinos más cercanos que distan 5, 7 y 10 m de un árbol positivo de referencia, aun cuando se observó una menor proporción de dispersión en apariencia aleatoria.
Análisis de poblaciones de CTV en Yucatán y Tamaulipas. Los dendrogramas construidos a partir de las matrices de ausencia y presencia de bandas (no mostrados), dieron como resultado para Yucatán, un coeficiente de similaridad de 0.86, observándose tres grupos. Se presentó mayor distancia genética entre el grupo 1 (patrón electroforético I) y el grupo 3 (patrón electroforético II), el grupo 2 (patrón electroforético III) que además corresponde a la huerta C1, puede ser un patrón de transición entre ambos grupos. En el dendrograma construido a partir de 43 aislamientos obtenidos de Tamaulipas, con un coeficiente de similaridad de 0.8, se observaron siete grupos que correspondieron a los patrones electroforéticos caracterizados.
Por lo tanto, Tamaulipas presentó mayor variabilidad de aislamientos de CTV, con respecto a Yucatán, lo cual puede ser diversos factores como la edad de las huertas (25-30 años), homogeneidad de las huertas (monocultivo), manejo intensivo, diversidad de variedades y combinaciones injerto/portainjerto e intercambio de material vegetativo posiblemente infectado, que al ser expuestas a infecciones múltiples del CTV, provocó cambios en la estructura poblacional de virus. Al respecto se han realizado numerosos estudios, sometidos a cambios de hospederos, áfidos vectores, condiciones climáticas y manejo, entre otras (Ayllón et al., 2006; Sambade et al., 2007; Weng et al., 2007).
El análisis de varianza molecular (AMOVA), refuerza la idea sobre la fuente común del CTV en Yucatán y Tamaulipas, ya que se calculó 31% de variación entre las poblaciones, el mayor porcentaje de variación se observó dentro de las poblaciones (Cuadro 3), que puede ser derivado de los factores antes mencionados, además que el primer reporte de tristeza ocurrió en Tamaulipas en 1983 (SENASICA, 2010), con un periodo amplio para la diversidad aunado a la presencia de otros áfidos vectores del CTV distintos a T. citricida, en especial de A. gossyppi, que participa en la dispersión de la enfermedad como ha ocurrido en España e Israel (Cambra et al., 2000).
El análisis de dispersión del vecino más cercano y la dinámica de la dispersión de focos no fue concluyente debido, que no todos los árboles identificados como positivos a CTV, pudieron ser caracterizados molecularmente; sin embargo, éstas herramientas analíticas pueden ser de gran utilidad en el estudio de la dispersión de poblaciones de patógenos.
CONCLUSIONES
Desde la llegada de T. citricida a México, no ha sido posible detectar cambios en la estructura poblacional del CTV atribuibles a este vector, tampoco a la sintomatología severa que se exprese en decaimiento de los árboles. Esto puede deberse que los aislamientos moderados detectados en ambas regiones estén actuando como protectores naturales.
La diversidad de la estructura poblacional en virus, es un mecanismo que evita la respuesta de resistencia del hospedero o como reserva que mantiene a los haplotipos con ventajas en otros ambientes y con habilidad para infectar numerosos hospederos; por ello y con los resultados antes descritos, se aporta información sobre algunos de los factores que contribuyen o permiten la diversidad génica viral.
AGRADECIMIENTOS
El presente trabajo de investigación fue parcialmente financiado por el proyecto CONACYT G35488-b. Campaña contra el virus de la tristeza de los cítricos (CTV) en Tamaulipas y Yucatán (DGSV), Comité de Fomento e Investigación Citrícola del Estado de Tamaulipas (CFICET); Campo Experimental Francisco Villa; Unión Agrícola Regional de Citricultores de Tamaulipas (UARCT) y Fundación Produce Tamaulipas.
LITERATURA CITADA
Albiach, M. R.; Guerri, J.; Hermoso de Mendoza, A.; Laigret, F.; Ballester-Olmos, J. F. and Moreno, P. 2000. Aphid transmission alters the genomic and defective RNA populations of Citrus tristeza virus isolates. Phytopathology. 90:134-138. [ Links ]
Ayllón, M. A.; López, C.; Navas-Castillo, J.; Garnsey, S. M.; Guerri, J; Flores, R. and Moreno, P. 2001. Polymorphism of the 5' terminal region of Citrus tristeza virus (CVT) RNA: Incidence of three sequences types in isolates of different origin and pathogenicity. Arch. Virology. 146:27-40. [ Links ]
Ayllón, M. A.; Rubio, L.; Sentandreu, V.; Moya, A.; Guerri, J. and Moreno, P. 2006. Variations in two genes sequences of Citrus tristeza virus alter host passage. Virus Genes. 32:119-128. [ Links ]
Cambra, M.; Gorris, M. R.; Marroquín, C.; Román, M. P.; Olmos, A.; Martínez, M. C.; Hermoso de Mendoza, A.; López, A. and Navarro, L. 2000. Incidence and epidemiology of Citrus tristeza virus in the valencian community of Spain. Virus Res. 71:85-95. [ Links ]
Diario Oficial de la Federación (DOF). 2001. Norma Oficial Mexicana NOM-031-FITO-2000. Por la que se establece la campaña contra el virus tristeza de los cítricos. [ Links ]
d'Urso, F.; Rubio, M. A.; Ayllón, L.; Sambade, A.; Hermoso de Mendoza, A.; Guerri, J. and Moreno, P. 2000. Contribution of uneven distribution of genomic RNA variants of Citrus tristeza virus (CTV) within the plant to changes in the viral population following aphid transmission. Plant Pathol. 49:288-294. [ Links ]
Gaona, G. G.; Ruiz, C. E. y Peña, M. R. 2000. Los pulgones (Homóptera: Aphididae) y sus enemigos naturales en la naranja, Citrus sinensis (L.), en la zona centro de Tamaulipas. Acta Zoológica Mexicana. 81:1-12. [ Links ]
Garnsey, S. M.; Gumpf, D. J.; Roistacher, C. N.; Civerolo, E. L.; Lee, R. F.; Yokomi, R. K. and Bar-Joseph, M. 1987. Toward a standardized evaluation of the biological properties of Citrus tristeza virus. Phytophylactica. 19(2):151-157. [ Links ]
Gottwald, T. R.; Garnsey, S. M. and Borbón, J. 1998. Increase and patterns of spread of Citrus tristeza virus infection in Costa Rica, and the Dominican Republic in the presence of the brown citrus aphid, Toxoptera citricida. Phytopathology. 88:621-636. [ Links ]
Gottwald, T. R.; Richie, S. M. and Campbell, C. L. 1992. LCOR2- Spatial correlation analysis software for the personal computer. Plant Dis. 76:213-215. [ Links ]
Greig, S. P. 1952. The use of random and contiguous quadrats in the study of the structures of plant communities. Ann. Bot. 16:293-316. [ Links ]
Herrera, I. L. 2004. Caracterización biológica y molecular de aislados del virus tristeza de los cítricos (CTV) en México. Tesis de Doctorado. CINVESTAV-Irapuato. 185 p. [ Links ]
Jesus, J. W. C. e Bassanezi, R. B. 2004. Análise da dinâmica e estrutura de focos da Morte Súbita dos Citros. Fitopatologia Brasileira, Brasília. 29(4):399-405. [ Links ]
Kong, P.; Rubio, L.; Polek, M. and Falk, B. W. 2000. Population structure and genetic diversity within California Citrus tristeza virus (CTV) isolates. Virus Genes. 21:139-145. [ Links ]
Lloyd, M. 1967. Mean crowding. J. Anim. Ecol. 36:1-30. [ Links ]
Loeza, K. E.; Palacios, T. E. C.; Ochoa, M. D. L.; Mora, A. G.; Gutierrez, E. M. A.; Febres, V. J.; Moore, G. A. and Alvarez, R. R. 2005. Molecular characterization of Citrus tristeza virus isolates from Veracruz and Tamaulipas Status, Mexico. In: Hilf, M. E.; Duran, A. N. and Rocha, P. M. (eds). Proceedings of the 15th Conference of the International Organization of Citrus Virologists. California, USA. 407-411p. [ Links ]
Mendoza, A.; Salazar, C.; Alvarado, O.; Cruz, M. A. y Barrera, H. 2003. Diferenciación molecular de razas severas y débiles de aislamientos del virus de la tristeza de los cítricos en México. Rev. Fitotec. Mex. 26(4):223-230. [ Links ]
Michaud, J. P. and Alvarez, R. R. 2000. First collection of brown citrus aphid, Toxoptera citricida (Homoptera: Aphididae) in Quintana Roo, México. Florida Entomologist. 83:357-358. [ Links ]
Morisita, M. 1959. Measuring the dispersion of individual and analysis of distributional patterns. Mem. Fac Sci. Kyushu Uni. Ser. E. (Biol.). 2:215-235. [ Links ]
Moya, A.; Elena, S. F.; Bracho, A.; Miralles, R. and Barrio, E. 1999. The evolution of RNA viruses: a population genetics view. PNAS. 97(13):6967-6963. [ Links ]
Nolasco, G.; Fonseca, F. and Silva, G. 2007. Occurrence of genetic bottlenecks during Citrus tristeza virus acquisition by Toxoptera citricida under filed conditions. Archives of virology DOI 10:1007/s00705-007-1089-8. [ Links ]
Peakall, R. and Smouse, P. E. 2006. GenAlEx 6: genetic analysis in Excel. Population genetic software for teaching and research. Mol. Ecol. Notes. 6:288. [ Links ]
Powell, A. G. 1991. Virus spread and vector dynamics in genetically diverse plant populations. Ecology. 72(1):232-241. [ Links ]
Powell, C. A. and Lin, Y. 2005. Separation of Citrus tristeza virus isolates in mixed infections through transfer by single brown citrus aphids. Hortscience. 40:694-696. [ Links ]
Rivas, V. P.; Loeza, K. E.; Mora, A. G.; Febres, V.; Ochoa, M. D.; Gutiérrez, E. M. A.; Cintra de Jesus, J. W.; Correia, M. C. y Arno, W. N. 2008. Estructura poblacional de aislamientos del Citrus tristeza virus y su asociación con la muerte súbita de los cítricos en Brasil. Agrociencia. 42:85-93. [ Links ]
Rubio, L.; Ayllón, M. A.; Kong, P.; Fernández, A.; Polek, M. L.; Guerri, J.; Moreno, P. and Falk, B. W. 2001. Genetic variation of Citrus tristeza virus isolates from California and Spain: evidence for mixed infections and recombination. J. Virol. 75:8054-8062. [ Links ]
Ruiz, G. N. 2008. Detección, dispersión y muestreo en la erradicación del Citrus tristeza virus en plantaciones comerciales de cítricos. Tesis de doctorado. Colegio de Postgraduados. Texcoco, México. 105 p. [ Links ]
Ruiz, G. N.; Mora, A. G.; Rivas, V. P.; Góngora, C. C.; Loeza, K. E.; Ochoa, M. D.; Ramírez, V. G.; Gutiérrez, E. A. y Álvarez, R. R. 2009. Sensibilidad de inmunoimpresión-ELISA y DAS-ELISA en el diagnostico del virus tristeza de cítricos en Tamaulipas, México. Revista Chapingo. Serie Horticultura. 15(1):41-47. [ Links ]
Sambade, A.; Ambrós, S.; López, C.; Ruíz-Ruíz, S.; Hermoso de Mendoza, A.; Flores, R.; Guerri, J. and Moreno, P. 2007. Preferential accumulation of severe variants of Citrus tristeza virus in plants co-inoculated with mild and severe variants. Arch. Virol. DOI 10.1007/s00705-006-0932-7. [ Links ]
Servicio Nacional de Sanidad Inocuidad y Calidad Agroalimentaria (SENASICA). 2010. URL: http://mail2.senasica.gob.mx/default.asp?id=1010. [ Links ]
Sentandreu, V.; Castro, J. A; Ayllón, M. Z.; Rubio, L.; Guerri, J.; González, C. G. and Moya, A. 2006. Evolutionary analysis of genetic variation observed in Citrus tristeza virus alter host passage. Arch. Virol. 151:875-894. [ Links ]
Silva, V. S.; Peña del Río, M. A.; Peña, M. R.; Villegas, J. N.; Byerly, M. K. y Rocha, P. M. 2001. Distribución del virus de la tristeza en tres plantaciones comerciales de cítricos del estado de Nuevo León, México. Agrociencia. 35:441-450. [ Links ]
Weng, Z.; Barthelson, R.; Gowda, S.; Hilf, M. E.; Dawson, W. O. and Xiong, Z. 2007. Persistent infection and promiscuous recombination of multiple genotypes of RNA virus within a single host generate extensive diversity. PLOS ONE 2(9): 917.doi:10.1371/journals.pone.0000917. [ Links ]
Yokomi, R. A.; Lastra, R.; Stoetzel, M. B.; Damsteet, V. D.; Lee, R. F.; Garnsey, S. M.; Gottwald, T. R.; Rocha-Peña, M. A. and Niblett, C. L. 1994. Establishment of brown citrus aphid (Homoptera: Aphididae) in Central America and the Caribbean Basin and transmission of Citrus tristeza virus. J. Econ. Entomol. 87:1078-1085. [ Links ]














