Introducción
El chile (Capsicum spp.) es una hortaliza perteneciente a la familia de las solanáceas, originaria de América y cultivado en todo el mundo, con innumerables usos como producto fresco, seco y procesado (Dubey et al., 2019). Sin embargo, la incidencia de plagas, así como eventos climáticos extremos son los causantes de considerables pérdidas en el rendimiento de ciertas variedades de chile (Joukhadar y Walker, 2019). En los últimos 20 años, el crecimiento en producción fue hasta de un 35%, siendo México el segundo mayor productor con 3.5 millones de toneladas (FAOSTAT, 2017), a pesar de considerables pérdidas en el rendimiento a causa del estrés biótico y abiótico (Lesk et al., 2016). Para erradicar estas problemáticas, se están buscando diferentes enfoques, destacando los sistemas de producción basados en el uso de microorganismos benéficos, usados en países como Turquía, que son un modelo de transición hacia prácticas agrícolas sustentables en un futuro, con la ventaja de disminuir el uso de plaguicidas (Dogan et al., 2016).
Los hongos entomopatógenos son ampliamente usados en el control biológico de insectos plaga y fitopatógenos del suelo (Jaber y Ownley, 2018). Pero además de su uso en el biocontrol, muchos hongos entomopatógenos actúan como endófitos, colonizando tejidos de la planta sin causar un daño aparente, promoviendo el crecimiento vegetal, mejorando la productividad y la vitalidad de la planta (Geisen et al., 2017; Hiruma et al., 2016; Hyde y Soytong, 2008; Raya-Díaz et al., 2017). Este aumento en el crecimiento se explica por las relaciones simbióticas entre los hongos endófitos y sus hospederos, que desencadenan modificaciones en procesos fisiológicos como la eficiencia en la fotosíntesis, el intercambio de gases, así como una mejor distribución de la energía (Rozpądek et al., 2015). En referencia al cultivo de papa, la aplicación de hongos endófitos entomopatógenos (HEE) en el tubérculo-semilla aumentó la fotosíntesis y el contenido de nutrientes en suelos sin adición de fertilizantes (Krell et al., 2018). La inoculación artificial de HEE en etapas tempranas del cultivo supera muchas limitantes comparado con la aplicación convencional de hongos entomopatógenos, pero algunos autores sugieren hacer aplicaciones repetidas del mismo HEE y así mejorar la colonización endófita (Jaber y Ownley, 2018). Existe evidencia que sugiere que la mejor forma de inocular los HEE es desde la semilla, lo que aduce a la importancia del método de inoculación. El tipo de método por el cual se inoculan los HEE es determinante en el nivel de promoción de crecimiento vegetal y en otras propiedades que confieren en plantas, como la protección contra insectos y patógenos de plantas, aunque hasta la fecha no existe un consenso al respecto (Jaber y Enkerli, 2016; Mckinnon et al., 2016; Vidal y Jaber, 2015).
Investigaciones recientes donde se probaron cuatro aislados de HEE (BB42, BB09, MA28 y MA25) han demostrado su capacidad de reducir la población de Bactericera cockerelli (Sulc) (Hemiptera: Triozidae) en invernadero, un insecto plaga y un importante vector de enfermedades en el estado de San Luis Potosí, México (Villegas-Rodríguez et al., 2017). Estos cuatro aislados tienen además la capacidad de promover el crecimiento vegetal en etapas tempranas, aunque en los ensayos in vitro no se encontraron diferencias significativas, los ensayos en maceta sugieren que el aislado MA28 tuvo mayor efecto en el crecimiento de chile poblano (Ortiz-Espinoza et al., 2019). Lo señalado anteriormente, hizo formular el objetivo de esta investigación, que fue evaluar el efecto de las cuatro cepas de HEE mencionadas sobre plantas de chile poblano a nivel fotosintético y de crecimiento, durante las primeras etapas de desarrollo en laboratorio y en invernadero, comparando su efecto con tres nuevas cepas aisladas de suelos agrícolas del estado de San Luis Potosí y con un testigo, y comparando por igual el efecto cuando el HEE es inoculado en semilla o por aspersión. Lo anterior considerando como hipótesis que todas las cepas son promotoras activas del mejoramiento de procesos fisiológicos en las etapas más avanzadas del cultivo.
Materiales y Métodos
Aislados de hongos entomopatógenos y endófitos
En este ensayo se evaluaron 7 cepas de HEE: tres aislados nativos de San Luís Potosí (RV01, RV05, SL14) donados por el laboratorio de fitopatología de la Facultad de Agronomía y Veterinaria de la Universidad Autónoma de San Luis Potosí; dos cepas que fueron aisladas de insectos, una corresponde a Beauveria bassiana (BB42) [(Bals. -Criv.) Vuill. 1912] y otra a Metarhizium anisopliae (MA25) [(Metschn.) Shotokan 1883]; finalmente, se probaron dos ingredientes activos de productos comerciales, la cepa de B. bassiana (BB09) del producto Bassianil MR BioTropic y otra cepa de M. anisopliae (MA28) del producto Meta - Bichs®, Bio- Bichs®. Los últimos cuatro aislados fueron donados por el Laboratorio de Reproducción de Organismos Benéficos del Comité Estatal de Sanidad Vegetal del Estado de Guanajuato, México (CESAVEG) (Villegas-Rodríguez et al., 2014).
Las tres cepas nativas de San Luis Potosí fueron aisladas de suelos agrícolas, utilizando al insecto trampa Tenebrio molitor (gusano de la harina) (Ríos-Velasco et al., 2014). De acuerdo con sus características morfológicas y macroscópicas, se propone que el aislado RV01, pertenece al género Metarhizium, el cual presentó conidios cilíndricos hialinos, con bordes redondeados y característica de coloración verde oliva al observarse en el microscopio óptico (40X) (Sepúlveda et al., 2016); el aislado RV05, por su parte, presentó similitud con el género Paecilomyces, en el cual se observaron conidióforos cortos, paredes lisas, hialino, no ramificado, y se observaron fiálides producidos en ramas cortas en hifas, consistentes en fiálides individuales que nacen irregularmente en hifas aéreas (Paul et al., 2013). Por último, el aislado SL14 presentó características morfológicas asociadas al género Penicillium, como lo son conidios globosos y conidióforos densamente peniciliados, conidióforos hialinos, ramificados peniciliadamente en los ápices con métula primaria y secundaria, formando cabezas conidiales de color verde amarillento bastantes separadas (Rothen et al., 2017). Cada uno de los cultivos monospóricos se sembró en Agar Dextrosa Sabouraud (BD Bioxon®) suplementado con 5% de extracto de levadura, y se incubaron a 25 ± 1ºC, de una a dos semanas, hasta que se presentó esporulación (Villegas-Rodríguez et al., 2017).
Cultivo de chile poblano en laboratorio y en invernadero
El experimento se realizó en los meses de agosto a diciembre de 2018 utilizando como modelo el cultivo de chile poblano (Capsicum annuum L.). Las semillas fueron donadas por productores de chile poblano del municipio de Mexquitic de Carmona, San Luis Potosí. Se evaluaron dos métodos de inoculación de HEE: el primer método consistió en desinfectar superficialmente las semillas de chile poblano con una solución de hipoclorito de sodio al 10% (NaOCl) durante 10 minutos, después se realizó un lavado con etanol al 70% por un minuto, y finalmente se realizaron cinco lavados con agua destilada estéril (Behie et al., 2017). Se utilizó un testigo, el cual consistió en sumergir las semillas en una solución al 0.2% de INEX-A® (COSMOCEL®), y para el resto de los tratamientos se prepararon 10 ml de una solución de conidios e INEX-A® (COSMOCEL®) al 0.2%, con una concentración final de 1 x 108 esporas ml-1, y una viabilidad de más del 90%. Se sembraron 50 semillas por cada tratamiento en semilleros de poliestireno expandido de 200 cavidades rellenas del sustrato comercial Peat moss (Premier Horticulture, Quakertown, PA) (Akello y Sikora, 2012). En el segundo método de inoculación, después de sembrar 400 semillas (50 por cada tratamiento y el testigo), se realizó la aspersión del sustrato con la solución de conidios y se repitió la inoculación por aspersión en toda la planta después del surgimiento de la primera hoja verdadera (Tall y Meyling, 2018).
Las plantas se mantuvieron en condiciones de laboratorio en semilleros de poliestireno expandido después de su germinación a una temperatura de 25 a 28 °C, con una humedad relativa del 60 al 80% y un fotoperiodo de 16:8 horas (Luz: Oscuridad) proporcionado con lámparas de 32 Watts (Phillips ®). A los 51 días después de la inoculación (ddi) se trasplantaron 5 plantas por tratamiento en bolsas de polietileno de 5 litros de capacidad usando la mezcla de sustrato BM2, Berger®. El experimento se ejecutó en un invernadero de baja tecnología, tipo túnel ubicado en el campo agrícola experimental de la Facultad de Agronomía y Veterinaria de la Universidad Autónoma de San Luis Potosí. Desde el trasplante hasta la finalización del cultivo se aplicó fertilización de manera semanal, ajustándose a las necesidades del cultivo (Orellana y León, 2011).
Evaluación del efecto de inoculación con HEE en el intercambio de gases
Los parámetros de intercambio de gases y de fluorescencia de la clorofila se registraron con un sistema portátil para la medición de fotosíntesis LI-6400XT (Licor, Inc.; NE, EE. UU), analizando cinco plantas por tratamiento, seleccionando una hoja con un desarrollo pleno al momento de la medición, la cual fue la misma en los 3 análisis realizados. Las variables de intercambio de gases fueron: tasa de asimilación neta (μmol CO2 m-2 s-1), transpiración (mmol H2O m-2 s-1) y conductancia estomática (mol H2O m-2 s-1). La primera medición se realizó en condiciones de laboratorio a los 33 ddi, con una temperatura promedio de 31°C y un nivel de radiación fotosintéticamente activa (RFA) de 100 µmol m-2s-1 proporcionado por el equipo de medición (Mantzoukas et al., 2015). En la etapa de invernadero se realizaron otras dos mediciones, una a los 86 ddi y la otra a los 116 ddi con un nivel de RFA de 800 µmol m-2s-1 y 900 µmol m-2s-1. Los valores de RFA referidos se decidieron con base en el registro de RFA sobre las plantas al momento de cada medición y para que la radiación fuera constante para todas las plantas durante la misma.
Evaluación del efecto de inoculación con HEE parámetros relacionados con la fluorescencia de la clorofila
Los parámetros de fluorescencia de la clorofila registrados fueron: fluorescencia mínima (Fo) en oscuridad de una hoja, que posteriormente se sometió por pocos segundos a una luz roja lejana para forzar la migración de electrones entre el fotosistema I (PSI) y el fotosistema II (PSII) (Buchanan, et al., 2015). De esta manera se estimó la eficiencia efectiva del PSII (ϕPSII) y la eficiencia máxima de PSII (Fv/Fm) [la fluorescencia variable (Fv) es la diferencia de la fluorescencia máxima (Fm) respecto de la fluorescencia mínima (Fo), dividido entre el valor de la fluorescencia máxima (Fm) (García-Cristóbal et al., 2015)]. Además, con pulsos de luz saturada cada 20 s se calculó la disipación fotoquímica (qP), y la disipación no fotoquímica (NPQ y qN) y la tasa transporte de electrones (ETR) después de la aplicación de una serie de pulsos de saturación bajo irradiación actínica creciente (Li et al., 2007; Kalaji et al., 2014). Las mediciones se realizaron a los 44, 87 y 117 ddi, analizando cinco plantas por tratamiento.
Evaluación de la promoción del crecimiento vegetal
Al finalizar el experimento (121 ddi), se midió la longitud de la raíz y se registró además el peso seco de la parte aérea y de la raíz por separado, sumándose para obtener el valor de la producción de biomasa total (Khan et al., 2015).
Porcentaje de colonización
Se evaluó el porcentaje de colonización en hoja, tallo y raíz de plantas inoculadas con hongos endófitos por tratamiento a los 28, 45 y 120 ddi. Se evaluaron dos plantas por tratamiento a los 28 y 45 ddi, y tres plantas por tratamiento a los 120 ddi. Para cada análisis se extrajeron las plantas, se lavaron adecuadamente, se separaron en tallo, hojas y raíces y con un bisturí se obtuvieron 5 secciones para los análisis realizados a los 28 ddi y 45 ddi (con dos plantas por tratamiento), 10 secciones para los análisis realizados a los 121 ddi (con tres plantas por tratamiento). Las secciones de tejido de cada tratamiento se colocaron en cajas Petri, y se desinfectaron superficialmente con solución de hipoclorito de sodio al 5% (NaClO) durante 20 minutos. Después se realizó un lavado con etanol al 70% durante un minuto y finalmente se realizaron cinco lavados con agua destilada estéril. Posteriormente se secaron en una campana de flujo laminar (excluyendo la epidermis) y se colocaron las diferentes secciones en cajas Petri con Agar Dextrosa Sabouraud (BD Bioxon®), suplementado con 5% de extracto de levadura, se incubaron durante siete a diez días a 25 ± 1ºC, monitoreando diariamente el crecimiento micelar y observando en el microscopio, comprobando que corresponda a la morfología del HEE inoculado y confirmando que son endófitos (Parsa et al., 2013). Como un control de desinfección, se inocularon 10 µl del líquido remanente del proceso de desinfección. Los datos se expresaron como porcentaje de colonización, donde el porcentaje de colonización = 100 x (número de piezas de plantas colonizadas/número total de piezas de plantas analizadas) (Gurulingappa et al., 2010).
Análisis Estadístico
Los experimentos se llevaron a cabo según un diseño completamente al azar. Los datos se analizaron de acuerdo con un arreglo factorial de tratamientos en donde se consideraron los efectos simples y combinados de los aislados de HEE (BB09, BB42, MA25, MA28, RV01, RV05, SL14 y un testigo inoculado solamente con INEX-A) y los métodos de inoculación [Inoculación en Semilla (IS) e inoculación por aspersión en el sustrato y en la primera hoja verdadera (IA)]. Las variables de fluorescencia de la clorofila, intercambio de gases, producción de biomasa y longitud de la raíz analizaron mediante análisis de varianza (ANAVA) con arreglo factorial y el porcentaje de colonización con ANAVA de medidas repetidas. Cuando se encontraron efectos estadísticamente significativos se realizó la comparación de medias con la prueba de Dunnett con un α = 0.05 en función de que las comparaciones de medias se propusieron con respecto a un testigo y a que se ha señalado que es eficiente en reducir el error, en comparación con las pruebas de Tukey y Duncan (Sauder y DeMars, 2019). En todos los análisis se utilizó el software SAS versión 9 (SAS Institute Inc., 2002). Los datos de Fv/Fm, qP y qN a los 87 ddi se transformaron con la función de coseno para normalizar los datos.
Resultados
Evaluación del intercambio de gases
A los 33 ddi, cuando las plantas se mantuvieron en condiciones de laboratorio, se encontró un efecto significativo de la cepa (HEE, p= 0.002) sobre la tasa de asimilación neta, la conductancia estomática y la transpiración (Tabla 1). A los 86 y 116 ddi no se encontraron diferencias significativas entre las variables evaluadas (Tabla 1). Además, existió una interacción significativa entre los factores HEE y método de inoculación sobre la tasa de asimilación neta y la transpiración (p < 0.005 HEE*MI, Tabla 1), observando que algunas cepas aumentan estas variables, y que este efecto es dependiente del método de inoculación empleado (Figs. 1A y 1C).
Tabla 1 Resultados de los análisis de varianza de las variables de intercambio de gases en condiciones controladas, a los 33 días después de la inoculación y en condiciones de invernadero (86 y 116 días después de la inoculación) de plantas de chile poblano inoculadas comparando dos métodos de inoculación (MI) y diferentes aislados de hongos entomopatógenos y endófitos (HEE).
| Tiempo | Fuente de variación | Tasa de asimilación neta (μmol CO2 m-2 s-1) | Conductancia estomática (mol H2O m-2 s-1) | Transpiración (mmol H2O m-2 s-1) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| GL | F | p | GL | F | p | GL | F | p | ||
| 33 ddi | MI | 1 | 2.42 | 0.128 | 1 | 0.03 | 0.871 | 1 | 0.22 | 0.040 |
| HEE | 7 | 4.00 | 0.002 | 7 | 3.13 | 0.011 | 7 | 3.37 | 0.007 | |
| HEE*MI | 7 | 3.51 | 0.005 | 7 | 1.71 | 0.136 | 7 | 2.39 | 0.040 | |
| 86 ddi | MI | 1 | 2.95 | 0.074 | 1 | 0.88 | 0.353 | 1 | 0.02 | 0.897 |
| HEE | 7 | 1.9 | 0.091 | 7 | 1.87 | 0.089 | 7 | 1.09 | 0.381 | |
| HEE*MI | 7 | 2.60 | 0.020 | 7 | 1.01 | 0.432 | 7 | 0.76 | 0.622 | |
| 116 ddi | MI | 1 | 0.33 | 0.565 | 1 | 0.88 | 0.35 | 1 | 0.15 | 0.704 |
| HEE | 7 | 0.71 | 0.665 | 7 | 1.87 | 0.08 | 7 | 1.38 | 0.288 | |
| HEE*MI | 7 | 0.91 | 0.505 | 7 | 1.01 | 0.43 | 7 | 1.01 | 0.432 | |
HEE: Hongo endófito entomopatógeno; MI: Método de inoculación; ddi: días después de la inoculación; GL: Grados de libertad. Los valores F y p se obtuvieron en el análisis de varianza.
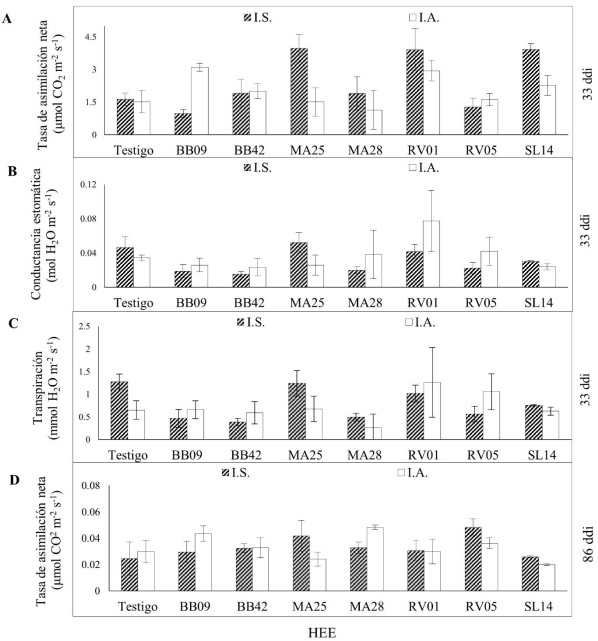
Testigo: inoculación con una solución de INEX-A ® al 0.02%; ddi: días después de la inoculación; las barras de error representan el error estándar
Fig. 1 Tasa de asimilación neta, conductancia estomática y transpiración en plantas de chile poblano inoculadas con hongos endófitos entomopatógenos (HEE) desde semilla (I.S.) y por aspersión en sustrato y en la primera hoja verdadera (I.A.)
La inoculación promovió el aumento de la tasa de asimilación neta, aunque sólo para algunos aislados y con dependencia del método de inoculación. A los 33 ddi, la inoculación por semilla con los aislados MA25, RV01 y SL14 promediaron 3.9 μmol CO2 m-2 s-1, valor mayor al de las plantas testigo. Mientras que, en plantas inoculadas por aspersión, el aislado BB09 y el RV01 fueron los inóculos que aumentaron la tasa de asimilación neta con respecto al testigo (p = 0.002 HEE*MI; Fig. 1A). A pesar de que a los 86 ddi no se encontraron efectos estadísticamente significativos en la tasa de asimilación neta entre las cepas de HEE y los MI evaluados, la interacción entre ambos factores sí resultó significativa (p= 0.020). A los 86 ddi se observó un aumentó en la tasa de asimilación neta en comparación con el testigo en las plantas inoculadas desde semilla con el aislado RV05 y en las inoculadas por aspersión con MA28 (Fig. 1D).
La conductancia estomática varió significativamente por efecto de la inoculación solamente con una de las 7 cepas evaluadas, RV01. A los 33 ddi, la inoculación por aspersión con el aislado RV01 aumentó significativamente (p =0.011 HEE; Fig. 1B) la conductancia estomática (0.077 mol H2O m-2 s-1) en comparación con el testigo (0.034 mol H2O m-2 s-1). La inoculación con las cepas distintas de RV01 por cualquiera de los métodos evaluados fue poco relevante sobre la conductancia estomática.
La inoculación causó disminución de la transpiración cuando se realizó en la semilla con 5 de las 7 cepas evaluadas, pero no cuando se realizó por aspersión. Este efecto solo se observó a los 33 ddi (HEE*MI p=0.020). A los 86 y 166 ddi no se registró efecto significativo de la inoculación sobre la transpiración. A los 33 ddi la inoculación por semilla con los aislados BB09, BB42, MA28, RV05 y SL14 redujo hasta la mitad la transpiración en comparación con el testigo. (p= 0.040 HEE*MI, Fig. 1C). La inoculación por aspersión no generó cambios significativos en la transpiración (Fig. 1C).
Evaluación de la fluorescencia de la clorofila
Considerando el umbral de significación estadística de 0.05, a los 44 y 87 ddi, tres de los seis parámetros de fluorescencia de la clorofila resultaron afectados por el método de inoculación y/o por el aislado de HEE (Fv/Fm, ϕPSII y qP), aunque se encontró una interacción significativa sólo sobre ϕPSII a los 44 ddi (Tabla 2). La cepa RV01 provocó una disminución de un 11% de la Fv/Fm en relación con el valor registrado por el testigo, a los 87 ddi (HEE, p=0.0099, Tabla 2). La inoculación por semilla provocó aumentos significativos con respecto a la inoculación por aspersión, en la ϕPSII, un 8% a los 44 ddi y un 23% a los 87 ddi, y la qP, un 14% a los 87 ddi (Tabla 3). A los 117 ddi, ninguna variable de fluorescencia de la clorofila resultó afectada significativamente (Tabla 2).
Tabla 2 Análisis de varianza para evaluar el efecto de dos métodos de inoculación (MI) y de diferentes aislados de hongos endófitos entomopatógenos (HEE) en parámetros de fluorescencia de la clorofila medidos en plantas de chile poblano a los 44, 87 y 117 días después de la inoculación.
| Tiempo | Factor de variación | Fv/Fm | ϕPSII | qP | qN | NPQ | ETR (μmolm−2 s−1) | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| GL | F | p | F | p | F | p | F | p | F | p | F | p | ||
| 44 ddi | MI | 1 | 0.00 | 0.9542 | 4.56 | 0.040 | 0.08 | 0.7852 | 2.22 | 0.1455 | 0.97 | 0.3318 | 0.65 | 0.4266 |
| HEE | 7 | 1.27 | 0.2963 | 1.09 | 0.3938 | 3.31 | 0.0088 | 1.67 | 0.1520 | 1.33 | 0.2674 | 1.50 | 0.2027 | |
| HEE*MI | 7 | 1.61 | 0.1674 | 2.95 | 0.0164 | 1.08 | 0.3959 | 2.24 | 0.0557 | 1.57 | 0.1784 | 1.70 | 0.1433 | |
| 87 ddi | MI | 1 | 2.66 | 0.1122 | 10.66 | 0.0026 | 7.29 | 0.0134 | 0.35 | 0.5554 | 0.11 | 0.7372 | 3.45 | 0.0723 |
| HEE | 7 | 3.24 | 0.0099 | 1.59 | 0.1719 | 1.22 | 0.3177 | 0.95 | 0.4832 | 1.12 | 0.3749 | 1.43 | 0.2270 | |
| HEE*MI | 7 | 1.92 | 0.0975 | 0.70 | 0.6744 | 0.70 | 0.6688 | 0.47 | 0.8505 | 0.21 | 0.9814 | 1.85 | 0.1111 | |
| 117 ddi | HEE | 1 | 0.20 | 0.658 | 0.22 | 0.6402 | 0.49 | 0.4880 | 0.46 | 0.5009 | 0.57 | 0.4560 | 0.44 | 0.5097 |
| MI | 7 | 1.70 | 0.1542 | 1.51 | 0.1985 | 0.97 | 0.4668 | 1.39 | 0.2419 | 1.17 | 0.3478 | 1.37 | 0.2508 | |
| HEE*MI | 7 | 0.88 | 0.1435 | 1.10 | 0.3838 | 0.79 | 0.602 | 0.45 | 0.8589 | 1.01 | 0.4408 | 0.79 | 0.6009 | |
Fv/Fm: Eficiencia máxima del PSII; ϕPSII: Eficiencia efectiva de PSII; qP: Disipación fotoquímica; qN y NPQ: Disipación no fotoquímica; ETR: Tasa de transporte de electrones; GL: Grados de libertad. Los valores de F y p se obtuvieron del análisis de varianza; ddi: Días después de la inoculación.
Tabla 3 Parámetros de fluorescencia de la clorofila medidos en plantas de chile poblano inoculadas con dos métodos distintos y con diferentes aislados de hongos entomopatógenos a los 44 y 87 días después de inoculación.
| Tratamiento | Fv/Fm | ϕPSII | qP | qN | NPQ | ETR (μmol m−2 s−1) | |
| 44 ddi | Testigo | 0.7716 | 0.2553 | 0.5311 | 0.7575 | 1.5197 | 11.1954 |
| BB09 | 0.7787 | 0.2512 | 0.5226 | 0.7601 | 1.5249 | 10.9826 | |
| BB42 | 0.7884 | 0.2450 | 0.5058 | 0.7692 | 1.6248 | 10.7355 | |
| MA25 | 0.7848 | 0.2321 | 0.4488 | 0.7361 | 1.4056 | 9.7974 | |
| MA28 | 0.7841 | 0.2437 | 0.4906 | 0.7443 | 1.4770 | 10.8354 | |
| RV01 | 0.7938 | 0.2211 | 0.4420 | 0.7363 | 1.4221 | 9.7820 | |
| RV05 | 0.7873 | 0.2340 | 0.4152 | 0.7321 | 1.3839 | 9.3011 | |
| SL14 | 0.7745 | 0.2500 | 0.5114 | 0.7363 | 1.3999 | 10.9368 | |
| I.S. | 0.7824 | 0.2513 * | 0.4839 | 0.7398 | 1.4364 | 10.5941 | |
| I.A. | 0.7834 | 0.2318 | 0.4829 | 0.7535 | 1.5031 | 10.2974 | |
| 87 ddi | Testigo | 0.6671 | 0.1892 | 0.5911 | 0.8797 | 2.0476 | 72.5128 |
| BB09 | 0.65338 | 0.1864 | 0.5897 | 0.8545 | 1.8532 | 73.1762 | |
| BB42 | 0.6990 | 0.1846 | 0.5903 | 0.8700 | 2.0087 | 73.2403 | |
| MA25 | 0.6935 | 0.2018 | 0.6366 | 0.8482 | 1.7927 | 83.1870 | |
| MA28 | 0.6946 | 0.1648 | 0.5174 | 0.8610 | 1.9889 | 71.1979 | |
| RV01 | 0.5913 | 0.1317 | 0.4736 | 0.8549 | 1.7597 | 53.5992 | |
| RV05 | 0.6943 | 0.1620 | 0.5481 | 0.8728 | 2.0281 | 77.7084 | |
| SL14 | 0.6562 | 0.1625 | 0.5487 | 0.8683 | 1.9571 | 71.0264 | |
| I.S. | 0.6808 | 0.1909 * | 0.5984 * | 0.8612 | 1.9209 | 75.5306 | |
| I.A. | 06565 | 0.1548 | 0.5255 | 0.8661 | 1.9381 | 68.3815 |
Fv/Fm: Eficiencia máxima del fotosistema II (PSII); ϕPSII: Eficiencia efectiva de PSII; qP: Disipación fotoquímica; qN y NPQ: Disipación no fotoquímica; ETR: Tasa de transporte de electrones; ddi: Días después de la inoculación. El símbolo (*) indica diferencia estadística significativa de acuerdo con la prueba de Dunnett (p ≤ 0.05) al comparar de manera independiente del efecto de los HEE es con respecto al testigo y el efecto del método de inoculación; en este último caso el * se colocó en el valor mayor cuando la prueba de comparación de medias resultó significativa.
La inoculación promovió el incremento significativo de la ϕPSII cuando se realizó por semilla, pero promovió un decremento en esa variable cuando se hizo por aspersión. El incremento se registró con los aislados BB09, BB42, MA25, MA28 y RV05, con valores hasta 30% mayores que el testigo en las plantas inoculadas por semilla a los 44 ddi. En contraste, la inoculación por aspersión con las cepas BB42, MA25, MA28, RV01 y RV05 promovió la reducción de la ϕPSII (Tabla 2; Fig. 2).
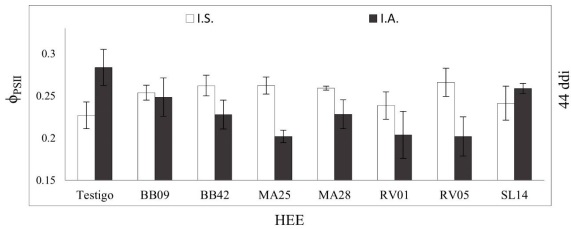
I.S.: Inoculación en semilla; I.A.: Inoculación por aspersión; ddi: Días después de la inoculación. Las barras de error representan el error estándar.
Fig. 2 Efecto del método de inoculación y de diferentes aislados de hongos endófitos entomopatógenos en la eficiencia máxima del PSII (ϕPSII) a los 44 ddi
Evaluación del crecimiento de plantas
Las variables de crecimiento fueron afectadas tanto por el método de inoculación como por la cepa de HEE. Las plantas que fueron inoculadas por semilla aumentaron el peso seco de la parte aérea de la planta, un 20% con respecto a las plantas inoculadas por aspersión (p<0.05), mientras que en la producción de biomasa total el aumento fue de un 18% (p<0.05). La inoculación con el aislado RV05 superó en más de un tercio el peso seco de la parte aérea (p<0.05) y casi duplicó la biomasa total con respecto al testigo (p<0.05). La inoculación con el aislado RV01 casi duplicó el peso seco de la raíz en comparación con el testigo. La inoculación por aspersión favoreció el incremento de la longitud de la raíz (Tabla 4).
Tabla 4 Atributos de crecimiento de plantas de chile poblano inoculadas con hongos entomopatógenos con dos métodos luego de 121 días de experimentación.
| FV | Peso seco parte aérea (mg. planta-1) |
Peso seco raíz (mg. planta-1) HEE |
Biomasa total (mg. planta-1) |
Longitud de la raíz (cm) |
|---|---|---|---|---|
| Testigo | 2.14 ± 0.21 | 0.5974 ± 0.05 | 2.74 ± 0.03 | 13.05 ± 1.09 |
| BB09 | 2.46 ± 0.18 | 0.8096 ± 0.07 | 3.27 ± 0.04 | 17.43 ± 1.04 |
| BB42 | 2.31 ± 0.22 | 0.7894 ± 0.08 | 3.10 ± 0.05 | 17.07 ± 1.09 |
| MA25 | 2.58 ± 0.15 | 0.6447 ± 0.02 | 3.23 ± 0.01 | 14.32 ± 1.07 |
| MA28 | 2.64 ± 0.29 | 0.7545 ± 0.10 | 3.39 ± 0.05 | 17. 10 ± 0.91 |
| RV01 | 2.79 ± 0.37 | 0.95 ± 0.13 | 3.75 ± 0.07 | 16.36 ± 1.10 |
| RV05 | 3.30 ± 0.33 * | 0.74 ± 0.05 | 4.04 ± 0.03* | 13.59 ± 0.92 |
| SL14 | 2.01 ± 0.29 | 0.57 ± 0.07 | 2.58 ± 0.04 | 15.65 ± 1.19 |
| MI | ||||
| I.S. | 2.81 ± 0.13 * | 0.78 ± 0.04* | 3.60 ± 0.16 * | 15.22 ± 0.54 |
| I.A. | 2.24 ± 0.13 | 0.68 ± 0.04 | 2.93 ± 0.15 | 15.91 ± 0.57* |
| Resultados del ANAVA (valores de p) | ||||
| HEE | 0.0159 | 0.0799 | 0.018 | 0.3303 |
| MI | 0.0016 | 0.0335 | 0.0171 | 0.0090 |
| HEE*MI | 0.1195 | 0.4604 | 0.1390 | 0.0271 |
| EE | 0.1004 | 0.0310 | 0.1196 | 0.4001 |
El símbolo * indica diferencias estadísticamente significativas en la comparación de medias con la prueba de Dunnett (p ≤ 0.05). EE: Error estándar.
El MI interactuó de manera significativa con la cepa de HEE sobre la longitud de raíz (p = 0.0271) (Fig. 3). Las plantas inoculadas por aspersión con las cepas BB09, BB42 y MA28 desarrollaron raíces un 21%, 17% y 16% mayores que el testigo, similares a la longitud registrada en raíces de aquellas que fueron inoculadas en semilla con la cepa RV01 (Fig. 3).
Porcentaje de colonización
Independientemente de la cepa de HEE, la inoculación por semilla en promedio duplicó la colonización de hoja, tallo y raíz en comparación con la inoculación por aspersión. No obstante, se registraron variaciones que dependieron de la cepa de HEE inoculada. Los aislados RV05, RV01 y BB42 generaron mayores porcentajes de colonización, que fueron hasta cinco o diez veces más que los alcanzados por BB09, MA25 y SL14.
Las cepas RV05 y BB42 se encontraron de manera más frecuente en hoja, tallo y raíz, que los otros aislados, principalmente al ser inoculadas en la semilla (Fig. 4). El aislado RV05 se encontró en todos los tejidos evaluados, con porcentajes de colonización que alcanzaron 100% en raíz a los 28 ddi al inocularse en semilla, y de un 40% a los 121 ddi, y, además, fue el aislado que se detectó mayormente en tallo, con un 100% de colonización al inocularse en semilla, y de 40% al inocularse por aspersión a los 28 ddi (Fig. 4). Cuando fue inoculado en la semilla, el aislado RV01 se detectó en raíz con un 50% de colonización a los 45 ddi y en hoja a los 28 y 45 ddi con 10% de colonización (Fig. 4A y C). El mismo aislado, RV01, solamente se encontró en la hoja cuando fue inoculado por aspersión, con un nivel de colonización de 40% (Fig. 4A). El aislado BB42 se encontró en hoja, raíz y tallo, aunque fue más frecuente al ser inoculado en la semilla que al ser inoculado por aspersión, con niveles de colonización de hasta 50% (Fig. 4).
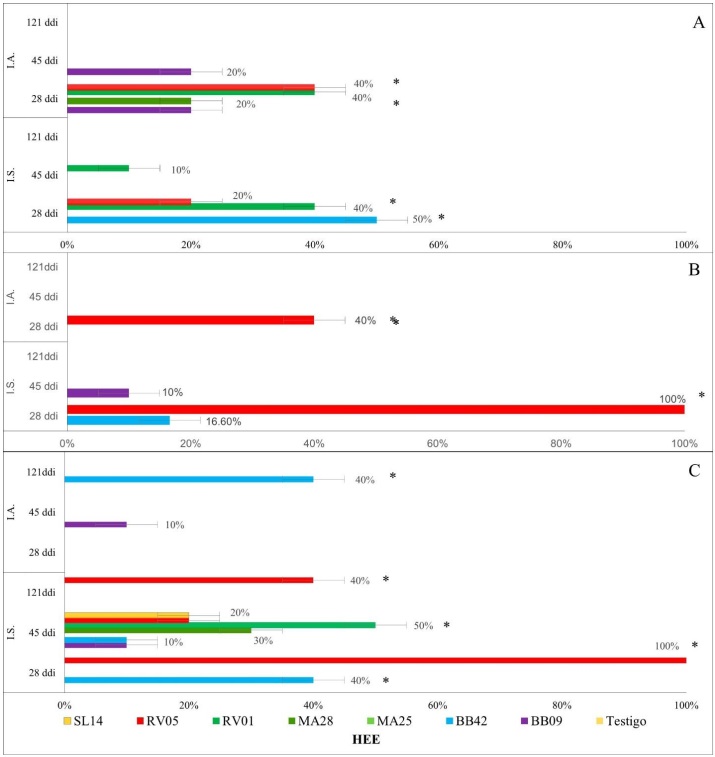
I.S.: Inoculación en semilla; I.A.: Inoculación por aspersión en sustrato y en la primera hoja verdadera. Las barras de error representan el error estándar. Se realizó una prueba de Dunnett con un α = 0.05, p ≤ 0.0001
Fig. 4 Efecto del método de inoculación y de diferentes cepas de HEE en el porcentaje de colonización en hojas (A), tallos (B) y raíces (C) en plantas de chile poblano a los 28, 45 y 121 días después de inoculación (ddi)
El aislado BB09 alcanzó porcentajes de colonización de 20% en la hoja cuando se inoculó por aspersión (Fig. 4A) y en un 10% en la raíz con ambos métodos de inoculación evaluados (Fig. 4C); no obstante, en tallo solo se observó la presencia del hongo cuando la inoculación se realizó en semilla (Fig. 4B). El aislado MA25, por su parte, sólo se encontró en la hoja al ser inoculado por aspersión (Fig. 4A) mientras que SL14 sólo se encontró en la raíz, pero al ser inoculado en la semilla (Fig. 4C).
Discusión
Efectos de la inoculación con HEE en el intercambio de gases y en la fluorescencia de la clorofila en plantas de chile poblano
Los resultados de esta investigación apoyan la hipótesis de que algunas cepas de HEE promueven el mejoramiento funcional en las plantas de chile, en variables como la tasa de asimilación neta, conductancia estomática y transpiración, como se registró a los 33ddi (Fig. 1).
Se observó un aumento en los parámetros fisiológicos de las variables analizadas durante la primera etapa del experimento. El efecto más sobresaliente fue el aumento en la tasa de asimilación neta de las plantas inoculadas por semilla con los aislados RV01, MA25 y SL14 (Fig. 1A, HEE p= 0.005). En cuanto a las plantas inoculadas por aspersión, sobresalen las cepas BB09 y RV01, aumentando la tasa de asimilación neta. Una mayor asimilación neta de CO2 puede considerarse una forma de soportar la elevada demanda de energía, que podría alterar sustancialmente el rendimiento fotosintético, al igual que otras variables como la conductancia estomática (Centritto et al., 2009). A los 33 ddi la cepa RV01 inoculada por aspersión aumentó la conductancia estomática (p=0.011, Fig. 1A) y la transpiración (p=0.007, Fig. 1C). Este aumento podría beneficiar a la planta, ya que un aumento en estos parámetros favorece la absorción de nutrientes minerales y de microelementos (Cho et al., 2008). Mejorar las propiedades fotosintéticas podría conducir a un uso más eficiente de la energía obtenida de la luz, así como a una mayor asimilación del carbono en el ciclo de Calvin (Kramer y Evans, 2011). Existen antecedentes donde la colonización por hongos endófitos interviene en la regulación de proteínas relacionadas con la fotosíntesis y en la respuesta de la planta a estrés al exceso de luz o la sequia (Gómez-Vidal et al., 2006; Ghaffari et al., 2018).
En este trabajo se encontró un efecto en algunas de las variables de fluorescencia de clorofila a causa del método de inoculación (Tabla 2). En las mediciones realizadas a los 87 ddi, en invernadero, fue evidente un aumento de la ϕPSII en las plantas inoculadas desde semilla, en comparación con las plantas inoculadas por aspersión (Tabla 3), aunque no todas las cepas de HEE promovieron esta respuesta (Fig. 2). En otros cultivos inoculados desde semilla, como la papa, la inoculación con Metarhizium brunneum aumentó la Fv/Fm y la ϕPSII, al igual que la conductancia estomática, la tasa de asimilación neta, la biomasa y el contenido de macroelementos como nitrógeno y fosforo (Krell et al., 2018). Otros organismos benéficos, como las bacterias del género Bacillus han demostrado efectos similares en plantas de chile habanero al aumentar parámetros como qP, ETR y Fv/Fm (Samaniego-Gámez et al., 2016). Estos mismos autores documentaron la reducción de la transpiración, lo que coincide con nuestros resultados. Por otro lado, en otros modelos como el sorgo dulce (Sorghum bicolor) inoculado por aspersión con B. bassiana, M. robertsii e Isaria fumosorosea, no se encontró un efecto en el contenido de clorofila, en la transpiración y en la fotosíntesis (Mantzoukas et al., 2015), aunque en el trabajo solo se aplicó un método de inoculación.
Efectos de la inoculación de HEE en la producción de biomasa de chile poblano
Se registró un alto porcentaje de colonización en plantas inoculadas con el aislado RV05 (Fig. 4), factor que pudo influir en el aumento significativo en la producción de biomasa, en comparación el testigo sin inocular (Tabla 4). Esta cepa presenta similitud en su morfología con aislados del género Paecilomyces, que también son endófitos en chile (Paul et al., 2013)
Los resultados de este trabajo muestran que los aislados BB42, BB09 y MA28 aumentaron significativamente la longitud de la raíz en comparación con el testigo cuando son inoculados por aspersión (Tabla 4 y Fig. 3). Es probable que el aumento en la longitud de raíces ocurriera en las primeras etapas de crecimiento, como fue comprobado en un estudio previo en donde se documentó que la longitud de la raíz de las plantas inoculadas con los aislados MA28 y BB42 aumentó hasta tres veces más que el testigo a los 45 ddi (Ortiz-Espinoza et al., 2019). Cabe señalar que las mayores longitudes de raíz se registraron en las plantas inoculadas por aspersión con las cepas de B. bassiana (BB09 y BB42) y de M. anisopliae (MA28) pero este efecto no se reflejó en el aumento del peso seco de la raíz, evaluada al finalizar el experimento, en cambio, el crecimiento registrado en raíces de plantas inoculadas con el aislado RV01 desde semilla, aumento tanto la longitud de la raíz como el peso seco final de la raíz (Tabla 4). La promoción de crecimiento en raíces inducido por la inoculación con Metarhizium anisopliae está respaldada por otros autores (García et al., 2011; Sasan y Bidochka, 2012; Bamisile et al., 2018). Anteriormente se observó un aumento en la longitud de plántulas de chile poblano en estudios in vitro con la cepa BB42 (Ortiz-Espinoza et al., 2019), pero este efecto no ocurre en ensayos en invernadero. B. bassiana como endófito tiene un amplio rango de hospederos, y es sumamente efectivo en colonizar las plantas cuando es asperjado en las hojas, como pudimos comprobarlo en los ensayos de endofitismo (Fig. 4), sin embargo, en los parámetros fisiológicos estudiados el efecto de la inoculación de B. bassiana no fue significativo, aunque se comprobó que otras cepas tienen capacidad de promover el crecimiento vegetal e inducir proteínas relacionadas con la fotosíntesis y el metabolismo energético (Jaber y Enkerli, 2016; Mckinnon et al., 2016; Tall y Meyling, 2018).
Efecto del método de inoculación en el porcentaje de colonización
Se han probado diferentes técnicas para inocular artificialmente HEE en cultivos. La técnica de aspersión sobresale como la metodología más aplicada y exitosa, en comparación con otras técnicas como la aplicación en raíces directamente o la inoculación directa en semilla (Bamisile et al., 2018). Sin embargo, esto contrasta con los resultados obtenidos en este trabajo, y con muchos otros reportes que resaltan las cualidades de la técnica de inoculación en semilla como la mejor técnica para introducir HEE artificialmente en cultivos agrícolas, demostrando efectos antagónicos contra hongos fitopatógenos, asi como una reducción del efecto causado por insectos plaga, ya sea por competencia de espacio y nutrientes o bien, por la induccion de respuestas de defensa de la planta (Quesada-Moraga et al., 2009; Gurulingappa et al., 2010; Akello y Sikora, 2012; Akutse et al., 2013; Greenfield et al., 2016).
La inoculación en la semilla promovió un mayor porcentaje de colonización en tallo, hojas y raices en comparación con el método de aspersión, como fue evidente en las plantas inoculadas con el aislado RV05, principalmente en tallo y en raíz (Fig. 4A). Muchos HEE han demostrado altos índices de colonización en plantas de diferentes familias, con variaciones no solo en función de la cepa, sino también en cuanto al órgano donde fue aislado, y sobre todo con el tiempo en que el endofitismo fue detectado (Ownley et al., 2008; Akutse et al., 2013; Castillo-Lopez et al, 2014). En este trabajo, las cepas locales mostraron mayor capacidad de colonización que el resto de las cepas evaluadas (Fig. 4), y estos aislados fueron los mayores promotores del crecimiento vegetal en chile poblano (Tabla 4). Los beneficios de las plantas en relación con la colonización por hongos endófitos generalmente son inducidos en las etapas tempranas (Soliman et al., 2013), y en este trabajo se comprobó que este efecto perdura hasta la etapa de invernadero, a los 87 ddi en aquellas plantas que fueron inoculadas en semilla, y con aislados locales. En el presente estudio se reportó un alto porcentaje de colonización principalmente por parte del aislado local RV05 a los 28 ddi (Fig. 4A), y de las cepas RV01 y SL14 a los 45 ddi (Fig. 4B). Cuando es inoculado desde semilla, la colonización de M. anisopliae con su hospedero comúnmente inicia a los 7 ddi en los que debe competir con otros microorganismos en la rizosfera, y en ocasiones es forzado a actuar como un endófito oportunista (Barelli et al., 2018). En la colonización inicial del hospedero intervienen diversos factores, y se mantienen mientras exista un equilibrio entre los costos y los beneficios de la relación mutualista entre la planta y el HEE (Hiruma et al., 2016). Es evidente que ocurrió una interacción benéfica en las plantas de chile poblano inoculadas con las cepas RV01 y RV05, las cuales mostraron mayor desarrollo radicular y de la parte área de la planta, y, además, en ambos casos, la inoculación en semillas fue el mejor método para inducir estos efectos. Esta reportado en Arabidopsis thaliana que la interacción entre la hifa del hongo con las raíces es más estable que las relaciones con células de la epidermis, y solo promueve el crecimiento cuando la biodisponibilidad de nutrientes es baja, lo cual genera una respuesta en la planta (factores de transcripción) que favorecen el crecimiento del hongo dentro de la planta (Liberman y Benfey, 2016). De acuerdo con los resultados discutidos anteriormente, RV05 coloniza plantas de chile poblano de manera eficiente cuando es desinfectada y después sumergida en una solución de conidios, y esta persiste hasta los 121 ddi (Fig. 4).
Conclusiones
En este trabajo se comprobó experimentalmente la promoción de crecimiento vegetal hasta la etapa de invernadero en chile poblano, con la inoculación con aislados de HEE nativos de San Luis Potosí (RV01 y RV05). El resto de las cepas estudiadas no promovieron el crecimiento.
El mejor método de inoculación de HEE fue el de sumergir las semillas estériles en una solución de conidios (MI), incrementando el peso seco del tejido foliar, la producción de biomasa, la longitud de la raíz y con capacidad de mejorar las características funcionales del cultivo (tasa de asimilación neta, transpiración, ϕPSII y la qP) y el porcentaje de colonización.











 text new page (beta)
text new page (beta)



