Introducción
La creciente demanda de alimentos a nivel mundial representa un desafío para los próximos 30 años, ya que el crecimiento acelerado de la población para el año 2050 (> 9x109 habitantes) demandará duplicar la producción de alimentos (Godfray H.C.J. et al., 2010, p. 812). Entre los alimentos más importantes se encuentran los cereales, cuya producción deberá incrementarse a 1x106 millones de toneladas anuales, para 2050 (United Nations, 2015, p. 66). Entre estos, el trigo es uno de los alimentos de mayor interés, debido a su aporte calórico y proteico, así como una fuente importante de micronutrientes (Poudel & Bhatta, 2017, p. 3).
La importancia de este cereal ha conducido a investigaciones exitosas en el Valle del Yaqui, Sonora, México, enfocadas a incrementar su productividad, desde los inicios de la Revolución Verde promovida por el Dr. Norman E. Borlaug (1968, p. 10). La gran demanda global por este cereal ha generado opciones productivas cada vez más robustas y eficientes, incluyendo la generación de variedades con mayores rendimientos, más calidad del grano y resistentes a enfermedades; así como la aplicación de nuevas prácticas de manejo agrícola, incluyendo técnicas y densidades de siembra, métodos de labranza, calendarios de riego, control fitosanitario y fertilización, entre otras tecnologías (Matson & Jewett, 2013 p. 299).
Sin embargo, el impacto de las prácticas agrícolas en combinación con las condiciones climáticas prevalecientes en el Valle del Yaqui (temperaturas extremas, baja precipitación pluvial, y alta evapo-transpiración), puede ser causa de los suelos salinos con bajo contenido de materia orgánica y nutrientes observados en la región (Cortes-Jimenez et al., 2009, p. 135), impactando negativamente el óptimo aprovechamiento de los insumos agrícolas por el cultivo (i.e. sólo el 23% de nitrógeno aplicado es aprovechado por el cultivo) (Grahmann et al., 2019, p. 5). De esta manera, a nivel mundial, el rendimiento del trigo ha disminuido gradualmente (9%) durante 1981 a 2010 (Asseng, 2015, p. 304). Por lo tanto, el mantener la productividad sustentable de trigo realizando estudios eco-fisiológicos y con microorganismos (MOOS) benéficos, son requeridos para la generación de alternativas de producción de bajo impacto bajo las condiciones edafo-climáticas actuales y futuras. Lo cual permitirá generar conocimiento científico sobre la interacción del trigo con los factores abióticos y bióticos del agro-sistema, destacando tener una mejor comprensión de las interacciones planta-suelo.
El ecosistema suelo puede contener una extensa diversidad y población de microorganismos, se estima que el 90% son bacterias, 9% actinomicetos y 1% hongos, siendo la rizósfera donde se encuentra la mayor población microbiana cultivable que se estima en 1x106 UFC/cm3 (Sgroy et al., 2009, p. 371). La rizósfera es la porción de suelo donde los procesos mediados por MOOS están influenciados por el sistema radicular (Kloepper et al., 2004, p. 219). Esta zona incluye el suelo que está en contacto con las raíces de las plantas, y a menudo se extiende a pocos milímetros fuera de la superficie de las mismas (Bringhurst, Cardon, & Gage, 2001, p. 8), teniendo un importante ambiente de interacción entre planta y microorganismos (Gray & Smith, 2005, p. 395). En esta zona la planta excreta una amplia diversidad de compuestos como aminoácidos y azúcares, los cuales proveen una fuente rica de energía y nutrientes para los MOOS involucrados en las interacciones que pueden ser benéficas, neutras o perjudiciales para la planta (de Souza et al., 2015, p. 187; Scagliola et al., 2016, p. 401).
Las RPCV son un grupo de bacterias rizosféricas con la habilidad de promover el crecimiento, la salud de las plantas y restaurar la fertilidad del suelo (Valenzuela-Aragon et al., 2018). Para ello utilizan diversos mecanismos, entre los que destacan: I) la fijación biológica del nitrógeno atmosférico (Guzmán et al., 2012, p. 182; Robertson & Groffman, 2015, p. 424); II) solubilización de minerales como fósforo (P) (Corrales et al., 2014, p. 67; Kumar et al., 2013, p. 1361); III) producción de sideróforos (Patel et al., 2018, p. 81); y IV) la habilidad de producir fitohormonas (de Souza, Ambrosini, & Passaglia, 2015b, p. 401; Sheirdil et al., 2019, p. 12). Además de forma indirecta, las RPCV pueden actuar como agentes de biocontrol contra fitopatógenos por medio de I) la producción de sideróforos (Villarreal-Delgado et al., 2018, p. 95); II) de quitinasas (Thilagar et al., 2018, p. 813); III) de antibióticos (Cattelan et al., 1999, p. 1670; Nyambura-Ngamau, 2012, p. 6414); y IV) la competencia por espacio y nutrientes (Martínez-Viveros et al., 2010, p. 293).
De acuerdo a Numan et al. (2018, p. 21), los MOOS más reportados como RPCV habitan en la rizósfera y pertenecen a los géneros Achromobacter, Azotobacter, Azopirillum, Bacillus, Burkholderia, Enterobacter, Microbacterium, Pantoea, Pseudomonas, Rhizobium, y Streptomyces. Por ejemplo, Shaharoona et al., (2008, p. 147) reportó que la inoculación del cultivo de trigo con Pseudomonas fluorescens resultó en un incremento significativo del peso de raíz (19-43%); número de macollos por planta (10-21%); producción de grano (15-43%) y rendimiento de paja (22-39%), comparado con plantas no inoculadas. De manera similar, cepas del género Bacillus han demostrado que potencian el crecimiento de cultivos agrícolas como el tomate (Solanum lycopersicum), chile (Capsicum annuun L.), T. aestivum y T. durum (Sood et al., 2018, p. 1; Thilagar et al., 2018, p. 813; Majeed et al., 2015, p. 1; Robles-Montoya et al., 2019, p. 201).
Por otro lado, la aplicación Bacillus polimixa BcP26 resultó en un incremento significativo en la absorción de N, P y K, desde 10% hasta 61% más que el control no inoculado, y la aplicación de B. megaterium BcM33 incrementó en 11% y 18% el peso seco de la raíz y tallo respectivamente, en el cultivo de algodón (Gossypium hirsutum) (Egamberdiyeva & Höflich, 2004, 293). Con base en lo antes señalado, el objetivo del presente trabajo fue identificar RPCV asociadas a la rizósfera del trigo en el Valle del Yaqui, mediante I) su identificación molecular; II) características metabólicas involucradas en la promoción de crecimiento vegetal; III) el impacto de su inoculación sobre variables morfométricas en el cultivo de trigo. Esto se realizó para las tres RPCV, ya sea de forma individual y en consorcio.
Método
Microorganismos y condiciones de crecimiento
Las cepas bacterianas utilizadas (TE3T, TRQ8 y TRQ65) fueron seleccionadas con base en su capacidad de colonizar la rizósfera del cultivo de trigo, en lotes comerciales localizados en el Valle del Yaqui, Sonora, México (Valenzuela-Aragon, et al., 2018), y por su capacidad antagónica contra Bipolaris sorokiniana, el agente causal de la mancha borrosa en este cereal (Villa-Rodriguez et al., 2016, p. 2329; Villa-Rodriguez et al., 2019, p. 135). Las cepas en estudio, criopreservadas a -80º C en glicerol al 10%, fueron crecidas en cajas de Petri conteniendo Agar Nutritivo (AN, DIBICO®) a 28±2°C por 48 h (Labnet® 311DS). La morfología de la colonia, tamaño, color, forma y el patrón de crecimiento se registró después de las 48 horas de incubación, según lo descrito por Somasegaran y Hoben (1994). La reacción de Gram se realizó según lo descrito por Vincent y Humphrey (1970). Posteriormente, una colonia de cada cepa fue individualmente transferida a un tubo Falcon (50 mL) estéril (121°C y 15 psi/15 min) con 20 mL de Caldo Nutritivo (CN, DIBICO®) y cultivadas durante 24 h en agitación a 120 rpm y 28±2°C (Labnet® 311DS), para los experimentos posteriores.
Identificación molecular
La identificación molecular de las cepas en estudio se realizó mediante la secuenciación del gen 16S ARNr con los oligonucleótidos FD1 (5'-CCGAATTCGTCGACAACAGAGTTTGATCCTGGCTCAG-3') y RD1 (5'- CCCGGATCCAAGCTTAAGGAGGGGGGCCCCCC-3') (Bresler et al., 2000, p. 904). Las condiciones de la reacción en cadena de la polimerasa (PCR, por sus siglas en inglés) consistieron en una desnaturalización a 94°C por 3 min, alineamiento a 55°C por 30 segundos, y extensión a 72°C por 1 min (lo anterior se repitió durante 35 ciclos), y una extensión final a 72°C (10 min). Los amplicones fueron visualizados mediante una electroforesis en gel de agarosa al 2%, usando como colorante GelRedTM (BiotiumTM®). Los amplicones purificados fueron secuenciados mediante la plataforma Sanger. Las secuencias nucleotídicas obtenidas se editaron con el software FINCH TV (Geospiza, Inc.; Seattle, WA, EE. UU.; http://www.geospiza.com), y fueron comparadas con la herramienta de alineamiento local básico BLASTn de NCBI (National Center for Biotechnology Information, por sus siglas en inglés) (Altschul et al., 1990, p. 403), considerando el porcentaje de máxima identidad. Las secuencias del gen 16S ARNr fueron depositadas en la base de datos Genbank y publicadas con el número de acceso: MH057214 (TE3T), MK493638 (TRQ8) y MK493706 (TRQ65).
Las secuencias anteriormente mencionadas se utilizaron para construir un árbol filogenético mediante el software CLC Sequence Viewer (CLC bio, Aarhus, Denmark), con el modelo de evolución Kimura80 (Kimura, 1980, p. 111), y el modelo de construcción Neighbor-Joining. Dicha construcción se realizó con base en 1000 iteraciones para el cálculo del porcentaje de bootstrap. La secuencia del gen 16S ARNr de Pseudomonas sp. (MH569548) fue utilizada como “outgroup”.
Caracterización in vitro de mecanismos de RPCV en las cepas de estudio
Para la evaluación in vitro de la capacidad de promoción de crecimiento vegetal de las cepas estudiadas, el pre-inóculo fue realizado bajo las condiciones descritas anteriormente. Posteriormente se tomó 1 mL (1x106 células/mL) de cada pre-inóculo y se transfirió a 10 mL de CN (DIBICO®), incubándose durante 24 horas en agitación a 120 rpm y 28±2°C, para después centrifugar (Labnet® Harmle Z 446 K) a 3,500 rpm por 8 min. La biomasa obtenida fue lavada por duplicado con solución salina (0.9% NaCl) estéril (121 °C y 15 psi por 15 min) y re-suspendidos con agua destilada estéril, ajustando la concentración celular a 1x106 células/mL, utilizando una cámara de Neubauer para el conteo de células.
Producción de indoles. 1 mL (1x106 células/mL) de las cepas TE3T, TRQ8, y TRQ65 fueron inoculadas individualmente en 10 mL de CN (DIBICO®) suplementado con 100 mg/L de L-triptófano (Sigma®), a 30±2°C por 5 días y 120 rpm de agitación (de los Santos-Villalobos et al., 2013, p. 615). Posteriormente, los cultivos celulares fueron centrifugados (4000 rpm durante 10 min), y los sobrenadantes reaccionaron individualmente en oscuridad por 30 min con el reactivo de Salkowski (4.5g de FeCl3 (FagaLab®) en H2SO4 (J.T. Baker®) 10.8 M), en una relación 2:1 (reactivo-muestra), para determinar la concentración de indoles acorde al método colorimétrico de Glickmann & Dessaux (1995, p. 793). La formación de un color rosado indicó la producción de indoles, la cual se cuantificó por espectrofotometría a 540nm (BioTek® ELx800). Las concentraciones de indoles producidas fueron estimadas con una curva patrón de AIA (Sigma®), en un rango de 2-50 µg/ml. Los ensayos se realizaron por triplicado
Solubilización de fósforo insoluble. Las cepas fueron inoculadas por triplicado usando 10 µL de una suspensión de 1x106 células/mL en cajas de Petri conteniendo Agar Pikovskaya (PVK), suplementado con azul de bromofenol (C19H10Br4O5S) (Jalmek®) y fosfato tricálcico (Biobasic®) como fuente insoluble de fósforo (Glucosa (Jalmek®) 10.0 g/L, Ca3(PO4)2 5.0 g/L, (NH4)2SO4 (Jalmek®) 0.5 g/L, NaCl (Biobasic®) 0.2 g/L, MgSO4-7H2O (Jalmek®) 0.1 g/L, KCl (Jalmek®) 0.2 g/L, extracto de levadura (DIBICO®) 0.5 g/L, MnSO4-H2O (Jalmek®) 0.002 g/L, FeSO4-7H2O (Jalmek®) 0.002 g/L, Agar (DIBICO®) 15.0 g/L, azul de bromofenol 0.025 g/L, y pH 7.0) (Pikovskaya, 1948, 315). La capacidad de las cepas para solubilizar fosfatos fue positiva con base en la formación de un halo transparente, después de 7 días de incubación a 28±2°C (Onyia & Anyanwu, 2013, p. 52).
Producción de sideróforos. El ensayo para detectar la producción de sideróforos por las bacterias estudiadas fue descrito por Alexander and Zuberer, (1991, p. 39), utilizando el Agar Chrome Azurol S (CAS). Este fue preparado mezclando cuidadosamente 4 soluciones, teniendo la siguiente composición, Solución 1: 10 mL de 1 mM FeCl3 (disueltos en 1 mM HCl) y 50 mL de CAS (Sigma®) (1.21 mg/mL) fueron añadidos por separado a 40 mL de HDTMA (Sigma®) (1.82 mg/mL). Solución 2: 30.24 g de PIPES (Sigma®) fueron disuelto en 750 mL de solución salina (0.3 g KH2PO4 (FagaLab®), 0.5 g NaCl y 1 g NH4Cl (Jalmek®)), el pH fue ajustado a 6.8 con KOH (Jalmek®) al 50%, el volumen se ajustó a 800 mL, y después 15 g de agar bacteriológico (DIBICO®) fueron añadido. Solución 3: 2 g glucosa, 2 g manitol (Jalmek®), 493 mg MgSO4, 11 mg CaCl2 (Jalmek®), 1.17 mg MnSO4, 1.4 mg H3BO3 (Jalmek®), 0.04 mg CuSO4 (FagaLab®), 1.2 mg ZnSO4 (FagaLab®), y 1 mg Na2MoO4 (Jalmek®) se disolvieron en 70 mL de agua destilada. Solución 4: se filtraron 30 mL de casamino ácidos (USBiological®) al 10% (1 mg/mL). El medio de cultivo se inoculó con 10 µL de una suspensión celular de 1x106 células/mL, y se incubó a 28±2 °C por 7 días. La formación de un halo color naranja-amarillo confirmó la producción de sideróforos por las cepas estudiadas (Patel et al., 2018, p. 81). Los ensayos se realizaron por triplicado.
La capacidad de las cepas de estudio para producir sideróforos y solubilizar fósforo inorgánico se categorizó en 3 niveles: bajo (<1); intermedio (entre 1 y 2); o alto (> 2) (Marra et al., 2013, p. 603), y se determinó el índice de solubilización de fósforo insoluble (IS) y el índice de producción de sideróforos (IP) mediante la siguiente fórmula:
Promoción del crecimiento por las RPCV estudiadas, en cámara de crecimiento
La capacidad de las cepas TE3T, TRQ8 y TRQ65 para promover el crecimiento vegetal fue evaluada utilizando como planta modelo el trigo variedad CIRNO C2008. El ensayo de interacción planta x RPCV se llevó a cabo en una cámara de crecimiento (BJPX-A450, BIOBASE®), simulando condiciones de campo registradas en el Valle de Yaqui (13 h oscuridad a 14°C, 2 h luz a 18°C, 7 h luz a 25°C y 2 h luz a 18°C), durante los últimos 3 años por la estación del clima REMAS (27°22′12.28” N y 109°55’51.71” O). Para esto, 250 semillas de trigo fueron desinfectadas previamente esterilizando la superficie con 1.5% (v/v) con hipoclorito de sodio (NaClO) por 10 min, y 3 lavados con agua destilada estéril (Grobelak et al., 2015, p. 22). Las semillas desinfectadas fueron germinadas en toallas de papel húmedas (50 x 25 cm) enrolladas (ISTA, 1985) y transferidas asépticamente a charolas forestales (diámetro de cavidad 4.7 cm) que contenían 190 gramos de una mezcla de suelo estéril y perlita (esterilizados por 5 días consecutivos a 121°C - 15 lb/in2 por 1 h), en una relación 70:30. Los pre-inóculos bacterianos fueron cultivados en tubos Falcon (50mL) con 10 mL de CN, e incubados a 28°C por 24 h en agitación continua (120 rpm). Para la preparación del inóculo se tomó 1 mL (1x106 células/mL) del pre-inóculo y se inoculó en 200 mL de CN contenidos en un matraz Erlenmeyer (1 L), e incubado bajo las condiciones mencionadas con anterioridad. Una vez que se cumplió el tiempo de incubación, se procedió a centrifugar la suspensión bacteriana a 3500 rpm por 15 min, la biomasa obtenida se lavó 2 veces con agua destilada estéril y se ajustó la densidad celular a una concentración de 1x106 células/mL (Valenzuela-Aragon et al., 2018).
Finalmente, 1 mL (1x106 células/mL) de cada cepa bacteriana fue inoculado a cada plántula de trigo. Se realizó un diseño experimental aleatorio y se evaluaron 8 tratamientos con las cepas individuales y las interacciones entre éstas: 1) TE3T; 2) TRQ65; 3) TRQ8; 4) TE3T-TRQ65; 5) TE3T-TRQ8; 6) TRQ65-TRQ8; 7) CS3 (consorcio formado por las 3 cepas); y 8) un tratamiento control (plántulas sin inocular). Se realizaron 2 réplicas biológicas, cada una con 15 plántulas para cada tratamiento. Después de 45 días de la inoculación (etapa GS14 de la escala Zadoks), se procedió a la medición de parámetros morfométricos en las plantas de trigo, como: la longitud aérea (LA) y de raíz (LR); peso seco aéreo (PSA) y de raíz (PSR); e índice de biovolumen (IB = circunferencia*longitud aérea).
Resultados
Identificación molecular de las cepas bacterianas estudiadas
Basados en la secuenciación del gen 16S ARNr, la cepa TRQ8 fue afiliada taxonómicamente a B. megaterium (cobertura 100% e identidad 99.66%) (Robles-Montoya et al., 2019); TRQ65 a B. paralicheniformis (cobertura 100% e identidad 90.91%) (Valenzuela-Ruiz et al., 2019); y TE3T a B. cabrialesii (cobertura 100% e identidad 100%) (de los Santos Villalobos et al., 2019). Adicionalmente, en la Fig. 1 se muestra un árbol filogenético en el que se expresan las relaciones de similitud y disimilitud que existen entre las cepas en estudio. Las secuencias relacionadas taxonómicamente se agrupan en clados, lo cual es sustentado por el valor de bootstrap [el porcentaje en el que un clado se repite en 1000 simulaciones al azar (iteraciones)]. La configuración de un clado se considera fiable si presenta un bootstrap mayor a 50. Así, los valores de 62% para B. megaterium TRQ8, B. paralicheniformis TRQ65 con 98%, y B. cabrialesii TE3T con 95 74% sustentan la afiliación taxonómica en el presente estudio.
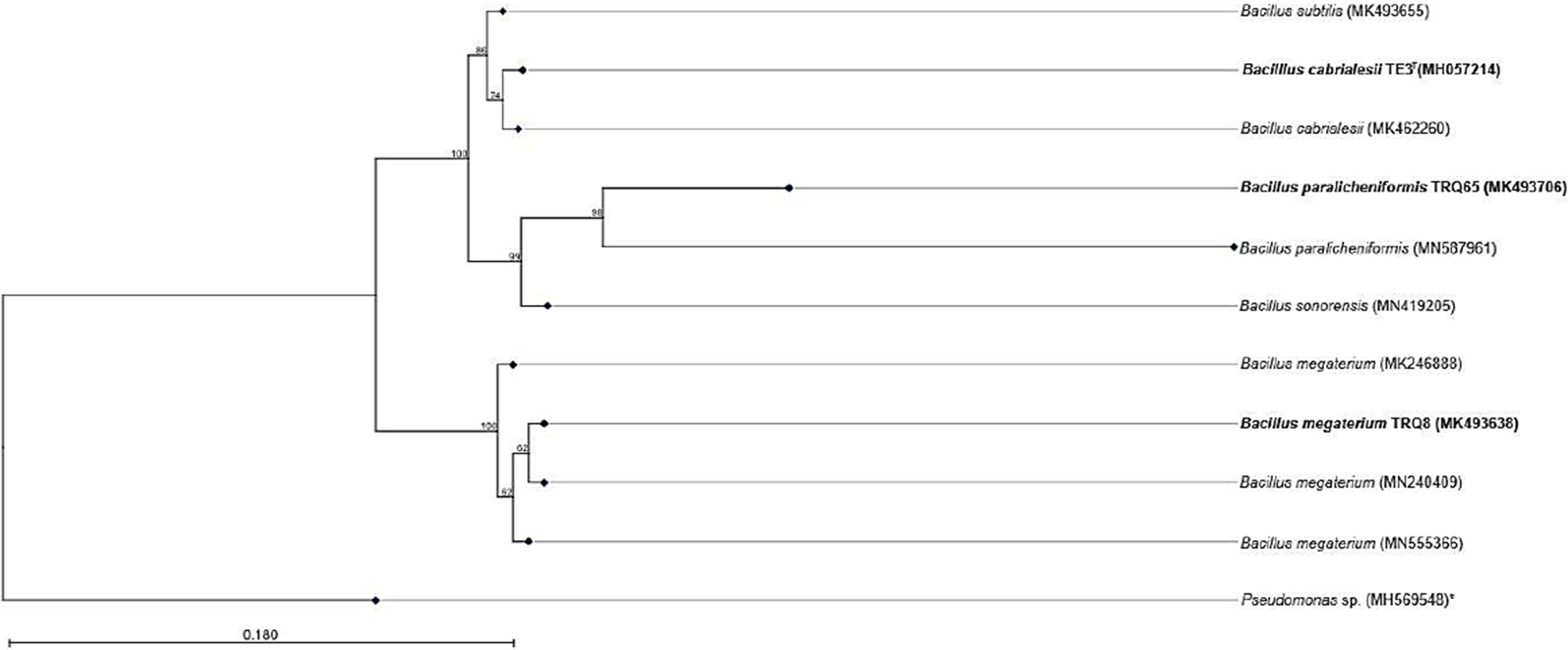
*Indica la secuencia outgroup (Pseudomonas sp. MH569548).
Fig. 1 Árbol filogenético construido con las secuencias del gen 16S ARNr de las cepas en estudio, utilizando el modelo Kimura80 y Neighbor-Joining. Los agrupamientos se determinaron con 1000 iteraciones (bootstrap).
Por otra parte, las características morfológicas macro y microscópicas de las cepas en estudio se presentan en la Tabla 1, las cuales se distinguen por la forma de bacilo Gram positivo. Además, la capacidad de producir esporas es una de las características del género Bacillus y comúnmente deseada para su producción a nivel industrial.
Tabla 1 Características morfológicas de las tres rizobacterias promotoras del crecimiento vegetal.
| Cepa | Afiliación taxonómica | Numero de Accesión | Características Macroscópicas | Características Microscópicas | Reacción GRAM |
| TRQ8 | Bacillus megaterium | MK493638 | Circular con borde entero y elevación convexa | Bacilo | Gram + |
| TRQ65 | Bacillus paralicheniformis | MK493706 | Irregular con borde ondulado y elevación plana | Bacilo | Gram + |
| TE3T | Bacillus cabrialesii | MH057214 | Irregular con borde lobulado y elevación plana | Bacilo | Gram + |
Caracterización metabólica de las RPCV in vitro
Las cepas estudiadas mostraron la capacidad de producir indoles, siendo la cepa B. paralicheniformis TRQ65 la que produjo la mayor concentración (39.29 µg mL-1), seguida por B. megaterium TRQ8 y B. cabrialesii TE3T (Tabla 2). Similarmente, las 3 cepas mostraron la capacidad de solubilizar el fósforo insoluble, sin observar diferencias significativas (P ≥ 0.05) entre ellas. Sin embargo, sólo la cepa TRQ8 fue capaz de producir sideróforos (IP = 8.17) (Tabla 2).
Tabla 2 Caracterización metabólica in vitro de las tres rizobacterias promotoras del crecimiento vegetal estudiadas.
| Cepa | Afiliación taxonómica | Producción de índoles (µg mL-1) | Solubilización de fosfatos (IS) | Producción de sideróforos (IP) |
| TRQ8 | Bacillus megaterium | 12.03 ± 1.93 b | 1.38 ± 0.04 a | 8.17 ± 0.01 |
| TRQ65 | Bacillus paralicheniformis | 39.29 ± 0.30 a | 1.37 ± 0.05 a | - - |
| TE3T | Bacillus cabrialesii | 8.21 ± 1.35 c | 1.43 ± 0.04 a | - - |
Medias (n=3) en la misma columna con la misma letra no presentan diferencias significativas, según la prueba de Tukey HSD (P ≥ 0.05). Las variaciones corresponden a la desviación estándar.
Promoción del crecimiento en el trigo por las RPCV, en cámara de crecimiento
El consorcio de las cepas TRQ65+TRQ8 presentaron diferencia significativa positiva sobre las plantas de trigo comparadas con el control (no inoculado), en las 5 variables analizadas (longitud aérea, longitud de raíz, peso seco aéreo, peso seco de raíz, e índice de biovolumen), la longitud aérea y de raíz mostraron un incremento de 6% y 10%, respectivamente; mientras que el peso seco aéreo se incrementó en 60%, y el peso seco radicular mostró 82% de incremento (Fig. 2). El índice de biovolumen de las plantas inoculadas por este consorcio bacteriano (TRQ65 + TRQ8), presentó un incremento de 18%, en comparación con el control. Por otra parte, el consorcio TRQ8+TE3T mostró diferencia significativa positivas respecto del tratamiento control en las variables peso seco aéreo, peso seco de raíz e índice de biovolumen (25%, 44% y 18%), respectivamente. Por lo que respecta al consorcio TE3T+TRQ65, ninguna diferencia significativa fue observada en las variables analizadas, en contraste con las plantas no inoculadas (control).
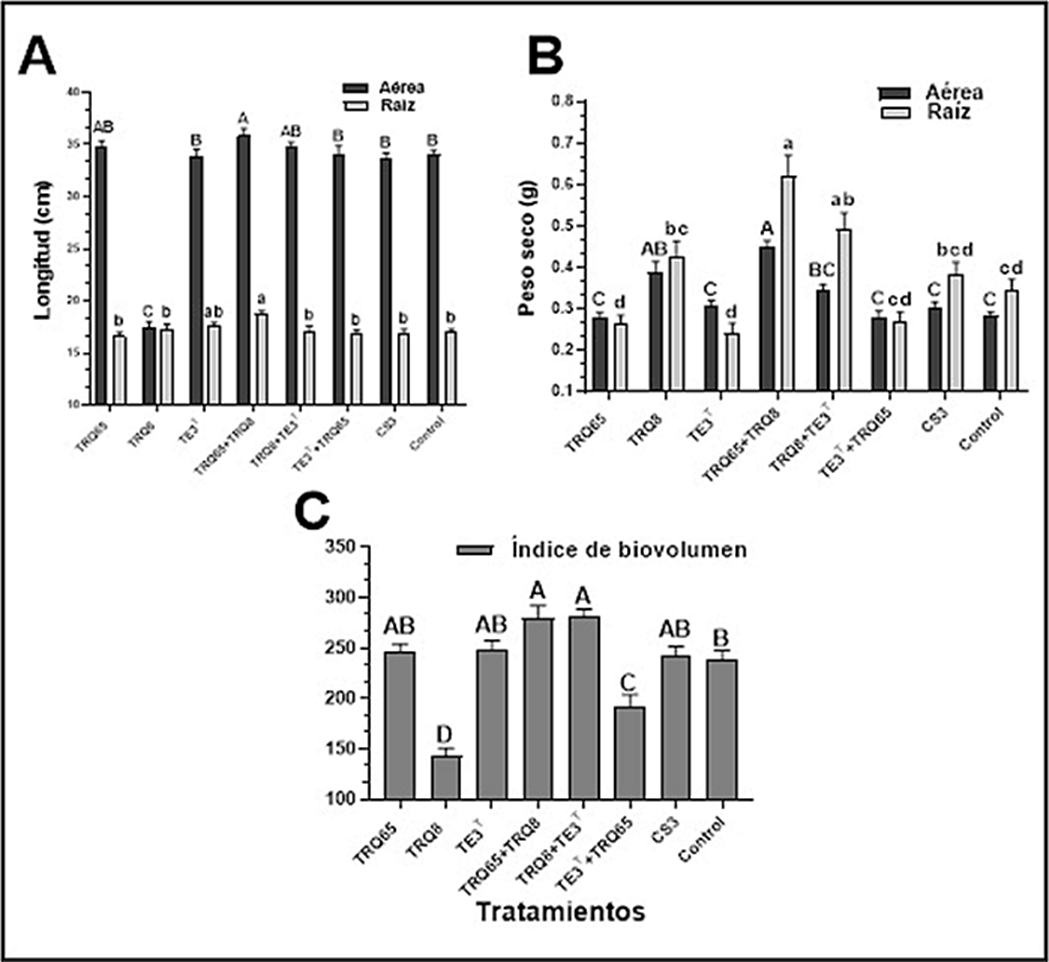
Fig. 2 Efecto de la inoculación de las cepas estudiadas (individuales o en consorcios) sobre (A) Longitud aérea y de raíz; (B) Peso seco aéreo y de raíz; y (C) Índice de biovolumen (circunferencia x longitud), bajo condiciones de cámara de crecimiento. Las literales indican diferencia significativa acorde con Tukey HSD (P<0.05).
El consorcio de las 3 cepas bacterianas (TRQ8 + TRQ65 + TE3T) mostró una tendencia a incrementar el valor de cuatro de las variables estudiadas (LA, PSA, PSR e IB); sin embargo, no se observaron diferencias significativas en comparación con el tratamiento control. Por otro lado, en los tratamientos de inoculación individual, la cepa TRQ8 mostró el mayor incremento significativo (39%) con respecto al control para la biomasa seca aérea. Lo anterior evidencia que el efecto de promoción de crecimiento más importante fue debido a la inoculación de las cepas TRQ65+TRQ8.
Discusión y Conclusiones
Las cepas bacterianas estudiadas, mediante la secuenciación del gen 16S ARNr, fueron afiliadas taxonómicamente al género Bacillus; específicamente, la cepa TRQ8 a B. megaterium; la cepa TE3T a B. cabrialesii; y la cepa TRQ65 a B. paralicheniformis (Tabla 1 y Fig. 1). Esta afiliación taxonómica fue soportada por las características macro y microscópicas de las cepas, relacionadas al género Bacillus (Tabla 1), tanto en morfología colonial como celular (Heyrman et al., 2009, p. 193). El género Bacillus es ampliamente utilizado en la biotecnología agrícola, donde el 85% de los inoculantes microbianos que actualmente se comercializan incluyen cepas de este género en su composición, debido a su amplia versatilidad metabólica (Villarreal-Delgado et al., 2018, p. 95)
Diversas cepas de las especies mencionadas anteriormente han sido reportadas como BPCV promisorias. B. megaterium ha mostrado la capacidad de regular el crecimiento en el cultivo de trigo, mejorando significativamente variables morfométricas, como longitud de raíz (68.4%) y peso seco (>50%), con respecto a plantas no inoculadas (Robles-Montoya et al., 2019, p. 201), y producir polihidroxibutirato (46.79% en un medio de cultivo con 1% de etanol), un metabolito de reserva involucrado en la competencia de las bacterias bajo condiciones de estrés (Aguirre et al., 2017, p. 24; Sanches-Santos et al., 2017, p. 1855); B. cabrialesii es una nueva especie recién reportada (de los Santos Villalobos et al., 2019) y los trabajos con esta nueva especie bacteriana están siendo desarrollados. Sin embargo, su relación filogenética con B. subtilis es la más alta y este género de bacteria ha sido estudiado por su capacidad promotora del crecimiento vegetal en cultivos de tomate y trigo obteniendo incrementos en la longitud de raíz (5.2% y 5.6%, respectivamente), así como en el peso seco de raíz y parte aérea con un aumento de 60% y 45% respectivamente para cada cultivo, debido posiblemente por la solubilización de fósforo y producción de índoles (Valenzuela-Aragon et al., 2018; Walia et al., 2014, p. 145), así como por su capacidad como agente de control biológico contra Bipolaris sorokiniana, mostrando 98% de inhibición de crecimiento de dicho patógeno (Villa-Rodriguez, et al., 2019, p. 135); mientras que B. paralicheniformis ha sido reportado como promotora del crecimiento vegetal, promoviendo un aumento de la biomasa seca total (17.8%), índice de biovolumen (41%), y aumento de nutrientes (34% N, 18% P, y 29% K) en el cultivo de Capsicum annuum (Thilagar et al., 2018, p. 813), eso fue atribuido a la solubilización de fosfatos y la producción de fitohormonas, como AIA (Angulo et al., 2014, p. 338; Valenzuela-Aragon et al., 2018).
Además, diversas especies del género Bacillus se caracterizan por ser ubicuos, encontrándose principalmente como bacterias rizosféricas o endófitas asociadas a distintos cultivos agrícolas, incluido el trigo (Khalid et al., 2004, p. 2303; Akinrinlola et al., 2018, p. 1; de los Santos-Villalobos, 2018, p. 191). Lo anterior es atribuido a su capacidad de formar endosporas, y colonizar las plantas mediante la producción de sustancias antimicrobianas contra otros competidores (Valenzuela-Aragon et al., 2018). Adicionalmente, el género Bacillus es ampliamente reportado como RPCV del crecimiento vegetal y puede ser utilizado de manera individual o en co-inoculación con otros géneros bacterianos. Por ejemplo, B. licheniformis 255 (cepa solubilizadora de fosfatos) incrementa la concentración de fósforo disponible en el suelo cuando es co-inoculada con Rhizobium pisi en Cytisus striatus y Lupinus luteus (Balseiro-Romero et al., 2017, p. 676).
Las RPCV pertenecientes al género Bacillus actúan mediante diversos mecanismos, como la producción de fitohormonas, la secreción de antibióticos, la inducción de resistencia sistémica, producción de enzimas líticas de la pared celular de patógenos (Ghosh, Gupta, & Mohapatra, 2019; Villarreal-Delgado et al., 2018, p. 95; Won et al., 2019, p. 8). De esta manera, es determinante estudiar los potenciales mecanismos de promoción de crecimiento vegetal de las cepas promisorias, ya que éste es considerado uno de los criterios previos para conocer la interacción de las cepas bacterianas con las plantas. En el presente estudio, las 3 cepas bacterianas mostraron la capacidad para producir indoles (8.21 a 39.29 µg/mL) (Tabla 2), observando la mayor producción (39.29 µg/mL) por la cepa TRQ65. La elaboración de compuestos indólicos por bacterias ha mostrado un efecto sobre el balance hormonal en las plantas, y, por lo tanto, influye en su crecimiento (Govindasamy et al., 2009, p. 71; He et al., 2017, p. 1180). Así, los compuestos indólicos producidos por RPCV, y en específico por el género Bacillus, han sido asociados a la interacción planta-microorganismo, y su actividad promotora del crecimiento radicular y foliar en las plantas (Ali et al., 2009, p. 519).
Además, las cepas estudiadas mostraron índices de solubilización de fósforo (Tabla 2) en un rango de 1.37 a 1.43, siendo la cepa B. subtilis quien manifestó el mayor valor. Hasta la fecha, se han descrito diversas especies bacterianas con la capacidad de solubilizar fósforo inorgánico insoluble (Corrales et al., 2014), pertenecientes a los géneros Pseudomonas, Bacillus, Rhizobium, Burkholderia, Achromobacter, Agrobacterium, Micrococcus, Aerobacter, Flavobacterium y Erwinia (Chen et al., 2006, p. 33; Paredes & Espinosa, 2010, p. 61). Lo anterior ha sido evidenciado por la capacidad de las cepas bacterianas para producir ácidos orgánicos, y la actividad de fitasas (mio-inositol hexakisfosfato fosfohidrolasas) para mineralizar fitatos (Idriss et al., 2002, p. 2097; Jorquera et al, 2008, p. 1025; Kumar et al., 2013, p. 1361; Richardson & Simpson, 2011, p. 989; Singh et al., 2014, p. 2981).
Por otra parte, distintos reportes han confirmado que la producción de sideróforos por cepas bacterias impacta significativamente la asimilación de varios metales, incluyendo Fe, Zn, y Cu para las plantas (Egamberdiyeva and Höflich, 2004, p. 293; Antoun, 2013, p. 353; Patel et al., 2018, p. 81); así como la supresión del crecimiento de organismos patógenos (Carrillo-Castañeda et al., 2005, p. 1853; Joseph et al., 2007, p. 141; Wahyudi et al., 2011, p. 34). B. megaterium TRQ8 fue la única cepa que mostró la capacidad de producir sideróforos (IP = 8.18), cuando se inoculó en el medio Agar CAS (de los Santos-Villalobos et al., 2012, p. 2615).
La función promotora del crecimiento vegetal de las cepas TRQ8, TRQ65, y TE3T fue estudiado por su inoculación en plantas de trigo. En comparación con el tratamiento control, la co-inoculación de las cepas TRQ65+TRQ8 presentó diferencia significativa (p<0.05) en todas las variables morfométricas analizadas en el cultivo, como lo indicaron estas variables: LA = 5.5%, LR = 10.5%, PSA = 60.7%, PSR = 82-3% e IB = 17.6% (Fig. 2). La co-inoculación de B. paralicheniformis TRQ65 y B. megaterium TRQ8 mostró un incremento en la longitud y peso seco de la planta de trigo, y en el índice de biovolumen, lo cual sugiere una movilización incrementada de nutrientes en la planta (Thilagar et al., 2018, p. 813). El comportamiento anteriormente descrito, fue observado por la inoculación en consorcio de las cepas TRQ8 y TRQ65; sin embargo, la inoculación de dichas cepas individualmente al cultivo de trigo no mostró diferencias significativas en comparación con las plantas no inoculadas, e incluso la inoculación de TRQ8 disminuyó en un 90% la longitud aérea, 65% el índice de biovolumen; mientras que la inoculación de TRQ65 redujo el peso seco aéreo y de raíz en un 3% y 30%, respectivamente.
Diversos estudios han evidenciado que las capacidades de las RPCV mejoran cuando son inoculadas en consorcio (Brenner et al., 2008, p. Por ejemplo, Dary et al. (2010, p. 323) y Malboobi et al. (2009, p. 1479) demostraron que la inoculación de consorcios binarios de RPCV como P. putida P13, P. agglomerans P5, Bradyrhizobium sp.750 y Pseudomonas sp. Az13, a plantas de Solanum tuberosum y Lupinus luteus, tienen a mayor promoción del crecimiento vegetal en variables como peso seco de raíz, peso seco aéreo, contenido de nitrógeno y rendimiento final en el caso de S. tuberosum, que una cepa individual; esto debido a que al combinar bacterias con distintas capacidades metabólicas ocurre un efecto sinérgico en la utilización simultanea de compuestos orgánicos, e inorgánicos que se encuentran en el suelo. Dicho efecto sinérgico fue observado en el presente estudio, donde por influencia de la inoculación del consorcio binario B. megaterium TRQ8 y B. paralicheniformis TRQ65, hubo incrementos significativos en todas las variables morfométricas analizadas (LA, LR, PSA, PSR e IB) con respecto al tratamiento control y a las cepas inoculadas individualmente.
La aplicación de consorcios bacterianos, específicamente binarios y ternarios del estudio mostró un impacto positivo en las variables analizadas a la planta, lo cual refuerza lo mencionado por Brenner et al. (2008) quienes mencionan que las poblaciones mixtas pueden realizar funciones que son difíciles e incluso imposibles para cepas individuales. El consorcio binario conformado por las cepas TRQ8 + TRQ65 mostró que sus características de promoción en conjunto pueden lograr un resultado deseado, en comparación con los resultados del consorcio de las 3 cepas bacterianas. El empleo de un consorcio microbiano ha demostrado que entre los involucrados tienen que equilibrar dos o más tareas para que se complementen eficientemente dentro de un sistema, y esto plantea en ocasiones desafíos insuperables, cuando se trata de la aplicación de 3 o más MOOS con características similares (Keller y Surette, 2006; Eiteman et al., 2008; Lynd et al., 2002; Brenner et al., 2008). Por ejemplo, durante la limitación de nutrientes una población minoritaria puede convertirse en la población más activa, si posee una actividad metabólica de la que depende la supervivencia de todo el consorcio (LaPara et al., 2002; Boopathy et al., 2015). Sin embargo, una gran cantidad de cepas o especies en un corsorcio no garantiza la supervivencia, ni el efecto promotor deseado.
Finalmente, con el presente estudio se concluye que las bacterias nativas del Valle del Yaqui, asociadas al cultivo de trigo, tienen la capacidad de promover el crecimiento de este cereal, en estadios tempranos de la planta. El efecto promotor del crecimiento vegetal por las cepas estudiadas se incrementó por su inoculación en consorcio (B. megaterium TRQ8 + Bacillus paralicheniformis TRQ65), a las plantas de trigo. Por lo cual, futuros estudios deben ser desarrollados para entender la ecología de dicho consorcio bacteriano, y la interacción con el sistema suelo-planta. Esto con el objetivo de incrementar el conocimiento sobre sus mecanismos de acción, y la regulación de éstos bajo las condiciones bióticas y abióticas de los agroecosistemas. Lo cual permitiría el uso de dichas cepas en campo, sin efectos adversos químico-biológicos al ambiente.











 nova página do texto(beta)
nova página do texto(beta)


