Introducción
Las zonas áridas, semiáridas y subhúmedas representan el 41% de la superficie del mundo, y albergan el 20% de la diversidad vegetal (Bran y Gaitán, 2012). México no es la excepción en este sentido, y este tipo de ecosistemas ocupan la mayor parte del territorio. Esto ha convertido a nuestro país en uno de los mayores centros de distribución de especies vegetales adaptadas a estas condiciones. La familia Asparagaceae agrupa a varios géneros de gran importancia, como Agave, Beaucarnea, Dasylirion, Nolina y Yucca, mismos que incluyen una gran cantidad de especies endémicas. Muchas de estas especies se encuentran bajo protección especial, amenazadas, o en peligro de extinción, debido a la sobreexplotación y destrucción de su hábitat (Eguiarte et al., 2013; Encina-Domínguez et al., 2013; Magallán-Hernández et al., 2014).
Por otro lado, estos grupos vegetales han sido aprovechados desde la época prehispánica debido a sus innumerables usos. Son fuente de alimentos, bebidas, fibras y materias primas para la elaboración de artesanías. Recientemente se les han encontrado usos no tradicionales, como la producción de compuestos químicos de alto valor, edulcorantes y biocombustibles, lo que le confiere más importancia a su conservación y uso racional (García et al., 2017). En este sentido, la propagación in vitro es una herramienta útil para la conservación de especies de estos grupos. Esta metodología consiste en la rápida multiplicación de plantas mediante el uso de medios de cultivo artificiales adicionados con reguladores de crecimiento en un ambiente controlado (fotoperiodo y temperatura), todo bajo condiciones axénicas.
La propagación in vitro permite también evaluar de una manera más sencilla y controlada la capacidad de respuesta de las plantas ante diversos factores de estrés, por ejemplo la presencia de metales pesados. Esto debido a que los mismos pueden ser incorporados al medio de cultivo en cantidades precisas con el fin de analizar la respuesta de la planta ante los mismos (Di Lonardo et al., 2011; Ashrafzadeh y Leung, 2015). De esta forma pueden estudiarse los diversos mecanismos de tolerancia a los metales tales como sistemas antioxidantes, unión de moléculas orgánicas con el metal, fitoestabilización, exclusión y acumulación (Srivastava, 2016; Sruthi et al., 2017).
De acuerdo con el mecanismo de tolerancia que posean, las plantas pueden clasificarse en las siguientes categorías: a) Bioacumuladoras. También conocidas como hiperacumuladoras. Toman el metal a través de la raíz y lo translocan a la parte aérea en donde se acumula y alcanza concentraciones mayores a las del suelo, esto sin mostrar síntomas de toxicidad. Estas plantas pueden ser usadas para la biorremediación ya que pueden remover los metales del suelo. b) Fitoestabilizadoras. Estas plantas toman y acumulan el metal en la raíz, pero sin translocarlo a la parte aérea. Este mecanismo también es útil para la biorremediación ya que fija los metales pesados impidiendo su lixiviación y posterior llegada a los cuerpos de agua (Memon et al., 2001; Lu et al., 2017). c) Exclusoras. No permiten la entrada de los metales a la raíz, esto a través de la excreción de compuestos orgánicos que forman complejos con los metales en el suelo. d) Indicadoras. Permiten el paso del metal a través de la raíz y su llegada a la parte aérea, alcanzando concentraciones en sus tejidos similares a las presentes en el suelo. Suelen presentar síntomas visibles que son proporcionales a la cantidad de metal presente en el suelo (Baker and Brook 1989; Tosié et al., 2016).
Existe elevada vulnerabilidad en los ecosistemas de zonas áridas a las actividades mineras, mismas que contaminan el suelo con metales pesados afectando su potencial ecológico y biológico, llegando a la degradación y posteriormente a la pérdida del suelo (Alipur et al., 2016; Hu et al., 2018). El Agave americana tiene mecanismos de exclusión para Cr debido a que se acumula principalmente en las raíces por lo que tiene un enorme potencial de fitoestabilización de Cr (Ramana et al., 2016). Los Agaves, y otros géneros relacionados, son elementos clave para la estructura y funcionamiento de los ecosistemas de las zonas áridas y semiáridas, por lo que es importante conocer su respuesta ante la presencia de metales pesados en el suelo. El contar con plantas de zonas áridas y semiáridas tolerantes a metales permitiría utilizar estas especies para procesos de rehabilitación de áreas contaminadas (Solanki y Dhankhar, 2011). El objetivo de este estudio fue analizar la susceptibilidad de especies de la familia Asparagaceae tolerantes a la baja disponibilidad de agua ante los metales pesados Cd, Cu, Cr, Fe, Mn, Pb y Zn en condiciones in vitro.
Materiales y Métodos
Material vegetal
Se seleccionaron 20 especies de la familia Asparagaceae de talla mediana y grande, que pudieran ser usadas en la restauración de ecosistemas contaminados por metales pesados. Los tejidos se tomaron del Banco de Germoplasma in vitro de la Unidad de Biotecnología Vegetal de la Universidad Autónoma de Aguascalientes (UAA), México. Las especies seleccionadas fueron: Agave bracteosa S. Watson ex Engelm, A. celsii Hook., A. chiapensis Jacobi, A. difformis A. Berger, A. funkiana K. Koch & C. D. Bouché, A. obscura Schiede ex Schltdl., A. palmeri Engelm, A. peacockii Croucher, A. potatorum Zucc., A. victoria-reginae T. Moore, A. salmiana Otto ex Salm-Dyck, A. titanota Gentry, Beaucarnea goldmanii Rose, B. recurvata Lem., Dasylirion acrotriche (Shiede) Zucc., D. glaucophyllum Hook., Nolina durangensis Trel.,Yucca carnerosana (Trel.) Mckelvey, Y. filamentosa L. y Y. filifera Chabaud.
Propagación in vitro del material vegetal
Se usaron plántulas generadas in vitro, de las cuales se eliminó la parte apical de las hojas para obtener un explante basal. Se colocaron cuatro explantes en frascos de 250 mL, conteniendo 50 mL de medio Murashige y Skoog, (MS) (1962), pH de 5.7 con 3% (w/v) de sacarosa y 8 g L-1 de agar como gelificante. Se adicionaron 2 mg L-1 de benciladenina (BA) para los géneros Agave y Yucca, para el resto de las especies se usó el mismo medio pero adicionados con 2.5 mg L-1 de BA. Los cultivos se mantuvieron a 25 ± 2 °C, con fotoperiodo de 18/6. A los tres meses se cuantificó el número de brotes generados y su longitud, con una n=16 (explantes). Los brotes generados se utilizaron en las fases posteriores del estudio.
Enraizamiento de brotes in vitro y análisis de la susceptibilidad a los metales pesados
Los brotes obtenidos en la etapa de propagación se transfirieron a medio MS sin metales (control) o en medio MS conteniendo metales pesados para su enraizamiento. Las concentraciones de metales seleccionados fueron a) 0.005 mM de CdCl2; b) 0.2 mM de CuSO4·5H20; c) 1 mM de KCr2O7; d) 1 mM de FeSO4·7H2O; e) 0.4 mM de Pb(NO3)2; f) 1.6 mM de MnSO4·H2O y g) 0.48 mM de ZnSO4·7H2O, todas las sales presentaban 99% de pureza, de grado de reactivo y marca SIGMA. Las concentraciones de metales a probar se seleccionaron de acuerdo a lo reportado en la literatura (Gatti, 2008; Ayari et al., 2010; Perveen y Anis, 2012; Wiszniewska et al., 2017). Se incluyeron tres brotes por tratamiento con tres réplicas. Los brotes se mantuvieron a 25 ± 2 °C, con fotoperiodo de 18/6. Después de dos meses de iniciado el experimento se registraron los datos de supervivencia y enraizamiento de los brotes. Posteriormente, las plántulas que sobrevivieron y generaron raíz se sacaron del recipiente de cultivo y las raíces se lavaron cuidadosamente para eliminar restos de medio. Las plántulas fueron fotografiadas con una cámara SONY® de 20.1 megapixeles y las fotografías fueron analizadas con el procesador de imágenes Imagen Java 1.46 , que determina la posición de puntos específicos por lo que se puede calcular el área de las raíces desarrolladas para conocer el efecto de los metales. Los datos antes descritos se analizaron con un ANOVA, n=9 y prueba de Dunnet (P≤0.05) usando el paquete estadístico GraphPad Prism 7.09.
Cuantificación de metales pesados
Se seleccionaron sólo las especies que desarrollaron raíz en todos los tratamientos con metales pesados. Las plantas generadas in vitro se dividieron en parte aérea y raíz, que se liofilizaron (liofilizador Freezone® 4.5 Labconco). Las muestras se homogenizaron con el equipo TissueLyser II QIA GEN® y se digirieron por 24 horas con ácido nítrico (HNO3) aforando a un volumen de 30 mL. La cuantificación de metales pesados se realizó por absorción atómica (espectrofotómetro PerkinElmer, Atomic Absorption Spectrometer, PineAACLE900H). Para evaluar la exactitud de la medición se incluyó un blanco (mezcla sin muestra); un estándar (metal conocido); un fortificado (metal conocido + muestra); no fortificado (muestra); duplicado uno (muestra); y duplicado dos (muestra), con una n=3. El factor de translocación (TF) se calculó dividiendo la concentración del metal de la parte aérea entre la concentración del metal de la raíz y el factor de bioacumulación (BAC) se calculó dividiendo la concentración del metal en el tejido (parte aérea) entre la concentración del metal en el medio de cultivo (Chang-Kee et al., 2018).
Resultados
Propagación in vitro del material vegetal
Todas las especies generaron brotes de 2 a 8 cm de longitud después de los 3 meses de cultivo. B. recurvata fue la especie que generó el mayor número de brotes con 5.7 brotes en promedio por explante, seguido por N. durangensis con 5.6 brotes, D. glaucophyllum y Agave obscura con 4.4 brotes (Fig. 1). Las especies que generaron el menor número de brotes fueron A. palmeri, A. peacockii y A. difformis con 2 brotes por explante. En la Fig. 1 se muestra el aspecto los brotes generados.
Enraizamiento de brotes in vitro y análisis de la susceptibilidad a los metales pesados
La supervivencia de las especies evaluadas durante el enraizamiento es un indicador directo de su sensibilidad ante el tóxico (susceptibilidad). La supervivencia de las especies estudiadas fue alta, oscilando entre 80 y 95%. La supervivencia fue mayor en el medio con Mn, y disminuyó en el siguiente orden: Cu > Zn> Cd >Fe> Pb >Cr. El tratamiento con cromo generó los porcentajes más bajos de supervivencia de las especies analizadas (Cuadro 1).
Cuadro 1 Supervivencia de las especies evaluadas expuestas a metales pesados en la etapa de enraizamiento.
| Familia Asparagaceae |
Control (%) |
Cd (%) |
Cu (%) |
Cr (%) |
Fe (%) |
Mn (%) |
Pb (%) |
Zn (%) |
|---|---|---|---|---|---|---|---|---|
| 1. A. bracteosa | 93.3 ± 0.6 | 96.7 ± 2.1 | 93 ± 5.2 | 78.3 ± 16.1 | 96 ± 5.2 | 60 ± 24* | 79 ± 13.5 | 77.7 ± 13.7 |
| 2. A. celsii | 100 ± 0 | 97.7 ± 2.3 | 99.3 ± 0.6 | 60.3 ± 35.4* | 97.7 ± 1.5 | 96.3 ± 5.5 | 97.7 ± 1.5 | 97.7 ± 1.5 |
| 3. A. chiapensis | 99.3 ± 0.6 | 98.3 ± 0.6 | 90.7 ±1.2 | 66.3 ± 3.5* | 98 ± 1.7 | 95 ± 1.7 | 96.7 ± 2 | 97 ± 1.7 |
| 4. A. difformis | 100 ± 0 | 97.3 ± 1.5 | 93.3 ± 5.8 | 70 ± 10* | 97.3 ± 2.1 | 96 ± 3 | 99.3 ± 0..6 | 96.9 ± 1.6 |
| 5. A. funkiana | 99 ± 0 | 97 ± 1.7 | 94 ± 1.7 | 36.3 ± 15* | 92 ± 3.5 | 98.3 ± 1.2 | 89.7 ± 3.5 | 97.7 ± 0.6 |
| 6. A. obscura | 100 ± 0 | 98.3 ± 0.6 | 96 ± 5.3 | 85 ± 6.2 | 90.7 ±1.2 | 98.7 ± 1.3 | 88 ± 19 | 97 ± 1.7 |
| 7. A. palmeri | 100 ± 0 | 97.3 ± 1.2 | 96.3 ± 5.5 | 82.7 ± 4.6* | 98.7 ± 0.6 | 97 ± 2 | 82.7 ± 4.6* | 93 ± 5.2 |
| 8. A. peacockii | 100 ± 0 | 97.7 ± 1.5 | 99.3 ± 0.6 | 73 ± 3* | 98.3 ± 0.6 | 98.7 ± 0.6 | 94.7 ± 4.5 | 97 ± 1.7 |
| 9. A. potatorum | 98.3 ± 2.1 | 98.3 ± 0.6 | 92 ± 10.6 | 50 ± 5* | 97.7 ± 1.5 | 99 ± 1 | 99.3 ± 0.6 | 93.7 ± 9.2 |
| 10. A. victoria-reginae | 100 ± 0 | 96 ± 1.7 | 97.7 ± 1.5 | 65 ± 8.5* | 98.3 ± 1.2 | 99.3 ± 0.6 | 98.7 ± 0.6 | 97.7 ± 1.5 |
| 11. A. salmiana | 100 ± 0 | 99.7 ± 0.6 | 96.3 ± 5.5 | 89 ± 9.5* | 97 ± 2 | 99.3 ± 0.6 | 98 ± 1 | 97.3 ± 1.2 |
| 12. A. titanota | 100 ± 0 | 96.3 ± 1.5 | 82.7 ± 4.6* | 62.7 ± 3.1* | 97.7 ± 2.3 | 98 ± 1.7 | 97.7 ± 1.2 | 95 ± 4.6 |
| 13. B. goldmanii | 99.3 ± 0.6 | 58.7 ±12.5* | 88.7 ± 2.3 | 31.7 ± 15.3* | 66.3 ± 29.7 | 97 ± 1.7 | 78.3 ± 20.2 | 95 ± 1.7 |
| 14. B. recurvata | 99.3 ± 0.6 | 60.7 ± 17.5* | 90.7 ± 1.2 | 34.3 ± 24.9* | 38.7 ± 13* | 83.3 ± 5.8 | 71.7 ± 7.6 | 88.3 ± 4 |
| 15. D. acrotriche | 98 ± 1.7 | 71.7 ± 9.8 | 72 ± 7.2 | 17.7 ± 6.8* | 76.3 ± 20.3 | 98 ± 1.7 | 43.3 ± 26.3* | 97 ± 1.7 |
| 16. D. glaucophyllum | 99.7 ± 0.6 | 78 ± 36.4 | 79.3 ± 3.1 | 5 ± 5* | 41 ± 21.5* | 93 ± 3 | 66.3 ± 16.5 | 96 ± 3 |
| 17. N. durangensis | 98 ± 1.7 | 47 ± 21.7* | 95.7 ± 3.1 | 16.7 ± 12.6* | 30.3 ± 8.4* | 90.7 ± 5 | 36.3 ±12.3* | 66 ± 18.7 |
| 18. Y. carnerosana | 95.7 ± 3.5 | 82 ± 13.9 | 76.7 ±17.9 | 16.7 ± 7.7* | 91 ± 1.7 | 89.7 ± 3.5 | 88.7 ± 2.3 | 55 ± 19.5* |
| 19.Y. filamentosa | 94 ± 1.7 | 84 ± 10.4 | 76.7 ± 3.1 | 35 ± 5* | 63.3 ±15.3 | 88 ± 7.2 | 42 ± 13.1* | 78.3 ± 3 |
| 20. Y. filifera | 97 ± 3.4 | 95 ± 1.7 | 60 ± 14.6 | 17.3 ± 6.8* | 91 ± 1.7 | 89.7 ±1.5 | 27.3 ± 15* | 44.7 ± 12.3* |
Media ± Desviación estándar n=9. Prueba Dunnet (P ≤ 0.05). * Indica diferencia significativa.
En cuanto al efecto de los metales en el desarrollo del sistema radical, esto medido como área del mismo, se tuvieron estos resultados. Las siguientes especies presentaron mayor área radicular en los tratamientos con metales: en Cu A. bracteosa y A. difformis; en Fe A. bracteosa, A. chiapensis, A. difformis y N. durangensis; en Mn A. obscura, A. palmeri, D. glaucophyllum y N. durangensis; y en Zn A. bracteosa, A. difformis, A. palmeri, D. glaucophyllum y N. durangensis. Las especies que no desarrollaron raíz fueron en Cu A. funkiana, A. potatorum, A. victoria-reginae y B. recurvata; en Fe A. peacockii, B. recurvata, D. glaucophyllum, Y. carnerosana y Y. filamentosa; en Mn, B. recurvata, D. acrotriche y Y. carnerosana y en Zn B. recurvata (Fig. 2).
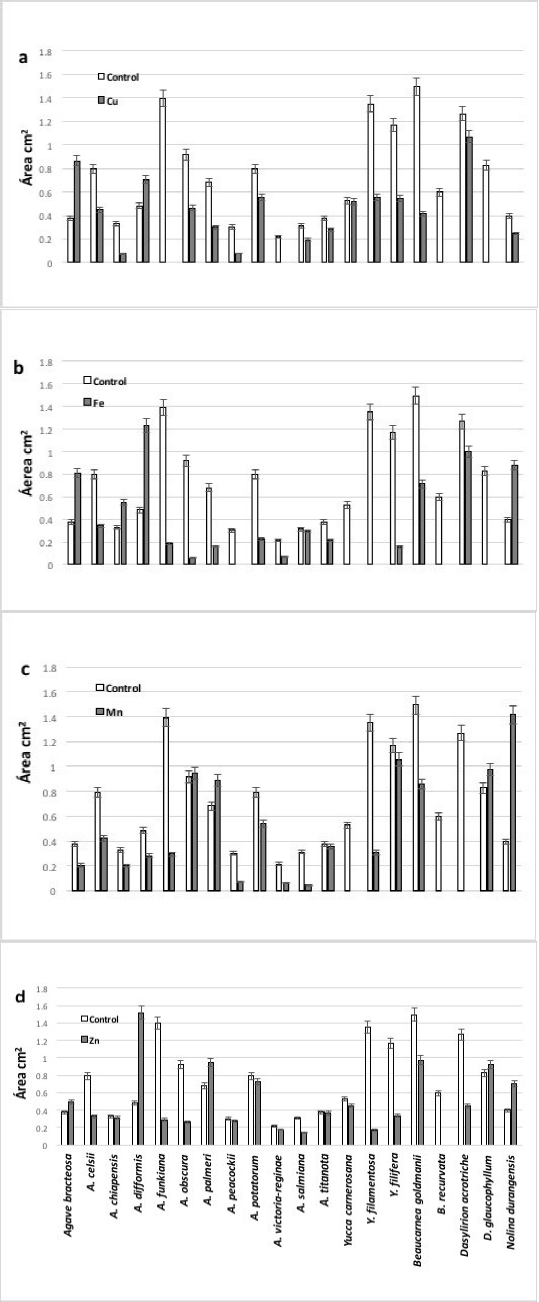
Fig. 2 Efecto de los metales en el desarrollo de las raíces de las especies analizadas en los tratamientos con a) Cu+2; b) Fe+2; c) Mn+2; d) Zn+2.
Las especies que presentaron mayor área radicular en el tratamiento con Cd fueron: A. difformis y en Pb A. difformis y N. durangensis. En el tratamiento con cromo solo cinco especies formaron raíz: A. celsii, A. chiapensis, A. obscura, A. palmeri y A. salmiana. Las especies que no formaron raíz en Cd fueron: A. bracteosa, A. titanota y Y. filamentosa y en el tratamiento con plomo B. recurvata y Y. carnerosana (Fig. 3).
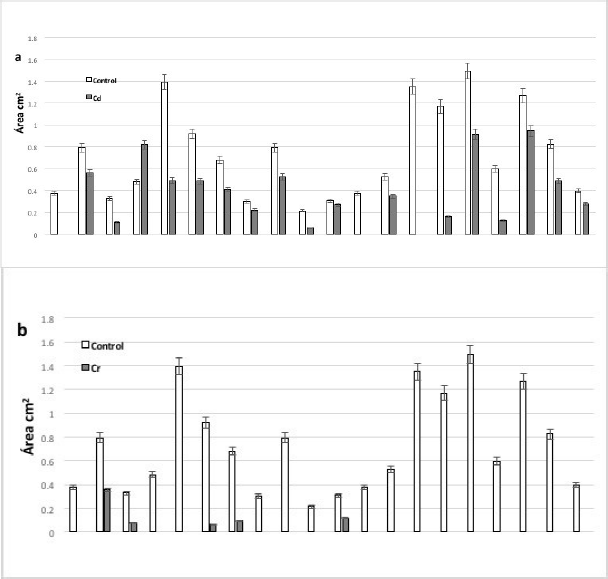
Fig. 3 Efecto de los metales en el desarrollo de las raíces de las especies analizadas en los tratamientos con a) Cd+2; b) Cr+2; c) Pb+2.
La especie A. palmeri presentó menor biomasa de la parte aérea en el tratamiento con cromo; se observa una raíz más gruesa y menos abundante en comparación con el control. En el tratamiento con plomo se observa una menor longitud de las raíces en comparación con el resto de las especies (Fig. 4).
Cuantificación de metales pesados
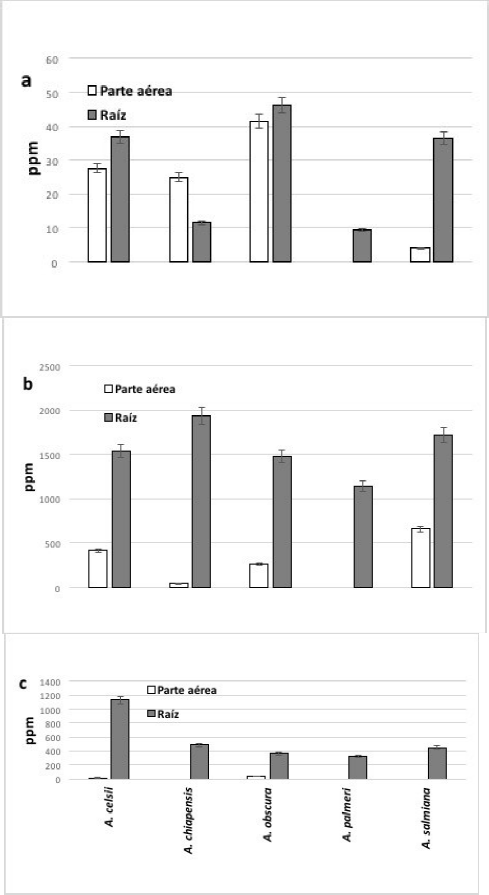
Para estos experimentos se eligieron las especies que sobrevivieron y formaron raíz en todos los tratamientos, que fueron A. celsii, A. chiapensis, A. obscura, A. palmeri y A. salmiana. En las plantas control no se detectaron los metales. Las especies expuestas a Cu, Cr, Fe, Pb y Zn acumularon el metal principalmente en raíz (Figs. 5 y 6), en tanto que el Mn se acumuló mayormente en la parte aérea de A. celsii, A. obscura y A. salmiana.
En el caso del Cd, algunas especies como A. celsii y A. obscura acumularon el metal tanto en raíz como en la parte aérea. A. chiapensis acumuló más metal en las hojas y A. obscura más en las raíces. La especie A. palmeri acumuló Cd, Cr y Pb en las raíces por lo que podría tener un uso potencial en restauración de sitios contaminados por estos metales.
Para determinar la eficiencia de acumulación se calcularon los valores de TF y BAC. Los valores de TF fueron muy bajos para las cinco especies en el tratamiento con cobre y fierro. Por otro lado, los BAC fueron mayores oscilando entre 2.17 y 11.7, las especies evaluadas con estos metales correspondieron a fitoestabilizadoras. Para el metal manganeso A. chiapensis, A. osbcura y A. palmeri presentaron valores de TF mayores a 1 se clasificaron como hiperacumuladoras y A. celsii como indicadora. En zinc, A. osbcura se clasificó como hiperacumuladora y el resto como fitoestabilizadoras (Cuadro 2).
Cuadro 2 Media del Factor de Translocación (TF) y Factor de Bioacumulación (BAC) para Cu, Fe, Mn y Zn, en cinco especies clasificadas como: Fitoestabilizadora (F); Hiperacumuladora (H); o Indicadora(I).
| Especie / Metal |
Cu | Fe | Mn | Zn | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| TF | BAC | C | TF | BAC | C | TF | BAC | C | TF | BAC | C | |
| A. celsii | 0.04 | 3.31 | F | 0.45 | 3.47 | F | 0.97 | 38.78 | I | 0.51 | 70.52 | F |
| A. chiapensis | 0.02 | 1.55 | F | 0.07 | 1.35 | F | 2.53 | 34.81 | H | 0.62 | 66.44 | F |
| A. obscura | 0.27 | 11.73 | F | 0.21 | 8.22 | F | 1.11 | 31.55 | H | 1.06 | 53.57 | H |
| A. palmeri | 0.05 | 8.97 | F | 0.19 | 5.54 | F | 1.47 | 20.13 | H | 0.82 | 36.66 | F |
| A. salmiana | 0.08 | 5.13 | F | 0.25 | 2.17 | F | 0.80 | 31.60 | F | 0.44 | 40.03 | F |
En Cd la especie A. chiapensis fue hiperacumuladora, A. palmeri exclusora y A. celsii, A. osbcura y A. salmiana fitoestabilizadoras. En cromo, A. chiapensis y A. palmeri exclusoras. En plomo los valores de TF y BAC fueron muy bajos, las cincos especies se clasificaron como exclusoras (Cuadro 3).
Cuadro 3 Media del Factor de Translocación (TF) y Factor de Bioacumulación (BAC) para Cd, Cr y Pb, en cinco especies clasificadas como: Fitoestabilizadora (F); Hiperacumuladora (H); o Exclusora (E).
| Especie / Metal | Cd | Cr | Pb | ||||||
|---|---|---|---|---|---|---|---|---|---|
| TF | BAC | C | TF | BAC | C | TF | BAC | C | |
| A. celsii | 0.75 | 55.3 | F | 0.27 | 4.04 | F | 0.01 | 0.19 | E |
| A. chiapensis | 2.15 | 49.86 | H | 0.02 | 0.42 | E | 0 | 0 | E |
| A. obscura | 0.89 | 82.78 | F | 0.18 | 2.55 | F | 0.10 | 0.44 | E |
| A. palmeri | 0 | 0 | E | 0 | 0 | E | 0 | 0 | E |
| A. salmiana | 0.11 | 8 | F | 0.38 | 6.40 | F | 0 | 0 | E |
Las especies hiperacumuladoras en Mn, Zn y Cd se pueden usar para remediar zonas contaminadas. Las especies A. celsii, A. obscura, A. palmeri y A. salmiana clasificadas como fitoestabilizadoras y exclusoras se pueden usar para la restauración. Las especies evaluadas se pueden usar para diferentes fines, debido a su capacidad de absorber metales en diferentes niveles.
Discusión
Los sistemas de propagación in vitro han mostrado su eficiencia en varias especies de la familia Asparagaceae. En este trabajo, se utilizaron protocolos previamente desarrollados para especies de Agave (Domínguez et al., 2008), Yucca (López-Ramírez et al., 2018) y Beaucarnea, Dasylirion y Nolina (Reyes-Silva et al., 2013). Los resultados obtenidos en cuanto a la eficiencia de estos sistemas fueron similares a lo reportado en los trabajos mencionados. Se partió de tejidos ya establecidos in vitro y conservados en un banco de germoplasma, por lo que no fue necesaria la colecta de material vegetal en campo ni el establecimiento in vitro del mismo.
Los metales analizados en este estudio pueden ser divididos en dos categorías. Cu, Fe, Mn y Zn que son considerados micronutrientes, ya que tienen un papel en la bioquímica de la planta. Ésta cuenta con mecanismos para tomarlos del suelo y sólo son tóxicos cuando se encuentran en concentraciones muy elevadas. Estos metales forman parte del medio de cultivo usado en este trabajo. Por otro lado, Cd, Cr y Pb no son micronutrientes y no son necesarios para la planta. Su presencia en el suelo suele ser tóxica, aun en bajas concentraciones. En este estudio el metal que resultó más tóxico para las especies analizadas fue el Cr. Este metal disminuye la actividad enzimática, produce daños a nivel membrana, clorosis, y daño a nivel de la raíz (Beltrán y Gómez, 2015). Los metales en tejidos vegetales ocasionan trastornos histológicos, inhiben el crecimiento y afectan la fotosíntesis, incluso en concentraciones subletales (Ouyang et al., 2012; Peláez et al., 2014). La raíz es el órgano principal que retiene metales pesados debido a la adsorción y a la quelación mediante fitoquelatinas y compartimientos vacuolares (Du et al., 2018). El Cr entra en las raíces por reducción y complejación con exudados de la raíz que mejoran la solubilidad y la movilidad a través del xilema, su acumulación es principalmente en raíces y muy baja en brotes (Singh et al., 2016). Las plantas inmovilizan los metales en las raíces lo que reduce la biodisponibilidad del metal a entrar en la cadena alimenticia. D. maritima L., es una especie que pertenece a la familia Asparagaceae y tiene uso potencial en fitoextracción de Cd, Cu, Cr y Zn (Fait et al., 2018). Existen plantas que son tolerantes y se pueden desarrollar ante la presencia de Cr. Ramana et al. (2016) estudiaron A. americana ante la presencia de Cr en suelo y concluyeron que él metal se acumuló principalmente en las raíces, lo que demuestra su potencial de fitoestabilizar al contaminante. La especie Paspalum conjugatum acumuló uniformemente al cromo en todas sus partes (raíz, tallo, hojas, flores), Echinochloa colona, Cyperus odoratus y Digitaria sanguinalis fueron acumuladoras de Cd, Cu, Cr y Zn (Mendieta y Taisigüe, 2014).
La concentración de los metales en la parte aérea y raíz fue significativamente diferente entre las especies evaluadas. La habilidad de translocar el metal desde las raíces a la parte aérea se evalúa por el TF. El BAC se define como la relación del contenido del metal en la parte aérea y medio de cultivo con el metal. Valores muy bajos de TF y BAC quieren decir que el mecanismo de la planta es de exclusión (Fu et al., 2019). Las plantas que son resistentes a la sequía pueden tolerar contaminantes como los metales pesados, dependiendo del grado y de la absorción del metal en parte aérea o raíz, las plantas se pueden clasificar en hiperacumuladoras, fitoestabilizaoras, exclusoras o indicadoras, es importante identificar especies que estabilicen los metales pesados en la raíz, evitando así, su exposición a la cadena alimenticia, en este caso serían las fitoestabilizadoras (Nirola et al., 2016). Cuando las plantas tienen mecanismos que controlan la translocación del metal desde la raíz hasta la parte aérea acumulándolo a una concentración similar a la expuesta, se considera indicadora (Srivastava et al., 2016). Generalmente metales como Cd, Cr y Pb se acumulan fundamentalmente en raíces y metales como Cu, Fe, Mn y Zn en la parte aérea de las plantas (Fernández et al., 2018). El cadmio fue estudiado en Agave lechuguilla y los resultados arrojaron que reduce las células del parénquima, causa estrés oxidativo, interfiere en la vascularización, daños funcionales, senescencia celular y clorosis. El Cd ingresa a las plantas a través de una vía simplástica y llega al xilema (Méndez-Hurtado et al., 2013).
El cultivo in vitro es una herramienta fundamental para entender las relaciones planta-contaminante ya que puede predecir la respuesta de las plantas al medioambiente y también sirve para desarrollar protocolos para plantas con elevada capacidad de fitorremediación (Couselo et al., 2010; Morales-Rubio et al., 2016). El conocimiento y análisis de las plantas ante la presencia de metales pesados sirve para elegir aquellas plantas que acumulan el metal en la parte de la raíz y que tengan alta biomasa para tener mayor impacto en la restauración de suelos contaminados. Existen diferentes tipos de modelos de restauración, dependiendo del agente, el tipo y el nivel de degradación (Navarro et al., 2017).
Los sistemas de propagación in vitro son eficientes para conocer la respuesta de las especies vegetales ante los factores ambientales adversos, debido a que es más fácil realizar y controlar las pruebas de los bioensayos in vitro, a través de esta herramienta fue posible conocer la respuesta de las plantas ante los metales. Las especies A. celsii, A. chiapensis, A. obscura, A. palmeri y A. salmiana se desarrollaron en presencia de Cd, Cu, Cr, Fe, Mn, Pb y Zn; estas especies tolerantes a los metales, pertenecen al género Agave, debido a esta característica se recomienda su uso para la restauración de áreas contaminadas con metales pesados y con poca disponibilidad de agua. Las plantas poseen diversos mecanismos celulares, lo cual permite aumentar la tolerancia ante los metales pesados. Identificar la capacidad de las plantas para transferir metales servirá para elaborar guías de fitoremediación y restauración.











 nueva página del texto (beta)
nueva página del texto (beta)