Introducción
El nopal (Opuntia ficus-indica) pertenece a la familia de las Cactaceae y es una de las especies más cultivadas y estudiadas en México. El fruto es carnoso y varía en forma, tamaño y color, dependiendo de la variedad. Los frutos rojos son una fuente importante de compuestos bioactivos como vitamina C, vitamina E, polifenoles y pigmentos betalaínicos (Alba-Jiménez et al., 2014); además contienen una amplia cantidad de carbohidratos y baja acidez, lo que le proporciona sabor dulce y agradable; además presenta altos niveles de calcio, magnesio y algunos aminoácidos (prolina, glutamina y taurina) (Piga 2004, 9). No obstante, es un fruto perecedero, con vida de anaquel entre 9 a 15 días a temperatura ambiente, lo cual dificulta su almacenamiento y comercialización. Además, la presencia de espinas en su pericarpio limita su consumo, lo cual provoca una saturación en el mercado durante el pico de temporada de cosecha, ocasionando pérdidas del producto, por lo tanto, es necesario buscar alternativas de consumo como PMP.
Las frutas y hortalizas mínimamente procesadas son productos frescos listos para consumo que han sido sometidas a condiciones de lavado, sanitizado, pelado, rebanado y/o cortado manteniendo sus características de producto fresco (Moretti, 2007, 27; Del Nobile et al., 2009, 356). Estos productos son más perecederos que los intactos, especialmente cuando el producto además ser pelado es cortado, debido a que el daño ocasionado al tejido es mayor e incrementa rápidamente la velocidad de respiración, producción de etileno, reacciones bioquímicas como el oscurecimiento del tejido, que afectan su calidad, seguridad y vida poscosecha (Portela y Cantwell, 1998, 351). Algunas estrategias para reducir estos cambios son el almacenamiento a bajas temperaturas (5 ºC) y la aplicación de AC (Artés, 2006, 62; Gil et al., 2006, 4284). Añorve et al. (2006, 1000), reportaron en tuna variedad ‘Cristalina’ sin cáscara y almacenada en AC de 10% CO2 por 20 días a 2 ºC, mejor CV, SST y azúcares, así como disminución en el oscurecimiento del tejido. Sin embargo, no hay evidencias en tuna roja mínimente procesada y los pocos estudios que existen únicamente se han reportado en tuna de color verde.
Por lo tanto, el objetivo de este estudio fue evaluar los cambios en las características fisicoquímicas y de calidad visual que ocurren durante el almacenamiento en refrigeración bajo atmósferas controladas de tuna roja mínimamente procesada, para extender su vida poscosecha y pueda ser aprovechada como fuente importante de compuestos bioactivos.
Método
Especie de estudio
Frutos de tuna (Opuntia ficus-indica (L.) Mill. var. Rojo San Martín) fueron cosechados en el municipio General Felipe Ángeles, Puebla, México que se ubica a 19° 01ʹ 10.60ʺ N; 97° 42ʹ 43.28ʺ O y una altitud de 2,300 msnm. Se seleccionaron frutos de color y tamaño homogéneo, y se sanitizaron con una solución de hipoclorito de sodio (100 mg L-1 × 60 s).
Aplicación de tratamientos
La cáscara se eliminó de forma manual y de la parte central se obtuvieron rodajas de 1.5 cm de ancho × 4 cm de diámetro. Cuatro rodajas fueron colocadas en canastillas de plástico e introducidas en recipientes de vidrio de 20 L, posteriormente éstos fueron almacenados en una cámara de refrigeración a una temperatura de 5 ºC. A cada recipiente se le hizo pasar un flujo de gas humidificado (HR≈95-98%) con los siguientes tratamientos de AC: AC1: 5% O2 + 95% N2, AC2: Aire + 10% CO2, AC3: 10% CO2 + 5% O2 + 85% N2 y aire como control. Las AC se obtuvieron mediante una mezcla de gases de nitrógeno (N2), oxígeno (O2) y dioxido de carbono (CO2) (el N2 se utilizó para completar el volumen al 100 %). Las concentraciones de O2 y CO2 fueron registradas diariamente con un analizador de gases (PBI Dansensor, Checkpoint, Dinamarca) para asegurar que las proporciones de gas se mantuvieran constantes. Las rodajas de tuna fueron almacenadas durante 16 días y cada cuatro días se utilizaron muestras por triplicado por cada tratamiento, se obtuvieron 5 g de tejido, se homogenizó y centrifugó (Hettich zentrifuge, Universal 32R, Alemania) a 4000 × g por 20 min (Aquino-Bolaños y Mercado-Silva, 2004, 277). El sobrenadante fue utilizado para medir los atributos de calidad AT, SST y pH. Además se evaluó la enzima PFO, el porcentaje de PFP y CV.
Atributos de calidad
Los AT se cuantificaron por el método descrito por Aquino-Bolaños et al. (2013, 350). A 100 µL de la muestra, previamente diluida (1:200), se agregaron 900 µL de agua destilada y se mezcló con 100 µL de fenol al 80% (v/v) y 5 mL de H2SO4 concentrado. La mezcla se incubó a 30 °C durante 20 minutos y posteriormente se midió la absorbancia a 490 nm en un espectrofotómetro (JENWAY, 6305, Reino Unido). El contenido de azúcares se reportó como mg de glucosa mL-1. Los SST se midieron con un refractómetro digital (ATAGO, PR-32, Japón) a temperatura de 20 °C y los resultados se reportaron como °Brix (método 932.12 de la AOAC, 2005). El pH se determinó directamente en el jugo utilizando un potenciómetro digital (OAKTON, 510, Malasia), previamente calibrado con amortiguadores de pH 7 y 4. La actividad de la enzima PFO fue evaluada en 5 g de tejido fresco homogenizado con 0.6 g de polivinilpolipirrolidona (PVPP) y 30 mL de amortiguador de fosfatos (50 mM, pH 7), posteriormente se centrifugó (Hettich zentrifuge, Universal 32R, Alemania) a 4000 × g durante 15 min a 4 °C y el sobrenadante fue usado para la determinación de PFO. El catecol (60 mM) se utilizó como sustrato y se midió la absorbancia a 420 nm en un espectrofotómetro (JENWAY, 6305, Reino Unido). La actividad se expresó en unidades de actividad (UA); siendo una unidad de actividad de PFO el cambio de 0.1 unidades de absorbancia por minuto (Aquino-Bolaños y Mercado-Silva, 2004, 277). La PFP se reportó como porcentaje de pérdidas acumuladas respecto al peso inicial del fruto en una balanza digital (Ohaus Scout Pro 400 g x 0.01 g) (Ochoa y Guerrero, 2012, 117). La CV fue evaluada mediante una escala de 9 puntos, donde: 9 = excelente, libre de defectos; 7 = buena, defectos menores; 5 = regular, ligeros defectos; 3 = pobre, defectos excesivos; 1 = rechazado. Una calificación de 5 fue considerada como el límite de comercialización (Alba, 2013, 31).
Análisis estadístico
Se utilizó un Modelo Lineal Generalizado (GLM), con un diseño multivariado (MANOVA) para dos factores y su respectiva interacción. El primer factor fue el tratamiento (composición de la atmósfera controlada) con tres niveles y un grupo control, y el segundo factor fue el tiempo con cinco niveles. La medición de las variables de respuesta a las unidades experimentales fue independiente en el tiempo. Además, los datos fueron transformados a logaritmo base 10 para cumplir con los supuestos de normalidad y homogeneidad de varianzas. Posterior al análisis se realizó la conversión de los valores promedio e intervalos de confianza a su escala original (Zar, 1996, 202). También se realizó un Análisis de CP a las todas las variables fisicoquímicas de la tuna considerando solo el registro de los los tratamientos al día 16, además se obtuvieron los puntajes factoriales “factor score” de los CP los cuales fueron analizados con un ANOVA unifactorial. Todos los análisis fueron procesados en el software Statistica 7.0 (StatSoft, Inc. 1984-2004) y se verificaron que los suspuestos homogenidad de varianzas y distribución de error normal se cumplirán en las variables de respuesta, además se realizaron las compraciones múltiples por el método de Tukey y en nivel de significancia fue de α 0.05 para todos los análisis.
Resultados
Las variables de respuesta cuantificadas en las rodajas de Opuntia indicaron diferencias asociadas al diseño bifactorial multivariado, debido a que el factor tratamiento aportó contraste significativo (λ Wilks = 0.097, P<0.0001), así como también el tiempo indicó diferencias (λ Wilks = 0.003, P<0.0001); la interacción entre tratamiento × tiempo tuvo efecto sobre las variables dependientes (λ Wilks = 0.03, P<0.0001). Posterior al MANOVA se realizaron los ajustes univariados para cada variable de respuesta con su respectivo diseño bifactorial.
La concentración promedio de azúcares no presentó cambios entre los tratamientos como factor fijo del análisis (F=1.6, P=0.2), pero se registraron diferencias entre los días de almacenamiento (F=15, P<0.00001), por lo que la contribución aditiva de los factores tratamiento × tiempo es el componente que aporta contraste entre los valores promedio de los tratamientos del almacenamiento de tunas en las distintas condiciones de AC en los diferentes días de almacenamiento (F=2.3, P=0.02). Durante el almacenamiento se observó pérdida de concentración de azúcares (inicial= 186.61 mg glucosa mL-1), la mayor reducción en promedio se presentó en los primeros cuatro días (12%). En el día 12, los tratamientos AC1 y AC3 mostraron un incremento en este parámetro y disminuyó en el día 16 hasta valores de 153 y 158 mg glucosa mL-1, respectivamente (Fig. 1A).
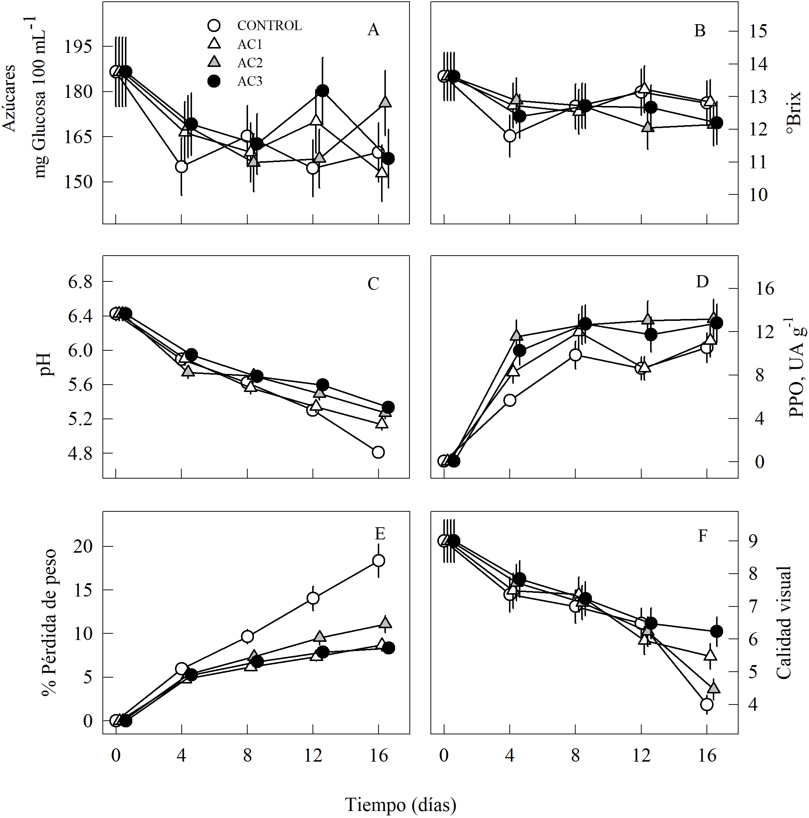
Fig. 1 Valores promedio (± 1 error estándar) de AT (A), SST (B), pH (C), PFO (D), PFP (E) y CV (F) en Opuntia ficus indica mínimamente procesada después de 16 días de almacenamiento en tratamientos de AC: AC1 (5% O2 + 95% N2), AC2 (10% CO2 + aire), AC3 (5% O2 + 10% CO2 + 85% N2) y grupo control (aire).
El contenido de SST no difirió en el factor tratamiento (F=0.8, P=0.52), por el contrario, hubo diferencias atribuidas al tiempo de almacenamiento (F= 7.0, P=0.0001), pero no hubo efecto aditivo de la interacción tratamiento × tiempo sobre los valores promedio de los SST (F= 1.2, P=0.30000). Al inicio del almacenamiento los SST fueron de 13.6 °Brix. En el día 4 se presentó una reducción en todos los tratamientos, principalmente en el grupo control (=11.8 °Brix). Posteriormente los SST se mantuvieron constantes, mientras que en el día 12 de almacenamiento la AC2 mostró una reducción contrastante respecto a las otras AC, lo cual se homogenizó en el día 16 (Fig. 1B).
Los valores de pH mostraron diferencias entre los tratamientos (F= 30, P<0.00001), y entre los días de almacenamiento (F= 725, P<0.00001), y la interacción tratamiento × tiempo también aportó contraste entre los valores promedios como resultado de la composición de las AC durante el almacenamiento de las tunas mínimamente procesadas (F= 13, P<0.00001). Todos los tratamientos presentaron tendencia a disminuir el pH durante el almacenamiento (inicial= 6.42, Fig. 1C). En el día 16, los tratamientos AC2 y AC3 presentaron valores mayores respecto con AC1 y grupo el control.
La actividad de la enzima PFO fue contrastante entre los tratamientos (F= 10.7, P<0.00001), y también se registraron diferencias entre los días de almacenamiento (F= 819.7, P=0.00001). Pero la interacción tratamiento × tiempo no difirió entre los valores promedio como consecuencia del almacenamiento de las tunas mínimamente procesadas bajo AC (F= 1.6, P=0.1). Al inicio del almacenamiento se presentó la menor actividad de la enzima, mientras que en el día 4 hubo un incremento drástico en todos los tratamientos (Fig. 1D), AC2 y AC3 presentaron los valores promedios más altos respecto al grupo control. En el día 12 la actividad de PFO fue menor en el grupo control y AC1 en contraste con AC2 y AC3. Al final del período de almacenamiento tratamientos registraron actividad de PFO homogénea.
La PFP difirió entre los tratamientos (F= 32.5, P=0.00001), y se presentaron diferencias entre los días de almacenamiento (F= 144.1, P<0.00001), también la interacción tratamiento × tiempo tuvo efecto entre los valores promedio de la tuna mínimamente procesada almacenada en diferentes concentraciones de AC (F= 4.34, P<0.00060). En todos los tratamientos se observó incremento al transcurrir los días de almacenamiento, siendo el control el que mostró la mayor PFP durante todo el almacenamiento. Al final del periodo de almacenamiento, los tratamientos AC1 y AC3 presentaron alrededor del 9% de PFP, mucho menor que el control (18%) (Fig. 1E).
La CV durante el almacenamiento presentó diferencias entre los tratamientos (F= 7.64, P<0.0002), y varió entre los días de almacenamiento (F= 140.5, P<0.00001), la interacción tratamiento × tiempo también aportó contraste entre los valores promedios como consecuencia del almacenamiento de las tunas en distintas condiciones de AC (F= 5.67, P<0.00001). Durante el almacenamiento, la CV disminuyó paulatinamente en todos los tratamientos. Al final del almacenamiento los tratamientos AC1 y AC3 fueron mejor evaluados respecto a los tratamientos AC2 y el control (Fig. 1F).
Con la técnica de ordenación multivariada (Componentes Principales) que utilizó para analizar las variables respuesta a los 16 días de aplicar los tratamientos, indicó que el primer factor contribuyó con el 67% de la varianza explicada y el segundo componente sólo contribuyó con el 18%. La asociación lineal del primer componente fue explicada por el pH, PFP, CV, PFO y AT (Tabla 1). Mientras que en el segundo componente la combinación lineal sólo la aportó el parámetro de SST. Además, la comparación de los valores promedio de los puntajes factoriales “factor score” del primer componente CP1 indicó que los tratamientos AC1 y AC3 son diferentes del control y AC2 (F= 7.55, P<0.0002, Fig. 2).
Tabla 1 Puntajes factoriales del análisis de CP de tuna mínimamente procesada bajo AC y su contribución para cada variable de respuesta
| Variable | CP1 | CP2 |
|---|---|---|
| AT | 0.717 | 0.521 |
| SST | 0.572 | 0.732 |
| pH | 0.939 | -0.254 |
| PFO | -0.850 | 0.006 |
| PFP | -0.895 | 0.276 |
| CV | 0.876 | -0.344 |
Discusión
En los frutos de tuna, los azúcares glucosa y fructosa, así como sacarosa, en menor proporción (Kuti y Gulloway, 1994, 387; El Kossori et al., 1998, 263), son el principal sustrato para la respiración poscosecha. Su descenso en las rodajas de tuna mínimamente procesada principalmente porque el daño en el tejido es mayor podría atribuirse al metabolismo acelerado derivado del estrés del corte del tejido, que provoca un mayor consumo de las reservas energéticas (Marques et al., 2011, 606). Por el contrario, el incremento observado en AC1 y AC2 podría estar asociado a un aumento en la actividad de la enzima invertasa (Kuti y Galloway, 1994, 387), que degrada la sacarosa e incrementa los niveles de glucosa y fructuosa (Cantwell y Suslow, 2002, 445; Adams, 2010, 33), como ha sido reportado en la pulpa de tuna por Kuti y Galloway (1994, 387). Un resultado similar ha sido registrado en cubos de manzana almacenados durante 7 días a 4 °C en bajas concentraciones de O2 y altas concentraciones de CO2 (Rocha y De Morais, 2000, 435). Mientras que en tunas de la variedad ‘Gialla’ almacenadas en cajas con película plástica de poliolefina de alta permeabilidad a los gases y a temperatura de 4 ºC durante 9 días, y en tunas con cáscara de color amarillo y pulpa color naranja empacadas en contenedores de tereftalato de polietileno transparente (PET) y sellados con cuatro diferentes películas plásticas: con la propia tapa de PET, PD 900®, 11 μm o 14 μm de revestimiento de capa de cloruro de polivinilo (PVC), y almacenadas 12 días a 3 ± 1 °C y 80 ± 2.5% de HR, o a 6 ± 1 ° C y 70 ± 2.5% de HR, no muestran efectos significativos sobre el contenido de sólidos solubles totales (Piga et al., 2003, 257; Marques et al., 2015, 1810).
Las tunas se caracterizan por ser frutos con baja acidez (Stintzing et al., 2001, 396; Yahia y Mondrangon-Jacobo, 2011, 2311), lo que se atribuye a su bajo contenido de ácidos orgánicos, principalmente de ácido cítrico (Teles et al., 1984, 421). La disminución de pH en los frutos de todos los tratamientos podría derivar de la actividad de la enzima pectin-metil-esterasa (PME) que cataliza la desmetilación de la pectina esterificada, quedando grupos carboxilo libres, con lo cual se acidifica el tejido. Un comportamiento similar ha sido reportado por Añorve et al. (2006, 1000), Piga et al. (2003, 257) y Piga et al. (2000, 15) en tuna mínimamente procesada de la variedad Cristalina; en tunas mínimamente procesadas empacadas en charolas plásticas con recubrimiento de poliolefina y almacenadas a 4 °C; y en tuna variedad Gialla mínimamente procesada empacada en poliestireno con película de poliolefina almacenada a 4 y 15 °C, donde se observó que conforme disminuye el pH incrementa la actividad de la enzima PME.
El incremento observado en la actividad de PFO podría ser atribuido a la respuesta del tejido después del daño ocasionado durante la elaboración del PMP. El corte conduce a cambios en la estructura de la membrana celular y provoca la liberación de los compuestos fenólicos almacenados en el interior de las vacuolas que son oxidados con la intervención de PFO (Saltveit, 1998, 691; Mayer, 2006, 2318; Yoruk y Marshall, 2003, 361). Un resultado similar fue observado en cilindros de jícama almacenados a 5, 7.5 y 10 °C (Aquino-Bolaños et al., 2000, 1241), y en rebanadas de plátano preservadas durante 5 días en atmósfera controlada con 3% O2 y 10% de CO2, donde se presentó un aumento en la actividad de PFO derivado del estado de desprotección celular frente a las reacciones enzimáticas que se producen después del corte (Bico et al., 2009, 512). Otras tecnologías como el procesamiento mínimo a altas presiones de 400 MPa, también provocan el aumento en la actividad de PFO en rebanadas de aguacate (Woolf et al., 2013, 70).
La PFP se relaciona con la remoción de la capa epidérmica protectora y la reducción de tamaño del producto durante su procesamiento mínimo, que incrementa el área de exposición del tejido interno hacia la atmósfera, provocando un aumento en la velocidad de evaporación (Brecht, 1995, 18; Saltveit, 1998, 691), deshidratación (Artés et al., 2007, 178) y la salida de nutrientes (Heard, 2002, 188). Se ha reportado que la PFP también depende de la presentación del fruto (entero o en mitades), así como del tiempo y temperatura de almacenamiento (Piga et al., 2000, 18; Corrales et al., 2006, 224); adicionalmente se ha observado en rodajas de kiwi almacenadas en atmósfera con 5% de O2 y 5% de CO2 (Rocculi et al., 2005, 319), y en rebanadas de papaya var. Maradol, presentaron menor pérdida de peso después de 18 días a 5 °C (Rivera-López et al., 2004, 83). En este estudio la aplicación de AC ayudó a disminir la PFP, lo cual puede ser atribuida no solo al descenso en la velocidad de respiración del producto (Izumi et al., 1996, 165) sino también a la menor pérdida de compuestos celulares (Agar et al., 1999, 435).
La CV incluye una serie de atributos como apariencia, color, brillo, forma (Bansal et al., 2015, 7) y tamaño, que son percibidos principalmente por la vista y que contribuyen a la aceptación por parte del consumidor (Fiszman, 2005, 523). Estos atributos, junto con el sabor, dulzura, valor nutricio, firmeza, jugosidad, resistencia, humedad y turgencia están relacionados con los procesos metabólicos y fisiológicos inherentes a la maduración y como resultado del manejo poscosecha (Bansal et al., 2015, 8). A pesar de que las operaciones de pelado y cortado pueden tener efectos negativos en la calidad de los frutos mínimamente procesados al acelerar las reacciones asociadas a su deterioro (Goldman et al., 2005, 1961; Artés et al., 2007, 178), en este estudio la aplicación de AC con bajas concentraciones de O2 y altas en CO2, (tratamientos AC1 y AC3) permitió que los frutos en rodajas mantuvieran una CV dentro del límite de comercialización al presentar uniformidad de color e integridad del tejido. Estos resultados son similares a los indicados por Cantwell (1992, 445) quien indicó que el uso de atmósferas con 2-8% de O2 y 5-15% de CO2 extienden la vida y facilitan la comercialización de PMP. Un comportamiento similar fue observado en frutos de tuna mínimamente procesada en estado de madurez comercial de la variedad Gialla en rodajas de 2 cm de ancho empacadas en atmósfera pasiva en recipientes de teralftalato de polietileno y almacenadas 12 días a 5 ºC, ya que la CV se mantuvo en el límite de comercialización (Allegra et al., 2015). En el estudio reslizado por Añorve et al. (2006, 1000), se reportó en tuna ‘Cristalina’ de color verde sin cáscara, que las AC extienden la CV por 20 días de almacenamiento a 2 °C, en este estudio el tiempo la CV se mantuvo por un menor tiempo (16 días), muy probablemente debido a que la temperatura de almacenamiento fue mayor (5 °C), la variedad de tuna fue diferente, y que los frutos además de quitarles la cáscara también fueron cortados en rodajas, lo que provocó un mayor daño en el tejido ocasionando que la vida de anaquel fuera menor. Sin embargo, los 16 días de vida de anaquel de los frutos de tuna roja es tiempo suficiente para ser comercializado como PMP.
Finalmente, el análisis de CP indicó que las variables respuesta pH, CV, PFP, PFO y CAT son los principales parámetros que determinan la vida poscosecha de tuna mínimamente procesada bajo AC, y que las bajas concentraciones de O2 y altas en CO2 pueden disminuir la PFP y la actividad de PFO, lo que conduce a una mayor estabilidad de pH y azúcares con la consecuente estabilidad en CV.











 nueva página del texto (beta)
nueva página del texto (beta)



