Introducción
Los lixiviados son definidos en la NOM-083-SEMARNAT-2003, como un líquido que se forma por la reacción, arrastre o filtrado de los materiales que constituyen a los residuos, y que contiene en forma disuelta o en suspensión, sustancias que pueden infiltrarse en los suelos o escurrirse fuera de los sitios en los que se depositan los residuos y que puede dar lugar a la contaminación del suelo y de cuerpos de agua.
Dos de los aspectos que inciden en la generación de lixiviados son la humedad de los residuos y la pluviosidad de la zona en donde se encuentra el vertedero, el lixiviado procede principalmente de la degradación de la materia orgánica contenida en los residuos, a lo que se suman otros líquidos presentes en los residuos. El lixiviado de los residuos sólidos urbanos (RSU) puede contener de forma disuelta nutrientes, metales pesados, compuestos recalcitrantes y otros compuestos xenobióticos (Colomer y Robles, 2011) (Renou et al., 2008). Los metales pesados, a diferencia de los contaminantes orgánicos, son persistentes en la naturaleza, por lo tanto tienden a acumularse en distintos nichos de los ecosistemas, son bioacumulados y bioaumentados a medida que se avanza en los diferentes niveles de la red trófica. Para que los metales pesados puedan ser extraídos, la fitorremediación ofrece un bajo costo para la extracción de ellos, ya que es una tecnología innovadora que utiliza a las plantas y microorganismos asociados a su rizosfera para la remediación in situ y ex situ de suelos, lodos, sedimentos y aguas contaminadas (Volke et al., 2005).
La planta bioacumuladora C. zizanioides, tolera varios entornos y es de rápido crecimiento. Su efectividad, simplicidad y bajo costo hacen que C. zizanioides sea un valioso aliado en el tratamiento de aguas, así como en la rehabilitación y fitorremediación de suelos contaminados (Truong et al., 1995) (Truong y Thai, 2015). En el tratamiento de suelos contaminados con metales pesados, el uso de agentes quelantes representa una gran ventaja para conseguir aumentar la eficiencia de extracción por parte de las plantas, ya que los metales en estado libre son pocos solubles y por ende tienen baja disponibilidad; se conoce que adicionando compuestos quelantes se estimula a la formación de complejos con los iones metálicos, que son captados por las plantas (Maqueda, 2003). Los ácidos orgánicos de bajo peso molecular, como el ácido cítrico y el ácido tartárico, son productos naturales, procedentes de exudados de las raíces de las plantas, presentan una importante capacidad de formar complejos y quelatos con los metales y los nutrientes (Cieśliński et al., 1998). El uso de los quelantes (ácidos orgánicos) representa una gran ventaja para conseguir aumentar la eficiencia de extracción por parte de las plantas, ya que los metales en estado libre son pocos solubles y por ende tienen baja disponibilidad; como ya se mencionó, adicionando quelantes se estimula a la formación de complejos con los iones metálicos, que son captados por las plantas (Maqueda, 2003).
El propósito de esta investigación fue evaluar el efecto que tienen los ácidos orgánicos adicionados al suelo donde crece C. zizanioides que ha sido expuesto a los lixiviados de residuos sólidos urbanos de la empresa Promotora Ambiental (PASA) S.A.B. de C.V. Se cuantificó el contenido de Pb, Tl y V en la planta C. zizanioides y en el suelo obtenido de un relleno sanitario, utilizado como sustrato. Esta investigación también contribuirá al conocimiento y uso de esta especie vegetal como una alternativa para el tratamiento biológico de los lixiviados que son generados en los sitios de disposición final de los residuos sólidos urbanos.
Método
Colecta de planta lixiviado y suelo
Dentro del relleno sanitario de la empresa Promotora Ambiental S.A.B. de C.V., ubicado en el municipio de Teapa (17°48'39.7"N, 92°59'32.2"W), Tabasco, México, se tomaron tres individuos de la especie vegetal de C. zizanioides con su terrón de suelo silvestre, de aproximadamente de 30 cm de diámetro, y se colectaron muestras de suelo representativas del sitio, de aproximadamente 20 kg del suelo del relleno sanitario de 0 a 30 cm de profundidad. Además, se colectaron aproximadamente 10 litros de muestra del lixiviado proveniente de la laguna artificial adyacente a la celda de RSU, en recipientes de polietileno de alta densidad (HDPE) y fueron preservados a 4ºC, esto con base en la norma NMX-AA-003-1980 para la determinación de metales pesados.
Las muestras de C. zizanioides, suelo y lixiviados fueron llevadas al laboratorio de suelos de la División Académica De Ciencias Biológicas, Universidad Juárez Autónoma De Tabasco (DACBiol-UJAT). Las muestras de suelo fueron previamente secadas a temperatura ambiente, sobre papel absorberte, para posteriormente ser molidas y tamizadas en malla de 2mm (#10). Se realizaron esquejes de la planta C. zizanioides para los tratamientos por triplicados para la fase experimental de este trabajo. Los esquejes de C. zizanioides conservaron las raíces y fueron lavados con agua de grifo; después de esto, dichos esquejes fueron colocados en macetas que contenían el suelo que previamente había sido preparado, se dejó aclimatar por un mes hasta recuperar las características de la planta madre.
Diseño experimental
El diseño experimental experimento consistió de un solo factor, con una distribución completamente al azar. Se llevaron a cabo unidades experimentales (Tabla 1) para observar el efecto de los ácidos orgánicos en el suelo y sobre la biodisponibilidad de Plomo, Talio y Vanadio en C. zizanioides. Cada una de las unidades experimentales se regó con el lixiviado, aproximadamente 2 litros por unidad experimental. Se seleccionaron dos ácidos orgánicos (ácido cítrico y ácido tartárico) y dos concentraciones (10 mM y 15 mM) para cada uno de ellos, cabe mencionar que para cada uno de los tratamientos se realizó por triplicado. La fase experimental tuvo una duración de 96 días.
Parámetros fisicoquímicos del suelo
Para la determinación de las propiedades fisicoquímicas del suelo se midió el pH (potenciómetro) del suelo con base a lo descrito en la NOM-021-SEMARNAT-2000 y el porcentaje de materia orgánica se obtuvo con base al método de Walkley y Black descrito en el Manual “Metodologías de Análisis Físico-Químicos de Suelos” Aguilera y Domínguez (1982).
Pretratamiento de muestras (digestión acida) para determinación de metales
La metodología que se utilizó fue la propuesta por Margesin y Schinner (2005) en “Manual for Soil Analysis” y la utilizada por Luis (2004). Esto con la finalidad de eliminar toda la carga orgánica que las muestras puedan contener y pudieran interferir con la determinación y cuantificación de los metales presentes en las muestras.
Digestión de material vegetal
Se tomaron por separado 0.25 g de las muestras secas de raíz y hojas de cada uno de los tratamientos de C. zizanioides y fueron colocados en un vaso teflón agregando 10 ml HNO₃ concentrado para posteriormente colocarlos en el horno de microondas durante 15 min a 800 W. Al terminar la digestión se dejó enfriar a temperatura ambiente y se filtró utilizando papel Whatman #40 y se termina el aforo a 50 ml con agua desionizada.
Digestión de muestras de suelo
Se pesaron 0.5 g de muestra seca de suelo de cada uno de los tratamientos, y se colocaron en un vaso teflón, se añadieron 2 ml de HNO₃ concentrado, 6 ml de HCl concentrado y 10 ml de agua desionizada, dejando reposar 30 minutos. Se sometió a digestión en el horno de microondas durante 15 min a 800 W y se dejó enfriar, una vez que el líquido se digirió a temperatura ambiente, la muestra se filtró utilizando papel Whatman #40, el aforo fue terminado a 50 ml con agua desionizada.
Digestión de Lixiviado
Las muestras que fueron colectadas directamente de la zona de descarga de los lixiviados fueron filtradas con papel Whatman #40, una vez obtenido el líquido filtrado, se agregaron 10 ml de HNO3 concentrado en un matraz volumétrico de 50 ml y se aforo con la muestra. El contenido del matraz se vertió en un vaso teflón, posteriormente, se ingresó la muestra en un horno de microondas durante 15 min a 800 W, esto con el fin de mineralizar la muestra y eliminar el exceso del material orgánico que pueda interferir en los análisis de determinación de metales.
Determinación de Pb, Tl y V
Las muestras digeridas se analizaron en un espectroscopio de emisión óptica de plasma acoplado inductivamente IRIS Advantage de Thermo Jarrell Ash Corporation (Margesin y Schinner (2005); Luis (2004), utilizando una curva de calibración multielemental a partir de una solución estándar comercial SIGMA-ALDRICH 51844.
Los datos obtenidos para la determinación de Pb, Tl y V en el suelo y la planta C. zizanioides de cada uno de los tratamientos fueron sometidos a un análisis de varianza (ANOVA) esto con la finalidad de conocer la diferencia entre medias de los tratamientos, se utilizó la prueba de la diferencia mínima significativa (LSD por sus siglas en inglés) con un intervalo de confianza del 95% (P≤0.05), con el software IBM SPSS Statistics, versión 24.0 (IBM, EU).
Resultados y discusión
Parámetros fisicoquímicos del suelo
El pH del suelo inicial fue de 5.7 (moderadamente ácido), este suelo es el utilizado como cobertura en las celdas del relleno sanitario de la empresa PASA S.A.B. DE C.V. Una vez que fueron agregados los lixiviados al suelo donde crece C. zizanioides (T1-T5) se observa un aumento en el pH en todos los tratamientos (Figura 1). La NOM-021-SEMARNAT-2000 establece una escala de pH para suelos con un pH mayor a 5.0 y menor a 8.5 como pH aceptable, esto para la clasificación de la acidez o alcalinidad del suelo, por consiguiente, el T1 y para el resto presentan valores de pH acercándose a la neutralidad.
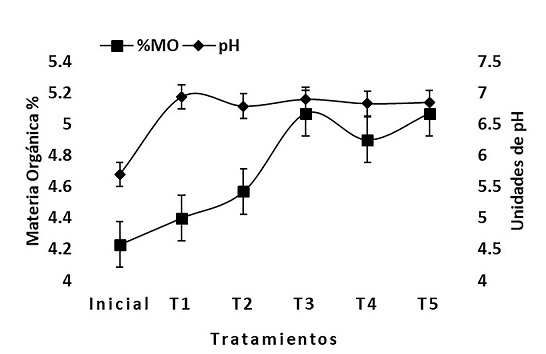
Inicial; T1: Sin ácidos orgánicos; T2: Ácido Cítrico 10mM; T3: Ácido Cítrico 15 mM; T4: Ácido Tartárico 10 mM; T5: Ácido Tartárico 15 mM.
Figura 1 % Materia Orgánica y pH del suelo de cada uno de los tratamientos
Conforme se fueron añadiendo las soluciones de los ácidos orgánicos al suelo, ocasionaron que se volviera más neutro el suelo donde crece C. zizanioides. Onireti et al. (2017) afirmaron que después de adicionar los ácidos orgánicos al suelo, existía una relación proporcionalmente directa al reaccionar con varios componentes del suelo a diferentes velocidades.
El contenido de materia orgánica (MO) del suelo varió conforme se aumentaban las concentraciones de los ácidos orgánicos. Los tratamientos T2 y T3 corresponden al ácido cítrico en donde las soluciones que fueron agregadas al suelo tenían concentraciones de 10 mM y 15 mM respectivamente, presentando porcentajes de MO de 4.57% > 5.07%, y los T4 y T5 que corresponden al ácido tartárico en el cual las soluciones que fueron adicionadas tenían una concentraciones de 10 mM y 15 mM, con valores del porcentaje de MO que van del 4.9% > 5.07%, el contenido de MO del suelo fue directamente proporcional a las concentraciones de las soluciones de los ácidos orgánicos, como se presenta en la Figura 1. La MO del suelo se ve influenciada por la presencia de los ácidos orgánicos, a medida en que aumentan las concentraciones de los ácidos orgánicos en el suelo, el contenido de MO del suelo va aumento, tendencia encontrada por Montiel et al., (2016) y por Onireti et al. (2017).
Identificación y cuantificación de Pb, Tl y V en el suelo
Las concentraciones de los metales presentes en el tratamiento testigo (T1) el cual solo fueron regados con los lixiviados de los RSU y en exposición a C. zizanioides son presentados en la Figura 2, la mayor concentración corresponde a Vanadio (V) 8.737 > Plomo (Pb) 7.462 > Talio (Tl) 2.246 mg/kg en el orden mencionado respectivamente.

Inicial; T1: Sin ácidos orgánicos; T2: Ácido Cítrico 10mM; T3: Ácido Cítrico 15 mM; T4: Ácido Tartárico 10 mM; T5: Ácido Tartárico 15 mM.
Figura 2 Identificación y cuantificación de A) Plomo, B) Talio, C) Vanadio en suelo. Medias de tratamientos por metal con una letra común no son significativamente diferentes (p > 0.05).
Los datos sobre la movilización en el suelo de Plomo, Vanadio y Talio para los cinco tratamientos se muestran en la Figura 2. En donde se puede observar notablemente la disminución de las concentraciones de los metales en estudio que estaban presentes en el suelo de los cuales posiblemente hayan sido transportados hacia las raíces y traslocados a las hojas de C. zizanioides. Para el análisis de varianzas se presentaron diferencias estadísticamente significativas en la concentración de Plomo (p = 0.0001), Talio (p = 0.0448) y Vanadio (p = 0.0001) para cada uno de los tratamientos experimentados, sin embargo, se obtuvo que el T1, T3, T4, T5 son diferentes al T2.
El tratamiento con ácido cítrico 10 mM (T2), disminuye considerablemente las concentraciones de los metales (Plomo, Talio y Vanadio) en comparación al tratamiento control (T1) y con el resto de los tratamientos experimentados (T3, T4, T5), como se observa en la Figura 2 el tratamiento con ácido cítrico 10 mM resulta ser el más efectivo con respecto a la movilización de los metales en el suelo hacia la planta.
Para el caso del Plomo existe una mayor movilización del suelo hacia la planta por los dos ácidos orgánicos, sin embargo, el T2 moviliza la mayor cantidad de Plomo con respecto al T1 (control) y con el resto de los tratamientos, para el caso del Plomo en comparación a los diferentes tratamientos son estadísticamente significativos (Figura 2A). Montiel (2016), reportó como la mayor concentración de Plomo (8.718 mg/kg) en un suelo de cobertura de las celdas de un relleno sanitario el cual había sido contaminado con los lixiviados de RSU, por lo que nuestros datos se encuentran dentro del rango de valores un suelo contaminado por los lixiviados. Escolástico y Pérez, (2012) afirmaron que las altas concentraciones del ácido cítrico pueden mejorar la fitoextracción de metales contaminantes presentes en el suelo, sin embargo, para este caso una concentración igual a 10 mM resultó la más óptima para los tres elementos en estudio.
En la Figura 2B se puede observar una ligera disminución de Talio en el T2, estadísticamente el tratamiento T2 presentaron diferencias significativas en comparación con el resto de los tratamientos. Wu et al. (2015) reportaron una concentración de Talio de 6.42 < 2.16 mg/ kg en un suelo contaminado por este elemento. Por lo que se puede afirmar que el Talio puede movilizarse en la solución del suelo y C. zizanioides logra tolerar concentraciones iguales o mayores a lo encontrado en esta investigación.
Los datos sobre la movilización de Vanadio del suelo hacia la planta, por las cuatro soluciones de ácidos orgánicos se muestran en la Figura 2C, en donde se observa notablemente la disminución de Vanadio en el T2, el T2 y T4 son estadísticamente significativas en comparación al metal por tratamientos, se reportaron cantidades de Vanadio para un suelo contaminado por relaves de la minería en donde las concentraciones en el suelo rizosférico de Brassica juncea eran de 34.168 mg/g (Elektorowicz y Keropian, 2015).
Cuantificación de Pb, Tl y V en C. zizanioides (Raíz y Hoja)
Durante la determinación multielemental simultánea de elementos en las muestras de C. zizanioides (raíz y hojas) por el ICP-OES proporcionó la identificación del metal y la concentración. Cabe mencionar que para los tres metales en estudio presentaron diferencias estadísticamente significativas.
El comportamiento de la absorción de los metales en los órganos de C. zizanioides (raíz y hoja) fueron las siguientes Vanadio>Talio>Plomo, respectivamente. La presencia de los ácidos orgánicos en el suelo moviliza los metales para que estos fueran absorbidos por las raíces y traslocados a la parte área de la planta.
Los ácidos orgánicos contribuyeron al incremento del contenido de Talio en la parte área de C. zizanioides, en donde en el T2 las concentraciones Talio se reportaron de 2.199 > 3.525 mg/kg para la raíz y hojas de C. zizanioides, respectivamente. Cabe mencionar que el T2 resulto ser la más efectiva para la absorción de Talio en C. zizanioides, presentando una tendencia mayor en comparación al resto de los tratamientos en estudio como se puede observar en la Figura 3; las medias de la raíz de C. zizanioides no son significativamente diferentes con respecto a las hojas del T2 que presentaron diferencias estadísticamente significativas. Se ha reportado que especies nativas logran acumular concentraciones de Talio en un rango de 65-251 mg/kg (Habashi, 2013; Augustynowicz et al., 2014), logrando así que C. zizanioides compita con las especies nativas debido a su capacidad de tolerar altas concentraciones de Talio.
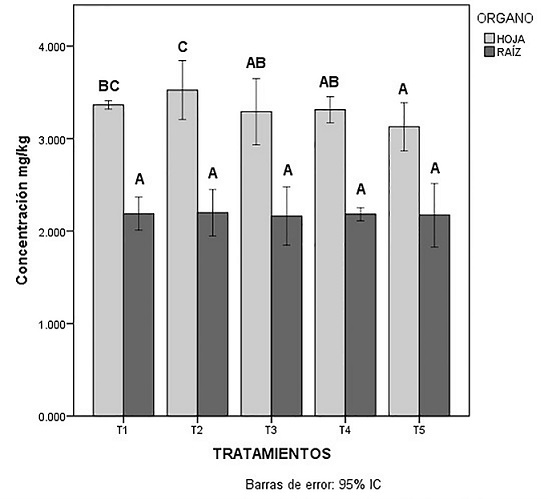
Inicial; T1: Sin ácidos orgánicos; T2: Ácido Cítrico 10mM; T3: Ácido Cítrico 15 mM; T4 Ácido Tartárico 10 mM; T5: Ácido Tartárico 15 mM.
Figura 3 Concentración de Talio en Chrysopogon zizanioides. Medias de órganos por tratamiento con una letra común no son significativamente diferentes (p > 0.05).
Mientras que el T2 logra la mayor cantidad de Plomo y Vanadio en las raíces de C. zizanioides en comparación al tratamiento T1, los tratamientos con ácido cítrico 15 mM (T3) y acido tartárico 10 y 15 mM (T4, T5) no resultaron ser tan efectivas para la absorción de Plomo en las raíces de C. zizanioides, en una investigación realizada por Escolástico y Pérez, (2012) afirmaron que bajas concentraciones de ácido cítrico y ácido tartárico no consigue extraer una cantidad significativa de metales del suelo, sin embargo la adición de ácidos orgánicos debe ser de hasta 10 mM kg-1 de lo contrario no habría efectos significativos estadísticamente sobre la solubilidad de los metales pesados del suelo hacía la planta (Liu et al., 2008).
La acumulación de Plomo en las raíces y hojas de C. zizanioides presentan las mayores concentraciones entre 4.205 > 2.104 mg/kg respectivamente que corresponden al T2 (Figura 4). Las concentraciones de plomo fueron las más bajas que se han reportados en la planta C. zizanioides contaminadas por lixiviados con una concentración de 1.80 mg/kg esto para todo el sistema de C. zizanioides (Morales, 2016). Cabe mencionar que el análisis de varianza presentó diferencias estadísticamente significativas entre los órganos (raíz y hojas) de C. zizanioides por tratamientos.

Inicial; T1: Sin ácidos orgánicos; T2: Ácido Cítrico 10mM; T3: Ácido Cítrico 15 mM; T4: Ácido Tartárico 10 mM; T5: Ácido Tartárico 15 mM.
Figura 4 Concentración de Plomo en Chrysopogon zizanioides. Medias de órganos por tratamiento con una letra común no son significativamente diferentes (p > 0.05).
En las Figuras 4 y 5 se observa en general que tanto el Plomo como el Vanadio la traslocación es menor, los valores de los metales son mayores en la raíz que en la parte aérea, en estudios previos se correlacionaba una tendencia en la acumulación de plomo en las raíces de las plantas, debido a la baja afinidad de traslocar el plomo de las raíces a las hojas puede ser el resultado de la movilidad del metal por vía del apoplasto (Romeiro, et al., 2006; Núñez, 2005; Mehra y Farago, 1994).
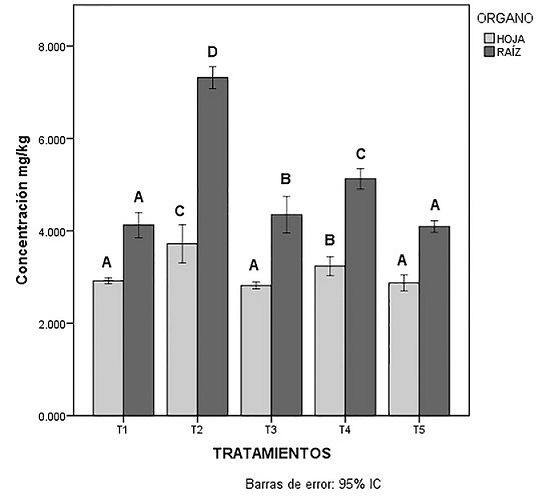
Inicial; T1: Sin ácidos orgánicos; T2: Ácido Cítrico 10mM; T3: Ácido Cítrico 15 mM; T4: Ácido Tartárico 10 mM; T5: Ácido Tartárico 15 mM.
Figura 5 Concentración de Vanadio en Chrysopogon zizanioides. Medias de órganos por tratamiento con una letra común no son significativamente diferentes (p > 0.05).
Sin embargo el caso del Talio es la excepción puesto que las concentraciones son mayores en la hoja con respecto a la raíz en comparación al Plomo y Vanadio en donde se logró una mayor absorción en el T2 exclusivamente en las raíces eso podría evidenciarse al tiempo de traslocación, se ha reportado que la mayor acumulación de plomo se realizó en ensayos a escala laboratorio en donde la absorción de plomo se efectuaba a mayor tiempo de exposición, el órgano que acumuló la mayor cantidad de plomo fueron las raíces en función del tiempo de exposición en donde de menor a mayor tiempo se encontraron rangos de concentración en la raíz 13000 > 16500 mg/kg respectivamente, teniendo en cuenta que los efectos duraderos de los ácidos orgánicos y maximizando su eficacia, se podrían lograr con un tiempo mayor de tratamiento, en el estudio con C. zizanioides se sugiere que el tiempo de exposición debería ser mayor para lograr con éxito procesos de fitorremediación, mecanismo de defensa, ya sea por algún tipo floración, actividades enzimáticas o microbianas en el suelo, etc. (Liu et al., 2008; Cahuich, 2018), los experimentos de fitoextracción mostraron que C. zizanioides puede ser considerado una especie hiperacumuladoras de plomo (Antiochia et al., 2007). Mismos que en otros estudios y ensayos con C. zizanioides se ha demostrado que la mayor concentración de plomo se realiza en las raíces, la alta tolerancia y acumulación de plomo se atribuye a la formación de complejos con fitoquelatinas (Chen et al., 2004; Ghosh et al., 2015; Andra et al., 2009).
Las concentraciones de Vanadio en los órganos la planta C. zizanioides (raíz y hojas) del T2 logró acumular la mayor cantidad de Vanadio en la raíz en comparación a las hojas de C. zizanioides, de las cuales se reportaron 7.317 mg/kg y 3.720 mg/kg de este elemento respectivamente. Sin embargo, como se puede apreciar en la Figura 5, el T2 logra translocar una significativa cantidad de Vanadio a la parte área de esta planta en estudio en comparación con el resto de los tratamientos.
El análisis estadístico presento diferencias estadísticamente significativas entre las hojas del T2 y T4 y en lo que corresponde a la raíz el T2, T3 y T4 son significativamente diferentes.
Hasta el momento no se han reportado concentraciones de Vanadio para el sistema de C. zizanioides, mientras que en otros estudios las concentraciones de Vanadio en Brassica juncea durante un proceso de fitoextracción en un suelo contaminado por relaves de la minería que contenían altas concentraciones de Vanadio se logra acumular en la raíz y hojas concentraciones que van de 10.111 y 5.090 mg/g respectivamente (Elektorowicz y Keropian, 2015). Las concentraciones que fueron reportadas para Vanadio en este trabajo de investigación y las reportadas por otros autores en diferentes especies de plantas hiperacumuladoras corresponden a una mayor acumulación de este elemento en las raíces, por tanto se puede afirmar que C. zizanioides puede acumular altas concentraciones de Vanadio en las raíces, logrando un proceso de fitoextracción exitoso en suelos contaminados.
Es importante mencionar que se presentaron diferencias con respecto a la acumulación de Plomo, Talio y Vanadio en los órganos de C. zizanioides, el cual se atribuye a la adición de los ácidos orgánicos sin embargo en diversas investigaciones se ha relacionado a que las plantas poseen un sistema interno muy específico de transportar metales de los tejidos radicales hacia la parte aérea, además de que se pueden correlacionar factores como el pH del suelo provocando que los metales queden adsorbidos en las partículas del suelo, disminuyendo así la biodisponibilidad hacia las plantas (Cuauhtémoc, 2010; Hernández, 2009; Brown et al., 1994).
Conclusiones
La presencia de los ácidos orgánicos en el suelo donde crece C. zizanioides modifican el pH y la MO. La solución de ácido cítrico 10 mM (T2) resultó ser la más efectiva puesto que movilizó la mayor cantidad de Plomo, Talio y Vanadio del suelo hacia la planta C. zizanioides en comparación con el resto de los tratamientos, El Talio se bioacumula más en la parte área, mientras que el Plomo y el Vanadio se bioacumulan más en la raíz de C. zizanioides. Este es el primer registro de bioacumulación de Vanadio por la planta C. zizanioides.











 nueva página del texto (beta)
nueva página del texto (beta)


