Introducción
Giardia lamblia (sin. Giardia intestinalis y Giardia duodenalis) es un protozoario intestinal de importancia médica y veterinaria, y es el agente causal de la Giardiasis. Esta infección intestinal es una de las enfermedades parasitarias de mayor incidencia y prevalencia con más de 300 millones de personas infectadas en el mundo cada año (Morrison et al., 2007). Afecta a individuos de todas las edades, ocasionando espasmos abdominales severos, náuseas, vómito, diarrea y malabsorción, esta última tiene gran impacto sobre todo en niños porque puede ocasionar desnutrición y retraso en el crecimiento. Los pacientes pueden ser sintomáticos durante una o dos semanas, y aunque la mayoría de las infecciones son controladas por una respuesta inmune eficiente, algunos individuos desarrollan enfermedades crónicas que aparecen incluso sin una inmunodeficiencia, y se prolongan por meses (Ortega and Adam, 1997).
La inmunopatología de la giardiasis es compleja y se ha descrito que intervienen elementos relacionados a la biología del parásito y su variabilidad genética, así como elementos relacionados al hospedero, como estado nutricional, inmunológico y de salud general, microbiota del tracto intestinal, así como aspectos genéticos (Singer and Nash, 2000a; Solaymani-Mohammadi and Singer, 2010). En la respuesta inmune al parásito participan células de la inmunidad innata y adaptativa, conociéndose que la respuesta humoral mediada por IgA tiene un papel importante en el control de la infección (Fink et al., 2018; López-Romero et al., 2015; Langford et al., 2002), y estos mecanismos de respuesta son efectivos en organismos inmunocompetentes, no así en personas susceptibles. A la fecha no se cuenta con vacunas para la prevención de la giardiasis en humanos, y los tratamientos farmacológicos más empleados como metronidazol y albendazol, se han utilizado ampliamente en campañas de desparasitación con resultados aceptables (Solaymani-Mohammadi et al., 2010). Sin embargo la ocurrencia de reinfecciones es alta y la farmacoresistencia también se ha reportado en algunos casos. Debido al impacto de este problema de salud, se han buscado alternativas más efectivas de tratamiento. Se conoce que los ácidos grasos poliinsaturados dietarios pueden modular la expresión de una gran variedad de genes que codifican para citocinas, moléculas de adhesión y proteínas inflamatorias (Sampath and Ntambi, 2005). El ácido linoleico conjugado (CLA) es una mezcla de 28 isómeros posicionales (7,9; 9,11; 10,12; 11,13) y geométricos (cis o trans) del ácido linoleico, cuya principal fuente dietaria son los productos lácteos y la carne de res (Chin et al., 1992). Se han estudiado ampliamente en modelos animales sus propiedades benéficas, tales como anticancerígenas, antiaterogénicas y antidiabetogénicas, y también se ha explorado su participación en la modulación de la respuesta inmune (Benjamin and Spener, 2009; O´Shea, 2004).
En lo que se refiere al efecto del CLA en la modulación de la respuesta inmune a patógenos se han descrito algunos estudios dónde aumenta la producción de anticuerpos contra infecciones ocasionadas por virus en humanos (Albers et al., 2003). En roedores sanos suplementados con CLA también se ha observado un incremento en la respuesta inmune intestinal (Ramírez-Santana et al., 2009, 2010). Algunos de los efectos del CLA en la respuesta inmune se han atribuido a sus propiedades como ligando de factores de transcripción conocidos como receptores activados por proliferadores de peroxisomas (PPAR) (Moya-Camarena, et al., 1999). Los PPARs ((, β/( y () son receptores nucleares que traducen estímulos nutricionales y/o farmacológicos en cambios en la expresión de genes. Se ha descrito el uso novedoso de algunos ligandos de PPAR para modular la respuesta inmune en el tratamiento de enfermedades parasitarias, como esquistosomiasis, chagas y malaria (Chen et al., 2008; Balachandar and Katyal, 2010; Rodrigues et al., 2010). Patel et al., (2004), describió el aumento en la expresión del receptor CD36, mediada por agonistas de PPAR (rosiglitazona), lo que condujo a un incremento en la fagocitosis de eritrocitos infectados con Plasmodium falciparum. Posteriormente, Boggild et al., (2009) describió el uso de rosiglitazona como una terapia adyuvante bien tolerada, para los casos no severos de malaria (Plasmodium falciparum). El tratamiento con este fármaco incrementó la eliminación del parásito y disminuyó los marcadores de inflamación asociados con la evolución de la malaria (Boggild et al., 2009). Kumar et al. (2011) probó en un modelo de infección con el parásito Plasmodium berghei en ratones inmunosuprimidos, que el CLA aumentó la producción de anticuerpos específicos y la funcionalidad de macrófagos. Estos hallazgos hacen del CLA un buen candidato para modular la respuesta inmune en el tratamiento de parasitosis e hipotetizamos que la suplementación oral de ácido linoleico conjugado aumentará las poblaciones de células presentadoras de antígeno en ratones infectados con Giardia lamblia. Por ello, el objetivo del presente estudio fue evaluar la actividad inmunomoduladora del CLA en la respuesta innata intestinal a Giardia lamblia para fortalecer las defensas naturales del hospedero e inducir un tipo de respuesta intestinal más efectiva contra el parásito.
Materiales y Métodos
Animales
Se incluyeron n=32 ratones machos cepa C3H/HeN de 10-12 semanas de edad (Harlan, Indianapolis, IN), los cuales fueron alojados en jaulas y mantenidos en condiciones de bioterio, con fotoperiodo de 12 h de luz/oscuridad, temperatura ambiente de 24° C, y humedad controlada. Los ratones fueron alimentados ad libitum con dieta comercial Global Diet 18% proteína (Tabla 1), en pellet (Harlan, Indianapolis, IN) y agua esterilizada. Se registró semanalmente el peso de los ratones, antes y después de la infección. Los animales fueron sacrificados por dislocación cervical en base a la NOM-062-ZOO-1999. El protocolo de investigación fue aprobado por al Comité de Ética en Investigación del Centro de Investigación en Alimentación y Desarrollo, A.C. (CE/005/2013).
Tabla 1 Composición de la dieta comercial Teklad Global diet 18%, Harlan.
| Ingrediente | ||
|---|---|---|
| Proteína | % | 18.6 |
| Grasa | % | 6.2 |
| Carbohidratos | % | 44.2 |
| Fibra cruda | % | 3.5 |
| Fibra detergente neutrala | % | 14.7 |
| Cenizas | % | 5.3 |
| Energía | (kcal/g) | 3.1 |
| Energía de proteína | % | 24 |
| Energía de grasa | % | 18 |
| Energía de carbohidratos | % | 58 |
| Ácidos grasos | ||
| C16:0 Palmítico | % | 0.7 |
| C18:0 Esteárico | % | 0.2 |
| C18:1ω9 Oleico | % | 1.2 |
| C18:2ω6 Linoleico | % | 3.1 |
| C18:3ω3 Linolenico | % | 0.3 |
| Total grasa saturada | % | 0.9 |
| Total grasa monoinsaturada | % | 1.3 |
| Total grasa poliinsaturada | % | 3.4 |
Ingredientes: (en orden descendente de inclusión) trigo, maíz, soya, gluten de maíz, aceite de soya, carbonato de calcio, fosfato de calcio, levadura, sal iodada, lisina, DL-metionina, cloruro de colina, caolina, oxido de magnesio, vitamina E, complejo de bisulfito de sodio como fuente de vitamina K, oxido manganoso, sulfato ferrroso, oxido de zinc, niacina, pantotenato de calcio, sulfato de cobre, cloruro de piridoxina, riboflavina, mononitrato de tiamina, vitamina A, iodato de calcio, suplemento de vitamina B12, ácido fólico, biotina, vitamina D3, carbonato de cobalto. a La fibra detergente neutral es un estimado de la fibra insoluble, incluyendo celulosa, hemicelulosa y lignina.
Tratamientos
Los animales fueron asignados a dos grupos, un grupo con CLA y un grupo control con tampón salino fosfato (PBS). Se sacrificaron cuatro ratones de cada grupo antes de la infección, denominado tiempo 0 y post-infección a los días 2, 6 y 8 (dpi). El ácido linoleico conjugado (80% en mezcla 50:50 de los isómeros cis-9, trans-11-CLA y trans-10, cis-12-CLA) en forma de ácidos grasos libres CLARINOL®A-80 (Stepan Lipid Nutrition, Wormeer, The Netherlands) se administró 50 µL (50 mg CLA) por vía oral empleando una cánula de plástico para alimentación. La suplementación con CLA inició 3 días antes de la infección y continuó una semana después. Al grupo control se les administró un volumen igual de PBS usando el mismo procedimiento.
Infección experimental
Se estableció la infección experimental en el modelo murino empleando la metodología descrita por Velázquez et al. (2005). En forma resumida, los cultivos axénicos de Giardia lamblia (GS/M-83-H7) se mantuvieron en medio TYI-S-33. Se recolectaron en su fase log-lag y se preparó el inóculo en PBS estéril y frío, empleando una concentración final de 5x106 trofozoítos de Giardia lamblia en 200 µL de suspensión para cada ratón. Los ratones de los grupos de CLA y PBS se mantuvieron en ayuno previo a la administración del inóculo, la cual se realizó con una cánula de plástico (Instech Solomon, Plymouth Meeting, PA USA) que fue introducida hasta el intestino para depositar los trofozoítos y favorecer la infección.
Obtención de tejido intestinal y conteo de trofozoítos
Los animales fueron sacrificados por dislocación cervical en los días previamente establecidos para seguir la evolución de la infección. A partir de secciones de 5 cm de intestino delgado (duodeno), se evaluó la carga de trofozoítos en lavado intestinal, a los 0, 2, 6 y 8 días post infección, por medio de una incubación del tejido intestinal por una hora a 4°C en PBS estéril y frío, posteriormente se centrifugó la solución en una centrífuga refrigerada (Beckman Coulter, Brea, CA, USA) a 1663 g por 8 min. El pellet con los trofozoítos se resuspendió y se realizó el conteo al microscopio en una cámara de Neubauer. Adicionalmente, se tomaron cortes de 1.5 cm duodeno que fueron fijados en formaldehído al 10%. Se tiñeron seis secciones de tejido en parafina, de la muestra de dos ratones por grupo para visualizar trofozoítos e integridad de la mucosa intestinal. La tinción se realizó por métodos estándar de hematoxilina-eosina.
Aislamiento de células intestinales
Para la obtención de la células presentadoras de antígeno de intestino, se empleó el protocolo de Drakes et al. (2004). Mediante disección se removió de forma aséptica el intestino delgado, se lavó con solución salina balanceada de Hank sin calcio y sin magnesio (HBSS, Sigma-Aldrich, St. Louis, MO, USA) a 4°C a la que se adicionó 0.5% de penicilina/estreptomicina (10 mg/mL) y 0.4% de amfotericina B (250 µg/mL), para eliminar el contenido fecal. Posteriormente se removieron las placas de Peyer, se abrió el intestino longitudinalmente y se cortó en secciones de 1 cm. Se lavó en tres ocasiones con HBSS con EDTA 20 mM, en agitación a 37°C por 15 min. Se incubó con medio RPMI-1640 completo (0.5% de penicilina/estreptomicina (10 mg/mL), 0.4% de amfotericina B (250 µg/mL), 0.2% de gentamicina (160 mg/mL), 1% de piruvato de sodio (100 mM), 20 mM de HEPES y 5% de suero fetal bovino( para eliminar el exceso de EDTA. Se procedió a realizar cortes más pequeños del tejido y se colocó en una solución para digestión enzimática ((RPMI-1640 con colagenasa (100 UI/mL) y DNAsa I (100 µg/mL)(, por 1.5 h a 37°C y 150 rpm en un agitador orbital. Una vez filtrado con organza estéril el sobrenadante producto de la digestión, se centrifugó a 329 g por 8 min a 15°C para la recuperación del pellet celular. Se lavó y resuspendió en RPMI-1640 completo y se contó el número de células viables con azul de tripán al 0.4%.
Análisis de poblaciones por citometría de flujo
La inmunofenotipificación de las poblaciones celulares de interés se realizó usando anticuerpos conjugados con fluorocromos. En forma resumida, las células se centrifugaron a 329 g por 8 min a 15°C para retirar el medio y se lavó el pellet celular con 6 mL de PBA (PBS 1X y 0.01% de albúmina), se centrifugó a 447 g por 7 min y se resuspendió en PBA ajustando el volumen para la tinción de 3 x105 células para cada combinación de marcadores de fenotipo. Las células se marcaron con los anticuerpos anti ratón MHC-II-PE-Cyanine5 clona NIMR-4, CD11c- PE-Cyanine7 clona N418, y CD103 (Integrin alpha E) PE clona 2E7 y F4/80-Alexa Fluor 488 clona BM8 (eBioscience, SD). Se incluyeron los controles apropiados para cada anticuerpo y FMO. La adquisición de células se realizó en un citómetro de flujo FACSCanto II™ (BD Biosciences). El análisis de datos se llevó a cabo utilizando el programa FACSDiva V.7 y la preparación de imágenes con el programa Inkscape V.0.48.5.
Análisis estadístico
Los datos se presentan como medias ± DE. El experimento tuvo un diseño completamente al azar con arreglo factorial 2x4, donde el primer factor corresponde a la suplementación o no suplementación de CLA y el segundo factor corresponde a los tiempos de infección que fueron 4. El análisis estadístico se llevó a cabo con un ANOVA GLM y prueba de Tukey para comparación de medias usando el nivel de significancia de p˂0.05. Estas pruebas se realizaron con el paquete estadístico NCSS versión 8 (NCSS Statistical Software, Kaysville, UT, USA). Los gráficos fueron realizados en el programa GraphPad Prism® v6.0c. (San Diego, CA).
Resultados
Infección experimental: La suplementación oral del CLA en forma de ácidos grasos libres (50 mg de mezcla de isómeros en proporción 50:50 de cis-9, trans-11-CLA y trans-10, cis-12-CLA) y el placebo inició 3 días antes de la infección y continuó por 8 días post infección (dpi). El modelo de giardiasis fue establecido en la cepa C3H/HeN (n=32) y la carga parasitaria se monitoreó a los 0, 2, 6 y 8 dpi para evaluar la respuesta temprana al parásito. La cinética de infección evidenció un pico en la cuenta de trofozoítos a los 6 dpi coincidiendo con la fase aguda (Figura 1A). La carga parasitaria se redujo solamente en el grupo suplementado con CLA comparado con el grupo control (p(0.05) en los días 0, 2 y 6. En el análisis histológico de duodeno a los 6 dpi se confirmó la presencia de trofozoítos de Giardia lamblia adheridos al borde en cepillo de las células epiteliales, así como el infiltrado linfocitario en la lámina propia (Figura 1B). No se observaron cambios en el peso de los ratones entre grupos.
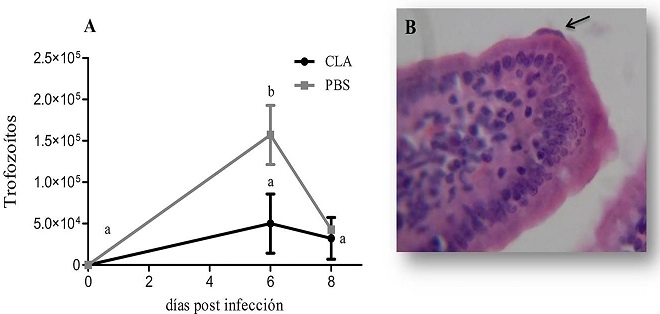
Figura 1 Evaluación de la carga parasitaria en un modelo de giardiasis inducida en ratón. Se obtuvieron 5 cm de duodeno para la cuantificación de trofozoítos. A) La cinética de infección mostró un pico máximo a los 6 dpi en la fase aguda. Cada punto corresponde a n=4 ratones por tiempo. Literales diferentes indican diferencias significativas entre tratamientos (p‹0.05). B) Microfotografía de un trofozoíto adherido (flecha) a una vellosidad de duodeno y el infiltrado linfocitario en lámina propia a los 6 dpi, se obtuvo por tinción con hematoxilina-eosina en cortes transversales (aumento 600x).
Efecto del ácido linoleico conjugado sobre las poblaciones de CPA: Las células presentadoras de antígeno (CPA) obtenidas por digestión enzimática del intestino delgado se analizaron por citometría de flujo. Las poblaciones de interés se estudiaron en la región de células dobles positivas a los marcadores de superficie CD11c+MHC-II+ en la región de expresión alta (high) (Figura 2A). El CLA tuvo un efecto en el incremento de la población CD11chiMHC-IIhi (p=0.027), a los dos días post infección, y además se observó un efecto del tiempo de infección a los 2 y 8 días (p=0.009). En el caso del grupo control, se observó un incremento también al día dos, sin embargo no fue estadísticamente significativo (Figura 2B). Dentro de esta población se evaluó la expresión de la integrina E CD103+ característica de células APC de lámina propia que podrían ser células dendríticas. El porcentaje de las células con fenotipo CD11chiMHC-IIhiCD103+ fue mayor a los 3 días de iniciada la suplementación con CLA y antes de la infección, esto comparado con el grupo control, y disminuyó los 6 dpi (p(0.05) (Figura 3A).
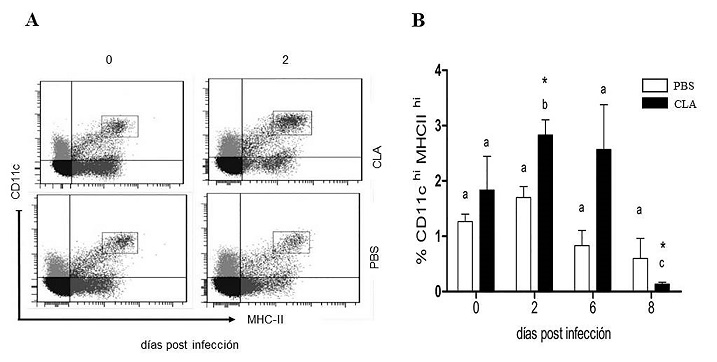
Figura 2 Porcentaje de células APC CD11c hi MHC-II hi en intestino delgado de ratones C3H/HeN infectados con Giardia lamblia. A) Las imágenes muestran los datos de porcentaje de cada población doble-positiva CD11c y MHC-II analizada a partir de una región seleccionada del gráfico de SSC y FSC, y son representativas de un ensayo n=4 ratones/tiempo (0 pre infección y 2 días post infección) en el grupo control (PBS) y el suplementado con CLA. B) Las barras muestran los porcentajes de células CD11c hi MHC-II hi evaluadas durante el día pre infección (0) y 2, 7 y 8 días post infección. Se empleó un diseño factorial de 2 x 4 GLM ANOVA y prueba de Tukey. Literales diferentes significan diferencias entre tratamientos, diferencias en el tiempo de infección se muestran con *(p(0.05).
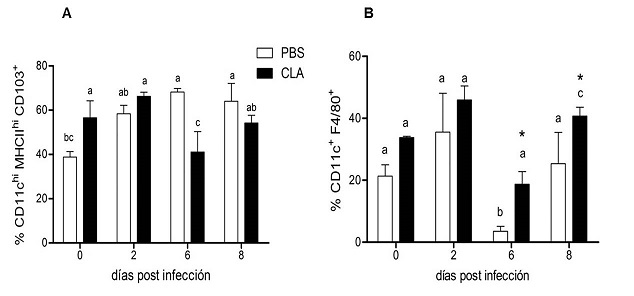
Figura 3 Porcentaje de células APC en intestino delgado de ratones C3H/HeN infectados con Giardia lamblia. A) Población MHC-IIahi CD11chi CD103+ y B) CD11c+ F4/80+. Las imágenes son representativas de un ensayo n=4 ratones/tiempo (0, 2, 6 y 8 días post infección) en el grupo control (PBS) y el suplementado con CLA. Los datos de porcentaje de cada población doblepositiva se analizaron en un diseño factorial de 2 x 4 GLM ANOVA. Literales diferentes significan diferencias entre tratamientos, diferencias en el tiempo de infección se muestran con *(p0.05).
En el grupo sin suplementación los porcentajes de células CD11chiMHC-IIhiCD103+ aumentaron a partir del día dos post infección, pero fueron significativamente diferentes hasta los 6 y 8 dpi. En la población CD11c+F4/80+, también se observó un incremento por efecto del tratamiento con CLA (p=0.01) a los 6 y 8 dpi, y del tiempo de infección en los mismos días (p=0.0026) (Figura 3B).
Discusión
En este estudio se evaluó la actividad inmunomoduladora del CLA sobre la respuesta innata intestinal a Giardia lamblia para aumentar las defensas naturales del hospedero e inducir un tipo de respuesta intestinal más robusta contra el parásito. Se encontró que en el modelo de infección, la carga parasitaria aumentó en la fase aguda de la infección, sin embargo en el grupo suplementado con CLA fue significativamente menor. Franco et al. (2013), observaron en un modelo de giardiasis inducida en hembras C57BL/6, que la suplementación con yogur Kéfir disminuía también la carga parasitaria a niveles un poco más altos a los encontrados en nuestro estudio. Se buscó probar el efecto sobre la inmunidad innata, particularmente sobre poblaciones de células presentadoras de antígeno ya que son fundamentales en iniciar y coordinar una respuesta inmunológica eficiente. El CLA aumentó el porcentaje de la población intestinal de células CD11chi MHC-IIhi de forma temprana a los dos días post infección, a diferencia del grupo control, que también aumentó pero no fue estadísticamente significativo. En esta población doble positiva de intestino se incluyen células dendríticas y macrófagos (Pabst and Bernhardt, 2010).
En la respuesta a Giardia son importantes la inmunidad innata y adaptativa, siendo esta última la más estudiada. La respuesta anti Giardia más documentada en ratón es la producción de IgA en las primeras semanas de infección, así como la participación de linfocitos CD4+ en la producción de citocinas (Fink and Singer, 2017). Sin embargo, los procesos de inmunidad innata a Giardia son poco entendidos, y se conoce que participan mastocitos, células dendríticas, macrófagos, células epiteliales y proteínas del complemento, así como la producción de óxido nítrico y péptidos antimicrobianos (López-Romero et al., 2015; Li et al., 2016), e incluso la relación con la microbiota en el ambiente intestinal (Fink and Singer, 2017). G. lamblia puede interaccionar con células dendríticas a través de la activación de la vía TLR4-MyD88-p38 y ERK1/2 MAPKs (Lee et al., 2015), e inducir la maduración de células dendríticas, además, se ha observado que macrófagos peritoneales de ratón pueden reconocer a Giardia mediante el receptor TLR2 (Li et al., 2017). La producción de algunas citocinas como TNF-α e IL-6, se ha descrito son necesarias para el control de Giardia en ratón (Zhou et al., 2003). Una fuente importante de estas citocinas proviene de los mastocitos los cuales pueden ser activados por metabolitos de Giardia (Muñoz-Cruz et al., 2018). Kamda et al. (2012), demostró que la IL-6 producida por células dendríticas es muy importante para la respuesta al parásito. Además, Fink et al. (2018), describieron la importancia de la células mieloides en la infección y respuesta a Giardia. Estos autores caracterizaron algunas poblaciones de macrófagos con fenotipo regulador y observaron que se incrementan, lo que sugiere que pudieran ser responsables de la poca inflamación inducida por la giardiasis. Esto coincide con nuestro modelo de infección, donde encontramos la presencia del parásito unido al epitelio intestinal, con infiltrado leucocitario en lámina propia, pero principalmente linfocitos. Recientemente Li et al. (2018) encontraron que las trampas extracelulares producidas por macrófagos (METs) son un nuevo mecanismo de la inmunidad innata para el control del parásito y apoya los primeros estudios que describieron el papel de los macrófagos en la respuesta a Giardia (Belosevic and Daniel, 1992). Así mismo Maloney et al. (2017), reportaron un incremento en las poblaciones de macrófagos en lámina propia de ratones infectados con Giardia lamblia. En nuestro estudio, observamos un aumento en la población CD11c+ F4/80+ post infección, sin embargo este incremento fue significativamente mayor por efecto del tratamiento con CLA, a los 6 y 8 días post infección.
La suplementación oral con el CLA también tuvo efecto sobre la población MHC-IIhi CD11chi CD103+. Al momento de la infección, el grupo con CLA tenía tres días recibiendo la suplementación y el efecto fue un número mayor de células con fenotipo MHC-IIhi CD11chi CD103+. En el grupo control este mismo nivel se alcanzó pero hasta el día seis post infección y se mantuvo sin cambios al día ocho. En el caso del grupo suplementado hubo una disminución que consideramos pudiera explicarse por la reducción de la carga parasitaria en intestino que se dio en menor tiempo en el grupo con CLA comparado con el control. El aumento temprano de esta población mejoró la respuesta del grupo suplementado. Las células CD103+ de lámina propia en intestino delgado están relacionadas con la diferenciación de células T reguladoras que expresan FOXP3 y la producción de ácido retinoico que favorece la respuesta humoral, principalmente de IgA secretora en mucosas (Pabst and Bernhardt, 2010), F4/80 también ha estado implicado en la inmunoregulación en intestino (Lin et al., 2005), mientras que otras subpoblaciones están involucradas en la diferenciación de Th17 (Denning et al., 2007). A su vez, la producción de IgA se ha demostrado que es importante en la respuesta y eliminación del parásito Giardia lamblia (Langford, 2002; Velázquez et al., 2005). Lantier et al. (2013), describieron la importancia de las células dendríticas CD103+ en la infección con el parásito Cryptosporidium parvum en ratones neonatos de la cepa C57BL/6. Dichos autores discuten la importancia de estas APC no sólo en la presentación de antígenos, sino por la estrecha comunicación con otras células de la respuesta inmune innata, lo cual promueve la eliminación del parásito. Los efectos del CLA en la inmunidad innata han demostrado una mejora en la actividad bactericida y la síntesis de óxido nítrico en macrófagos de ratones albinos suizos infectados con Leishmania y alimentados con dieta suplementada con CLA, comparados con los macrófagos de los ratones alimentados con dieta control (Kumar et al., 2011).
Cho et al. (2008) estudiaron el efecto del isómero trans-10, cis-12-CLA en células polimorfonucleares (PMN) y PBMC de caninos al estimularlas con perlas de látex. Las PBMC estimuladas con perlas de látex y suplementadas con CLA aumentaron la producción de TNF-α en el sobrenadante de cultivo, mismo que se utilizó para mejorar el estallido respiratorio y capacidad fagocítica de PMN. Se obtuvieron resultados muy similares en el estudio de Kang et al. (2007) donde utilizaron el mismo isómero de CLA y las mismas células pero de un modelo porcino. En dicho estudio buscaron los efectos de la expresión de PPAR( y observaron que el CLA logró estimular la producción de TNF-α en PBMC. Aunque en nuestro estudio no evaluamos funcionalidad, el aumento de las poblaciones y la reducción de la carga parasitaria sugiere que el CLA está modulando la respuesta y que probablemente esté asociado al efecto de las APC sobre los linfocitos T cooperadores y la respuesta adaptativa.
El CLA, un ácido graso presente en la dieta, tiene una actividad dual de activación de los factores de transcripción nucleares PPAR( y ( (Moya-Camarena et al., 1999). Dichos factores de transcripción tienen un papel importante en la modulación de la respuesta inmune a través del control de la expresión de citocinas inflamatorias, el aumento de las capacidades fagocíticas de células presentadoras de antígeno y su participación en la polarización de la respuesta T cooperadoras Th1/Th2 (Clark et al., 2000; Clark, 2002; Daynes and Jones, 2002). Aunque la población objetivo en este estudio fueron células mieloides, posiblemente se estimularon otras células de la respuesta inmune como linfocitos T y B. Se esperaría que incrementara la producción de anticuerpos ya que se ha descrito este efecto del CLA en otras investigaciones (Ramírez-Santana et al., 2009).
Debido a que el CLA se absorbe a nivel intestinal, consideramos que sus efectos tendrán un mayor impacto en el sistema inmune de mucosas en el que está siendo captado y sobre el cual no existen muchos estudios. Se están realizando otras investigaciones en nuestro laboratorio para evaluar el efecto del aumento de estas poblaciones en la inmunidad adaptativa al parásito y las interacciones de estos ácidos grasos con los mecanismos de defensa del sistema inmunológico que mejoren la respuesta en la giardiasis.
Conclusiones
La suplementación oral de CLA incrementó los porcentajes de la población de células presentadoras de antígeno CD11chiMHC-IIhi, CD11chiMHC-IIhiCD103+ y CD11c+ F4/80+ en intestino delgado y redujo la carga parasitaria de Giardia lamblia en el modelo de giardiasis. Estos resultados justifican la realización de más estudios que permitan dilucidar los mecanismos involucrados en los efectos inmunomoduladores del CLA en la mucosa intestinal y su posible contribución en la mejora de la respuesta adaptativa a patógenos como Giardia lamblia.











 nueva página del texto (beta)
nueva página del texto (beta)


