Introducción
Es importante conocer el número de cromosomas de las plantas para la planeación de un programa de fitomejoramiento, estudios evolutivos, filogenéticos, genéticos y taxonómicos (Nathewet et al., 2009, 432). Las especies del género Rubus presentan la no reducción de gametos, duplicación de genoma y apomixis (Otto y Whitton, 2000, 401; Meng y Finn, 2002, 768). La poliploidía en Rubus va desde 2n= 2x =14 a 2n = 14 x = 98; posiblemente, también existen 2n = 18x = 126, incluyendo número de cromosomas impares y aneuploides (Thompson, 1995, 1455; 1997,131; Meng y Finn, 1999, 225; Marcela-Delgado et al., 2010, 74). En especies diploides el tamaño de los cromosomas mide de 1 a 3 μm de longitud, con un contenido de ADN de 0.56 a 0.59 pg (Lim et al., 1998, 1032; Meng y Finn, 2002, 774). Sin embargo, los genotipos con el mismo número de cromosomas pueden diferir en el contenido de ADN y producir progenies poliploides (Meng y Finn, 2002, 774).
La poliploidía plantea un desafío en la segregación de los cromosomas, debido a que cada cromosoma presenta más de un homólogo (Mercier et al., 2015, 326). La duplicación del genoma entero o poliploidía juega un papel importante en la evolución de todas las angiospermas, permite que los híbridos interespecíficos fértiles generen múltiples genes para alelos en cada locus, mediante la liberación de genes duplicados de las mutaciones y a través de la especiación con flujo limitado de genes (Soltis y Burleigh, 2009, 5455; Proost et al., 2011, 63). Por otro lado, las cruzas heteroploides son utilizadas para introducir genes deseables de especies silvestres o materiales élite entre especies o cultivos capaces de generar progenies con variación en niveles de ploidía (Meng y Finn, 2002, 768). De acuerdo con Rieseberg y Willis (2007, 912), la poliploidía permite que las especies presenten una rápida evolución y adaptación.
Existen metodologías para clasificar y contar el número de cromosomas (Nathewet et al., 2009, 433), entre ellas, el método convencional del conteo de cromosomas en células somáticas bajo microscopio, usando tejidos meristemáticos o tipos de brotes y a través de células madres del polen (Thompson, 1997, 163). Otros métodos para determinar el nivel de ploidía son: la medición del tamaño del polen (Otto y Whitton, 2000, 436) y número de cloroplastos en las células guarda de la epidermis (Mastersoon, 1994); sin embargo, éstas son técnicas no precisas.
Las técnicas modernas que se están utilizando son: la hibridación genómica in situ (GISH), la cual usa el ADN genómico total (Heslop-Harrison y Schawarzacher, 2011, 31) y la técnica del citómetro de flujo (Bennett y Leitch, 2011, 589), que consiste en determinar el contenido de ADN de forma rápida y eficiente en las plantas y animales (Galbraith et al., 1983, 1049).
La citometría de flujo ofrece alternativas para determinar el tamaño, composición y niveles de poliploidía de genomas en especies con interés taxonómico y para el mejoramiento genético en plantas (Bennet et al., 2000, 907). Además, permite esclarecer la taxonomía y biodiversidad, e incluso plantear estrategias de conservación in situ y ex situ (Poehlman y Allen, 2005, 52).
El 70 % de las angiospermas presentan poliploidía (Mastersoon, 1994, 423); en programas de mejoramiento genético de zarzamoras y frambuesas (Rubus idaeus L.), es importante conocer el nivel de ploidía de los genotipos de Rubus para predecir el entrecruzamiento y combinaciones parentales (Meng y Finn, 2002, 226), distinguir las características taxonómicas de las colecciones de Rubus (Thompson, 1995, 1455), conocer la evolución y filogenia de los genotipos entre las especies y familias (Heslop-Harrison y Schwarzacher, 2011, 32). Por otro lado, al cruzar progenitores con diferentes niveles de ploidía se pueden generar progenies estériles o genéticamente inestables (Poehlman y Allen, 2002, 234).
En el género Rubus se han realizado conteos de cromosomas en 387 especies, que corresponde el 40% de las especies que se conocen, 90 variedades y selecciones de zarzamoras (Thompson, 1997, 164). Sin embargo, se carece de información respecto al número de cromosomas de las especies silvestres presentes en México, y de acuerdo con Zamorano et al. (2007, 58), para que el germoplasma de las especies de Rubus se pueda conservar, manejar y utilizar eficientemente, éste se debe caracterizar morfológicamente y genéticamente. Por lo tanto, el objetivo de este estudio fue determinar el número de cromosomas de las especies silvestres de Rubus adenotrichos Schltdl, R. cymosus Rydb, R. humistratus Steud., R. palmeri Rydb, R. pringlei Rydby, R. sapidus Schltdl; así como de las variedades Tupí y Kiowa, y las cruzas Tupí x R. sapidus y Kiowa x R. sapidus mediante la técnica de citología y describir las características morfológicas que definen o asocian la poliploidía de las especies silvestres y variedades de las zarzamoras.
Método
Las plantas de zarzamoras fueron establecidas en el invernadero del Colegio de Postgraduados: seis especies silvestres (R. adenotrichos; R. cymosus, R. humistratus, R. palmeri, R. pringlei y R. sapidus), dos variedades (Tupí y Kiowa) y dos progenies de las cruzas Tupí x R. sapidus y Kiowa x R. sapidus.
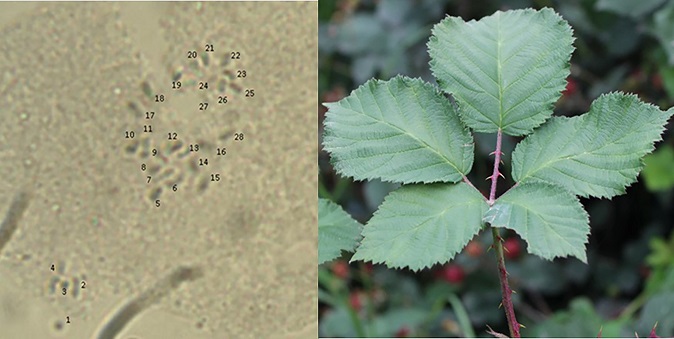
La determinación del número de cromosomas se realizó mediante la técnica de aplastado de los ápices de raíz en crecimiento (Huaman, 1995, 1-19). Se seleccionaron los ápices de las raíces vigorosas y se colectaron durante la mañana. El pretratamiento consistió en poner las puntas de las raíces en agua a 4°C durante 24 horas para acumular células en metafase. Después del pretratamiento, el fijado de las raíces se realizó en la solución de Carnoy, (alcohol 96°: ácido acético glacial: cloroformo 3:1:1 por volumen), durante 30 minutos. Posteriormente, las puntas de raíz fueron hidrolizadas en ácido clorhídrico (HCl) 1N durante 15 minutos a 60°C, se tiñeron con solución de Feulgen durante 15 minutos a 60°C y se utilizó acetocarmin 1% para el aplastado.
Una vez obtenida la tinción de las raíces se procedió a analizar, mediante observación directa en un microscopio con un objetivo de 100x (Marca ZEISS, Alemania), 50 células en metafase de dos o más puntas de las raíces por especie, se contaron el número de cromosomas por célula para cada especie y se obtuvo el nivel de ploidía con base en el número haploide partiendo de 1x = 7.
Descripción morfológica: la decripción de los caracteres morfológicos se realizó con base en descriptores cualitativos (UPOV, 2006) y la confirmación de las especies se hizo a través de la revisión del Herbario del Instituto de Ecología, A.C., México (IE-BAJÍO).
Las escalas que se usaron para registrar las variables fueron: nominal (n), ordinal (o) y binario (b), y se clasificaron de acuerdo con el órgano (tallo, hoja, flor y fruto) de la planta. Las variables de tallo fueron: porte de la planta (PP, n); densidad de la pilosidad en tallo (TPD, o); forma del tallo (TFT, n); y forma de la espina en tallo (TFE, n). Las variables foliares fueron: número de foliolos (HNF, n); forma del foliolo (HFF, n); forma de la base de la hoja (HFB, n); forma del ápice de la hoja (HFA, n); y margen de la hoja (HM, n). Las variables del órgano floral: color de pétalos (FCP, n) y forma de pétalo (FFP, n). Las variables del fruto: número de polidrupas por racimo (DNP, o) y número de drupas por polidrupa (DND, o).
Resultados
Caracterización cromosómica
Las observaciones citológicas mostraron variación en el número de juegos cromosómicos de diploide a pentaploide (2x = 14, 3x = 21, 4x = 32 y 5x =35) en las especies de R. adenotrichos, R. cymosus, R. humistratus, R. palmeri, R. pringlei y R. sapidus), las variedades Tupí y Kiowa y las progenies de las cruzas Tupí x R. sapidus y Kiowa x R. sapidus. De acuerdo con Heslop-Harrison y Schwarzacher (2011, 32), cada especie presenta un número característico de cromosomas en su núcleo, el número varía entre especies y frecuentemente incrementa y decrece durante la evolución y especiación de las especies. La poliploidía juega un papel muy importante en la evolución del género Rubus (Thompson, 1997, 163).
Los cromosomas en estas especies son pequeños, lo que impide identificar sus características morfológicas. De acuerdo con Masterson (1994, 422), las especies poliploides incrementan el volumen de la célula y originan cambios fenotípicos que afectan el metabolismo y la regulación de genes durante el desarrollo de la planta.
Las especies, R. adenotrichos y R. humistratus fueron diploides, es decir, 2n = 2x = 14 (Figura 1 y 2). En el caso de R. adenotrichos se confirmó que presenta 14 cromosomas reportados de acuerdo al resultado obtenido por Thompson (1995, 1456).
Las especies R. pringlei (Figura 3), R. sapidus (Figura 4), la variedad Tupí (Figura 5) y la cruza Tupí x R. sapidus (Figura 6) presentaron 21 cromosomas, es decir, 2n = 3x = 21, por lo tanto, son triploides. De acuerdo con Ramsey y Schemske (1998, 500), las especies triploides presentan baja fertilidad y tienden a producir gametos aneuploides, por los emparejamientos cromosómicos y la segregación durante el proceso de la meiosis, que dan origen a gametos euploides; éstos pueden producir descendencias triploides y tetraploides, como consecuencia, los triploides pueden facilitar la transición de diploides a tetraploides permitiendo la propagación de poliploides.
El número de cromosomas de R. palmeri (Figura 7), la variedad Kiowa (Figura 8) y la cruza Kiowa x R. sapidus (Figura 9) fueron 2n= 4x= 28, es decir, tetraploides. Cuando un cromosoma se involucra en una asociación múltiple se forman gametos desequilibrados y la fertilidad se reduce (Ramsey y Schemske, 2002, 637). Sin embargo, la reducción de la fertilidad va de acuerdo al tipo de polipliodía (Mercier et al., 2015, 325). En especies autopoliploides, las copias de cada cromosoma comparten las mismas posibilidades de recombinación entre sí, como consecuencia con frecuencia presentan quiasmas múltiples, aunque no de forma sistemática (Grandont et al., 2013, 182); por el contrario, en las especies alopoliploides, los cromosomas presentan intercambio genético parcial (Jenczewski y Alix, 2004, 42).
La especie R. cymosus presentó 2n = 5x = 35 cromosomas (Figura 10). Los poliploides presentan mayor avance en relación con la evolución en comparación con sus ancestros diploides (Fawcett et al, 2009, 5740; Proost et al., 2011, 63).
Las especies poliploides generalmente marcan diferencias de sus progenitores en las características morfológicas, ecológicas, fisiológicas y citológicas, que pueden contribuir en el conocimiento de nuevos nichos ecológicos y reproductivos (Levin, 2002, 187). Por lo tanto, la poliploidía es un mecanismo importante de adaptación y especiación en las plantas (Levin, 2002, 154; Otto y Whitton, 2000, 435).
Descripción morfológica de las especies de zarzamora
R. adenotrichos Schltdl
J. Rzedowski 53357 (IEB). Es un arbusto erecto a semi erecto, longitud de la rama larga de aproximadamente 4 m, tallo acanalado, pilosidad alta y antocianinas en primocañas y floricañas; espinas rectas e inclinadas en el tallo y en las nervaduras de las hojas. Hojas pentafoliadas, foliolos rómbicos con margen serrada, forma de la base de la hoja subtroncada y el ápice del foliolo acuminado. En relación con las flores, tiene pétalos de color blanco y redondos; los racimos presentan entre 40 a 60 polidrupas y cada polidrupa está compuesta de 50 a 100 drupas. Esta especie forma parte de la flora silvestre de México y localmente es apreciada por sus frutos comestibles y por sus propiedades medicinales, también presentan compuestos fenólicos con actividad antioxidante (Acosta-Montoya et al., 2010, 1499; Martínez-Cruz et al., 2011, 70; Mertz et al., 2007, 8621).
R. humistratus Steud
J. Rzedowski 53357 (IEB). Plantas de porte semierecta, tallo redondo y ausencia de pilosidad, espinas en el tallo en forma de punzón. Hojas trifoliadas, con márgenes biserradas, foliolos rómbicos, base obtusa y el ápice acuminado, los pétalos son blancas y lanceoladas. Los racimos presentan de 4 a 6 polidrupas y las polidrupas compuestas de 10 a 20 drupas.
R. pringlei Rydb
J. Rzedowski 53357 (IEB). Las plantas son semierectas a rastreros, tallos redondos y pilosidad abundante, los tallos de primocaña son de color gris y las espinas en forma de punzón. Las hojas trifoliadas, de color gris en el envés, con margen serrrada y base subcordada, la forma del foliololo es ovado y el ápice redondo. Los pétalos son blancos y elípticos. Los racimos están compuestos entre 8 a 10 polidrupas y las polidrupas están formados entre 30 a 50 drupas.
R. sapidus Schltdl
J. Rzedowski 53357 (IEB). Arbustos de porte semierecto a rastrero, tallo angular, pilosidades cortas, y las espinas del tallo son curveadas. Hojas trifoliadas, con márgenes biserradas, foliolos rómbicos, base del foliolo obtuso y ápices acuminados. Las flores presentan pétalos blancos y de forma lanceolados. Los racimos formados de 4 a 6 polidrupas y cada polidrupa compuesta entre 6 a 20 drupas.
Variedad Tupí
J. Rzedowski 53357 (IEB). Es una de las principales variedades utilizadas por los productores de zarzamora, se caracteriza por presentar porte semierecto, tallos acanalados y espinas rectas e inclinadas. Hojas pentafoliadas y foliolos ovales con márgenes serrados. Los pétalos son ovados y de color rosa. Frutos grandes con drupas de 30 a 50 por polidrupas.
Cruzas Tupí x R. sapidus
Plantas de porte semi-rastreras, tallos redondos y espinas rectas e inclinadas; hojas trifoliadas, foliolos rómbicos, con márgenes de los foliolos serrados y ápices acuminados. Pétalos blancos y lanceolados, las polidrupas presentan entre 8 a 14 drupas.
R. palmeri Rydb
J. Rzedowski 53357 (IEB). Plantas robustas y rastreras, tallo angular con ausencia de pilosidad y espinas curveadas. Las primocañas y floricañas con pigmentación de antocianinas. Hojas pentafoliadas, las hojas presentaron foliolos rómbicos, base subcordada, con margen biserrada y ápice ovado. Pétalos de colores rosas y redondos; racimos compuestas entre 50 a 100 polidrupas, y cada polidrupa formada entre 9 a 14 drupas.
Variedad Kiowa
Plantas de porte semierecto, tallos redondos, espinas en tallo, rectas e inclinadas; hojas trifoliadas y pentafoliadas, foliolos ovados con márgenes biserrados, base subcordada y ápice acuminado. Los petalos son redondos y de color blanco, con polidrupas formados entre 30 a 40 drupas.
Cruza Kiowa x R. sapidus
Plantas de porte semi-rastreras, tallos redondos y con espinas rectas e inclinadas; hojas pentafoliadas y el margen de los foliolos biserradas y foliolos acuminados. Pétalos redondos y blancos.
R. cymosus Rydb
J. Rzedowski 53357 (IEB). Planta semierecta a erecta, tallos redondos y sin pubescencias, con espinas curveadas. Hojas son trifoliadas, con foliolos rómbicos y márgenes serruladas, ápices acuminados y base de la hoja obtusa. Pétalos blancos y elípticos; los racimos presentaron de 6 a 10 polidrupas y cada polidrupa compuestos de 8 a 14 drupas.
La variación de los juegos cromosómicos en las especies de zarzamora se debe principalmente a la variación genética. Gianoli (2004, 13) argumenta que la variación genética también se apoya en la “plasticidad fenotípica”, que se asume como la capacidad de un organismo para producir fenotipos diferentes como respuesta a cambios ambientales, aspecto que tiene que ver con la interacción genotipo por ambiente.
La caracterización morfológica ha permitido reconocer las principales características que distinguen a cada una de las especies silvestres y variedades. Moreno et al. (2011, 126) mencionan que la colección, caracterización y evaluación del germoplasma son tareas prioritarias para la conservación, el mejoramiento y la obtención de materiales sobresalientes con mejores características productivas.
En mejoramiento genético de frutales, generalmente se da importancia a aquellos atributos que aportan al rendimiento, calidad y tamaño de frutos. Por ello, es conveniente que los genotipos R. palmeri, R. pringlei y R. sapidus, junto con la variedad Tupí, se integren en programas de pre mejoramiento. De acuerdo con Lobo (2006, 51), el uso de las especies silvestres disminuye la vulnerabilidad genética de las especies. Los resultados obtenidos en el presente trabajo proveen las bases científicas para el uso racional de las especies en el mejoramiento genético y generación de nuevas variedades.
Discusión o Conclusión
Las especies de zarzamoras presentaron variabilidad en el número de juegos cromosómicos: R. adenotrichos (2n = 2x = 14), R. cymosus (2n = 5x = 35), R. humistratus (2n = 2x = 14), R. palmeri (2n = 2x = 28) , R. pringlei (2n = 2x = 21) y R. sapidus (2n = 2x = 21); las variedades Tupí (2n = 2x = 21) y Kiowa (2n = 2x = 28), y las progenies de las cruzas Tupí x R. sapidus (2n = 2x = 21) y Kiowa x R. sapidus (2n = 2x = 28)











 nueva página del texto (beta)
nueva página del texto (beta)