Introducción
Las enfermedades crónicas degenerativas son patologías de larga duración, cuyo proceso es generalmente lento; entre las que se incluyen las enfermedades cardiovasculares (ECV), diferentes tipos de cáncer, enfermedades de las vías respiratorias y diabetes mellitus. Todas estas representan un problema que va en un aumento progresivo, debido al envejecimiento de la población y a los estilos de vida actuales que acentúan el sedentarismo y la mala alimentación (Zhang et al., 2015, 1). Actualmente, el 70% de los mexicanos padecen obesidad, donde cerca de una tercera parte son jóvenes (Colchero et al., 2016, 22). En México, una de las bebidas que contribuye al incremento de estos factores de riesgo son las bebidas azucaradas, como los refrescos (Colchero et al., 2016, 33). Por ello, se han implementado alternativas para aumentar el consumo de productos naturales que puedan ayudar a reducir el riesgo de contraer de estas enfermedades. Las frutas y los vegetales son productos naturales que aportan componentes que ejercen beneficios a la salud y se han asociado en la prevención de enfermedades causadas por el estrés oxidativo. Actualmente, existen evidencias científicas que correlacionan un efecto benéfico con el consumo de frutas y vegetales que son ricos en fitoquímicos y la disminución en el desarrollo de las ECV (Zhang et al., 2015, 15).
El mango (Mangifera indica L.) pertenece a la familia Anarcadáceas se cultiva en zonas tropicales y sub-tropicales de México, donde crecen diversas variedades de mango, entre ellas la variedad ‘Ataulfo’. Durante el proceso de industrialización se utiliza el 60 % del fruto y el 40 % restante son sub-productos (SP), entre los que se encuentran la cáscara (15-20 %), la pasta (residuo de la obtención del concentrado) y el hueso (60 %) (Ravani y Joshi, 2013, 690). Estudios previos han demostrado que la cáscara y la pasta son ricos en fitoquímicos, entre ellos fibra dietética, compuestos fenólicos y carotenoides (Blancas-Benítez et al., 2015a, 11; Ajila et al., 2007, 18). Los carotenoides son tetraterpenoides formados por poli-isoprenoides (por ocho unidades) unidas con dobles enlaces conjugados y con ramificaciones de grupos metilo por cada cinco átomos de carbono (Kiokas et al., 2016, 77). Actualmente, se conocen más de 600 carotenoides, que se dividen en carotenos y xantófilas (Kiokas et al., 2016, 47). Los carotenos (α-caroteno y β-caroteno) y las xantofilas (zeaxantina, β-criptoxantina, luteína) desempeñan diversas funciones como pro-vitamínicos, antioxidantes, activadores del sistema inmunológico, entre otros (Fiedor y Burda, 2014, 13).
Por otra parte, la extracción asistida por ultrasonido (EAU) ha demostrado ser una tecnología emergente viable para la conservación de alimentos a partir de la inactivación de enzimas, mejorando la calidad sensorial y aumentando la vida de anaquel de diferentes productos (Zou y Jiang, 2016, 24). Sin embargo, existen pocos trabajos que se hayan enfocado sobre el efecto de la EAU en el contenido de carotenoides en los jugos de frutas o subproductos de ellas (Zou y Jiang, 2016, 24; Janiszewska y Sakowski, 2013, 30). En este sentido, aprovechar los SP del mango como ingrediente para la formulación de bebidas podría aumentar el contenido y consumo de carotenoides. Así mismo, la EAU en las bebidas facilitaría la liberación de estos compuestos de los SP y aumentaría su bioaccesibilidad. En este sentido, el presente estudio consiste en evaluar el contenido y bioaccesibilidad de los carotenoides en bebidas a base de SP de mango ‘Ataulfo’.
Método
Obtención de la materia prima
Los SP (cáscaras y pasta) del mango ‘Ataulfo’ fueron donados de una empresa procesadora de la ciudad de Tepic, Nayarit, México (Mexifrutas, S.A. de C.V.) y fueron trasladadas inmediatamente al Instituto Tecnológico de Tepic, en donde fueron secados por un proceso convencional a 60 °C por 15 h y 7 h para la cáscara y la pasta, respectivamente. Se eligió esta temperatura para conservar los compuestos bioactivos de los SP (Izli et al., 2017, 192). Los SP del mango fueron molidos y almacenados a -20 °C hasta su análisis. Los mangos fueron adquiridos en un mercado de la localidad con un estado de madurez de consumo (12.5 °B) y fueron lavados, sanitizados, pelados y se obtuvo la pulpa, que se almacenó a -20 °C.
Extracción asistida por ultrasonido (EAU) para la preparación de las bebidas de mango
Todas las bebidas fueron elaboradas con los siguientes ingredientes; agua purificada, cáscara, pasta, pulpa de mango, sacarosa, ácido ascórbico, áloe vera (AgroFresh Food, México) y goma xantana (Drogueria Cosmopolita, México), de acuerdo a lo indicado en la Tabla 1. Los SP del mango se seleccionaron como fuente de fibra dietética. La bebida control (BC) consistió en mezclar los ingredientes mencionados anteriormente en 300 mL de agua purificada. Posteriormente, se adicionaron 200 mL más a la mezcla y se agitó hasta quedar totalmente homogenizado en los envases previamente lavados y sanitizados. La preparación de BC se realizó por triplicado, las cuales fueron envueltas con papel aluminio y se almacenaron a temperaturas de refrigeración (5 ± 0.1 °C).
Cuadro 1 Formulación de bebidas preparadas con sub-productos de mango ‘Ataulfo’.
| Bebidas de mango ‘Ataulfo’ | ||||
|---|---|---|---|---|
| BC1 | B-EAU1* | B-EAU2+ | B-EAU3- | |
| Cáscara (g) | 1 | 1 | 1 | 1 |
| Pasta (g) | 1 | 1 | 1 | 1 |
| Pulpa (g) | 10 | 10 | 10 | 10 |
| Goma xantana (g) | 0.2 | 0.2 | 0.2 | 0.2 |
| Aloe Vera (g) | 0.4 | 0.4 | 0.4 | 0.4 |
| Azúcar comercial (g) | 12 | 12 | 12 | 12 |
| Ácido ascórbico (g) | 0.4 | 0.4 | 0.4 | 0.4 |
| Agua (mL) | 500 | 500 | 500 | 500 |
1: Bebida de mango control. B- EAU: bebidas de mango tratadas con extracción asistida por ultrasonido (EAU): *Condición óptima de extracción para β-caroteno en cáscara y pasta (XTE: 30 min, XA: 30 %, XC: 0.8). + Condición óptima para la inhibición de mesófilos en bebidas de mango (XTE: 15 min, XA: 70 %, XC: 0.4). -Condición óptima para la inhibición de coliformes totales (XTE: 12 min, XA: 100 %, XC: 1).
En el caso de las bebidas tratadas con la EAU estas fueron preparadas de la misma manera solo que al finalizar la elaboración se empleó un procesador de ultrasonido UP 400S (Hielscher GmbH, Teltow, Germany) con un sonotrodo de 3 a 40 mm de diámetro y una frecuencia constante de 24 KHz. La energía ultrasónica fue controlada por el ajuste de la amplitud de la sonda al sonicator. Posteriormente, el transductor de ultrasonidos (H7 Tip 7, Hielscher, Teltow, Alemania) fue introducido aproximadamente 150 mm en el interior de cada botella y las bebidas fueron sonicadas en oscuridad a fin de evitar posibles daños inducidos por la luz. El tiempo de extracción (TE), la amplitud de sonicación (AS) y el ciclo (C) se utilizaron como variables independientes. Las condiciones óptimas utilizadas en este estudio fueron: el contenido de β-caroteno (B-EAU1) (XTE: 30 min, XAS: 30 %, XC: 0.8); inhibición de los mesófilos en las bebidas de mango (B-EAU2): (XTE: 15 min, XAS: 70 %, XC: 0.4); y la inhibición de las bacterias coliformes (B-EAU3): (XTE: 12 min, XAS: 100 %, XC: 1). Después de aplicar la EAU, las bebidas se almacenaron a temperaturas de refrigeración (5 ± 0,1 °C). Las bebidas BC y B- EAUs fueron una suspensión coloidal. Las bebidas (BC y B-EAUs) se envolvieron en papel de aluminio y fueron colocadas sobre hielo para ser transportadas a la Universidad de Sonora en Hermosillo, Sonora e inmediatamente fueron almacenados a 4 ºC hasta su análisis. Las bebidas con la EAU fueron comparados con la BC, que no fue sometida a la EAU (Cuadro 1).
Extracción de carotenoides en las bebidas de mango
La extracción de los carotenoides de las bebidas del mango se realizó siguiendo el método descrito por Qin (2008, 78). Brevemente, 200 µL de cada bebida se homogenizó con una disolución salina (500 µL, 0,85 % w/v), y cloroformo-metanol (3000 µL, 2:1 v/v) y se utilizó equinenona como estándar interno (100 µL), se agitaron por 30 s a temperatura ambiente (25 °C). Después, se centrifugaron (3500 rpm a 4 °C por 10 min) y el extracto orgánico fue recuperado. Posteriormente, el residuo se lavó con 3000 µL de hexano (BHT 0.25 % w/v) y se repitió el procedimiento anterior. Cada uno de los extractos se llevaron a sequedad por arrastre de nitrógeno gaseoso a 40 °C (Organomation, N-Evap 111, USA) para ser re-suspendidos en 200 µL de etanol (BHT 0.25 % w/v) y se filtraron con acrodiscos (Acrodisc®, Micropore Millex GN, nylon; 0,20 µm de tamaño de poro de 13 mm de diámetro), se colocaron en frascos viales ámbar para cromatografía de 1.5 mL (Thermo Scientific Fsher) e inmediatamente fueron analizados por HPLC-DAD.
Análisis de carotenoides por HPLC-DAD
El análisis de los carotenoides por HPLC-DAD se realizó siguiendo el método descrito por Qin (2008, 78). Los extractos de los carotenoides fueron analizados en un cromatógrafo de líquidos de alta presión Agilent 1200 (Agilent 1200 Series®, USA), equipado con una bomba cuaternaria, un inyector de muestra automática, un detector de arreglo de diodos (DAD) y equipado con una columna C18 Alltima (3,0 × 150 mm, 5 μm de partículas, Thermo Scientific®, Wilmington, USA) por un sistema binario de dos solventes en diferentes proporciones. Se utilizaron dos eluentes para el análisis, el eluente A fue metanol/metil ter-butil éter/ acetato de amonio 0.03M en agua (85:12:3 v/v/v) y el eluente B fue metanol/metanol ter-butil éter/acetato de amonio 0.03M (8:90:2 v/v/v). El gradiente utilizado fue 0 min, 0 % B; 21 min, 45 %B; 22 min, 55 %B; 33 min, 95 % B; después se mantuvo a 95 % B, hasta los 39 min; y finalmente, un ciclo de acondicionamiento de 20 min con las condiciones iniciales para el siguiente análisis. El flujo de elución fue de 0.4 mL min-1 y el tiempo total de la corrida fue 60 min. El volumen de inyección de las muestras fue de 10 µL. La cuantificación individual de los compuestos se realizó con los métodos de calibración utilizando el estándar externo (equinenona) y el estándar añadido a las muestras para obtener el porcentaje de recuperación de equinenona. Para el cálculo de los porcentajes de recuperación (%R) se procedió en inyectar en el HPLC-DAD cada extracto a una concentración conocida de equinenona y se obtuvo un área para cada carotenoide a medir. Luego, las áreas de los compuestos fueron restadas con el área de equinenona externo y con este resultado se calculó la concentración obtenida de cada carotenoide. El porcentaje de recuperación se calculó de acuerdo con la Ec. 1.
Donde el %R es el porcentaje de recuperación. CEo es la concentración de equinenona obtenido. CEa es la concentración de equinenona agregada.
Los carotenoides analizados en las bebidas de mango fueron: α-caroteno (αC) y β-caroteno (βC); y las xantofilas: (β-criptoxantina (βCr), Luteina (Lut) y zeaxantina (Zea). Los picos se compararon con los tiempos de retención (tR) y los espectros de absorción de UV/Vis de los estándares. Los carotenoides fueron detectados a 450 nm y los resultados fueron expresados como µg de carotenoide/100 mL de la bebida.
Bioaccesibilidad in vitro de carotenoides
La digestión gastrointestinal in vitro se realizó siguiendo el método descrito por Saura-Calixto et al. (2000) con algunas modificaciones. Las bebidas fueron digeridas en dos fases secuenciales: digestión gástrica (DG) e intestinal (DI). Para este análisis se colocaron 6 muestras de cada bebida, los cuales se tomaron duplicados en cada etapa de la digestión para poder ser analizadas, tal como se describe a continuación. Se midieron 100 mL de cada bebida y se les añadió 10 mL de la solución HCl-KCl (0.2 M, pH 1.5). Posteriormente, se agregó 200 μL de una disolución de pepsina (P-7000, ≥ 250 unidades/mg Sigma-Aldrich Chemical Co., St Louis MO, USA; 300 mg/mL) y se incubaron a 40 ºC por 1 h con agitación constante. Pasado el tiempo, los 100 mL de cada bebida por duplicado de cada tratamiento fueron centrifugados a 3000 rpm por 15 min a 5 °C y el sobrenadante se recuperó; se añadió nitrógeno líquido por 5 s y se almacenaron a -45 °C, con la finalidad de evitar la oxidación de los carotenoides. Este paso se llamó digestión gástrica (DG). Por otro lado, otro lote de muestra continuó el proceso de digestión, a los tubos se les agregó 5 mL de amortiguador de fosfato (0.1 M, pH 7.5) y 1000 µL de pancreatina porcina (5 mg/mL de amortiguador de fosfato 0.1 M, pH 7.5, P-1750 Sigma Aldrich,) y se incubaron por 6 h a 37 ºC con agitación constante. Posteriormente, se agregaron 9 mL del tampón Tris-maleato (0.1 M, pH 6.9) y se mezclaron con la disolución de α-amilasa (A-3176 Type VI-B, Sigma Aldrich). La solución se colocó en un baño a 37 ºC por 16 h en agitación constante. Se tomó una muestra considerada como digestión intestinal (DI) y se almacenaron en las mismas condiciones mencionadas anteriormente.
Por otro lado, otro lote de muestras procedente de la digestión intestinal se centrifugó y los sobrenadantes de los duplicados restantes se mezclaron con dos lavados con 5 mL de agua destilada y fueron transferidos a las bolsas de diálisis (12,000-14,000 de corte de peso molecular; tubo de diálisis Visking, Sigma Aldrich). Las muestras se dializaron a 25 ºC por 48 h. Finalizado el proceso, el contenido retenido de la bolsa de diálisis se almacenó en las mismas condiciones, esta fracción se le llamó fracción indigestible soluble (FIS). Por otro lado, el residuo se dejó secar durante 24 h y se almacenó 45 °C, nombrando a esta fracción como fracción indigestible insoluble (FII). A cada una de las fracciones obtenidas se les extrajeron los carotenoides y a partir de los resultados obtenidos se determinó el porcentaje de la bioaccesibilidad (%BA) de cada carotenoide utilizando la Ec. 2.
Donde el %BA es el porcentaje de bioaccesibilidad (αC, βC, βCr, Lut y Zea), DI son los caroteoides liberados en la digestión intestinal, FIS son los carotenoides determinados en la fracción indigestible soluble, FII son los carotenoides determinados en la fracción indigestible insoluble.
El porcentaje carotenoides no bioaccesibles (%NBA) fue calculado a partir de la Ec. 3:
Cinética de liberación de los carotenoides
La cinética de liberación de los carotenoides se determinó siguiendo el método reportado por Blancas-Benítez et al. (2015b, 57) con algunas modificaciones. Se tomaron 100 mL de cada bebida y se mezclaron con 10 mL de amortiguador de fosfatos (0.05 M, pH 1.5); el pH se ajustó a 1.5. A continuación se añadió 200 µL de la disolución de pepsina (P-7000, polvo ≥250 unidades/mg de Sigma-Aldrich; 300 mg/mL) y se incubó a 37 °C durante 1 h. Posteriormente, se ajustó el pH de las bebidas a 6.9 con 20 mL de amortiguador de fosfatos 0.05 M (pH 6.9) y se pusieron en bolsas de diálisis de celulosa (12,000-14,000 de corte de peso molecular; tubo de diálisis Visking, Sigma Aldrich), previamente hidratadas en 100 mL buffer fosfato 0,05 M (pH 6.9) durante 10 min. Se añadió 1000 µL de la disolución de la α-amilasa pancreática (A-6255, Sigma-Aldrich; Sigma 110 U/mL, 40µl / 7 mL), ajustando el volumen a 30 mL. Las bolsas de diálisis se colocaron en recipientes con 200 mL de tampón de fosfatos (0.05 M, pH 6.9), previamente estabilizados a 37 °C y en contante agitación. Se tomaron alícuotas de 1000 µL del medio externo (tampón de fosfato 0.05 M, pH 6.9, 37 °C) en intervalos de 30 min por 3 h las cuales fueron congeladas en nitrógeno líquido y almacenados a -45 ºC hasta su análisis. Los carotenoides se extrajeron de cada alícuota para ser cuantificados y a partir de estos resultados se determinó la velocidad inicial de liberación con la Ec. 4:
Donde: vo es la velocidad inicial de liberación de los carotenoides en tiempo específico durante la digestión in vitro (mg/min), C1-C0 es la diferencia de concentración entre la concentración específica con la concentración inicial (mg/g db) y t1-t0 es la diferencia de tiempo entre el tiempo específico y el tiempo inicial (min).
La velocidad final (Vf) y la constante de cinética (k) de αC, βC, βCr, Lut y Zea fueron determinadas a partir de las Ec. 5 y 6:
Donde, △C es la diferencia de concentración, △t es la diferencia del tiempo entre el tiempo específico y el tiempo inicial, Vf es la velocidad final de los carotenoides liberados durante la cinética de liberación in vitro, t es tiempo.
Una vez determinada la velocidad de liberación de los carotenoides se ajustaron a modelos de orden cero (Ec. 7) o de primer orden (Ec. 8):
Donde: A0 es el parámetro estimado, el sub-índice 0 indica el valor inicial, t es el tiempo (min) y k es la constante cinética en función del tiempo.
Análisis estadístico
Se realizó un análisis de varianza (ANOVA) de una sola vía, con el fin de determinar el efecto de la EAU sobre los carotenoides (α = 0.05). La prueba posterior utilizada fue una comparación múltiple de las medias aplicando la prueba de Tukey. También, se realizó una prueba de t-Student para poder comparar entre la DG y DI, así como FIS y FII. Los datos fueron procesados por el programa estadístico Statistica 10 (Stat Soft. Inc., Tulsa, OK, USA).
Resultados y Discusión
Elaboración de las bebidas de mango
Las bebidas fueron elaboradas con pulpa, cáscara y pasta de mango ‘Ataulfo’, los cuales son ricos en carotenoides. En estudios previos de nuestro grupo se cuantificó el contenido de βC en la cáscara y la pasta de esta variedad, dando resultados de 1.29 ± 0.12 mg/g p.s y 0.56 ± 0.007 mg/g p.s., respectivamente (Datos no publicados). Así mismo, se determinó la condición óptima de la EAU, la cual fue XTE: 30 min, XAS: 30 %, XC: 0.8 para ambos SP. Bajo estas condiciones el contenido de carotenoides se incrementó a 19.13 mg/g p.s. para la cáscara y 6.60 mg/g p.s para la pasta. Además, estos SP son ricos en fibra dietética (14.97 % en pasta y 41.34 % en cáscara) (Blancas-Benítez et al. (2015 b, 57). Por tal motivo, elaborar una bebida a base de estos SP de mango ‘Ataulfo’ pueden aportar ciertos beneficios a la salud debido a los compuestos bioactivos que presentan y que pueden tener actividad anti-proliferativa, anti-inflamatoria, inmunoreguladora, así como inhibir la peroxidación lipídica y aumentar la citotoxicidad de los linfocitos T y B en la sangre (Lauricella et al., 2017, 100; Lin et al. 2016, 22). También, se decidió adicionar aloe vera a las bebidas, ya que puede contribuir en diversas propiedades como la actividad del sistema nervioso central, actividad angiogénica, inmunoreguladora, antimicrobiana y gastroprotectora por su alto contenido de micronutrientes esenciales (Na, Ca, Mg y K), así como vitaminas, compuestos fenólicos, antraquinonas, mono y polisacáridos (pectina, hemicelulosa), esteroles, saponinas, aloína, aloe emodina, entre otros (Nandal y Bhardwaj, 2012, 84). Además, el aloe vera ayuda a conservar ciertos alimentos, esto debido a su ordenamiento molecular e isodiamétrica manteniendo sus propiedades sensoriales (Radi et al., 2017, 38). Sin embargo, su alto contenido de fibra dietética puede reducir la absorción de los carotenoides. Por tal motivo, se empleó la EAU debido a que esta tecnología puede romper las interacciones de la fibra dietética dejando más bioaccesibles a los compuestos que se encuentran dentro de la matriz de la fibra dietética (Carail et al., 2015, 24).
Efecto de la EAU sobre el contenido de carotenoides en las bebidas de mango ‘Ataulfo’
Al realizar los análisis cromatográficos de las bebidas de mango (BC y B-EAU), se identificaron y cuantificaron tres xantófilas (βCr, Lut y Zea) y dos carotenos (αC y βC), tal como se reporta en el Cuadro 2, donde se observa que en la BC, la Lut fue la que se encontró en mayor cantidad (3.29 µg/100 mL), seguido de αC (1.11 µg/100 mL), βCr (0.21 µg/100 mL) y Zea (0.01 µg/100 mL). Destaca el resultado de αC, que solamente había sido identificado en mango en las variedades ‘Gedong’, ‘Manalagi’, ‘Golek’, ‘Harum manis’, ‘Black-gold’ e ‘Indramayn’ (Khoo et al., 2011, 200). Nuestros resultados concuerdan con estudios previos, donde se ha reportado que la Lut es la xantófila que se encuentra en mayor concentración en la pulpa de mango (Chen et al., 2004, 16).
Cuadro 2 Contenido de carotenos y xantofilas en bebidas de mango ‘Ataulfo’.
| Bebidas de mango (Mangifera indica L.) ‘Ataulfo’ (µg/100 mL) | ||||
|---|---|---|---|---|
| BC1 | B-EAU1 | B-EAU2 | B-EAU3 | |
| Caroteno | ||||
| αC | 1.11 ± 0.03a | 1.09 ± 0.03a | 1.13 ± 0.03a | 1.16 ± 0.03a |
| βC | 0.16 ± 0.003a | 0.14 ± 0.002b | 0.07 ± 0.001c | 0.07 ± 0.001c |
| Xantofilas | ||||
| βCr | 0.21 ± 0.004b | 0.37 ± 0.007a | 0.16 ± 0.003d | 0.18 ± 0.003c |
| Lut | 3.29 ± 0.16a | 2.50 ± 0.12b | 1.44 ± 0.07d | 1.50 ± 0.07c |
| Zea | 0.01 ± 0.003b | 0.01 ± 0.0003b | 0.01 ± 0.0003b | 0.02 ± 0.0003a |
1BC: bebida sin tratamiento. B- EAU: bebida con tratamiento de ultrasonido-asistido: 1XTE: 30 min, XA: 30 %, XC: 0.8. 2XTE: 15 min, XA: 70 %, XC: 0.4. 3XTE: 12 min, XA: 100 %, XC: 1. α-caroteno (αC), β-caroteno (βC), β-criptoxantina (βCr), luteina (Lut) y zeaxantina (Zea). Los valores representan media ± desviación estándar de tres repeticiones. Diferentes letras representan diferencia significativa (α = 0.05) entre los diferentes tratamientos y el control.
El contenido de carotenoides en diferentes frutas oscila entre 0.8 µg/100 mL a 151.4 µg/100 mL (Aschoff et al., 2014, 213). Nuestros resultados fueron similares a los reportados en jugos con leche de soya tratados con altas presiones hidrostáticas (Cilla et al., 2012, 324). Sin embargo, los resultados obtenidos en esta investigación fueron menores a los reportados en la pulpa liofilizada de mango ‘Tommy Atkins’ (Petry y Mercadante, 2018, 335).
Al aplicar la EAU el contenido de los carotenos y las xantofilas cambiaron con respecto al BC (Cuadro 2), en donde se apreció un efecto negativo de la EAU sobre el contenido de Lut y βC y en menor medida βCr en las B-EAU2 y B-EAU3. Esto es debido al efecto de la cavitación sobre la estructura de estos compuestos (Song et al., 2015, 130). Song et al. (2015) observaron que los carotenoides sufren cambios estructurales cuando se encuentran en soluciones acuosas. Carail et al. (2015) reportaron que los carotenoides son inestables a altas amplitudes de sonicación (Carail et al., 2015, 274). Otros autores han reportado que los carotenoides se isomerizan durante el proceso de cavitación (Song et al., 2015, 134). Este cambio estructural (trans a cis) puede facilitar a que las xantofilas sean solubilizadas y ser absorbidas con mayor facilidad (Periago et al., 2001, 462). Por otro lado, el contenido de αC y Zea fue similar en todas las bebidas. El contenido de αC no tuvo diferencia significativa (p > 0.05) entre las bebidas. Esto se debe que el αC es un isómero que se forma a partir del 15-cis-β-caroteno durante el almacenamiento (Ornelas-Paz et al., 2008, 30; Marx et al., 2003, 45). El contenido de βC presentó diferencia significativa (p<0.05) en la B-EAU1, respecto a la BC (Cuadro 2). Se observó una disminución drástica en el contenido de βC en las muestras B-EAU2 y B- EAU3, lo cual parece indicar que la amplitud de extracción tiene un efecto importante en la estabilidad del βC. También, la βCr tuvo la misma tendencia por lo que las condiciones del EAU influyeron en la liberación de estos compuestos (Goula et al., 2017, 254).
Efecto de la EAU sobre la bioaceesibilidad in vitro de los carotenoides
La liberación de los carotenos (αC y βC) y las xantófilas (Lut, Zea y βCr) durante la digestión DG y DI in vitro de las bebidas de mango se presentan en el Cuadro 3. El contenido de αC se incrementó en la DI, frente a la DG en la BC. Sin embargo, en esta misma bebida, el contenido de βC presentó una disminución de compuestos. Estos resultados fueron similares a los encontrados en los zumos de la mezcla de frutas (kiwi, piña, mango, naranja) analizados por Rodríguez-Roque et al. (2014, 294). También pueden deberse al cambio de pH en las diferentes etapas de la digestión (Rodríguez-Roque et al., 2014, 294). Además, se sabe que la estructura del βC no cambia durante la DI (Blanquet-Diot et al., 2009, 160). Por esta razón, el contenido de βC permaneció similar entre la DG y en la DI. Al igual que el ΒC, las xantófilas (Lut y βCr) permanecieron constantes durante el proceso de digestión en la BC (Cuadro 3). Sin embargo, el contenido de Zea se redujo entre ambas etapas en la BC. De tal manera, la liberación de carotenoides entre DG y DI depende de los componentes de la matriz del alimento, las interacciones de los carotenoides con otros componentes (fibra dietética, proteínas, ácidos grasos), la forma de preparación de bebidas, los cambios de pH entre las etapas de la digestión, entre otros (Estevez-Santiago et al., 2016, 438) son algunas de las razones por las cuales pueden existir estas diferencias.
Cuadro 3 Contenido de carotenoides liberados en la digestión gástrica (DG) y digestión intestinal (DI) en las bebidas de mango ‘Ataulfo’.
| Bebidas de mango (Mangifera indica L.) ‘Ataulfo’ (µg/100 mL) | |||||
|---|---|---|---|---|---|
| BC1 | B-EAU1 | B-EAU2 | B-EAU3 | ||
| Caroteno | |||||
| DG | αC | 1.59 ± 0. 04aB | 0.79 ± 0.02bA | 0.79 ± 0.02bA | 0.05 ± 0.001cB |
| βC | 2.65 ± 0.05 aA | 0.005 ± 0.0001dB | 0.009 ± 0.002bB | 0.006 ± 0.001cB | |
| Xantofilas | |||||
| βCr | 3.74 ± 0.07aA | 0.41 ± 0.008bA | 0.41 ± 0.008bA | 0.08 ± 0.001cB | |
| Lut | 0.48 ± 0.02bA | 2.09 ± 0.10aA | 0.44 ± 0.02bB | 0.02 ± 0.001cB | |
| Zea | 0.11 ± 0.003bA | 0.23 ± 0.007aB | 0.23 ± 0.007aA | 0.01 ± 0.0003cB | |
| DI | Caroteno | ||||
| αC | 2.04 ± 0.06aA | 0.83 ± 0.02bA | 0.23 ± 0.007cB | 0.28 ± 0.008cA | |
| βC | 2.35 ± 0.04aA | 0.06 ± 0.001bA | 0.03 ± 0.0006cA | 0.01 ± 0.0002dA | |
| Xantofilas | |||||
| βCr | 3.51 ± 0.07aA | 0.14 ± 0.003cB | 0.21 ± 0.004bB | 0.12 ± 0.0002dA | |
| Lut | 0.43 ± 0.02cA | 1.68 ± 0.08aB | 0.63 ± 0.03bA | 0.31 ± 0.01dA | |
| Zea | 0.04 ± 0.001bB | 0.36 ± 0.01aA | 0.01 ± 0.0003cB | 0.03 ± 0.009bA | |
1BC: bebida sin tratamiento. B-EAU: bebida con extracción asistida por ultrasonido: 1XTE: 30 min, XA: 30 %, XC: 0.8. 2XTE: 15 min, XA: 70 %, XC: 0.4. 3XTE: 12 min, XA: 100 %, XC: 1. α-caroteno (αC), β-caroteno (βC), β-criptoxantina (βCr), luteina (Lut) y zeaxantina (Zea). Los valores representan media ± desviación estándar de tres repeticiones. Diferentes letras minúsculas representan diferencia significativa entre los diferentes tratamientos y el control. Diferentes letras mayúsculas representan diferencia significativa entre etapas de digestión.
El Cuadro 3 se observa que al aplicar la EAU existe una disminución en el contenido de los carotenos y xantofilas en la DG y DI. El contenido de αC, βC, βCr disminuyó con respecto a BC en la DG. En este sentido, la disminución de estos compuestos fue mayor en la B-EAU3. Sin embargo, el contenido de Lut fue mayor en la B-EAU1 con respecto a BC y las B-EAU1 y B-EAU2 tuvieron mayor contenido de Zea con respecto a BC en la DG (Cuadro 3). De la misma manera, en la DI se aprecian estos comportamientos. Por lo tanto, las amplitudes altas generaron un efecto negativo sobre el contenido de las xantofilas (Song et al., 2015, 233).
El contenido de carotenos y xantofilas liberados durante la digestión in vitro de las EAU presentaron cambios importantes. El Cuadro 3 se observa un cambio significativo en la liberación de los carotenos y xantofilas entre la DG y DI. El αC tuvo una diferencia significativa (p< 0.05) entre las bebidas excepto en la B-EAU1. Las xantofilas (βC, βCr y Lut) mostraron diferencias significativas (p <0.05) en todas las bebidas con la EAU. Sin embargo, la Zea presentó diferencia en todas las bebidas. En el Cuadro 3, se muestra que en la B-EAU1 el contenido de αC aumentó en la DI. Sin embargo, el contenido de Lut disminuyó en la misma bebida en esta etapa digestiva. En cambio, el contenido de Zea aumentó en la B-EAU1 en la DI. Esto puede ser explicado en parte considerando que durante la EAU el αCr, la neoluteina, neoluteina monoester y neoluteina epóxido A y B sufren cambios estructurales produciendo la Zea (Cano y Ancos, 1994, 252). Del mismo modo, el contenido de βC aumentó en la DI en todas las bebidas con la EAU. Por lo tanto, los resultados muestran que los carotenos y las xantofilas son estables en TE prolongados y en AS bajas del EAU (Poojary et al., 2016, 584; Song et al., 2015, 220). Sin embargo, el proceso de cavitación en la B-EAU3 ocasionado por elevadas AS, produjo una disminución en el contenido de βCr y Lut, posiblemente debido a las reacciones de isomerización y/o oxidación (Song et al., 2015, 236).
Por otro lado, al hacer un comparativo entre el contenido de los carotenos y xantofilas sin el proceso de digestión in vitro (Cuadro 2) y con el proceso de digestión in vitro (Cuadro 3) se puede observar que el contenido de αC, βC, βCr y Zea en la BC aumenta en la DI. En contraste, en las B-EAUs los carotenos y las xantofilas dismininuyeron a excepción de la Zea (XTE: 30 min, XAS: 30 %, XC: 0.8), βCr (XTE: 12 min, XAS: 70 %, XC: 0.4) y Zea (XTE: 12 min, XAS: 100 %, XC: 1) (Cuadro 3). Por lo tanto, a pesar del incremento en Zea la EAU tuvo un impacto negativo sobre la bioaccesibilidad de los carotenoides cuando se encontraron en medios acuosos y sometidos a EAU (Carrillo-López et al., 2017, 52; Corte-Real et al., 2017; 14).
En el Cuadro 4 se muestra el contenido de los carotenos y xantófilas que están asociados en la FIS y FII. El contenido de αC de todas las bebidas presentó diferencia significativa (p< 0.05) entre FIS y FII. En contraste, el βC de la B-EAU no presentó diferencia significativa (p> 0.05). Sin embargo, todas las xantofilas de BC no presentaron diferencia significativa entre FIS y FII. Por el contrario, la βCr y Lut en las B-EAU1 y B-EAU2 presentaron diferencia significativa entre FIS y FII (p <0.05). En contaste; las tres xantofilas en la B-EAU3 no tuvieron diferencia significativa (p >0.05). La presencia de carotenoides en la FIS y FII se puede deber a que la interacción entre la fibra dietética (cáscara, pasta, pulpa) con la goma xantana mantiene a los carotenoides atrapados en una red que retarda o impide su liberación durante el proceso de digestión (Goñi et al., 2006, 236; Fernández-García et al., 2012, 91). Sin embargo, la energía que se generó durante el proceso de la cavitación facilitó la liberación de los carotenoides al romper las interacciones intermoleculares entre la goma xantana con la fibra dietética y los enlaces del complejo fibra-carotenoide (D'Evoli et al., 2013, 140; Palafox-Carlos et al., 2011, 268). En concordancia con los valores de carotenoides durante el proceso digestivo in vitro (Cuadro 3), el contenido de αC, βC y βCr disminuyeron en los EAUs (Cuadro 3). Sin embargo, la presencia de los carotenos y las xantofilas en la FIS y FII puede deberse a que estos compuestos están asociados con otros componentes formando interacciones covalentes y puentes de hidrógeno que impiden su liberación (Palafox-Carlos et al., 2011, 268; D'Evoli et al., 2013, 142). De tal manera, su retención en la FIS y FII pueden llegar al intestino grueso y pueden tener un efecto favorable en el colon por la acción de la microbiota (Sen et al., 2013, 11; Taipina et al., 2013, 58). Cabe mencionar, que no existen estudios sobre el efecto positivo y/o negativo del contenido de carotenoides en la FII, lo que abre la posibilidad de estudiar el efecto que pueden ejercer los carotenoides en el colon.
Cuadro 4 Contenido de carotenos y xantófilas asociadas a la fracción indigestible soluble (FIS) y fracción indigestible insoluble (FII) en las bebidas de mango ‘Ataulfo’1.
| Bebidas de mango (Mangifera indica L.) ‘Ataulfo’ (µg/100 mL) | |||||
|---|---|---|---|---|---|
| BC1 | B-EAU1 | B-EAU2 | B-EAU3 | ||
| Caroteno | |||||
| FIS | αC | 1.42 ± 0.04aA | 0.45 ± 0.01bA | 0.18 ± 0.005cB | 0.17 ± 0.005cB |
| βC | 0.88 ± 0.01aB | 0.03 ± 0.0006bA | 0.01 ± 0.0002cA | 0.02 ± 0.0004cA | |
| Xantofilas | |||||
| βCr | 1.25 ± 0.02aA | 0.04 ± 0.0008cB | 0.08 ± 0.001bB | 0.09 ± 0.001bA | |
| Lut | 0.40 ± 0.02bA | 0.76 ± 0.04aA | 0.39 ± 0.02cA | 0.25 ± 0.01dA | |
| Zea | 0.02 ± 0.0006cA | 0.15 ± 0.004aA | 0.005 ± 0.001dB | 0.03 ± 0.0009bA | |
| FII | Caroteno | ||||
| αC | 0.99 ± 0.03aB | 0.19 ± 0.005cB | 0.51 ± 0.01bA | 0.51 ± 0.01bA | |
| βC | 0.99 ± 0.02aA | 0.01 ± 0.0004bB | 0.01 ± 0.0004bA | 0.009 ± 0.0001cB | |
| Xantofilas | |||||
| βCr | 1.58 ± 0.03aA | 0.09 ± 0.002cA | 0.10 ± 0.002bA | 0.10 ± 0.002bA | |
| Lut | 0.34 ± 0.01aA | 0.20 ± 0.01cB | 0.29 ± 0.01bB | 0.29 ± 0.01bA | |
| Zea | 0.02 ± 0.0006cA | 0.19 ± 0.005aB | 0.05 ± 0.001bA | 0.02 ± 0.0006cA | |
1BC: bebida sin tratamiento. B-EAU: bebida con extracción asistida por ultrasonido: 1XTE: 30 min, XA: 30 %, XC: 0.8. 2XTE: 15 min, XA: 70 %, XC: 0.4. 3XTE: 12 min, XA: 100 %, XC: 1. α-caroteno (αC), β-caroteno (βC), β-criptoxantina (βCr), luteina (Lut) y zeaxantina (Zea). Los valores representan media ± desviación estándar de tres repeticiones. Diferentes letras minúsculas representan diferencia significativa entre los diferentes tratamientos y el control. Diferentes letras mayúsculas representan diferencia significativa entre etapas de digestión.
Efecto de la EAU sobre el porcentaje de bioaccesibilidad de los carotenoides
En la Figura 1 se muestra el %BA de carotenos (αC, βC) (Figura 1A) y xantofilas (Lut, βCr y Zea) (Figura 1B), en las bebidas de mango.
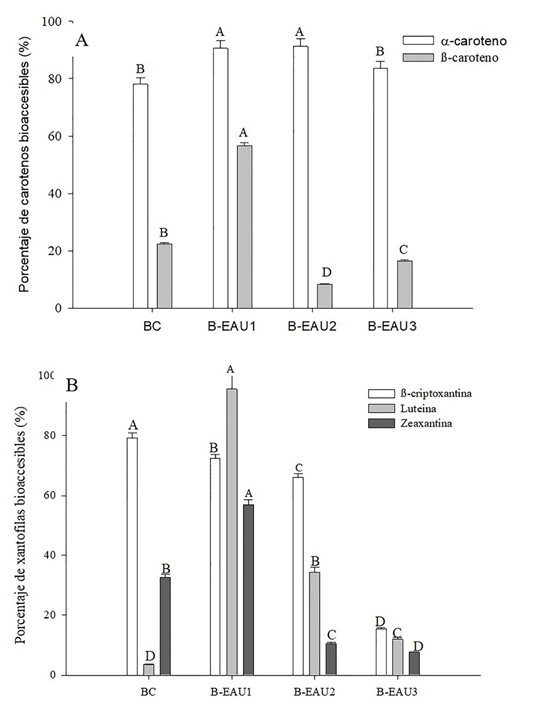
Figura 1 Porcentaje de bioaccesibilidad de (A) carotenos (α-C y β-C) y (B) xantófilas (Lut, Zea y β-Cr) en las bebidas de mango ‘Ataulfo’ (BC: bebida sin tratamiento. B-EAU: bebida con tratamiento de ultrasonido-asisitido: 1 (XTE: 30 min, XA: 30 %, XC: 0.8); 2(XTE: 15 min, XA: 70 %, XC: 0.4); 3 (XTE: 12 min, XA: 100 %, XC: 1). Los valores representan media ± desviación estándar de tres repeticiones. Diferentes letras representan diferencia significativa entre los diferentes tratamientos y el control.
La Figura 1A muestra que el αC presentó un %BA mayor en todos los EAU, respecto a la BC, con un 91.22 % (B-EAU2), 90.54 % (B-EAU1) y 83.52 % (B-EAU3). Por otra parte, el %BA de βC fue mayor en la B-EAU1 (56.68 %). La Figura 1B muestra que la βCr presentó un %BA mayor (79.35 %) en BC, en comparación con los tratamientos con EAU, por lo que la cavitación tuvo un efecto negativo en la estructura de esta xantofila. Sin embargo, para el resto de las xantofilas (Lut y Zea) el %BA fue mayor en el tratamiento B-EAU1 con un 95.63 y 56.88 %, respectivamente. Por lo tanto, las amplitudes altas y los tiempos de exposición prolongados (B-EAU1) favorecen la libración de los carotenos (αC y βC), Lut y Zea (Ofori-Boateng y Lee, 2013, 301). Por último, el βC es el caroteno más abundante en el mango, el cual se puede encontrar en forma all-trans, all-cis y cis-9 (Figura 1B) (Low et al., 2015, 70; Khoo et al., 2010, 8). De tal manera, la concentración de estos compuestos, las condiciones de las B-EAUs pueden contribuir en el %BA de los carotenos.
Las xantofilas (Lut, Zea) tienen actividad provitamínica, previenen patologías crónicas como el cáncer, enfermedades cardiovasculares, enfermedades de la visión (cataratas y degeneración macular asociada a la edad) y enfermedades relacionadas al envejecimiento (Taipina et al., 2013, 60; Edwards, 2016, 29; Mares, 2016, 6).
Por otra parte, se determinó el porcentaje de los carotenos y xantófilos no bioaccesibles a partir de la diferencia del %BA (Figura 2).
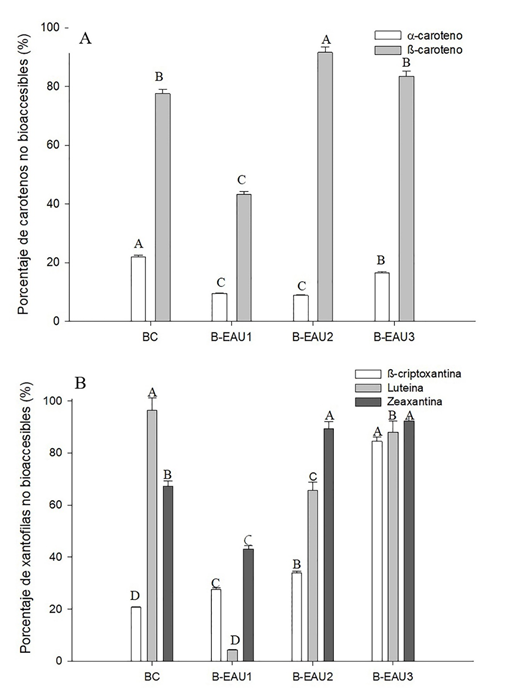
Figura 2 Porcentaje no bioaccesible de (A) carotenos (α-C y β-C) y (B) xantofilas (Lut, Zea y β-Cr) en las bebidas de mango ‘Ataulfo’ (BC: bebida sin tratamiento. B-EAU: bebida con tratamiento de ultrasonido-asisitido: bebida con tratamiento de ultrasonido-asisitido: 1 (XTE: 30 min, XA: 30 %, XC: 0.8); 2(XTE: 15 min, XA: 70 %, XC: 0.4); 3 (XTE: 12 min, XA: 100 %, XC: 1). Los valores representan media ± desviación estándar de tres repeticiones. Diferentes letras representan diferencia significativa entre los diferentes tratamientos y el control.
Los carotenos no bioaccesibles son aquellos que quedaron retenidos en la FIS y la FII. El porcentaje de βC no bioaccesible fue de 91.6, 83.5, 77.5 y 43.2 % en las bebidas B-EAU2, B-EAU3, BC y B-EAU1, respectivamente (Figura 2A). El porcentaje no bioaccesible del αC fue mayor (21.9 %) en la BC respecto a las demás bebidas. También, en la misma bebida se observó el mismo efecto en la Lut (96.5 %). El mayor porcentaje de βCr y Zea no bioaccesibles se presentó en la BC y B-EAU3 con un 96.5 y 92.3 %, respectivamente (Figura 2B). Por lo tanto, encontrar xantofilas y carotenos asociados en la fracción indigestible de las bebidas de mango pueden ejercer funciones en el colon, ya que son inmunomodulares, por ejemplo, astaxantina, βCr y Zea favorecen la inhibición del cáncer de colon (Kuppusamy et al., 2014, 146). Así mismo, el βC puede favorecer la proliferación de microbiota precursora de la fermentación colónica. Se conoce que el βC es un sustrato para el crecimiento de E. coli, el cual produce ácidos grasos de cadena corta (Jawed et al., 2016, 202; Wassef et al., 2014, 232).
Cinética de liberación de los carotenoides
El contenido de αC, βC, βCr, Lut y Zea liberado de las bebidas de mango se muestra en el Cuadro 5, donde se observa que la liberación de αC fue mayor (1.92 µg/100 mL), seguido de βCr (0.82 µg/100 mL), Lut (0.40 µg/100 mL), Zea (0.12 µg/100 mL) y βC (0.08 µg/100 mL) en la BC a los 180 min. Este comportamiento se puede explicar considerando que existe una acción sinérgica o antagónica entre ellos durante su liberación (Ordoudi et al., 2015, 20; Fernández-García et al., 2008). También, durante el proceso de la cinética de liberación, existen otros compuestos que pudieran estar ejerciendo estas acciones sobre los carotenoides tales como la fibra dietética (Ordoudi et al., 2015, 22).
Cuadro 5 Cinética de liberación de α-caroteno (αC), β-caroteno (βC), β-criptoxantina (βCr), luteina (Lut), zeaxantina (Zea) en las bebidas de mango ‘Ataulfo’.
| Tiempo (min) | Bebidas de mango (Mangifera indica L.) ‘Ataulfo’ (µg/100 mL) | ||||
|---|---|---|---|---|---|
| BC1 | B-EAU1 | B-EAU2 | B-EAU3 | ||
| 30 | 0.21 ± 0.006b | 0.77 ± 0.02a | 0.11 ± 0.003c | 0.07 ± 0.002d | |
| 60 | 0.25 ± 0.007b | 0.78 ± 0.02a | 0.25 ± 0.007b | 0.14 ± 0.004c | |
| αC | 90 | 0.49 ± 0.01c | 0.83 ± 0.02a | 0.61 ± 0.01b | 0.28 ± 0.008d |
| 120 | 0.50 ± 0.01c | 0.97 ± 0.03a | 0.63 ± 0.02b | 0.40 ± 0.01d | |
| 150 | 0.62 ± 0.02c | 1.63 ± 0.05a | 1.50 ± 0.04a | 0.71 ± 0.02b | |
| 180 | 1.92 ± 0.05b | 2.28 ± 0.06a | 2.43 ± 0.07a | 2.63 ± 0.08a | |
| 30 | 0.02 ± 0.0004b | 0.11 ± 0.002a | 0.004 ± 0.001c | 0.11 ± 0.002a | |
| 60 | 0.04 ± 0.008d | 0.11 ± 0.002c | 0.53 ± 0.01a | 0.28 ± 0.005b | |
| βC | 90 | 0.04 ± 0.008d | 0.92 ± 0.02b | 1.02 ± 0.02a | 0.39 ± 0.008c |
| 120 | 0.04 ± 0.008d | 1.63 ± 0.03b | 2.37 ± 0.04a | 0.65 ± 0.01c | |
| 150 | 0.07 ± 0.001c | 3.22 ± 0.06a | 3.03 ± 0.06a | 1.14 ± 0.02b | |
| 180 | 0.08 ± 0.001b | 4.84 ± 0.09a | 4.30 ± 0.08a | 4.74 ± 0.09a | |
| 30 | 0.26 ± 0.005 | 2.88 ± 0.05 | 1.47 ± 0.03 | 0.48 ± 0.009 | |
| 60 | 0.26 ± 0.005 | 3.54 ± 0.07 | 1.48 ± 0.03 | 0.73 ± 0.01 | |
| βCr | 90 | 0.33 ± 0.006 | 4.96 ± 0.09 | 1.49 ± 0.03 | 0.80 ± 0.01 |
| 120 | 0.35 ± 0.007 | 6.43 ± 0.12 | 2.61 ± 0.05 | 1.02 ± 0.02 | |
| 150 | 0.35 ± 0.007 | 7.49 ± 0.15 | 2.78 ± 0.05 | 2.53 ± 0.05 | |
| 180 | 0.82 ± 0.01 | 9.15 ± 0.18 | 3.95 ± 0.08 | 6.16 ± 0.12 | |
| 30 | 0.07 ± 0.003c | 0.49 ± 0.02a | 0.45 ± 0.02b | 0.001 ± 0.0005d | |
| 60 | 0.11 ± 0.005a | 0.55 ± 0.02a | 0.45 ± 0.02b | 0.004 ±0 .0002c | |
| Lut | 90 | 0.21 ± 0.01c | 0.65 ± 0.03a | 0.56 ± 0.03b | 0.68 ± 0.03a |
| 120 | 0.40 ± 0.02d | 0.77 ± 0.03a | 0.57 ± 0.03c | 0.73 ± 0.03b | |
| 150 | 0.43 ± 0.02d | 0.71 ± 0.03b | 0.62 ± 0.03c | 1.03 ± 0.05a | |
| 180 | 0.40 ± 0.02d | 0.86 ± 0.04c | 1.23 ± 0.06a | 1.24 ± 0.06b | |
| 30 | 0.009 ± 0.0002d | 0.04 ± 0.001a | 0.02 ± 0.006c | 0.03 ± 0.0009b | |
| 60 | 0.03 ± 0.0009b | 0.08 ± 0.002a | 0.02 ± 0.006c | 0.03 ± 0.0009b | |
| Zea | 90 | 0.14 ± 0.004a | 0.11 ± 0.003a | 0.03 ± 0.009b | 0.03 ± 0.0009b |
| 120 | 0.13 ± 0.004a | 0.12 ± 0.003a | 0.03 ± 0.009c | 0.06 ± 0.0002b | |
| 150 | 0.13 ± 0.004b | 0.13 ± 0.004b | 0.05 ± 0.001c | 0.65 ± 0.02a | |
| 180 | 0.12 ± 0.003c | 0.14 ± 0.004c | 0.72 ± 0.02b | 1.74 ± 0.05a | |
BC: bebida sin tratamiento. B-EAU: bebida con extracción asistida por ultrasonido: 1 (XTE: 30 min, XA: 30 %, XC: 0.8); 2(XTE: 15 min, XA: 70 %, XC: 0.4); 3 (XTE: 12 min, XA: 100 %, XC: 1). Los valores representan media ± desviación estándar de tres repeticiones. Diferentes letras minúsculas representan diferencia significativa entre los diferentes tratamientos y el control.
Al comparar la liberación de los carotenos y las xantofilas en las B-EAUs, se observó que presentaron mayor velocidad de liberación con respecto a la BC. En el Cuadro 5 se observa que los carotenos (αC y βC) en las B-EAUs no tuvieron diferencia significativa a los 180 min. Sin embargo, la liberación de βCr (9.15 µg/100 mL) en la B-EAU1 fue mayor que el resto de las bebidas. Del mismo modo, Lut y Zea tuvieron mayor liberación en la B-EAU2. Por tal motivo, se considera que el efecto de las condiciones del EAU influye en la liberación de estos compuestos (Goula et al., 2017, 254).
Por otra parte, al comparar el cuadro anterior con la bioaccesibilidad, se puede concluir que el efecto de la EAU durante el proceso de digestión favoreció la liberación de estos compuestos, sin embargo su bioaccesibilidad fue menor. Estos resultados sugieren que existen factores que influyen negativamente sobre la bioaccesibilidad, como la presencia de algunos minerales (cofactores divalentes), la fibra dietética, el tipo de lípidos presentes, que son liberados durante el proceso de digestión (Eriksen et al., 2017, 51; Corte Real et al. 2016, 35). Por esta razón, se analizó la velocidad de liberación de los carotenos y xantofilas.
En la Figura 3 se muestran las velocidades de liberación de αC, βC, Lut, Zea y βCr en las bebidas del mango. En la Figura 3A y 3B se observa que el comportamiento de la liberación de αC y βC fueron similares en todas las muestras, respectivamente. Sin embargo, αC y βC tuvieron una mayor velocidad de liberación en la B-EAU3 en los 180 min (Figura 3A).

Figura 3 Velocidad de liberación de α-Caroteno (A), β-Caroteno (B), β-Criptoxantina (C), Luteína (D) y Zeaxantina (E) en las bebidas de mango ‘Ataulfo’ (BC: bebida sin tratamiento. B- EAU: bebida con tratamiento de ultrasonido-asistido: bebida con tratamiento de ultrasonido-asistido: 1 (XTE: 30 min, XA: 30 %, XC: 0.8); 2(XTE: 15 min, XA: 70 %, XC: 0.4); 3 (XTE: 12 min, XA: 100 %, XC: 1).
Las Figuras 3C y 3E muestran que la liberación de βCr y Zea fueron a partir de los 120 min. En la Figura 3D se muestra la velocidad de liberación de Lut, en donde su liberación máxima estuvo en las muestras B-EAU2 y B-EAU3 a los 180 min. Estos resultados se deben que el βC, Zea y algunos ácidos grasos (ácido palmítico y laúrico) presentes en el mango facilitan el transporte por difusión facilitada de la Lut (Nwachukwu et al., 2016, 315; Nidhi et al., 2014, 257). Sin embargo, el efecto de la cavitación rompe los enlaces ésteres, puentes de hidrógeno y covalentes de las xantofilas con la fibra dietética haciendo su liberación con mayor facilidad (Nwachukwu et al., 2016, 185; Altemimi et al., 2015, 103). Por lo tanto, se determinaron los parámetros cinéticos de la liberación de cada caroteno y xantofilas. En el Cuadro 6 se muestran los parámetros cinéticos Vf y k, de los carotenos y xantófilas a partir de la cinética de liberación.
Cuadro 6 Determinación de los parámetros cinéticos del α-caroteno (αC), β-caroteno (βC), β-criptoxantina (βCr), luteina (Lut) y zeaxantina (Zea) en las bebidas de mango ‘Ataulfo’1.
| Bebidas de mango (Mangifera indica L.) ‘Ataulfo’ (µg/100 mL) | ||||
|---|---|---|---|---|
| BC1 | B-EAU1 | B- EAU2 | B-EAU3 | |
| αC | ||||
| Vf | 1.19 | 0.004 | 0.038 | 2.42 |
| k | 1.013 | 0.007 | 0.020 | 0.022 |
| R | 0.8865 | 0.8641 | 0.8263 | 0.7974 |
| βC | ||||
| Vf | 2.007 | 2.007 | 2.53 | 2.41 |
| k | 0.009 | 0.028 | 0.039 | 0.022 |
| R | 0.9505 | 0.8764 | 0.7276 | 0.9276 |
| βCr | ||||
| Vf | 2.44 | 0.004 | 3.76 | 2.422 |
| k | 0.006 | 0.008 | 0.007 | 0.016 |
| R | 0.8809 | 0.9556 | 0.9363 | 0.8661 |
| Lut | ||||
| Vf | 1.33 | 0.004 | 3.21 | 2.81 |
| K | 0.012 | 0.004 | 0.006 | 0.049 |
| R | 0.9642 | 0.9041 | 0.9503 | 0.933 |
| Zea | ||||
| Vf | 3.47 | 0.001 | 2.43 | 1.35 |
| k | 0.016 | 0.007 | 0.020 | 0.027 |
| R | 0.9994 | 0.919 | 0.8674 | 0.8519 |
1BC: bebida sin tratamiento. B-EAU: bebida con tratamiento de ultrasonido-asisitido: 2XTE: 30 min, XA: 30 %, XC: 0.8. 3XTE: 15 min, XA: 70 %, XC: 0.4. 4XTE: 12 min, XA: 100 %, XC: 1. Vf: Velocidad final de liberación (µg/min); k: constante cinética.
En el Cuadro 6 se observan los parámetros estimados para los carotenos y las xantofilas en cada bebida. La Zea presentó una mayor liberación (3.47 µg/min) en BC. Sin embargo, en las bebidas con la EAU, el βC presentó una concentración mayor (2.007 µg/min) en B- EAU1, βCr (3.76 µg/min) en B-EAU2 y Lut (2.81 µg/min) en la B- EAU3. También, en este Cuadro 6 se muestra el ajuste de los datos al modelo cinético de primer orden (R), que ratifica que el proceso de liberación de los carotenos y xantofilas está controlado por reacciones químicas que ocurren durante el proceso de digestión y no por difusión. Por lo tanto, la variabilidad del ajuste de cada compuesto depende de la heterogeneidad del alimento lo cual es habitual cuando se trabaja con alimentos, en los que la composición no es únicamente dependiente del compuesto sino también de la cantidad de la muestra dentro del alimento (Shannon et al., 2017, 465; Kodal y Aksu, 2017, 130). Así mismo, la liberación de los carotenos y xantofilas va a depender de las propiedades de incremento de viscosidad que puede presentar la fibra dietética soluble lo que favorece un proceso de difusión más lento (Palafox-Carlos et al., 2011, 401; Kotake-Nara y Nagao, 2011, 33). De esta manera, estudios previos han demostrado que la matriz alimentaria, las interacciones con la fibra dietética, proteínas y ácidos grasos (esterificados o en forma libre), dentro de las micelas, pH del medio (en comparación con el agua), la competencia entre los mismos carotenoides, la formulación de ciertas bebidas, los tratamientos físicos y tecnológicos influyen en el comportamiento de la liberación de los compuestos de interés (Kong et al., 2016. 168; Domínguez-Cañedo et al., 2015, 425; Mardai et al., 2012, 201).
Conclusiones
Los SP de mango ‘Ataulfo’ fueron utilizados en este estudio para elaborar bebidas con la aplicación del EAU. También, el uso de nuevas tecnologías como la EAU pueden resultar una alternativa viable para la extracción de estos compuestos y tener más bioaccesibles a los carotenos y xantofila. De esta manera, el contenido de las xantofilas y los carotenos de las bebidas dependió de cada condición de EAU. Sin embargo, la B-EAU1 tuvo la mayor bioaccesibilidad in vitro de luteína, zeaxantina, α-caroteno y β-caroteno en un 95.63, 56.88, 58.68, y 90.54 %, respectivamente. Sin embargo, la BC y la B-EAU3 tuvieron mayor retención a la β-criptoxantina (96.5 %) y zeaxantina (92.3 %), respectivamente. Del mismo modo, los factores intrínsecos de las bebidas al igual que EAU influyeron en la velocidad de liberación de los carotenoides.











 nueva página del texto (beta)
nueva página del texto (beta)


