Introducción
La lignocelulosa es la materia orgánica más abundante en la tierra y está compuesta de tres polímeros: celulosa (35-50%), hemicelulosa (25-30%) y lignina (25-30%) (Wang et al. 2011, 9321). Se encuentra presente en maderas, maderas suaves, residuos agroindustriales como la paja de trigo, rastrojos de maíz, etc., a partir de los cuales puede ser utilizada como materia prima para la producción de celulosa en la industria del papel. Sin embargo, para la extracción de celulosa es necesario solubilizar la lignina y dado que este compuesto es recalcitrante, el material se somete a diferentes tratamientos térmicos o químicos conocidos como pulpeo; estos procesos son caros, contaminan gran cantidad de agua en los lavados de la pulpa, ocasionando daños ambientales por los productos químicos utilizados en el proceso. Por estos motivos, ha sido necesario buscar alternativas para contrarrestar estos efectos negativos, como lo es el proceso de biopulpeo, que consiste en deslignificar las materias primas mediante el uso de hongos de pudrición blanca, ya que poseen un complejo de enzimas específicas que atacan a la lignina previamente a la utilización de un proceso fisicoquímico tradicional (Scott et al. 1998, 17).
Las enzimas ligninolíticas extracelulares pueden ser lacasas Lac (EC. 1.10.3.2), lignino peroxidasas LiP (E.C. 1.11.1.14), manganeso peroxidasa MnP (E.C, 1.11.1.13), versátil peroxidasas VP (E.C. 1.11.1.16) (Järvinen et al., 2012, 1).
Se conocen diferentes cepas con capacidad para producir enzimas ligninolíticas como Pleurotus ostreatus (Thakur et al. 2012, 2), Ceriporiopsis subvermispora (Saad et al. 2008, 221), Phanerochaete chrysosporium (Tanaguchi et al. 2005, 638), sin embargo, se considera que el uso de cepas nativas asegura la sobrevivencia del inóculo si proviene del medio donde se encuentra el sustrato (Li et al. 2011, 1587 ). El uso de técnicas cualitativas para la selección de cepas con potencial enzimático es una herramienta poderosa (Lalita y Pasher 2014, 1) ya que permite de manera rápida determinar la capacidad de los hongos de secretar enzimas y su comparación mediante el I.P. (Valenzuela et al. 2001, 743). El objetivo de este trabajo es identificar cepas de hongos nativos del Valle del Yaqui con actividad ligninolítica para su posterior aplicación en el proceso de biopulpeo sobre material lignocelulósico.
Método
Las cepas evaluadas de hongos nativos fueron aisladas del suelo destinado a la producción de trigo, bajo prácticas agrícolas orgánicas (TSO) o mixtas (química y orgánica) (TSM). Las cepas (TSM40, TSM35, TSO46, TSO45, TSM32, TSM36, TSO38, TSO41, TSO39, TSM43) pertenecen a COLMENA (Colección de Microorganismos Edáficos y Endófitos Nativos), proporcionados por el Laboratorio de Biotecnología del Recurso Microbiano del Instituto Tecnológico de Sonora en el Valle del Yaqui, Sur de Sonora. Todas las cepas fueron conservadas en agar extracto de malta (AEM). Las cepas aún se encuentran en estudio para determinar su género y especie.
Actividad ligninolítica
La selección de hongos por actividad extracelular de LiP fue realizada en medio sólido en placa con AEM, con 0.1 g/L de Azure B (Lalita y Prasher 2015, 2). La actividad positiva de los aislados seleccionados se basó en el cambio de morado-azul a azul claro (Montoya et al. 2014, 118). La selección de hongos por actividad extracelular de Lac fue realizada con AEM, con 0.05% de ABTS (2,2’azino- bis (3-etilbenzo-tiazolin-6-ácido sulfónico) a 30° C (Martín-Sampedro et al. 2015,121); la actividad positiva de los aislados seleccionados se basó en la formación de halos color verde. La selección de hongos por producción de Xil para actividad hemicelulolítica se realizó en placas de AEM conteniendo 0.1% de xilano por 14 días a 23°C (Sasidhara y Thirunalasundari 2014, 377). Se tiñó la placa con 15 ml de solución rojo congo al 0.1% (Koyani et al. 2014, 3) y se dejó reposar por 15 minutos; posteriormente, se lavó la placa con 10 ml de solución de NaCl 1M, se dejó reposar por 10 minutos y se repitió la operación. La actividad positiva xilanolítica de las cepas seleccionadas se basó en formación de halos color naranja claro en la placa. La cantidad de inóculo en cada una de las pruebas fue de 2x106 esporas fúngicas/mL.
Índice de Potencia
La actividad de LiP se detectó mediante la formación de un halo azul claro; para Lac, una formación de halo verde, y para actividad xilanolítica, una formación de halo naranja claro. A los 14 días de incubación de las placas, se tomaron fotografías de las cepas con una cámara fotográfica Nikon D3300 y se utilizó un calibrador Vernier Surtek 122206 para estandarizar la longitud de las mediciónes, y fueron procesadas para la determinación de la longitud de los halos con el Software Image J 1.44 (Figura 1) para su subsecuente cálculo del índice de potencia (IP), usando la expresión (1) (De la Rosa-Hernández et al., 2014).

Figura 1 Cepa TSO40 en medio sólido AEM 0.1 g/L Azure B: A significa la medición del área del hongo, B es la medición del área del halo de actividad enzimática, C significa el área en mm2 del crecimiento del hongo calculado por Image J 1.44.
Los resultados son reportados como media ± desviación estándar (SD) de las muestras por triplicado. Se realizó una prueba de comparación de medias simple para comparar y seleccionar la cepa con mayor I.P. La diferencia significativa de cada tratamiento se determinó usando Statgraphics Plus 5.1 con un P-value <0.05.
Resultados
Para la selección de cepas con posible actividad de LiP, se utilizó el colorante Azure B, (Archibald 1993, 3112); para Xil en el medio sólido, se usó xilano como inductor, y el revelado se realizó mediante la técnica de rojo congo (Bairagi 2016, 2). En el caso de Lac, el indicador e inductor fue ABTS (Chaparro et al 2009, 239). El criterio de selección de las cepas productoras de enzimas consistió en la utilización del I.P., eligiendo aquellas que presenten los valores mayores de I.P. para su posible aplicación en estudios posteriores.
En la Tabla 1 se obsevan las cepas positivas de acuerdo con su I.P. Las cepas TSM32 y TSO38 no presentaron actividad en este análisis. El hecho de que una cepa pueda secretar enzimas ligninolíticas, no significa que sea capaz de expresar todo el paquete enzimático ligninolítco (Archibald 1992, 3110); lo interesante en este estudio es que las cepas TSM50, TSM35 y TSO46 presentaron actividad positiva en las cuatro enzimas evaluadas, considerándose como cualidades favorables a la hora de escalar el estudio a una matriz compleja.
Tabla 1 Resultados de I.P.
| Cepa | I.P | ||
|---|---|---|---|
| LiP | Lac | Xil | |
| TSM40 | 1.14±0.01 | 1.11±1.46 | 1.03±0.00 |
| TSM35 | 3.83±0.29 | 7.50±0.94 | 1.29±0.00 |
| TSO46 | 1.20±0.13 | 20.79±2.70 | 1.38±0.00 |
| TSO45 | 1±0.00 | N.D. | N.D. |
| TSM36 | N.D. | 0.35±0.61 | 1.09±0.00 |
| TSO41 | 1.48±0.28 | N.D. | N.D. |
| TSO39 | N.D. | N.D. | N.D. |
| TSM43 | N.D. | 0.38±0.44 | N.D. |
Presentados con media ± desviación estándar (SD) P=0.05 N.D.= no detectable
Actividad de LiP
Se obtuvieron cinco cepas con actividad positiva de LiP TSM35>TSO41>TSO46>TSO40>TSO45, siendo TSM35 la más deseable según el análisis estadístico de diferencia de medias (Figura 3).

Figura 3 Diferencia de medias de índice de potencia a los 14 días de incubación de las cepas en medio extracto de malta con Azure B para revelar la actividad de LiP
Para la enzima LiP se detectaron cinco cepas con actividad positiva, siendo TSO45 la de menor I.P. con un valor de 1±0.00. En el caso de esta cepa, a medida que crecía el hongo, iba mostrando una decoloración que cubría la misma área que el crecimiento fúngico, por lo que para el índice de potencia se tomó el valor de 1, situación que no se presentó en las cepas en las que se indica que no hubo actividad. Las TSM40, TSO46 y TSO41 tuvieron un I-P., con un rango entre 1.14 y 1.48, siendo la cepa TSM35 la de mayor I.P. con un valor de 3.83 ± 0.29.
Se ha reportado el uso de Azure B como indicador de producción de LiP en medio sólido (Zhao et al. 1996, 396; Xu et al. 2015, 8 ; Gutiérrez-Soto et al. 2015, 6678). Por otro lado, en el estudio realizado por Montoya y colaboradores (2014, 121), se han detectado mediante formación de halos con Azure B, cepas productoras de LiP, las cepas Trametes trogii y Coriolus versicolor que probaron posteriormente en una matriz de aserrín de roble.
Actividad de Lacasa
Se obtuvieron cuatro cepas con actividad positiva de Lac TSO46>TSM35>TSM36>TSM43, siendo TSO46 la más deseable según el análisis estadístico de diferencia de medias (Figura 4).
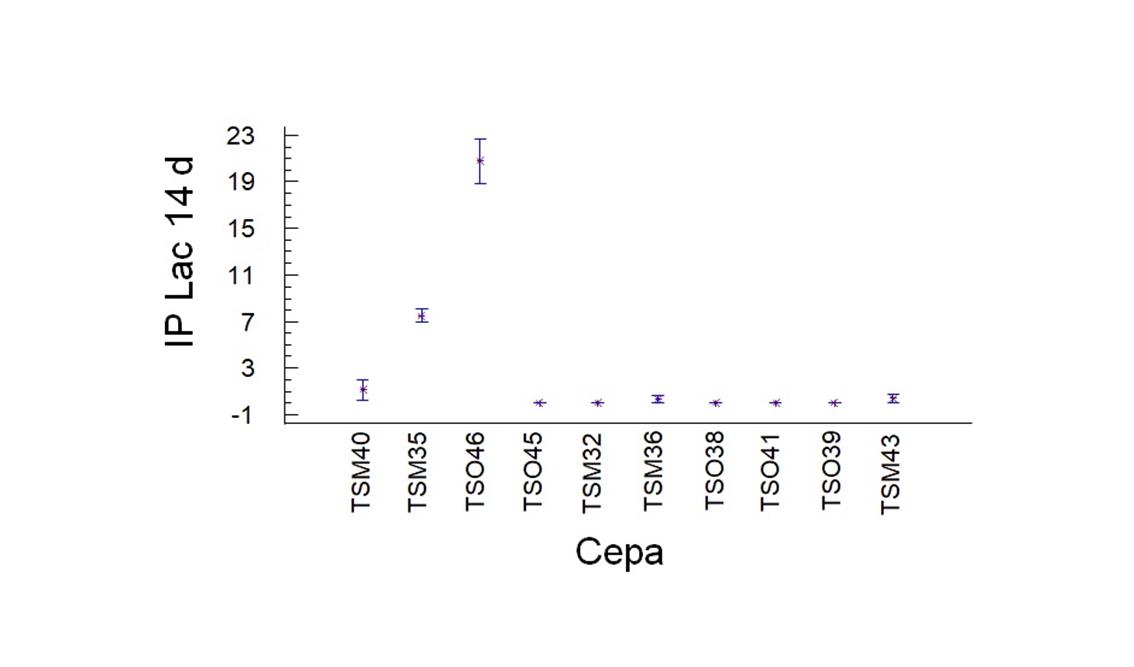
Figura 4 Diferencia de medias de índice de potencia a los 14 días de las cepas nativas en medio extracto de malta con ABTS (2,2’azino- bis (3-etilbenzo-tiazolin-6-ácido sulfónico) para actividad de Lac
Para la enzima Lac se detectaron también cinco cepas con actividad positiva, presentando TSM36 y TSM43 valores de I.P. de 0.35 ± 0.61 y 0.38 ± 0.44 respectivamente, siendo las las de valores menores de I.P. La cepa TSO46 presentó un valor de 20.79 ± 2.70 de I.P.; la cepa TSM35 presentó un valor de I.P. de 7.50 ± 0.94, el cual se considera un valor relativamente alto en comparación con las primeras cepas discutidas aquí. Las cepas con actividad enzimática positiva presentaron una coloración verde oscuro debido a que la enzima oxida ABTS a su radical catiónico (ABTS+) (Martín-Sampedro et al. 2015, 121). Montoya y colaboradores (2014, 121) evaluaron cepas nativas para Lacc utilizando métodos cualitativos y lograron su aplicación en material lignocelulósico (aserrín de roble).
Actividad de Xilanasas
Se obtuvieron cuatro cepas con actividad positiva de Xil TSO46>TSM35>TSM36>TSM40, siendo TSO46 la más deseable según el análisis estadístico de diferencia de medias (Figura 5).
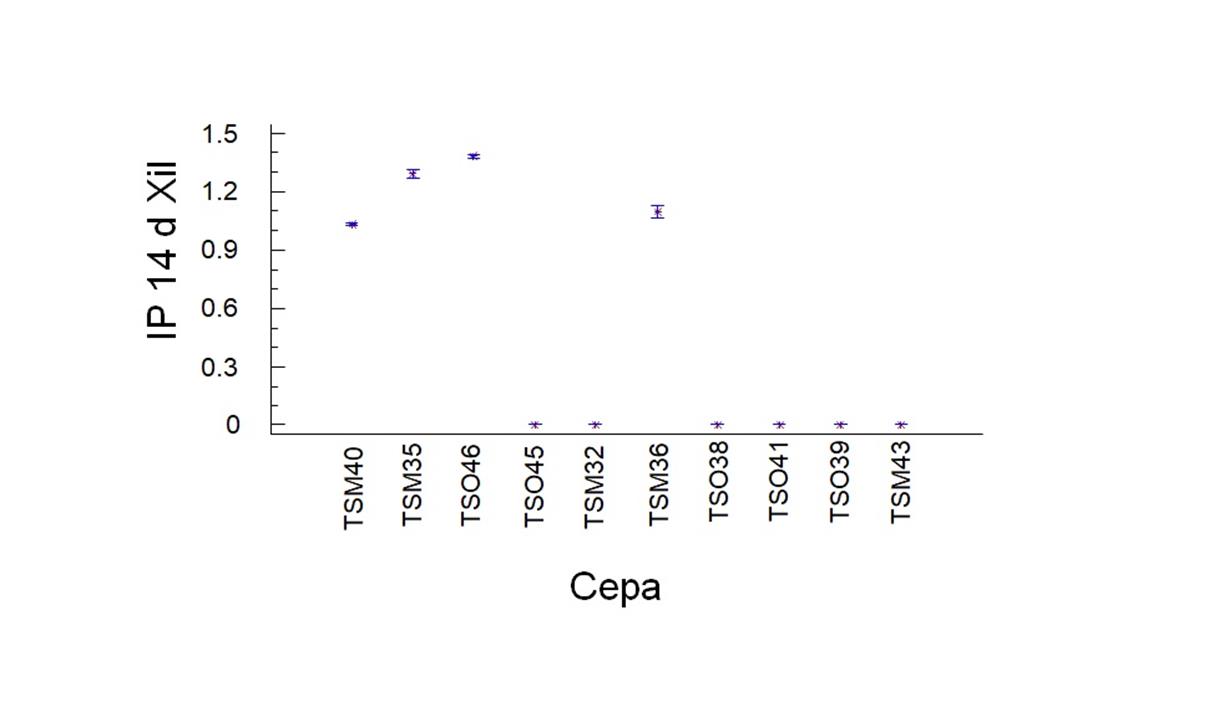
Figura 5 Diferencia de medias de índice de potencia a los 14 días de las cepas nativas en medio extracto de malta con xilano para actividad de LiP
En la medición de I.P. para Xil, se tuvo que cuatro cepas presentaron actividad positiva con valores de I.P. que van de 1.03 como mínimo a 1.38 como valor máximo, a pesar de que en este caso los valores de I.P son bajos en comparación con las otras enzimas evaluadas en este estudio; la cepa TSO46 es la que tiene mayor I.P. con valor de 1.38 en comparación con TSM40 con valor de I.P. de 1.03, TSM35 con un valor de I.P. de 1.29 y TSM36 con un valor de I.P. de 1.09. La cepa TSO46 también presentó en la enzima Lac el valor más alto de I.P. (20.79 ± 2.70) lo cual será interesante tomar en cuenta cuando se utilice en un futuro en matrices complejas. Existen diferentes trabajos, que al igual que en este estudio utilizaron la técnica de rojo congo para detectar actividad enzimática xilanolítica (Sasidhara y Thirunalasundari 2014, 378; Bairagi 2016, 2-4).
No se puede decir de manera contundente que las cepas vayan a tener un comportamiento favorable sobre el material lignocelulósico, sin embargo, existe evidencia de otros trabajos en los cuales, al utilizar métodos semi cuantitativos para la detección de enzimas ligninolíticas, al incorporarse a una matriz compleja obtuvieron una respuesta favorable. Por ejemplo, Montoya y colaboradores (2014, 122), seleccionaron cepas nativas de manera cualitativa y las aplicaron en una matriz compleja (aserrín de roble) obteniendo actividad de Lac y LiP.
Conclusiones
De las diez cepas nativas evaluadas, se eligieron por su mejor I.P en actividad de LiP la cepa TSM35, y para Lac y Xil la cepa TSO46 como las más deseables, ya que tuvieron un mejor índice de potencia en comparación con las otras cepas estudiadas. Se encontró que las cepas TSM50, TSM35 y TSO46 presentaron actividad positiva de las tres enzimas evaluadas, por lo que estas cepas tienen un alto potencial para utilizarse en un proceso de biopulpeo o pretratamiento para la deslignificación de material lignocelulósico.











 nueva página del texto (beta)
nueva página del texto (beta)


