Introducción
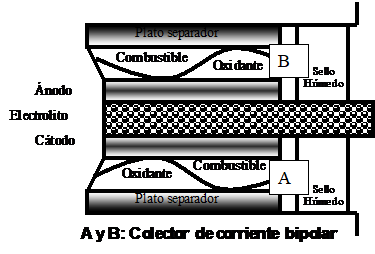
Una celda de combustible de carbonatos fundidos es un dispositivo de conversión de energía, que convierte energía química de la oxidación de hidrógeno o combustibles sólidos a electricidad. La MCFC convencional opera a 650°C, consiste de un cátodo de NiO poroso y litiado, una mezcla eutéctica de carbonato de litio (Li2CO3) y carbonato de potasio (K2CO3) fundido en una matriz electrolitica de óxido de aluminio litiado (LiAlO2) y un ánodo poroso de Ni. Una porción del electrolito se extiende más allá del área del electrodo y forma un sello húmedo contra la carcaza de la celda que se construye de acero inoxidable. En el lado de combustible de la MCFC el sello húmedo está expuesto simultáneamente a presiones parciales de oxígeno altas y bajas, que dan origen a una o más celdas galvánicas y que conducen a una corrosión severa (Urushibata et al., 1991; Giordano et al., 1988; Yamamasu et al., 1992; Selman et al., 1982; Swaroop et al., 1978).
Las partes atacadas por corrosión en una MCFC son los platos separadores y los colectores de corriente. Los platos separadores tienen tres funciones: (1) separar el ánodo del gas catódico, (2) proporcionar contacto eléctrico entre celdas en combinación con los colectores de corriente, y (3) proporcionar un sello húmedo. En los ejes de la celda, los platos separadores están en contacto directo con los carbonatos fundidos para formar un sello libre de escape de gas llamado “sello húmedo”(Keijzer et al., 1997). Véase la figura 1.
Los platos separadores son comúnmente fabricados de acero inoxidable de clasificación AISI 310 o 316, (AISI, American Iron and Steel Institute) los cuales no son resistentes a la corrosión en carbonatos fundidos y de alguna manera requieren algún recubrimiento (Yuh et al., 1986).
Muchos autores han investigado el comportamiento a la corrosión de los aceros inoxidables y de aleaciones modelo y la conductividad eléctrica de sus óxidos formados en carbonatos fundidos; tal como la formación de una doble capa de óxidos con un espesor de 5-10 mm en un acero AISI 316L después de 150 horas de exposición, en donde la capa externa fue principalmente de LiFeO2 con una capa compacta de Cr2O3 en la interfase metal - óxido (Shores and Sigh, 1984; Orozco-Cruz, 2003).
Por otro lado, también se llevaron a cabo experimentos de corrosión en muestras preoxidadas de los aceros AISI 316L y AISI 310S (1h a 750°C en una mezcla de gas O2-CO2-). Las muestras fueron expuestas bajo condiciones simuladas de una celda de combustible y las cantidades de Cr y Fe en las capas de óxido se determinaron por medio de Espectroscopia de Energías Dispersivas de rayos X (EDX). En el acero AISI 310S, la capa interna contenía más Cr que en la capa interna formada en el acero AISI 316L. Las muestras preoxidadas mostraron una conductividad eléctrica baja, pero una alta resistencia a la corrosión en el medio agresivo (Yuh et al., 1984).
El propósito principal de este trabajo fue evaluar el comportamiento de un acero AISI 310S sin recubrimiento y con recubrimiento de Aluminio (Al) aplicado por el método de “Slurry” (con y sin tratamiento térmico), aplicando la técnica de Espectroscopía de Impedancia Electroquímica, la cual es una técnica efectiva en el análisis de los mecanismos de reacción.
Método
Material de sustrato
El acero AISI 310S (24.53% Cr, 19.28% Ni, 0.077% C) fue utilizado en los experimentos, el cual fue seccionado en muestras con dimensiones de 6 x 15 x 2 mm, estas se desbastaron y pulieron antes del experimento y la aplicación del recubrimiento. Los experimentos se llevaron a cabo bajo tres condiciones diferentes: Muestra A: exposición directa del acero inoxidable al medio, Muestra B: acero inoxidable utilizado como sustrato y recubierto de Al sin tratamiento térmico y Muestra C: acero inoxidable con recubrimiento de Al con tratamiento térmico.
Recubrimiento
La aplicación del recubrimiento de Al se realizó por medio del método de Slurry. Subsecuentemente, se practicó un calentamiento a 80°C durante 15 minutos, posteriormente a 400°C por 3.5 horas para la evaporación del solvente y la consolidación del recubrimiento. Para la muestra C, se llevó a cabo un tratamiento térmico de difusión bajo un flujo de Argón a 820°C, con un tiempo de permanencia de 10 horas.
Medio de ensayo
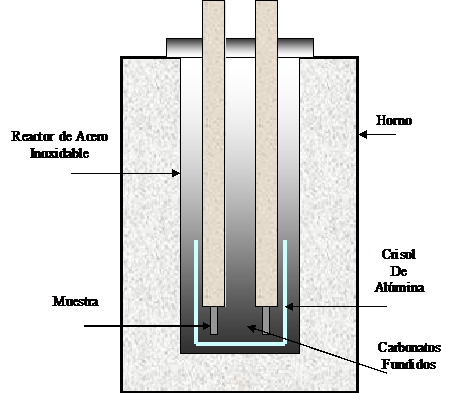
Los tres tipos de muestras fueron expuestos en carbonatos fundidos (62 mol% Li2CO3 -38 mol% K2CO3) a 650 °C en crisoles de alúmina, como se observa en la disposición experimental de la figura 2, donde el electrodo de trabajo está compuesto de una muestra conectada a un alambre conductor, el cual se protege del electrolito por un tubo de alúmina y un compuesto cerámico colocado en la base del tubo. El electrodo de referencia es similar al electrodo de trabajo.
Caracterización electroquímica y superficial
El comportamiento electroquímico fue estudiado mediante la técnica de Espectroscopía de Impedancia Electroquimica (EIS), con una amplitud de perturbación de 5 mV y un barrido de frecuencias en el intervalo de 20 KHz-10 mHz. El equipo utilizado fue un potenciostato EG&G283 con un Analizador de Respuesta de Frecuencia (FRA) Solartron 1255. Para el análisis de los diagramas de impedancia, se utilizó el software de simulación “Boukamp Equivalent Circuit” (Boukamp, 1986). La sección transversal de las muestras corroídas fue caracterizada mediante Microscopía Electrónica de Barrido (SEM-equipo JEOL JSM-84 equipado con un microanalizador KEVEX-EDS), y los compuestos superficiales por Difracción de rayos X (DRX-equipo Phillips PW 3710).
Resultados
Estudios electroquímicos
A partir de los análisis cualitativo y cuantitativo de los diámetros de los semicírculos de Nyquist, para las tres muestras es posible apreciar un área semicircular pequeña a altas frecuencias y una más grande a bajas frecuencias. Con el paso del tiempo de exposición, la evolución del diámetro de estos semicírculos es diferente para todas las muestras indicando esto que algún cambio del proceso electroquímico puede estar ocurriendo sobre la superficie. Es importante mencionar que el circuito eléctrico equivalente propuesto esta compuesto de dos elementos constantes de tiempo correspondientes a la reacción de oxidación del aluminio (y también Fe) en la interfase intermetalico-capa, presente a altas frecuencias y a la capa-respuesta eléctrica suscitándose a medias y bajas frecuencias. (Pérez et al; 2002).
Muestra A: En la figura 3 se presentan dos semicírculos, uno a frecuencias bajas y otro de menor diámetro a frecuencias altas. Se puede observar como el diámetro del semicírculo a frecuencias bajas disminuye en las primeras 24 horas de exposición, véase la figura 3. Después de 24 horas, el diámetro de este segundo semicírculo aumenta con el tiempo. También se detecta el desplazamiento de los semicírculos en la parte real de la impedancia, primero hacia la derecha y luego hacia la izquierda, indicando este comportamiento una posible disolución de la capa externa que disminuye la conductividad del electrolito, y al mismo tiempo, la corrosión del acero se desacelera debido a la formación de una posible capa de protección de LiFeO2 y LiCrO2. (Pérez et al; 2000).
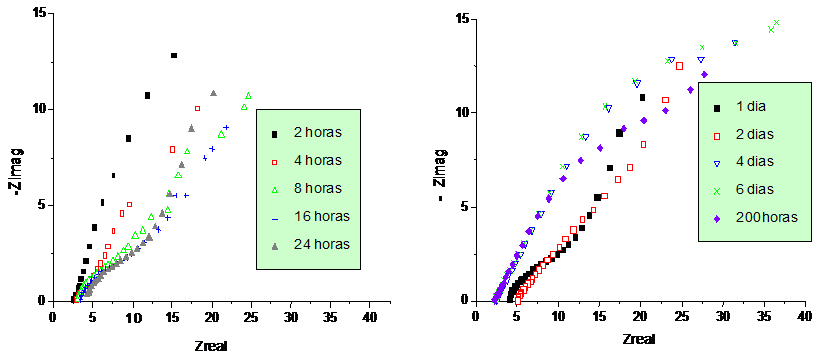
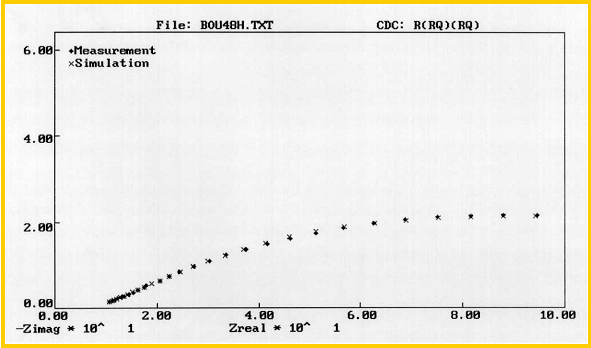
Figura 3 Diagramas de Nyquist para la muestra A expuesta durante 200 h en un medio de carbonatos fundidos (62 mol% Li2CO3 -38 mol% K2CO3) a 650 ºC.
Muestra B: En la figura 4, es posible observar que en las primeras horas de exposición se encuentran dos semicírculos, uno de diámetro pequeño a frecuencias altas y otro de mayor diámetro a frecuencias bajas. En el transcurso del tiempo hasta las 24 horas, el semicírculo de mayor diámetro disminuye, lo que sugiere un aumento en la velocidad de corrosión. Después de 24 horas, se observa claramente cómo este segundo semicírculo aumenta a través del tiempo y con esto aumenta la resistencia de la capa formada. Lo anterior confirma la posibilidad de disolución de una parte del acero recubierto debido a los defectos de la capa externa, entre otros posibles mecanismos. Por otro lado, el aumento del segundo semicírculo podría deberse a la posible transformación de Al2O3 a LiAlO2, en las zonas vulneradas. (Pérez et al; 2000).
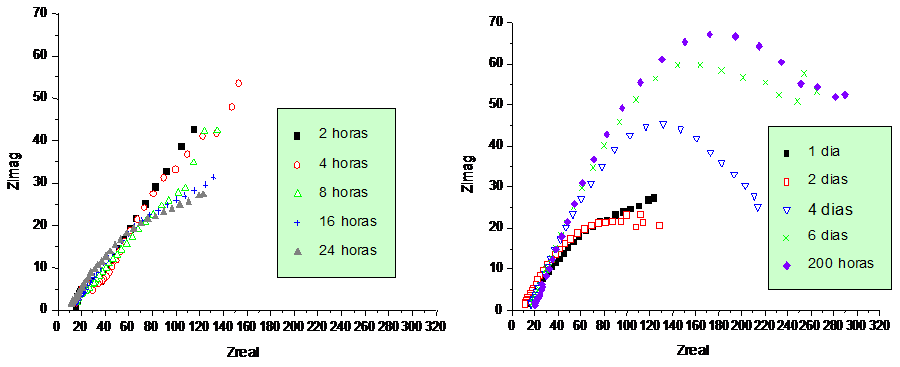
Figura 4 Diagramas de Nyquist para la muestra B expuesta durante 200 h en un medio de carbonatos fundidos (62 mol% Li2CO3 -38 mol% K2CO3) a 650 ºC.
Muestra C: en la figura 5, se observa que en las primeras 24 horas de exposición el segundo semicírculo que se ha formado a bajas frecuencias disminuye para después aumentar con el tiempo de exposición, sugiriendo este comportamiento una mayor resistencia de la capa formada.
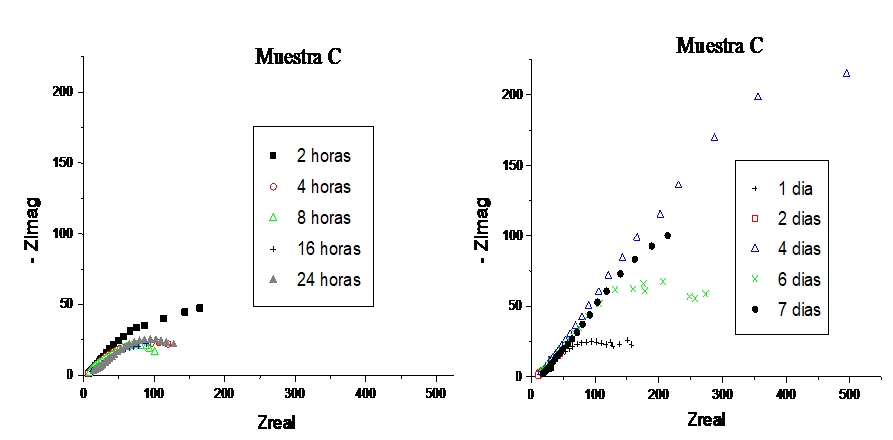
Figura 5 Diagramas de Nyquist para la muestra C expuesta durante 200 h en un medio de carbonatos fundidos (62 mol% Li2CO3 -38 mol% K2CO3) a 650 ºC.
El semicírculo a altas frecuencias podría relacionarse con la reacción de oxidación de Al a Al3+ (y en menor medida a la oxidación de Fe) por la evolución del diámetro de este al paso del tiempo. La transición del segundo semicírculo en frecuencias medias podría deberse a la resistencia y la capacidad de la capa de recubrimiento, y cuando este ya alcanzó las bajas frecuencias, correspondería al fenómeno de transporte de carga. (Pérez F. J., et al; 2002).
Caracterización superficial de productos de corrosión
La caracterización de los productos de corrosión realizada por difracción de rayos X (XRD) presentó para la Muestra A los picos de las fases LiFeO2 y el de LiCrO2. Para la Muestra B, se encontraron las fases γ-LiAlO2 y α-LiAlO2, así como fases intermetálicas. Por otro lado, la Muestra C, presentó picos de la fase LiAlO2, así como de LiFeO2 y fases intermetálicas. Véase la figura 6.
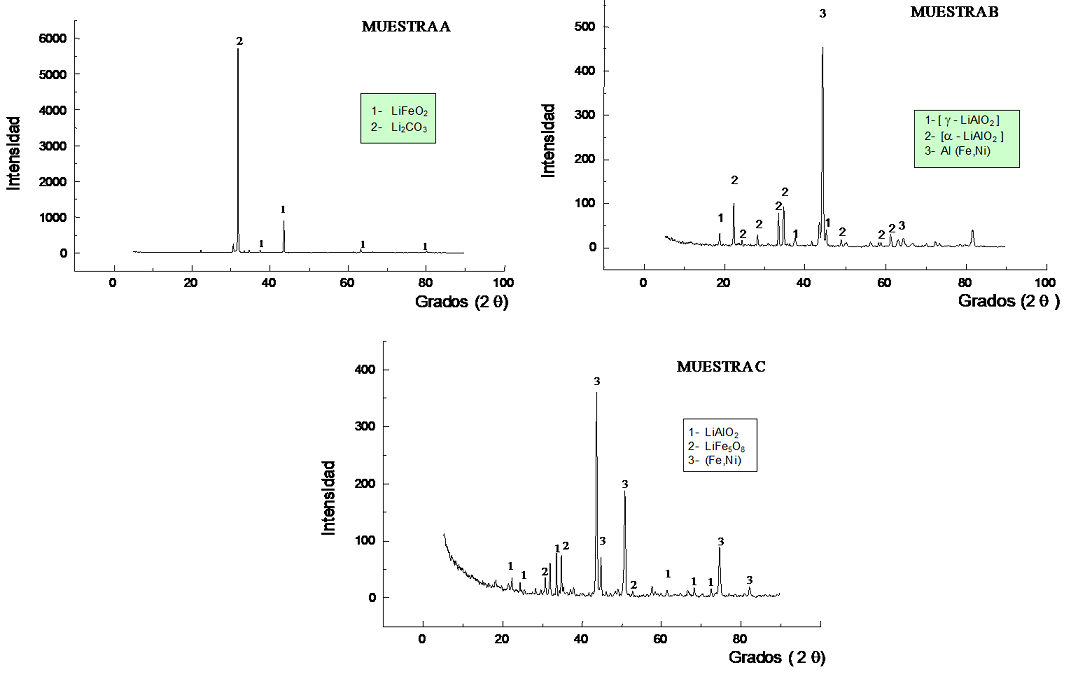
Figura 6 Difractogramas de los productos de corrosión para las muestras A, B y C expuestas durante 200 h en un medio de carbonatos fundidos (62 mol% Li2CO3 -38 mol% K2CO3) a 650 ºC
Microscopia electrónica de barrido y espectroscopía de energía dispersiva de rayos X
La figura 7 presenta la micrografía de la Muestra A obtenida por SEM, además de los respectivos mapeos de los principales elementos de la muestra. Se puede observar cómo el espesor de la capa mide aproximadamente 63 (m. De acuerdo a los mapeos realizados, la capa externa presenta Fe en mayor proporción y la capa interna presenta Cr. En la interfase entre estas dos capas se observa Ni en menor proporción. Los resultados obtenidos por XRD, confirman que se tiene una capa externa de LiFeO2.

Figura 7 SEM de la sección transversal y EDS-Mapping de la muestra A después de 200 h de exposición en un medio de carbonatos fundidos (62 mol% Li2CO3 -38 mol% K2CO3) a 650 ºC. (1000X)
La figura 8, presenta la sección transversal correspondiente a la Muestra B, así como los respectivos mapping. Se observa como la capa de los productos de corrosión que se ha formado es muy delgada y además no es homogénea.

Figura 8 SEM de la sección transversal y EDS-Mapping de la muestra B después de 200 h de exposición en un medio de carbonatos fundidos (62 mol% Li2CO3 -38 mol% K2CO3) a 650 ºC. (1000X)
De acuerdo con los mapeos de EDS, en la capa formada se tiene un contenido de Al, así como pequeñas cantidades de Ni y Cr. En la interfase capa-sustrato, se observa mucho contenido de Fe, que sería parte del contenido del sustrato. De esta manera, y corroborando con el resultado de XRD, la capa estaría formada principalmente por las fases g-LiAlO2 y a-LiAlO2, y el pico de mayor intensidad sería del acero y de unas posibles fases intermetálicas.
Por otro lado, la figura 9 presenta la sección transversal de la Muestra C con sus respectivos mapeos de EDS de los principales elementos. En esta sección transversal se puede observar como la capa tiene un gran espesor y no es homogénea, al parecer dos posibles capas características se han formado. Observando los mapeos, se encontró que la capa contiene Al, que quizá puede ser la mayor parte del recubrimiento. En la interfase capa-sustrato, se puede observar como existe los elementos Cr y Fe, y debajo de ellos se encuentra en menor proporción Ni. También en estos resultados, corroborando con el resultado de XRD, se confirma que la fase presente en la capa externa sería principalmente de LiAlO2, y que en la parte interna de la capa se encuentra la fase LiFeO2.
Discusión
La corrosión de estas muestras comprende procesos de oxidación y reducción. En el presente trabajo, la reducción del oxígeno toma parte en la reducción en forma de oxígeno disuelto químicamente y no físicamente, (Appleby and Nicholson, 1977; Appleby and Nicholson, 1980, Lu and Selman, 1990, Smith et al, 1990). De acuerdo a Appleby y Nicholson, la reducción del oxígeno sigue la trayectoria del superóxido o la trayectoria del peróxido, donde estas especies oxígeno son formados químicamente en los carbonatos fundidos de la siguientes manera:
Trayectoria superóxido:
3O2 + 2CO2- 3 = 4O- 2 + 2CO2 (1)
O- 2 + e- = O2- 2 (2)
O2- 2 + 2e- = 2O2- (3)
O2- + CO2 = CO2- 3 (4)
Trayectoria peróxido:
O2 + 2CO2- 3 = 2O2- 2 + 2CO2 (5)
O2 2 + 2e- = 2O2- (6)
O2- + CO2 = CO2- 3
La presencia de iones superóxido y peróxido en carbonatos fundido alcalinos ha sido confirmado por Espectroscopía Raman y Resonancia Electrónica de Spin, (Appleby and Nicholson, 1977; Appleby and Nicholson, 1990)
En un estudio electrotroquímico de los mecanismos de reducción del oxígeno, llevado a cabo en un electrodo de oro totalmente inmerso en carbonatos fundidos, Nishina et al, (1994) concluyeron que la difusión simultánea de O- 2 y CO2 es la característica dominante de la trayectoria de reducción del oxígeno en la mezcla eutéctica. Por otro lado, Peelen et al, (1997) estudiaron la reducción del CO2 en una misma mezcla eutéctica de 62mol% Li2CO3 y 38mol% K2CO3 a 650°C, con Voltametría de Barrido Líneal. Los resultados confirman la interpretación de los resultados de Nishina et al, (1994) en la cuál la reducción del oxígeno está limitada por la difusión del O- 2 y CO2.
El circuito equivalente para el comportamiento de estas tres muestras se puede observar en la figura 10, Cox representa la capacitancia del óxido, Rox la resistencia a la transferencia de carga a través de la capa de óxido, Cdl la capacitancia de la doble capa en la interfase capa-carbonatos fundidos y Rt la resistencia a la transferencia de carga. En la figura 11, se presenta el gráfico que contiene el ejemplo de la simulación y ajuste de los datos experimentales y simulados, donde se observa la aproximación de tales datos simulados.
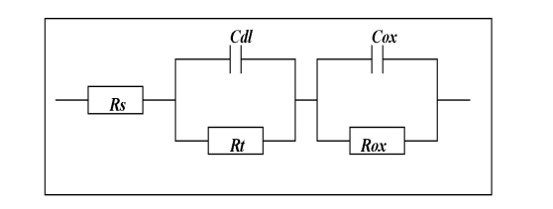
Figura 10 Circuito equivalente para la corrosión de carbonatos fundidos (62 mol% Li2CO3 -38 mol% K2CO3) a 650 ºC, correspondiente a las tres muestras
Muestra A.
De acuerdo a los parámetros del circuito obtenido, para la evaluación de la muestra A, y que se detallan en la Tabla I, se puede encontrar que Rox es mucho más grande que Rt, por lo cual se puede decir que el proceso de corrosión esta controlado por la transferencia de iones a través de la capa formada. Los resultados presentan dos fases en la capa de esta muestra, LiFeO2 y LiCrO2. Según Spiegel et al, (1997) después de una exposición de 50 horas, se forma una capa delgada y no protectora de Cr2O3 y por encima de esta capa se encuentra parcialmente una capa de Fe2O3.
Tabla I Datos de los parámetros ajustados a las curvas de EIS de la Muestra A durante la exposición en carbonatos fundidos.
| Tiempo (hr) |
Rs (Ωcm 2 ) |
Rt (Ωcm 2 ) |
Cdl (F/cm 2 ) |
Bdl | ROx (Ωcm 2 ) |
COx (F/cm 2 ) |
Box |
|---|---|---|---|---|---|---|---|
| 2 | 2.65 | 0.2516 | 7.50E-03 | 0.9 | 59.87 | 7.20E-02 | 0.6 |
| 96 | 2.45 | 1.87 | 7.12E-02 | 0.5 | 52.17 | 5.93E-02 | 0.6 |
| 144 | 2.24 | 3.49 | 9.72E-02 | 0.42 | 49.55 | 6.50E-02 | 0.62 |
| 200 | 2.24 | 0.247 | 8.74E-03 | 0.82 | 44.58 | 7.10E-02 | 0.53 |
Para evaluar los posibles mecanismos de corrosión a través de la capa, es necesario el conocimiento de la estructura y defecto cristalino, así como las difusividades de los aniones y cationes en los compuestos formados durante la corrosión. Para el Fe2O3, el transporte de Fe y O ha sido sugerido, pero la difusividad de ambos es extremadamente lenta. (Kofstad, 1988) Las espinelas son reportadas para transportar metales y oxígeno, pero el oxígeno con una velocidad más lenta. (Schemalzried, 1962) Por otro lado, los datos de difusión y defectos estructurales no son conocidos para la fase LiFeO2. Esta fase, es un óxido de tipo cúbico como el NaCl, con una distribución estadística de Li+ y Fe3+ en los sitios octahedricos de la red de empaquetamiento del oxígeno. Este mecanismo toma en cuenta que los óxidos ricos en Li están formando una capa externa, y así, la difusión hacia el exterior del Fe sería mucho más rápido que la difusión hacia el interior del oxígeno.
El proceso de formación de la capa externa de LiFeO2 sería, en primera instancia, la formación de Fe2O3, y el Fe de esta fase difunde a través de esta capa formada hacia la interfase capa-carbonatos fundidos, aunado a la difusión del Li+ hacia el interior de la capa y con oxígeno se llevaría a cabo la siguiente reacción:
2Fe3+ + Li2O + 3O2- = 2LiFeO- 2 (7)
y la cual es equivalente a
Fe3+ + Li+ + O2- 2 + 2e- = LiFeO2 (8)
La capa externa de LiFeO2 confirma que el comportamiento a la corrosión del acero AISI 310S no es óptimo en carbonatos fundidos bajo aire, Biedenkopf et al (1997) lo demostraron en un ambiente de 25vol.% CO2-75 vol.% mezcla de gas-aire.
Muestra B.
Por otro lado, en el análisis realizado al recubrimiento aplicado a la muestra se observó que esta era muy porosa y los elementos principales hallados por EDS fueron Al con Cr y Mg, los cuales están presentes en el recubrimiento para aplicación por “Slurry” comercial.
Los datos de los parámetros obtenidos en el ajuste de las curvas, se presentan en la tabla II. De la misma manera que la muestra anterior, los valores de Rox son mucho mayores que Rt, por lo cual se puede decir que el proceso de corrosión se encuentra controlado por la transferencia de iones a través de la capa formada y del recubrimiento.
Tabla II Datos de los parámetros ajustados a las curvas de EIS de la Muestra B durante la exposición en carbonatos fundidos.
| Tiempo (hr) |
Rs (Ωcm 2 ) |
Rt (Ωcm 2 ) |
Cdl (F/cm 2 ) |
Bdl | ROx (Ωcm 2 ) |
COx (F/cm 2 ) |
Box |
|---|---|---|---|---|---|---|---|
| 2 | 14.24 | 17.64 | 6.09E-04 | 0.6 | 293.69 | 1.57E-02 | 0.42 |
| 96 | 14.45 | 10.5 | 3.76E-03 | 0.42 | 219.42 | 3.44E-03 | 0.5 |
| 144 | 15.64 | 14.37 | 1.00E-02 | 0.32 | 289.84 | 3.50E-03 | 0.5 |
| 200 | 15.24 | 26.85 | 3.32E-02 | 0.14 | 306.52 | 3.27E-03 | 0.5 |
De acuerdo a los análisis de SEM-EDS y a los resultados de la caracterización por XRD, se encontró que la capa externa formada es una fase LiAlO2, y unas fases intermetalicas Al(Fe, Ni). Se puede decir, que el Al presente en el recubrimiento ha difundido bajo las condiciones de prueba formando al final una capa delgada y no uniforme. Las otras fases presentes se encuentran bajo esta capa.
Indacochea et al, (1998) encontraron con análisis selectivos de EDS, las fases intermetálicas de FeAl y FeAl2. Estas fases fueron halladas debajo de una capa muy delgada de LiAlO2.
La formación de la fase presente en la capa externa se propone con la siguiente reacción:
2Al3+ + Li2O +3O2- = 2LiAlO2 (9)
ó el equivalente:
Al3+ + Li+ + O2- 2 + 2e- = LiAlO2 (10)
Muestra C.
Por último, en la tabla III se presentan los valores de los parámetros obtenidos en el ajuste de las curvas de EIS. El circuito equivalente para esta muestra es semejante a los obtenidos para las muestras anteriores, es un circuito de doble capa.
Tabla III Datos de los parámetros ajustados a las curvas de EIS de la Muestra C durante la exposición en carbonatos fundidos.
| Tiempo (hr) |
Rs (Ωcm 2 ) |
Rt (Ωcm 2 ) |
Cdl (F/cm 2 ) |
Bdl | ROx (Ωcm 2 ) |
COx (F/cm 2 ) |
Box |
|---|---|---|---|---|---|---|---|
| 2 | 4.14 | 4.45 | 7.45E-03 | 0.42 | 254 | 1.03E-03 | 0.53 |
| 48 | 9.24 | 28.37 | 6.62E-03 | 0.32 | 488 | 2.27E-05 | 0.83 |
| 96 | 11.27 | 495.35 | 6.61E-03 | 0.77 | 458.93 | 3.60E-03 | 0.35 |
Por los resultados obtenidos de SEM-EDS y la caracterización por XRD después de la exposición en carbonatos fundidos, las fases encontradas en la capa formada sobre esta muestra son LiAlO2, LiFeO2 y unas fases interetálicas.
Indacochea et al, (1998) realizaron un estudio parecido sobre una muestra aluminizada y tratada térmicamente, ellos encontraron con análisis selectivos de EDS, una fase de LiAlO2 en la capa externa y debajo de ella fases intermetálicas de FeAl y FeAl2. Por otro lado, hicieron simulaciones termodinámicas en donde esperaban hallar otras fases de óxido litiados, tal como la fase LiFeO2, pero no la encontraron. Como se esperaba, las fases ricas en Fe son cercanas a la interfase sustrato-capa, mientras que las fases ricas en Al se encuentran hacia el exterior.
De esta manera, como el Li2CO3 es mucho más básico que el K2CO3, entonces los productos de corrosión formados son principalmente conteniendo Li. La formación de la fase LiAlO2 se lleva a cabo por medio de la reacción (9 o 10), y la formación de la fase LiFeO2 debajo de la fase anterior estaría promovida por la difusión de Al hacia el interior y la difusión de los iones Fe hacia el exterior, y además con una lenta difusión del oxígeno. La formación de las otras fases intermetálicas se llevan a cabo por la reacción entre Fe y Al, esta última difundida hacia la parte interior.
Conclusiones
El comportamiento a la corrosión del acero AISI 310S y en tres diferentes condiciones, con recubrimiento de Al con y sin tratamiento térmico fue evaluado a 650°C en una mezcla eutéctica de carbonatos fundido bajo una atmósfera de aire. Las especies corrosivas en carbonatos fundidos son formadas por la disolución del oxígeno de la fase gaseosa como iones superóxido y peróxido. En la muestra A, se formaron capas de LiFeO2 y LiCrO2 después de 200 horas de exposición. La capa de LiCrO2 aumenta por la difusión de Li hacia el interior y de Cr hacia el exterior. La capa externa de LiFeO2 confirma que el comportamiento a la corrosión del acero AISI 310S no es óptimo en carbonatos fundidos bajo aire. En la muestra B y C, se ha encontrado la fase LiAlO2 presente en la capa externa. En la muestra B, esta capa de LiAlO2 es muy delgada y además no homogénea y esto indica lo susceptible que puede ser al medio, y la capa que se ha formado en la muestra C ha sido de mayor espesor. El efecto del tratamiento térmico, cuyo objetivo es la difusión del Al hacia el interior, ha sido aceptable.
El uso de la técnica de EIS confirma la disolución local de las capas formadas, su crecimiento y la resistencia de transferencia de carga de estas muestras durante el tiempo de exposición.
En general, los tratamientos experimentales propuestos incrementaron la resistencia de transferencia de carga, pero no lo suficiente para alcanzar una durabilidad aceptable del acero inoxidable.











 nueva página del texto (beta)
nueva página del texto (beta)