Introducción
El uso de grandes cantidades de fertilizantes en la agricultura intensiva tradicional provoca contaminación del suelo, agua y plantas, dañando así a los ecosistemas, seres humanos y animales. Por eso, la agronanotecnología como conocimiento emergente procura encontrar métodos ecoamigables para mejorar la eficiencia y la sustentabilidad de las prácticas agrícolas modernas (Grillo, et al., 2016 1231; Ditta et al., 2015 55), así como para el control de enfermedades de los cultivos (Patel et al., 2014 71). Reportes recientes señalan que diversas NPs metálicas mejoran significativamente el crecimiento de las plantas y tienen el potencial de ser usadas como nanofertilizantes para incrementar la productividad agrícola (Liu et al., 2016 1).
Esta tecnología también está orientada a usar menos agroquímicos sintéticos y a reducir la generación de residuos contaminantes, buscando incrementar el crecimiento y rendimiento de los cultivos (Servin et al., 2015 91). La NT empleando métodos emergentes se orienta a la elaboración, caracterización y utilización de materiales con dimensiones muy pequeñas (< 100 nm), con orden de magnitud de 10-9, lo que significa en la escala atómica y molecular (Duran y Marcato, 2013 1227). En este grupo de materiales se encuentran varias NPs metálicas (Zn, Fe, Cu, Ag, etc.), teniendo muchas de ellas gran potencial en la agricultura debido a que pueden ser utilizadas como nanofertilizantes (Liu y Lal, 2015 133; Naderi y Danesh-Shahraki, 2013 2229), nanoherbicidas (Yadav y Srivastava, 2015 21), nanopesticidas (Dubey y Mailapalli, 2016 307) y nanosensores (Servin et al., 2015 2).
Las NPsZnO han recibido especial importancia en la industria de los cosméticos, textiles, medicina, electrónica y en la producción de alimentos. Se ha señalado que estas NPs reducen la presencia de enfermedades por su actividad antifúngica contra Penicillium expansum, Botrytis cinerea, Aspergillus flavus, Aspergillus niger, Aspergillus fumigatus, Fusarium culmorum y Fusarium oxysporum(Rajiv et al., 2013 385; He et al., 2011 207). Su efecto antifúngico se debe en parte porque causan malformación de hifas que provocan la muerte de los hongos (Servin et al., 2015 9). También se ha señalado que las NPsZnO mejoran el crecimiento de las plantas (Liu y Lal, 2015 135) y mejoran la calidad de los frutos al incrementar la concentración de azúcar (Zhao et al., 2014 11945), aunque algunos otros reportes indican un efecto opuesto, ya que se ha consignado un efecto fitotóxico en diferentes plantas cultivadas (Dimpka et al., 2015 119; Bandyopadhyay et al., 2014 60).
Por eso se reporta que las NPs pueden tener aplicaciones como nanofertilizantes (Subramanian et al., 2015 69), nanofungicidas (Kumar et al., 2016 101) y antimicrobiales para la protección de los cultivos (Shende et al., 2015 865). Diversos estudios señalan que la aplicación de NPs metálicas como zinc (Pandey et al., 2010 488; Prasad et al., 2012 913) y plata (Salama, 2012 192), han mostrado efectos significativos en la germinación de semillas y en el crecimiento de plantas (Burman et al., 2013 607); sin embargo, la información relacionada con el efecto de NPsZnO adicionadas o dopadas con plata es casi inexistente. Por lo anterior, el objetivo de este trabajo fue determinar el efecto en el crecimiento de plantas de C. annuum debido a la aplicación foliar de NPsZnO puras, y dopadas con plata al 1.25 y 2.5% en peso.
Método
Síntesis de las nanopartículas
Se realizaron los cálculos para determinar la cantidad de reactivos iniciales de acuerdo con la composición estequiométrica que deben tener las NPsZnO, NPsZnO+Ag (1.25%) y NPsZnO+Ag (2.5%). Se usaron nitratos de Zn y Ag como fuentes metálicas, ácido cítrico y etilenglicol como agentes quelantes y polimerizantes. La preparación de las NPs se llevó a cabo de con el siguiente procedimiento: primeramente, fue disuelta la cantidad establecida de ácido cítrico en 60 ml de agua destilada, a esta solución le fue añadida la cantidad correspondiente de sales metálicas y se sometió a agitación durante 15 min hasta la completa disolución de sales. Después se agregó la cantidad correspondiente de etilenglicol y se continuó con la agitación hasta obtener una solución homogénea. Las soluciones fueron vertidas en cajas de teflón y colocadas en una estufa de secado a una temperatura de 120 °C durante 24 h para obtener un material precursor seco. Este material fue pulverizado en un mortero de ágata, pesado para someterlo a un tratamiento de calcinación a 500 °C en atmósfera de aire por 2 h. Las NPs obtenidas fueron analizadas por difracción de rayos X (XRD) para conocer su estructura cristalina y por microscopía electrónica de barrido (SEM) y de transmisión (TEM) para estudiar su tamaño y morfología.
Manejo del cultivo.
La siembra de las semillas de pimiento dulce, variedad California (Wonder, Crown seed Heber California USA), fue en charolas de poliestireno de 200 cavidades con sustrato orgánico peat moss en condiciones de invernadero. El trasplante se realizó en macetas de polietileno de 1 L de capacidad cuando presentaron un par de hojas verdaderas y altura promedio de 3.8 cm. Se aplicó fertilización de fondo NPK (150-80-80 mg/maceta respectivamente). Como sustrato de siembra se empleó una mezcla de peat moos: perlita: zeolita (50:30:20 v/v). Durante el desarrollo del cultivo se aplicó riego con sistema automatizado, y cada tercer día se fertilizó con una solución Hoagland (Hoagland y Arnon, 1950 32), , la duración del experimento fue de 50 días.
Aplicación de NPs al follaje de las plantas
Las soluciones con las NPsZnO puras y con Ag al 1.25 y 2.5% en peso, fueron preparadas con una concentración de 50 mg L-1 en agua desionizada y dispersadas con un sonicador Branson 2510 por 30 minutos en dos tiempos de 15 minutos. La aplicación foliar de las NPs se realizó de manera manual una vez por semana, usando 1 ml de la solución planta-1 para cubrir el follaje, durante 21 días.
Determinación del crecimiento y biomasa
Se midió altura de la planta, área foliar (LI-COR modelo LI-300, Lincoln, Nebraska, USA), número de hojas, índice de clorofila (Minolta SPAD 502), longitud de raíz y biomasa seca (hojas, tallo, raíz). Estas mediciones se hicieron al final del experimento en todas las plantas.
Detección de peróxido de hidrogeno mediante tinción 3,3'-diaminobencidina (DAB)
La detección in situ de peróxido de hidrogeno se realizó tiñendo con 3,3'-diaminobencidina (DAB) usando la metodología propuesta por Daudi et al. (2012, 285). El DAB es oxidado por el peróxido de hidrógeno en presencia de algunas proteínas que contienen hemo, tales como peroxidasas, para generar un precipitado de color marrón oscuro. Este precipitado se explota como una mancha para detectar la presencia y distribución de peróxido de hidrógeno en el tejido vegetal.
Análisis estadístico de datos
El diseño experimental empleado fue completamente al azar con cuatro tratamientos y cinco repeticiones cada uno, en donde cada planta fue una repetición. Los tratamientos aplicados fueron los siguientes: T1 = Control; T2 = NPsZnO puras; T3 = NPsZnO con plata 1.25% en peso; T4 = NPsZnO con plata, 2.5% en peso. El análisis de las variables fisiológicas se realizó mediante un ANVA y prueba de rango múltiple (Tukey p≤ 0.05) con el software estadístico SAS-JMP versión 5.0.1 (2002).
Resultados
Caracterización de nanopartículas por difracción de rayos X
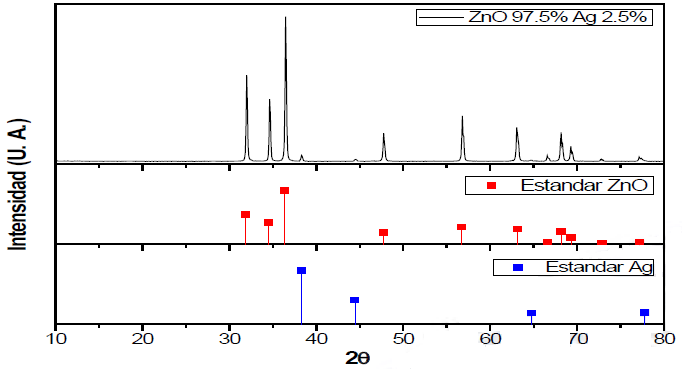
El patrón de difracción de las NPsZnO + Ag al 2.5% en peso se presenta en la Figura 1. Para facilitar la identificación de las especies cristalinas presentes se incluyen los difractogramas reportados en el banco de datos del ICDD (International Centre for Diffraction Data). En el patrón de difracción se detectaron las reflexiones características del ZnO y de Ag. Debe notarse la intensidad de los picos de ZnO y Ag, que demuestra la cristalinidad de dichas fases, así como la nula existencia de reflexiones adicionales relacionadas con fases secundarias indeseables.
Caracterización de nanopartículas por microscopia electrónica de transmisión
Respecto a la caracterización de las nanopartículas sintetizadas de ZnO y ZnO + Ag, en la Figura 2 se muestran micrografías de microscopía electrónica de transmisión (TEM) de las NPsZnO puras (A) y NPsZnO + Ag al 2.5% en peso (B). Se puede apreciar que las NPs que se sintetizaron tienen forma irregular aunque con tendencia a esférica y tamaños menores a 200 nm. Para las NpsZnO + Ag, el tamaño de las partículas es menor a 100 nm. De estas micrografías es difícil distinguir entre las partículas de ZnO y Ag, por lo que se tomaron nuevas micrografías en el modo de barrido del TEM (STEM), en la Figura 2C se observa la micrografía de la muestra de NPsZnO + Ag en la misma relación antes mencionada. Las partículas de mayor tamaño corresponden al ZnO y se observan pequeñas partículas (más brillantes) que corresponden a las de plata.

Figura 2 Microscopía electrónica de transmisión (TEM) de: A) nanopartículas de óxido de zinc puras, B) nanopartículas de óxido de zinc con plata al 2.5% en peso y (C) micrografía en modo STEM de nanopartículas de óxido de zinc con plata al 2.5% en peso
Comportamiento fisiológico de las plantas
El efecto de las NPsZnO puras, así como las dopadas con Ag al 1.25 y 2.5% en algunas variables de respuesta de las plantas de C. annuum, se presenta en el Tabla 1. Se puede detectar que las plantas sometidas a la aplicación foliar de NPsZnO + Ag al 1.25 y 2.5% respectivamente, presentaron mayor producción de biomasa seca, crecimiento de la parte aérea (Figura 3) y radicular (Figura 4) en comparación con el tratamiento control.
Tabla 1. Efecto de la aplicación al follaje de NPsZnO puras y dopadas con Ag, en diferentes variables fisiologicas de C. annuum.
| Tratamientos | |||||
|---|---|---|---|---|---|
| Variables | Control | NpsZnO puras |
NPsZnO + Ag 1.5% |
NPsZnO + Ag 2.5% |
p>F |
| Peso seco raíz (g) | 0.24±0.02b | 0.24±0.02b | 0.46±0.05 a | 0.51±0.05 a | 0.0003* |
| Peso seco tallo (g) | 0.13±0.01b | 0.12±0.0b | 0.23±0.01 a | 0.23±0.01 a | 0.0001* |
| Peso seco hojas (g) | 0.50±0.05 a | 0.53±0.04 a | 0.66±0.06 a | 0.67±0.04 a | 0.058ns |
| Índice clorofila (U Spad) | 47.16±1.26 a | 51.66±0.53 a | 50.08±1.37 a | 51.1±1.36 a | 0.07ns |
| Número de hojas | 20.2±2.17 a | 20.8±1.24 a | 22.6±3.6 a | 26.8±2.9 a | 0.328ns |
Medias (n = 5) ± error estándar de la media. Letras diferentes en la misma fila son estadísticamente diferentes.
* Diferencia estadística (Tukey, p < 0.05).
ns No significancia entre tratamientos.

Figura 3 Crecimiento promedio diferenciado de plantas de C. annuum debido a la aplicación foliar de nanopartículas de ZnO puras y con plata a las concentraciones de 1.25 y 2.5% en peso.

Figura 4 Desarrollo radicular de plantas de C. annuum que recibieron nanopartículas de ZnO puras y con plata a las concentraciones de 1.25 y 2.5% en peso.
Respecto a las plantas del tratamiento control, aquellas tratadas con NPsZnO + Ag al 2.5% (T4), mostraron el mayor incremento en altura (16.8%; Figura 5A), área foliar (30.3%; Figura 5B), biomasa seca total (59.5%; Figura 5C), biomasa seca de raíz (112.5 %; Tabla 1), biomasa seca de tallo (76%; Tabla 1) y longitud de raíz (24.4%; Figura 5D). Además, con este mismo tratamiento se observó un incremento (8%) del índice de clorofila (Tabla 1) y un aumento (32.6%) en el número de hojas (Tabla 1).
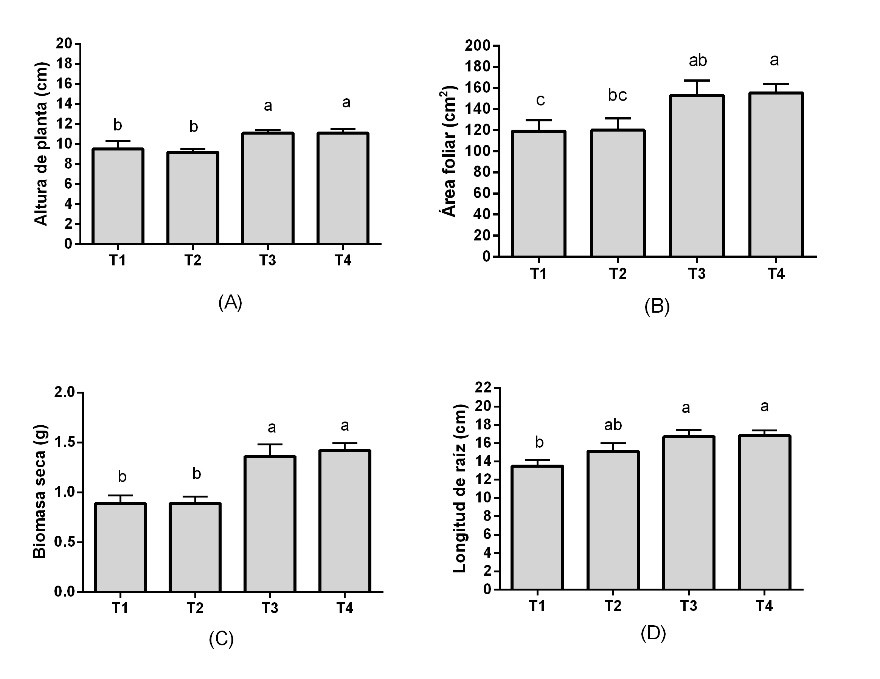
Figura 5 Crecimiento y producción de biomasa en plantas de C. annuum por efecto de nanopartículas de óxido de zinc puras y con Ag. A) Altura de planta, B) área foliar, C) biomasa seca y D) longitud de raíz. T1 = control, T2 = NPsZnO puras, T3 = NpsZnO + Ag al 1.25% y T4=NpsZnO + Ag al 2.5%. Medias (n = 5), las barras representan el error estándar de la media, letras diferentes son estadísticamente diferentes (Tukey, p ≤ 0.05).
Cuando se aplicaron NPsZnO + Ag al 1.25% (T3), se incrementó significativamente la altura (16.8%, Figura 5A), área foliar (28.31%, Figura 5B), biomasa seca (52.8%, Figura 5C) y longitud de raíz (23.7%, Figura 5D), en relación con el tratamiento control. También se consignó un incremento en el número de hojas (11.8%) e índice de clorofila (6.19%), aunque estos resultados no fueron estadísticamente significativos (Tabla 1). Por otro lado, la aplicación de NPsZnO puras (T2) incrementaron la longitud de la raíz (11.8% Figura 5D), con respecto al control.
La potencial fitotoxicidad de las NPs puede ser causada por un exceso endógeno en la producción de especies reactivas de oxígeno (ERO). Por tal motivo, realizamos experimentos de visualización de la producción de peróxido de hidrógeno en hojas. En la Figura 6 se muestra la producción de H2O2 debido a la aplicación de NPs después de 24 h. Todos los tratamientos mostraron producción de esta especie reactiva de oxígeno (Figura 6B , C y D). Sin embargo, la hojas con mayor deposición de H2O2 fueron las tratadas con NPsZnO + Ag al 2.5 %. Posterior a este tiempo fue disminuyendo, por lo que suponemos una activación del sistema antioxidante de la planta.
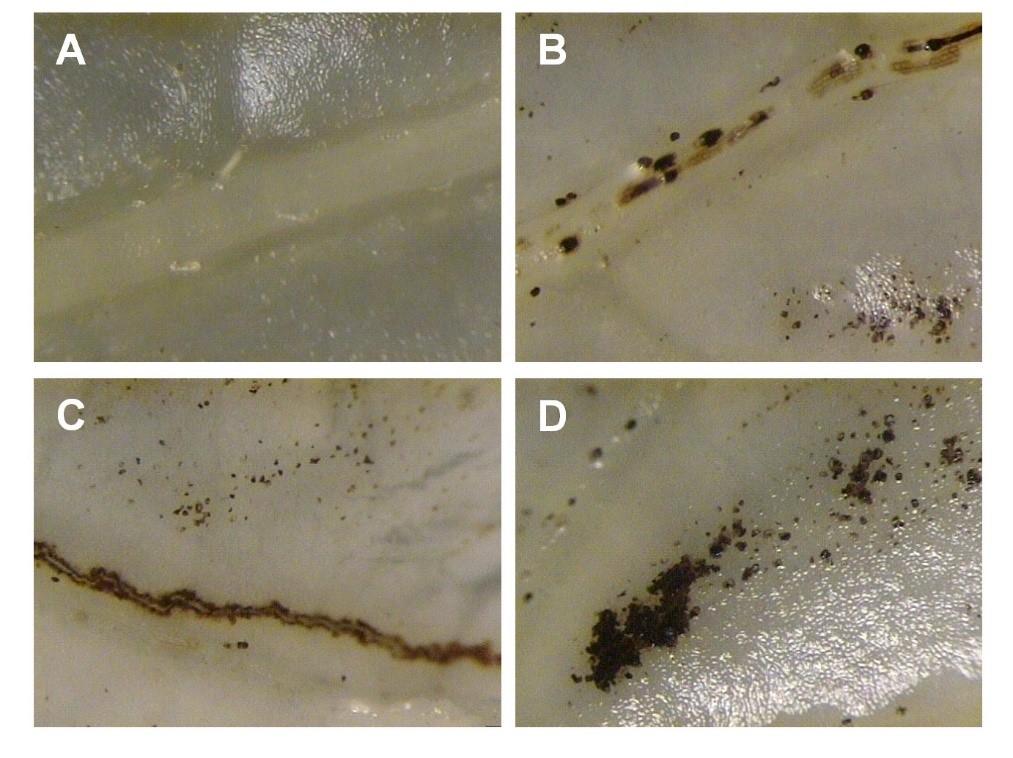
Figura 6 Tinción con DAB para detectar la formación de H2O2 in situ en plantas de C. annuum sometidas a la aplicación de nanopartículas de ZnO. A) Hojas de plantas control; B) Hojas de plantas tratadas con NPsZnO puras; C) Hojas de plantas tratadas con NPsZnO + Ag al 1.25 %; D) Hojas de plantas tratadas con NPsZnO + Ag al 2.5 %. (Amplificación 40 X).
Discusión
El efecto promotor del crecimiento en plantas de C. annuum por las NPsZnO observado en esta y otras investigaciones no está totalmente esclarecido. Navarro et al. (2008 372) Argumentan que los materiales de tamaño nanométrico con mayores áreas superficiales podrían absorber, translocar y retener de manera más eficiente los nutrientes en las plantas. Otros autores señalan que el aumento en el crecimiento y rendimiento de los cultivos, puede ser el resultado de la inhibición o control de alguna enfermedad por las NPsZnO (Servin et al., 2015, 2). Por su parte, Tarafdar et al. (2014 257) Reportan que estas NPs incrementan la actividad de ciertas enzimas como la fitasa, fosfatasa ácida y alcalina, las que pueden estar contribuyendo a la solubilización de un nutriente como el fósforo orgánico y su absorción por las plantas.
También se reporta que las NPs influyen significativamente en diversos aspectos fisiológicos y en mayor crecimiento de la raíz y tallo en cultivos hortícolas como Pisum sativum(Mukherjee et al., 2014 132). Esto puede ser debido a una mayor producción de ácido indolacético, el cual funciona como fitoestimulante hormonal, promoviendo así mayor velocidad de crecimiento (Pandey et al., 2010 493; Shyla y Natarajan, 2014 1379). Además, el zinc es considerado como uno de los ocho micronutrientes esenciales para las plantas, necesario en pequeñas cantidades, pero crucial para el buen desarrollo vegetativo (Pandey et al., 2010 489), ya que este micronutriente es precursor en la producción de auxinas fitorreguladoras del crecimiento, las cuales influyen en la elongación y división celular (Rehman et al., 2012 205). El zinc también desempeña una importante función en la producción de clorofila y por ende en la fotosíntesis, así como en mayor velocidad de germinación, producción de polen y biomasa (Prasad et al., 2012 906).
Diversos reportes concuerdan con los resultados obtenidos en esta investigación. Panwar et al. (2012 1) Señalan mayor crecimiento y producción de biomasa seca en plantas de tomate (Solanum lycopersicum) cuando aplicaron 20 mg L-1 de NPsZnO al follaje; además, encontraron concentraciones de Zn en las hojas, confirmando con ello que ocurrió la absorción en los estomas y su translocación basipétala vía floema. Otro estudio realizado por Prasad et al. (2012 912) Revelan que en semillas y plantas de cacahuate (Arachis hypogaea) una concentración de 1000 mg L-1 de NPsZnO promovió mejor germinación, así como mayor elongación de raíz y tallo. En plantas de soya (Glycine max) la dosis de 1 g L-1 de NpsZnO promovió efectos significativos en germinación y crecimiento, en comparación con las plantas no tratadas (Sedghi et al., 2013 76).
Los resultados obtenidos en este trabajo concuerdan con los reportados por Zhao et al. (2014 11949) en plantas de pepino (Cucumis sativus) que mostraron incrementos significativos en longitud y biomasa seca de la raíz con la incorporación al suelo de 400 y 800 mg kg-1 de NpsZnO, al igual que los resultados obtenidos por la aplicación foliar de 1.5 y 10 ppm de NpsZnO a plántulas de garbanzo (Cicer arietinum), ya que originaron mayor altura y biomasa seca. En ese mismo estudio se ha destacado que la aplicación de zinc en forma de nanofertilizante promueve el crecimiento de las plantas. Se ha sugerido que esa inducción del crecimiento se debe a que el zinc tiene una función muy importante como cofactor de enzimas involucradas en el proceso fotosintético, así como en la integridad y mantenimiento de las membranas celulares de las plantas (Burman et al., 2013 607). Es quizá por eso y otros beneficios fisiológicos y bioquímicos que las NPsZnO y otras nanopartículas, pudieran revolucionar la agricultura moderna (Sabir et al., 2014).
En la literatura concurre la ambivalencia sobre los efectos causados por estos nanomateriales. En ciertas investigaciones se informa que dosis bajas inducen crecimiento, mientras que las altas provocan fitotoxicidad. Lin y Xing (2008, 5582) señalan que la aplicación de 1000 mg L-1 de NPsZnO en zacate rye grass (Lolium perenne), causa una reducción en la biomasa; al afectar el crecimiento apical de la raíz, también observaron que las células corticales y epidermales se colapsaron, indicando lo anterior respuestas fitototóxicas por las NPs. En plantas de calabaza (Cucurbita pepo), las NPsZnO afectaron negativamente la producción de biomasa con la aplicación de 1000 mg L-1(Stampoulis et al., 2009 9476). Nosotros encontramos que una concentración de 50 mg L-1 induce la producción de H2O2 en las hojas, la cual se incrementa conforme aumenta la concentración de plata, lo que sugiere un aumento en la producción endógena de especies reactivas de oxígeno y una potencial fitotoxicidad que parece revertirse por el sistema antioxidante vegetal.
Por otra parte, se ha reportado que las NPsAg inducen un incremento de la longitud de la raíz, biomasa seca, mayor contenido de proteína, clorofila y carbohidratos; también inducen la activación de enzimas antioxidantes, resultando eso en una reducción de los niveles de especies reactivas de oxígeno (Salama, 2012 194; Sharma et al., 2012 2232), que pueden causar fitotoxicidad. La plata ha sido relacionada con el incremento de fitoreguladores de crecimiento como las citoquininas y giberelinas, las cuales participan en la división celular; asimismo este metal está involucrado con la concentración de etileno. Esta fitohormona influye en varios procesos como la germinación de semillas, senescencia, así como en respuestas de las plantas al estrés (McDaniel y Binder, 2012 26096). Otro factor que puede contribuir a los efectos positivos de las NPs aplicadas, es su tamaño nanométrico, debido a que producen mayor reactividad en el sistema vascular y celular de las plantas, en comparación con las mismas partículas pero de tamaño micrométrico, ya que el tamaño nano les permite permear fácilmente a través de las paredes y membranas celulares, incidiendo así de manera más directa en los diferentes organelos de las células (Prasad et al., 2012 921).
Conclusiones
La aplicación foliar de NPsZnO puras y con Ag a las concentraciones de 1.25 y 2.5% molar, mejoraron significativamente el crecimiento y producción de biomasa seca en plantas de C. annuum. El efecto promotor podría estar relacionado con la actividad que tiene el zinc como precursor en la síntesis de auxinas que promueven la división celular, así como por su influencia en la reactividad del ácido indolacético, el cual funciona como fitoestimulante hormonal. Además, es posible que las NPsAg pudieran estar involucradas en una mayor producción de las fitohormonas citoquinina y giberelina; aparte de inducir la actividad de enzimas antioxidantes.











 nueva página del texto (beta)
nueva página del texto (beta)