Introducción
La familia Crassulaceae es reconocida por tener una gran variedad de géneros y especies, las cuales son buscadas, colectadas y propagadas por su belleza con fines ornamentales. México es considerado como una zona de origen de muchas especies pertenecientes a esta familia. La siempreviva (Sedum praealtum A.DC) pertenece a la familia Crassulaceae, es frecuente en huertos familiares por su empleo como ornato y medicinal (Estrada-Salas et al., 2008). Sedum praealtum se está convirtiendo en una de las especies más importantes del género, por los muchos beneficios que se le están descubriendo en el ámbito clínico y ambiental. Monroy-Colín et al., (2011), propusieron a la siempreviva como una de las especies ideales en la instalación de jardines en las azoteas de edificios y casas - habitación por su rápido crecimiento y porque captura gran cantidad de dióxido de carbono.
Esta planta se ha utilizado durante mucho tiempo en la medicina tradicional como un agente anti-inflamatorio y analgésico, en el tratamiento de dolor de dientes, amigdalitis, para enfermedades de los ojos, erupciones cutáneas y de regeneración de tejidos, así como anticonceptivo (Meléndez-Camargo et al., 2002; Waizel-Bucay et al., 2011; Estrada-Salas et al., 2008), en gotas se utilizan contra afecciones oculares como carnosidad, cataratas, enrojecimiento y nube en ojos e inflamación dolor de oídos, también se utiliza el macerado de la planta para fuegos bucales, se toma en té para dolores de estomago (Pérez-García, 2009), desarrollo de espermicidas (Silva-Torres et al., 2003), hepatoprotector, además presenta efectos anticancerígenos (Meléndez-Camargo et al., 2002).
En varias especies del género Sedum se han encontrado compuestos como; cadaverina, nicotina, sarmentosina, sedamina, taninos, flavonoides, peletierina, ácido ursólico, daucosterol, apigenina, apigetrín, entre otros (Waizel-Bucay et al., 2011; Bensouici et al., 2015). Xu et al., (2015) trabajando con S. aizoon, encontraron cuatro nuevos compuestos flavonoides, así como compuestos y derivados fenólicos que no habían sido aislados dentro del género,
En una investigación para el análisis de extractos crudos de las flores de Sedum praealtum se encontró que el kaempferol y quercetina son los principales responsables de la actividad antioxidante de esta especie (Beltrán-Orozco et al., 2013). Estos autores concluyeron que la actividad antioxidante de flores frescas de Sedum praealtum se encuentra en el rango de la mayoría de frutas y verduras. Marquez-Rosales et al., (2012) con el propósito de determinar la actividad terapéutica de la siempreviva, establecieron una correlación altamente significativa entre la concentración de cinco fracciones orgánicas de compuestos polifenólicos de extractos de hojas y su capacidad para neutralizar radicales.
Aunque se han encontrado muchas propiedades terapéuticas, pocos estudios se han realizado para la micropropagación de especies del género Sedum. Wojciechowicz (2007) analizó el potencial de regeneración de diferentes explantes de yemas florales (pétalos, estambres y pistilos) en Sedum acre, S. aizoon, S. floriferum, S. grácil, y S. spectabile. En el 2002, Kitamura et al., trabajando con tallo y hoja de Sedum drymarioides, lograron propagar esta especie por la vía de organogénesis indirecta. Su-Juan et al., (2009) por la misma vía establecieron un protocolo de propagación de Sedum alfredii y utilizando hojas como explantes. Yang et al., en el 2012 lograron propagar S. spectabile Boreau cultivando la parte basal de las hojas. En la micropropagación del géneso Sedum, poco se ha utilizado la auxina 2,4-Diclorofenoxiacético (2,4-D), en los trabajos antes mencionados, han usado principalmente las auxinas ácido naftalenacético (ANA), ácido indolbutírico (AIB) ó ácido indolacético (AIA) en combinación con la citocinina bencilaminopurina (6-BAP) y en algunos casos con tidiazurón (TDZ), se logró inducir la formación de callo, para después generar brotes (Yang et al., 2012; Huan y Sivanessan, 2016). En el cultivo de tejidos entre los principales usos de las auxinas es la desdiferenciación del tejido para la formación de callo, la aplicación de auxinas potentes como el 2,4-D, en muchas especies vegetales puede inducir además, la embriogénesis somática (Machakova et al., 2008).
Las plantas medicinales y los metabolitos que de ellas se obtienen, son una fuente importante de nuevas alternativas para combatir diversos padecimientos sin el abuso de sustancias químicas de origen sintético, ejemplo de ello es la siempreviva, por lo que se realizó este trabajo con el objetivo de desarrollar un protocolo de establecimiento analizar el efecto de los reguladores de crecimiento 6-BAP y 2,4-D en la propagación in vitro de la siempreviva (Sedum praealtum).
Método
Material Vegetal
En la presente investigación se utilizaron plantas procedentes de viveros ubicados en La Barca, Jalisco, de donde se obtuvieron las hojas más jóvenes con un tamaño de entre 1.0 - 1.5 cm que fueron usadas como explantes. Las hojas fueron lavadas con agua corriente y jabón, posteriormente y bajo la campana de flujo laminar, los explantes fueron sometidos a un pretratamiento con etanol al 70% durante 2 minutos, seguido de inmersión en una solución de hipoclorito de sodio al 25% de producto comercial (Cloralex ®) al cual se le agregaron 3 gotas de Tween 20, durante 25 minutos, seguido de tres enjuagues con agua bidestilada estéril para remover los restos del hipoclorito de sodio.
Regeneración
A las hojas se les eliminó la parte basal y superior y fueron cultivadas en medio MS (Murashige y Skoog, 1962), suplementado con 6-BAP a concentraciones entre 0.0 y 2.0 mg/L y 2,4-D a concentraciones entre 0.0 y 2.0 mg/L, vitaminas L2 (Phillips y Collins, 1979), 30 g/L de sacarosa y solidificado con 8 g/L de agar. Se realizó un diseño bifactorial completamente al azar, se realizaron un total de 25 tratamientos (Tabla 1), cada tratamiento consistió de 6 repeticiones teniendo en cada repetición 3 explantes para dar un total de 18 unidades experimentales por tratamiento.
Todos los tratamientos fueron esterilizados en autoclave a 121 ºC por 20 minutos a 1.5 atms de presión. Los cultivos se mantuvieron en condiciones controladas en una cámara de incubación, con luz blanca, un fotoperiodo de 16 horas luz, 8 horas oscuridad y una temperatura promedio de 26 ± 2 °C.
Análisis estadístico
Los datos obtenidos fueron sometidos a un análisis de varianza (ANOVA) y al método de comparación múltiple de medias Tukey HSD. Se utilizó el software para análisis estadístico Past3. El objetivo de estas pruebas fue detectar la significancia del modelo y las diferencias entre las medias de los tratamientos (Compton, 1994).
Inducción de raíz y adaptación ex vitro
Los brotes formados fueron transferidos a medio de cultivo MS adicionado con AIA (2.0 mg/L) para la inducción de raíz. Para el establecimiento ex vitro se utilizaron vasos de poliestireno los cuales se rellenaron con sustrato previamente esterilizado formado con 40% arena amarilla, 50% tierra roja y 10% humus de lombriz. Se escogieron plántulas con suficiente raíz y con una longitud mínima de 3 cm, las plántulas fueron extraídas del medio de enraizamiento y lavadas con agua corriente para eliminar los restos de agar, en cada recipiente se colocó una plántula y se le agregaron aproximadamente 1.5 mL de carbendazim (fungicida) y 1.25 g/L del enraizador Raux (nitrógeno 7%, fosforo 37%, potasio 14%, ácidos fulbicos 3%, aminoácidos 3%, algas marinas 2%, ANA 2600 ppm y AIB 2400 ppm) este último con el fin de fortalecer el desarrollo de raíces. Los recipientes fueron cubiertos con una bolsa de plástico transparente, al cabo de 7 días, con unas tijeras se les cortó uno de los extremos, a los 15 días el otro extremo de la bolsa, esto con el propósito de permitir poco a poco la adaptación de las plántulas con el medio exterior, a los 22 días, las bolsas fueron removidas completamente y las plantas fueron colocadas bajo una malla-sombra al 70%.
Resultados
El procedimiento utilizado para la esterilización de la superficie de los explantes de S. Praealtum fue eficiente al utilizar 25% de hipoclorito de sodio (Cloralex ®) por 25 minutos, se presentaron algunas contaminaciones por hongos en algunas réplicas de los tratamientos, debido posiblemente al trabajo manual, estas no fueron determinantes para poder realizar análisis estadístico de los resultados. A pesar de la concentración utilizada y el largo tiempo de exposición, los explantes mantuvieron su viabilidad y no se presentó necrosis durante su establecimiento y desarrollo in vitro.
El número de brotes por explante se analizó mediante ANOVA resultando el factor 6-BAP como significativo mientras que la adición de 2,4-D no fue significativa, aunado a ese resultado se encontró la no significancia de la interacción entre ambos reguladores de crecimiento. En la Tabla 1 se muestra el análisis de comparación múltiple de medias de los tratamientos, se detectó que el mayor rendimiento de brotes fue obtenido cuando se utilizó la concentración de 0.5 mg/L de 6-BAP en ausencia de 2,4-D, en tanto, las demás concentraciones produjeron un menor rendimiento.
Tabla 1. Efecto del 6-BAP y del 2,4-D en la inducción de indirecta de brotes de S. praealtum. Comparación múltiple de medias. Prueba Tukey.
| Tratamiento | Reguladores de crecimiento (mg/L) |
Observaciones | Media No de brotes |
||
|---|---|---|---|---|---|
| 6-BAP | 2,4-D | ||||
| 1 | 0.0 | 0.0 | 6 | 0.0 | c |
| 2 | 0.0 | 0.1 | 6 | 6.6667 | b |
| 3 | 0.0 | 1.0 | 6 | 0.3333 | c |
| 4 | 0.0 | 1.5 | 6 | 0.3333 | c |
| 5 | 0.0 | 2.0 | 6 | 0.0 | c |
| 6 | 0.5 | 0.0 | 6 | 13.0 | a |
| 7 | 0.5 | 0.1 | 6 | 0.0 | c |
| 8 | 0.5 | 1.0 | 6 | 0.0 | c |
| 9 | 0.5 | 1.5 | 6 | 0.0 | c |
| 10 | 0.5 | 2.0 | 6 | 0.0 | c |
| 11 | 1.0 | 0.0 | 6 | 9.3333 | a |
| 12 | 1.0 | 0.1 | 6 | 0.0 | c |
| 13 | 1.0 | 1.0 | 6 | 0.0 | c |
| 14 | 1.0 | 1.5 | 6 | 0.0 | c |
| 15 | 1.0 | 2.0 | 6 | 0.0 | c |
| 16 | 1.5 | 0.0 | 6 | 0.0 | c |
| 17 | 1.5 | 0.1 | 6 | 0.6667 | c |
| 18 | 1.5 | 1.0 | 6 | 1.6667 | c |
| 19 | 1.5 | 1.5 | 6 | 1.0 | c |
| 20 | 1.5 | 2.0 | 6 | 0.6667 | c |
| 21 | 2.0 | 0.0 | 6 | 0.0 | c |
| 22 | 2.0 | 0.1 | 6 | 0.0 | c |
| 23 | 2.0 | 1.0 | 6 | 1.0 | c |
| 24 | 2.0 | 1.5 | 6 | 0.0 | c |
| 25 | 2.0 | 2.0 | 6 | 1.3333 | c |
Medias con la misma letra no son significativamente diferentes. α = 0.05
Los resultados se agruparon de tal manera que los mejores tratamientos para la producción de brotes fueron aquellos con concentraciones bajas de 6-BAP y siempre en ausencia de 2,4-D, mientras que concentraciones altas de ésta citocinina reduce significativamente la producción de brotes, esto puede deverse a la producción endógena de auxinas (Figura 1).
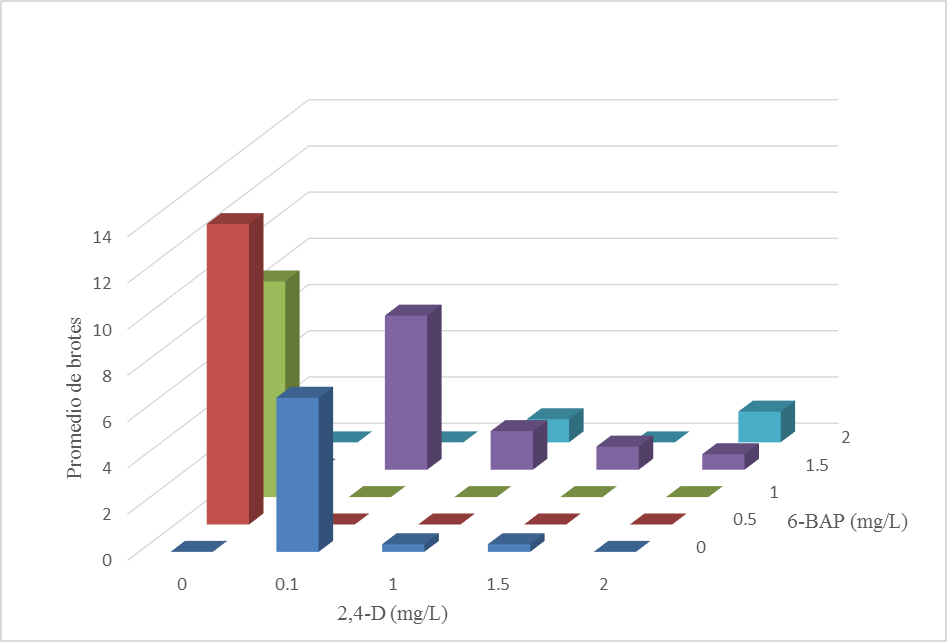
Figura1. Efecto de la combinación de reguladores de crecimiento sobre el número de brotes de S. praealtum
Después de 30 días de cultivo la mayoría de los explantes comenzaron a formar callo principalmente en los extremos que estaban en contacto con el medio, el callo presentó color blanco y poco compacto en aquellos tratamientos donde se logró la inducción de brotes.
A los 60 días de cultivo, se observaron callos compactos nodulares crecidos en los tratamientos con 6-BAP, los cuales comenzaron a tornarse de color café y de estos surgieron estructuras globulares verdes (Figura 2 a), después de 90 días de iniciado el cultivo concluyeron su desarrollo en brotes verdes bien diferenciados presentando hasta 4 entrenudos (Figura 2 c). Los callos formados en presencia de 2,4-D en el medio de cultivo, fueron de color blanco y compactos y en su mayoría no desarrollaron brotes, algunos de los tratamientos que contenían 2,4-D, solo o en combinación con BAP, se indujo la generación de brotes, (Tabla 1), este hecho posiblemente debido al efecto del genotipo de los explantes utilizados (Machakova et al., 2008).

Figura 2 Propagación in vitro de la siempreviva (Sedum praealtum A.DC) vía organogénesis indirecta; a) desarrollo de callo nodular y diferenciación de los brotes a los 60 días de cultivo; b) corte transversal de callo nodular mostrando el origen morfogénico de los brotes; c) brotes formados por organogénesis indirecta obtenidos con 0.5 mg/L de 6-BAP y 0.0 mg/L de 2,4-D después de 90 días de cultivo; d) adaptación ex vitro. Barra = 1 cm.
Los tratamientos con 0.5 mg/L de 6-BAP, 0.0 mg/L de 2,4-D y 1.0 mg/L de 6-BAP, 0.0 mg/L de 2,4-D produjeron un mayor número de brotes. Los brotes obtenidos del primer tratamiento presentaron una mayor longitud promedio y mayor número de hojas por brote (Figura 2c).
El procedimiento de individualización y cambio de las plántulas a medio de cultivo fresco conteniendo AIA (2.0 mg/L) se realizó mediante la transferencia de los brotes formados que habían alcanzado un tamaño promedio de 3 cm y desarrollado de 3 a 4 entrenudos, debido a que los brotes formados presentaban conexión con el sistema vascular (Figura 2b), fue necesario la disección para lograr la individualuzación de los brotes.
El AIA favoreció la inducción y crecimiento de raíces después de 25 días de cultivo en un 85% de las plántulas, las cuales se desarrollaron alrededor de su base con promedio de 4 a 6 raices por brote, con un crecimiento de hasta 3.0 cm, presentando un color crema. Cabe mencionar que el medio circundante se oscureció debido posiblemente a la liberación de fenoles por parte de las plántulas, este hecho no afectó su desarrollo.
El sustrato utilizado (Raux; enriquecido con nutrientes inorgánicos, orgánicos y auxinas) logró soportar el desarrollo de las plántulas ex vitro, se obtuvo una supervivencia del 70% en invernadero, debido posiblemente a factores como la deshidratación. Las plántulas sobrevivientes se desarrollaron con firmeza y vigor (Figura 2d).
Discusión y Conclusión
Sedum praealtum es un importante género de la familia Crassulaceae, la cual forma parte del grupo de las Dicotiledóneas, esta especie en los últimos años ha tomado relevancia en el campo de la medicina por los metabolitos secundarios que produce. La regeneración de brotes adventicios y morfogénesis in vitro de S. praealtum obtenida del cultivo de hojas como explantes en medio MS, utilizando varias concentraciones de 6-BAP en combinación con 2,4-D. En este trabajo los brotes formados en los tratamientos con bajas concentraciones de 0.0, 0.5 y 1.0 mg/L 6-BAP y 0.0 mg/L de 2,4-D se desarrollaron por organogénesis indirecta, no hubo desprendimiento de los brotes y no se observaron los estadíos de desarrollo globular, corazón y torpedo para la obtención de embriones somáticos (Figura 2a y 2b), característica de las especies dicotiledóneas (Gutierrez-Mora et al., 2012).
Los tratamientos con mayor número de brotes no contenian 2,4-D, resultados similares fueron obtenidos por López-Díaz et al., (2009), en el cual demostraron la formación de un mayor número de brotes en el tratamiento con 2.0 mg/L de 6-BAP y 0.0 mg/L de 2,4-D utilizando como planta experimental Kalanchoe daigremontiana.
Los tratamientos con altas concentraciones de 2,4-D y 6-BAP solos o en combinación, presentaron poco desarrollo de callo y bajo desarrollo de brotes (Tabla 1), lo cual confirma lo encontrado por Su-Juan et al. (2009), trabajando con Sedum alfredi determinaron que adicionando 2,4-D al medio de cultivo inhibe el desarrollo y crecimiento de brotes. Este hecho posiblemente sea debido a que el género Sedum, produzca in vitro cantidades relativamente altas tanto de auxina como de citocininas endógenas. Si bien es cierto que las auxinas fuertes como el 2,4 -D, pueden presentar un efecto inhibitorio por la acumulación de productos secundarios, ya sea por una influencia directa en actividades enzimáticas o en el proceso de la transcipción, también es cierto que un balance adecuado de su concentración con las citocininas en el medio de cultivo, puede ser capáz de inducir la formación de embriones somáticos por la vía directa o indirecta (Machakova et al., 2008).
La vía de propagación más utilizada en la mayoría de las crasuláceas es la inducción de brotes por la vía indirecta o directa (Wojciechowicz, 2007; Ahmed y Taha, 2014; Kumari. 2016; Liu et al., 2016). La producción de callo en Sedum spectabile fue reportada usando MS suplementado con 2.0 mg/L de 6-BAP y 1.0 mg/L de ANA, utilizando hojas como explantes (Zhang y Cheng, 2007). Se reportó más tarde la inducción de embriones somáticos de la misma especie Sedum spectabile estudiando el tipo de explante y concentración de reguladores de crecimiento, se encontró que la mayor regeneración fue en fragmentos centrales de hoja, siendo los fragmentos distales los que presentaron menor regeneración, el mayor número de embriones fue con MS suplementado con bajas concentraciones de auxinas y citocininas (Yang et al., 2012). La embriogénesis somática ha sido obtenida en pocas especies crasuláceas, en 2007, Song y Park aplicando 5 mg/L de 2,4-D en combinación con 0.5 mg/L de 6-BAP lograron la inducción de callo embriogénico y posterior maduración de embriones somáticos en Orostachys japonicus, utilizando como explante tallo. Ahmed et al., (2014), indujeron la formación de embriones somáticos mediante el cultivo in vitro de Crassula ovata siendo el mejor tratamiento 0.5 mg/L 2,4-D solo o en combinación con 1.0 mg/L de 6-BAP induciendo la formación de callo embriogénico en explantes provenientes del tallo, que aquellos provenientes de hoja. En el 2007 Cordeiro et al., reportaron que los efectos de la interacción de los diferentes reguladores de crecimiento (auxinas y citocininas) varían de acuerdo al regulador utilizado, tipo de explante y a las características propias del genotipo de la especie vegetal propagada y pueden actuar de manera sinérgica o no, en el fenómeno de desdiferenciación, por lo que cada interacción debe ser usada y probada para cada genotipo con el propósito de determinar la concentración exacta durante el proceso de establecimiento y propagación (Machakova et al., 2008).
El efecto del 2,4-D y 6-BAP sobre la micropropagación de la siempreviva (Sedum praealtum A. DC) fue analizado, encontrando que bajas concentraciones de 6-BAP (0.5 y 1.0 mg/L) pueden inducir la formación de callo y desarrollo de brotes por vía organogénesis indirecta utilizando como explante hojas. En tanto que el 2,4-D en las concentraciones usadas en este trabajo, los explantes desarrollaron callo compacto con poca capacidad morfogénica.











 nova página do texto(beta)
nova página do texto(beta)


