Introducción
La salinidad de los suelos es uno de los problemas mayores que enfrenta la agricultura, se estima que más de 800 millones de hectáreas en el mundo están afectadas, lo que representa una pérdida superior a los 12 mil millones de dólares anuales (Khalig et al., 2014, 18). Las plantas cultivadas en suelos salinos disminuyen su capacidad para absorber agua, presentan un desbalance nutricional, toxicidad, cambios fisiológicos y morfométricos, entre otros (Horie et al., 2012 11) ,. En general, la salinidad inhibe el crecimiento de las plantas y su productividad. El exceso de sales en el suelo o en el agua de riego, induce desequilibrios en las relaciones osmóticas entre el suelo y las plantas y en el metabolismo de estas. Existe un grupo de factores que aumentan la tolerancia de las plantas a la salinidad, la incorporación o aplicación de estos mejoran la productividad de los cultivos en estas condiciones (Ghazi Al-Karaki, 2008, 229). Además de la fertilidad reducida del suelo en zonas áridas, se considera la presencia de otros problemas ambientales como la concentración salina del agua, del suelo y la sequía. El daño en el suelo y en las plantas en zonas áridas y semiáridas no es fácil de reparar debido a la fragilidad que presentan estos ecosistemas (Pascual et al., 2000, 1877). Sin embargo, el impacto ecológico de la simbiosis micorrízica arbuscular (MA) es particularmente relevante para estos ecosistemas donde existe tolerancia alta de las plantas a estrés ambiental, en gran medida aportada por los hongos micorrízicos arbusculares (HMA) (Allen, 2007, 291) . En investigaciones recientes se amplia el contexto en el que se estudia la simbiosis micorrízica, determinando el rol del micelio fúngico en efectos ecosistémicos (Finlay et al., 2008, 201). Los HMA son biomejoradores importantes para suelos salinos ya que la colonización micorrízica arbuscular mejora el crecimiento, nutrición y vigor de la planta, mitiga el daño de las plantas hospederas causada por la salinización del suelo (Evelin et al., 2013, 71). Los HMA pertenecen al phylum Glomeromicota que forman asociaciones mutualistas con las raíces de la mayoría de las plantas vasculares (Jeffries et al., 2003, 1). En esta asociación denominada micorriza arbuscular (MA), el hongo coloniza de forma extra e intercelular el cortex de la raíz, desarrolla un micelio externo intrincado que rodea la raíz de las plantas colonizadas. Este micelio forma una conexión continua entre la solución del suelo y la planta, que permite la captación de iones desde el suelo y su transporte a la raíz del hospedero que influye de manera activa en la nutrición mineral. En sentido inverso, el HMA recibe compuestos carbonados provenientes de la fotosíntesis de la planta, necesarios para su metabolismo por tratarse de un simbionte obligado que requiere de la interacción con la planta para completar su ciclo de vida (Bago y Bécard, 2002, 33). La etapa de emergencia, constituye un indicador importante para el establecimiento y función de las plántulas (Rodríguez y Leihner, 2006, 37).
La albahaca (Ocimum basilicum L.) es un cultivo altamente rentable con una demanda alta en la industria farmacéutica, cosmética y perfumería, representa una fuente de ingresos para los productores. Entre las limitantes del cultivo destaca su establecimiento en zonas donde la salinidad de los suelos es alta (Reyes-Pérez et al., 2013 a, 101). En el Estado de Baja California Sur, México, la albahaca constituye uno de los principales cultivos de importancia económica dada por la demanda en el mercado nacional e internaciona lo cual genera una fuente de ingreso importante para los productores de esta especie aromática; si bien es cierto que su uso proporciona mayores ganancias, también se sabe que algunas de las variedades más demandadas y que se cultivan en la región, son sensibles a la salinidad. No existen antecedentes conocidos de la investigación de los HMA y su interacción con estrés salino en albahaca. El objetivo del estudio fue evaluar un consorcio de hongos micorrízicos arbusculares (HMA) que contenía las especies Funneliformis mosseae y Claroideoglomus etunicatum como posibles mitigadores del estrés por cloruro de sodio (NaCl) en plántulas de variedades de albahaca en la etapa de emergencia.
Método
Área de estudio
El experimento se desarrolló del 15 de mayo al 5 de junio de 2015, en una estructura de malla sombra (40% de sombreo, color negro, modelo 20 mesh) en el campo experimental del Centro de Investigaciones Biológicas del Noroeste, S.C. (CIBNOR) localizado al noroeste de La Paz, Baja California Sur, México, a los 24°08'10.03 LN y 110°25'35.31 LO, a 7 m.s.n.m. La temperatura media, máxima y mínima dentro de la malla sombra durante el periodo de experimentación fueron, 25.57 ± 5.96, 41.40 ± 6.06 y 14.40 ± 5.81 °C, respectivamente, con 57.36 ± 16.98% de humedad relativa. Los datos de las variables climatológicas que se registraron durante el periodo de estudio, se obtuvieron de una estación meteorológica portátil (Vantage Pro2 ® Davis Instruments, U.S.A.) que se colocó dentro de la estructura de malla sombra. El sitio experimental tiene un clima del tipo Bw (h’) hw (e) considerado como semiárido, con vegetación xerófila (García, 2004, 98).
Material genético
Se utilizaron semillas de albahaca de las variedades Napoletano, Genovese y Nufar (Vis Seed Company ®, Arcadia, Cal., U.S.A.) con respuesta diferencial al estrés por NaCl de acuerdo con Reyes-Pérez et al. (2013a, 101; 2013b, 869; 2013c, 257) y Reyes-Pérez et al. (2014, 35). Con el objetivo de evaluar la calidad de las semillas de las tres variedades a evaluar, previo al experimento se realizó un ensayo de germinación mediante la metodología propuesta por ISTA (2010, 51).
Diseño experimental
El experimento se estableció en un diseño completamente al azar con arreglo factorial con tres factores en estudio, considerando como factor 1 a las variedades de albahaca con respuesta diferencial al NaCl (Nufar, Genovese y Napoletano), el factor 2 fue el estrés por salinidad (0, 50 y 100 mM de NaCl) y el factor 3 los hongos micorrízicos arbusculares (0 -control- y 1 g del inóculo de HMA) con cuatro repeticiones de 30 semillas cada una.
Desarrollo del experimento
Se utilizó un lote de semillas de las variedades en estudio sin inocular como control y un lote de semillas inoculadas al momento de la siembra utilizando el método de recubrimiento de las semillas propuesto por Fernández et al. (1999b). El contenido de esporas del inóculo fue de 50-100 esporas g-1 de sustrato. Las semillas se sembraron en charolas de poliestireno de 200 cavidades las cuales contenían sustrato comercial previamente esterilizado (vermiculita). Para mantener la humedad del sustrato se irrigó todos los días en el horario de la mañana con el tratamiento correspondiente, control (agua destilada) o solución salina correspondiente, el riego fue uniforme utilizando una cantidad de 500 mL para cada charola consiguiendo que la solución aplicada drenará a traves de los orificios de las charolas con el fin de evitar la acumulación de sales en el sustrato que pudiera causar un shock osmótico. La aplicación de los tratamientos (0, 50 y 100 mM de NaCl) se realizó desde el momento de la siembra de las semillas en las charolas. Durante todo el experimento se hicieron análisis cada semana de pH y conductividad eléctrica al agua que drenaba por los orificios de las charolas con el fin de evitar efecto residual de sales en el sustrato. La emergencia se registró diariamente y el porcentaje final se determinó a los catorce días. La tasa de emergencia (M) se calculó utilizando la ecuación de (Maguire, 1962, 176):
M = n1/t1 + n2/t2 + … n30/t14; donde: n1, n2,…n30 = número de semillas germinadas en los tiempos t1, t2,… t14 (en días).
Análisis químico del sustrato y del inóculo utilizados
Se tomaron muestras del sustrato y del inóculo utilizados y se tamizó con malla número 10 (2 mm). Se midió el pH y conductividad eléctrica con una relación suelo: solución de 1:5 y se utilizó un potenciómetro (Hanna ®, modelo 211, U.S.A.) (Jackson, 1958, 66). La conductividad eléctrica (C.E., dS m-1) se midió con conductímetro (Hach ®, Modelo Sension5, Loveland, Colorado, U.S.A.) (Jackson, 1976, 283). El fósforo asimilable (P, mg kg-1) se midió del extracto acuoso, con una relación suelo: solución 1:5 y se utilizó Multiskan Acent ® (Modelo Labsystems, No. 354, Finland) (Jackson, 1976, 283). El potasio (K) extractable (mg kg-1) se determinó por espectrofotómetro de absorción atómica de flama (GBC ®, modelo Avanta, Australia) (Van Loon, 1985, 357). El calcio y magnesio extractable se midieron por complexometría, método volumétrico por titulación (valoración con EDTA 0.01 N), acorde con Cheng y Bray (1951, 449). El contenido de materia orgánica (M.O., %) se determinó por el método de Walkley y Black (NOM-021 SEMARNAT 2000 Método AS-07, 12) utilizando la malla número 35 (0.5 mm). El nitrógeno total (N) se determinó por el método de Dumas (Leco ®, modelo FP-528, U.S.A.) utilizando la malla número 100 (0.150 mm) (Bremner, 1965, 1091).
Variables morfométricas
Después de 21 días de aplicar los tratamientos salinos, se eligieron al azar 10 plántulas por repetición, de las cuales, cinco plántulas se utilizaron para medir variables morfométricas y las otras cinco para determinar porcentaje de colonización en sus raíces. Las variables morfométricas que se midieron fueron altura de la planta (cm), longitud de raíz (cm), biomasa fresca y seca de parte aérea y de la radícula (g), mismas que se determinaron por el método destructivo al dividir cada plántula en radícula y parte aérea y pesar cada una por separado, utilizando una balanza analítica (Mettler ® Toledo, AG204, U.S.A.). La biomasa fresca y seca de parte aérea y raíz se obtuvo al colocar estos tejidos en bolsas de papel e introducirlas en una estufa de secado (Shel-Lab ®, FX-5, serie-1000203, U.S.A.) a una temperatura de 70°C por 72 horas hasta obtener peso constante. Posteriormente se pesaron en balanza analítica (Mettler Toledo ®, AG204, U.S.A.).
Colonización de raíces por hongos micorrízicos arbusculares (HMA)
Para evaluar el porcentaje de colonización micorrízica se utilizó la metodología de Phillips y Hayman (1970, 158) y se utilizó como colorante el azul de tripano (C34H28N6O14S4). La colonización se evaluó tomando en cuenta la presencia de vesículas, arbúsculos y/o hifas cenocíticas (hifas) típicas de los HMA.
Análisis estadístico
Se realizaron análisis de varianza y comparaciones múltiples de medias (Tukey HSD p=0.05). Los valores de porcentaje de emergencia se transformaron mediante arcoseno (Little y Hills, 1989, 270; Steel y Torrie, 1995, 622) para cumplir con el supuesto de normalidad. Los análisis estadísticos se realizaron con el programa estadístico Statistica v. 10.0 para Windows (StatSoft ®, Inc., 2011, 1098).
Resultados
Análisis químico del sustrato
El sustrato (vermiculita) presentó una fertilidad química muy baja con un contenido medio de Mg2+ (4.9 mg kg-1), disponibilidad baja de K+ intercambiable (18.2 mg kg-1), muy baja de P asimilable (10.0 mg kg-1), contenido bajo de N (0.02%), cero contenido de materia orgánica, cero contenido de calcio, pH ligeramente ácido a neutro (6.4) y conductividad eléctrica muy baja (0.015 dS m-1).
Análisis químico del inóculo
El inóculo presentó una fertilidad química media con un contenido de 3.5 mg kg-1 de Mg2+, disponibilidad media de K+ intercambiable (23.44 mg kg-1), media de P asimilable (20.0 mg kg-1), bajo en Ca2+ (1.00 mg kg-1), contenido bajo de N (0.20%), 3.7% de materia orgánica, pH prácticamente neutro (7.3) y conductividad eléctrica muy baja (0.088 dS m-1).
Tasa y porcentaje de emergencia
Para tasa de emergencia (TE) se encontraron diferencias significativas entre variedades, NaCl, HMA, interacción variedades × NaCI × HMA, mientras que para las interacciones variedades × NaCl, variedades × HMA, NaCl × HMA no se encontraron diferencias significativas. Al analizar el factor variedades se observó que la variedad Napoletano mostró mayor tasa de emergencia, seguida por Nufar y Genovese (Tabla 1). Para el factor NaCl, se observó que la tasa de emergencia disminuyó significativamente conforme los niveles de NaCl incrementaron, registrándose la TE mayor en 0 mM de NaCl (Tabla 1). El análisis del factor HMA mostró que la tasa de emergencia fue mayor en aquellas semillas inoculadas con HMA (CM) con respecto al control (SM) (Tabla 1). En relación a la triple interacción de los factores, variedades × NaCl × HMA, los resultados muestran que la tasa de emergencia fue mayor en Napoletano en los tres niveles de NaCl y con HMA, mientras que los valores inferiores los mostraron Genovese y Nufar en 100 mM NaCl y sin HMA (Tabla 3). El porcentaje de emergencia (PE) mostró diferencias significativas entre variedades, NaCl, HMA y entre la triple interacción variedades × NaCl × HMA, mientras que para las interacciones variedades × NaCl, variedades × HMA, NaCl × HMA no se encontraron diferencias significativas. La respuesta de las variedades fue diferencial, aunque Napoletano y Nufar mostraron igualdad estadística en esta variable, mientras que Genovese mostró el porcentaje de emergencia menor (Tabla 1). El porcentaje de emergencia también disminuyó conforme se incrementaron los niveles de NaCl (Tabla 1) y en el mismo sentido, esta última variable mostró valores superiores en aquellas semillas tratadas con el consorcio de HMA (Tabla 1). En relación a la interacción de los factores variedad × NaCl × HMA mostró mayor porcentaje de emergencia la variedad Napoletano con 0 mM de NaCl con HMA y menor en Genovese 100 mM de NaCl sin HMA (Tabla 3).
Tabla 1. Respuesta de plántulas de tres variedades de albahaca sometidas a estrés salino por NaCl y la inoculación con HMA como mitigadores del estrés en la tasa, porcentaje de emergencia y variables morfométricas.
| Variedades | TE** | PE (%)** | AP (cm) ** | LR (cm) ** | BFPA (g) ** | |
|---|---|---|---|---|---|---|
| Genovese | 2.62 c | 63.33 b | 1.38 a | 4.33 b | 0.178 b | |
| Napoletano | 4.14 a | 81.66 a | 1.42 a | 5.49 a | 0.234 a | |
| Nufar | 3.11 b | 75.97 a | 1.17 b | 4.41 b | 0.187 b | |
| NaCl (mM) | TE** | PE (%)** | LR (cm) ** | BFPA (g) ** | BFR (g) ** | |
| 0 | 3.59 a | 80.69 a | 5.12 a | 0.175 b | 0.094 a | |
| 50 | 3.29 b | 73.75 b | 4.64 b | 0.214 a | 0.089 a | |
| 100 | 2.99 c | 66.52 c | 4.47 b | 0.210 a | 0.069 b | |
| HMA | TE** | PE (%)** | AP (cm) ** | LR (cm) ** | BFPA**(g) | BFR (g) ** |
| SM | 2.73 b | 65.09 b | 1.23 b | 4.19 b | 0.171 b | 0.068 b |
| CM | 3.85 a | 82.22 a | 1.42 a | 5.30 a | 0.229 a | 0.100 a |
TE = Tasa de emergencia, PE = Porcentaje de emergencia, AP = Altura de plántulas, LR = Longitud de raíz, BFPA = Biomasa fresca de parte aérea, NaCl = Cloruro de sodio, BFR= Biomasa fresca de raíz, HMA = Hongos micorrízicos arbusculares, SM = sin HMA (control), CM = con HMA (1 g del inóculo de HMA),
* = significativo a p ≤ 0.05,
** = significativo al p ≤ 0.01. Medias con letras distintas en una misma columna difieren estadísticamente (Tukey HSD, p = 0.05).
Tabla 3. Efecto de la interacción de variedades × NaCl × HMA en la tasa, porcentaje de emergencia y variables morfométricas de plántulas de variedades de albahaca sometidas a estrés por NaCl e inoculadas con HMA como mitigadores del estrés.
| Variedades | NaCl (mM) | HMA | TE* | PE (%)** | BFPA (g) ** | LR (cm) ** |
|---|---|---|---|---|---|---|
| Genovese | 0 | CM | 3.51 cd | 71.66 bcde | 0.191 cdefg | 6.08 ab |
| Genovese | 50 | CM | 3.18 cdef | 63.33 de | 0.191 cdefg | 4.69 bcdef |
| Genovese | 100 | CM | 2.8 cdef | 73.33 bcde | 0.183 cdefg | 4.27 cdef |
| Genovese | 0 | SM | 2.53 efg | 65.83 cde | 0.134 g | |3.96 ef |
| Genovese | 50 | SM | 2.28 fg | 60.83 e | 0.189 cdefg | 3.70 ef |
| Genovese | 100 | SM | 1.37 hi | 37.50 f | 0.159 efg | 3.32 f |
| Napoletano | 0 | CM | 4.95 a | 99.16 a | 0.172 defg | 6.10 ab |
| Napoletano | 50 | CM | 4.66 ab | 87.50 abc | 0.377 a | 5.75 abc |
| Napoletano | 100 | CM | 4.51 ab | 83.33 abcd | 0.280 b | 6.49 a |
| Napoletano | 0 | SM | 3.79 bc | 80.83 abcd | 0.191 cdefg | 5.00 abcde |
| Napoletano | 50 | SM | 3.53 cd | 79.16 abcde | 0.172 defg | 5.67 abcd |
| Napoletano | 100 | SM | 3.38 cde | 67.50 bcde | 0.248 bc | 3.96 ef |
| Nufar | 0 | CM | 3.76 bcd | 87.50 abc | 0.219 bcde | 5.04 abcd |
| Nufar | 50 | CM | 3.90 bc | 88.33 ab | 0.205 cdef | 4.21 def |
| Nufar | 100 | CM | 3.35 cde | 78.33 abcdev | 0.238 bcd | 5.13 abcde |
| Nufar | 0 | SM | 2.97 cdefg | 71.66 bcde | 0.157 efg | 4.57 bcdef |
| Nufar | 50 | SM | 2.53 efg | 70.83 bcde | 0.150 fg | 3.86 ef |
| Nufar | 100 | SM | 2.14 h | 59.16 ef | 0.155 efg | 3.69 ef |
HMA = Hongos micorrízicos arbusculares, SM = sin HMA (control), CM = con HMA (1 g del inóculo de HMA), TE = Tasa de emergencia, PE = Porcentaje de emergencia, BFPA = Biomasa fresca de parte aérea, LR = Longitud de raíz.
* = significativo a p ≤ 0.05,
** = significativo a p ≤ 0.01. Medias con letras distintas en una misma columna difieren estadísticamente (Tukey HSD, p = 0.05).
Variables morfométricas
Altura de plántulas (AP) mostró diferencias significativas entre variedades, HMA, la interacción variedades × NaCl, mientras que para NaCl, las interacciones variedades × HMA, NaCl × HMA y variedades × NaCl × HMA no se presentaron diferencias significativas. La altura de plántulas entre variedades fue mayor en Napoletano y Genovese, mientras que Nufar presentó valor inferior (Tabla 1). Respecto a la inoculación con HMA, la altura fue mayor en aquellas plántulas procedentes de semillas inoculadas con HMA (Tabla 1). En la interacción variedades × NaCl, la altura de plántulas fue mayor en Napoletano y Nufar con respecto a Genovese (Tabla 2).
Tabla 2. Efecto de las interacciones variedades × NaCl, variedades × HMA y NaCl × HMA en variables morfométricas de plántulas de albahaca sometidas a estrés por NaCl y HMA como mitigadores del estrés.
| Variedades | NaCl (mM) | AP (cm) ** | LR (cm) * | BFPA (g) ** | BFR(g) ** |
|---|---|---|---|---|---|
| Genovese | 0 | 1.13 c | 5.02 ab | 0.156 b | 0.079 c |
| Genovese | 50 | 1.17 c | 4.19 bcd | 0.180 b | 0.086 abc |
| Genovese | 100 | 1.20 c | 3.79 cd | 0.171 b | 0.069 c |
| Napoletano | 0 | 1.37 ab | 5.55 a | 0.182 b | 0.081 bc |
| Napoletano | 50 | 1.43 ab | 5.71 a | 0.283 a | 0.124 a |
| Napoletano | 100 | 1.47 a | 5.23 ab | 0.264 a | 0.072 c |
| Nufar | 0 | 1.43 ab | 4.80 abc | 0.188 b | 0.123 ab |
| Nufar | 50 | 1.43 ab | 4.03 cde | 0.177 b | 0.055 c |
| Nufar | 100 | 1.29 bc | 4.41 abcd | 0.197 b | 0.068 c |
| Variedades | HMA | BFPA (g) * | NaCl | HMA | BFPA (g) * | LR (cm) * |
|---|---|---|---|---|---|---|
| Genovese | SM | 0.167 cd | 0 | SM | 0.196 b | 4.51 c |
| Genovese | CM | 0.188 c | 0 | CM | 0.154 c | 5.74 a |
| Napoletano | SM | 0.190 bc | 50 | SM | 0.170 bc | 4.4.1 c |
| Napoletano | CM | 0.278 a | 50 | CM | 0.258 a | 4.88 bc |
| Nufar | SM | 0.154 d | 100 | SM | 0.188 b | 3.65 d |
| Nufar | CM | 0.220 b | 100 | CM | 0.233 a | 5.30 ab |
AP = Altura de plántulas, LR = Longitud de raíz, BFPA = Biomasa fresca de parte aérea, BFR = Biomasa fresca de raíz. HMA = Hongos micorrízicos arbusculares, SM = sin HMA (control), CM = con HMA (1 g del inóculo de HMA).
* = significativo a p ≤ 0.05,
** = significativo a p ≤ 0.01. Medias con letras distintas en una misma columna difieren estadísticamente (Tukey HSD, p = 0.05).
Longitud de la raíz (LR) mostró diferencias significativas entre variedades, NaCl, HMA, las interacciones variedades × NaCl, NaCl × HMA y variedades × NaCI × HMA. La interacción variedades × HMA no mostró diferencias significativas para esta variable. El análisis del factor variedades mostró a Napoletano con la longitud de raíz mayor respecto a las otras dos variedades (Tabla 1). Esta variable mostró valor superior en 0 mM de NaCl y disminuyó conforme los niveles de NaCl incrementaron (Tabla 1). Asimismo, la LR fue mayor en aquellas plantas cuyas semillas se inocularon con HMA (Tabla 1). Al descomponer la interacción variedades × NaCl para esta variable, se observó que las plántulas de Napoletano en 50 y 0 mM de NaCl mostraron longitud de raíz mayor, seguido de Napoletano en 100 mM de NaCl, mientras que Genovese en 0, 50 y 100 mM de NaCl mostró valores inferiores para esta variable (Tabla 2). La interacción NaCl × HMA mostró que la longitud de raíz fue superior en aquellas plántulas del control con HMA, seguido de aquellas plantas sometidas a 100 mM de NaCl con HMA (Tabla 2). La interacción variedades × NaCl × HMA mostró que las plántulas de Napoletano sometidas a 100 mM de NaCl cuyas semillas se inocularon con HMA mostraron longitud de raíz mayor, mientras que las plántulas de Genovese presentaron longitud de raíz menor en 100 mM de NaCl de semillas que no se inocularon con HMA (Tabla 3).
Para biomasa fresca de parte aérea (BFPA) se observaron diferencias significativas entre variedades, NaCl, HMA, las interacciones variedades × NaCl, variedades × HMA, NaCl × HMA y para la triple interacción variedades × NaCl × HMA. El análisis del factor variedades mostró que la BFPA fue mayor en Napoletano seguida por Nufar y Genovese (Tabla 1). La BFPA no disminuyó conforme los niveles de NaCl se incrementaron, ya que ésta fue mayor en 50 y 100 mM de NaCl (Tabla 1). La BFPA fue superior en las plántulas cuya semilla se inoculó con HMA (Tabla 1). El análisis de la interacción variedades × NaCl mostró que la BFPA fue mayor en Napoletano en 50 y 100 mM de NaCl (Tabla 2). En la interacción variedades × HMA, la BFPA fue mayor en Napoletano con HMA y menor en Nufar y Genovese sin HMA (Tabla 2). Considerando la interacción NaCl × HMA, la BFPA fue mayor en 50 y 100 mM de NaCl con HMA, mientras que el valor inferior se presentó en 0 mM de NaCl con HMA (Tabla 2). Con respecto a la triple interación variedades × NaCI × HMA la BFPA fue mayor en Napoletano en 50 mM de NaCl y con HMA, mientras que la BFPA menor la presentó Genovese en 0 mM de NaCl sin HMA (Tabla 3).
Para biomasa seca de parte aérea (BSPA) no se observaron diferencias significativas entre variedades, NaCl, HMA, las interacciones variedades × NaCl, variedades × HMA NaCl × HMA y para la triple interacción variedades × NaCl × HMA. Igualmente, biomasa seca de raíz (BSR) no mostró diferencias significativas entre variedades, NaCl, HMA, las interacciones variedades × NaCl, variedades × HMA, NaCl × HMA y para la triple interacción variedades × NaCl × HMA. Para biomasa fresca de la raíz (BFR) se observaron diferencias significativas entre NaCl, HMA y la interacción variedades × NaCl, mientras que entre variedades, las interacciones variedades × HMA, NaCl × HMA y variedades × NaCl × HMA no se presentaron diferencias significativas. El análisis de esta variable considerando el factor NaCl mostró que la BFR fue mayor en 0 y 50 mM de NaCl y disminuyó conforme se incrementaron los niveles de NaCl (Tabla 1). Esta variable también fue superior en aquellas plántulas cuya semilla se inoculó con HMA (Tabla 1). El análisis de la interacción variedades × NaCl mostró que la BFR fue superior para Napoletano en 50 mM de NaCl, seguido por Nufar en 0 mM de NaCl, mientras que la BFR menor la mostró Nufar en 50 mM de NaCl (Tabla 2).
Colonización de raíces por HMA
En esta etapa fenológica de la especie en estudio, ninguna de las raíces de las plántulas de las variedades en estudio mostraron presencia de vesículas, arbúsculos y/o hifas cenocíticas (hifas) típicas de los HMA. Sin embargo, a los 21 días después de la siembra, en aquellas plántulas cuyas semillas se inocularon con HMA se mostró un inicio del proceso observándose el micelio del hongo estableciendo contacto en el interior de las raíces de las plántulas pero no una autentica colonización (Figura 1). En las raíces de las plántulas cuya semilla no se inoculó con HMA, no se observó ningún indicio de colonización (Figura 2).
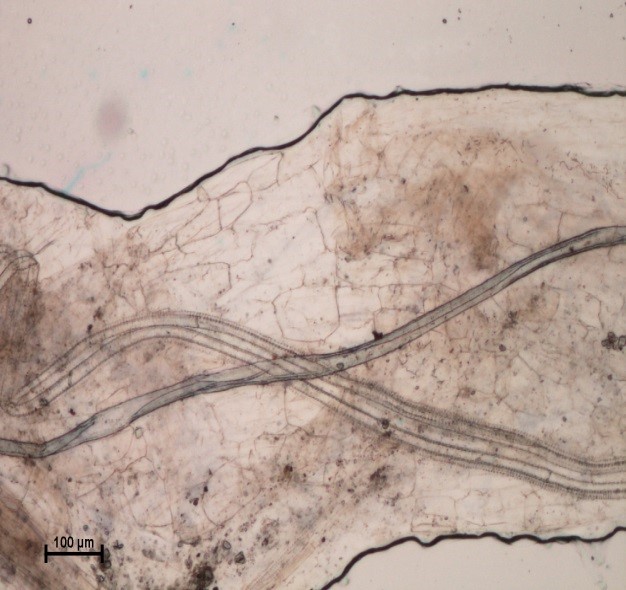
Figura 1 Micrografía de raíces de albahaca inoculadas con un consorcio de HMA (Funneliformis mosseae y Claroideoglomus etunicatum).
Discusión
El sustrato que se utilizó en este estudio se caracterizó como apto para el desarrollo de las especies de HMA evaluadas (Schubert y Hayman, 1986, 79; Swift, 2002, 4) y para la especie vegetal en estudio de acuerdo con Castellanos et al. (2000, 94). Un aspecto importante al momento de utilizar suelo o sustratos comerciales para estudios con HMA depende del contenido de P, ya que éste se relaciona con la colonización radicular por HMA. Si existe un nivel bajo de P se reduce el nivel de fosfolípidos en la membrana vegetal que conduce a una exudación radicular mayor lo cual trae como consecuencia una estimulación en la colonización del endófito (Smith y Read, 2008, 144). Desde el punto de vista nutricional el mayor beneficio de las plantas por la micorrízación deriva en un crecimiento superior por un incremento de la absorción de P cuando este elemento es limitante en el suelo, mientras que cuando no es limitante, el beneficio es nulo o reducido, según el grado de dependencia micorrízica de la planta. Schubert y Hayman (1986, 79) y Swift (2002, 4) estiman que los niveles de P contenidos en un suelo donde se pretende conocer esencialmente la eficiencia de los HMA deben mantenerse alrededor de 50 ppm, para lo cual insisten en la necesidad de realizar de manera anticipada un análisis del sustrato que se utilizará. Fernández-Martin (2003, 13) reporta que niveles altos de fósforo inhiben el proceso simbiótico. En un estudio se evaluó un concentrado de cepas de HMA en diferentes tipos de suelos y encontraron que en los suelos donde el P fue inferior de 50 ppm se presentó mayor actividad micorrízica (Fernández et al., 1999a, 9).
Las diferencias mostradas entre las variedades para tasa y porcentaje de emergencia se atribuyen a la respuesta de éstas al estrés salino, porque al incrementarse la concentración de NaCl impide la correcta imbibición y la emergencia se ve inhibida. Gomes-Filho et al. (1983, 183) establecen que existe una gran variabilidad entre variedades en respuesta al estrés salino, esta es una característica que desde el punto de vista del mejoramiento genético debe aprovecharse. Los resultados de este estudio demuestran que la tolerancia de las plántulas al estrés salino por NaCl no solo varía entre especies sino entre variedades de la misma especie y que debe considerarse al momento de realizar estos estudios. De acuerdo con Maas (1986, 12) y Reyes-Pérez et al. (2013, 268) es importante seleccionar y clasificar las variedades de especies de plantas por su tolerancia o sensibilidad a la salinidad en las primeras etapas fenológicas ya que una comparación de tolerancia durante la emergencia da pauta para utilizar diferentes criterios y condiciones para efectuar la evaluación de la respuesta de la planta en posteriores etapas fenológicas. Asimismo, es importante considerar que los criterios potenciales y mejores de selección para tolerancia a salinidad son entre otros el porcentaje de emergencia, la sobrevivencia de plántulas y las variables morfométricas (Tal, 1985, 199; Reyes-Pérez et al., 2013a, 112). La disminución de la tasa y porcentaje de emergencia de plántulas conforme las concentraciones de NaCl incrementaron, coincide con los resultados reportados en otras especies de plantas halofitas y glicófitas, en las cuales se encontró una emergencia mayor en los tratamiento de menor concentración de NaCl (Gorai y Neffati, 2007, 53). Resultados similares encontró Batista-Sánchez et al. (2015, 265) en tres variedades de albahaca donde la tasa y el porcentaje de emergencia disminuyeron conforme la concentración de NaCl se incrementó. Asimismo, coinciden con lo reportado por González et al. (2000, 105) quienes en una investigación con estrés salino (NaCl) en cultivares de Vigna unguiculata L., encontraron que a medida que incrementaron las concentraciones de NaCl se redujo la tasa y porcentaje de emergencia de las plántulas, confirmando que el NaCl tiene un efecto adverso en esta etapa fenológica. Uno de los efectos primarios del estrés por NaCl es retardar la emergencia de plántulas (Batista-Sánchez et al., 2015, 265) debido a la inhibición del crecimiento del eje embrionario por un retraso de la movilización de reservas y a los disturbios de la membrana causado por la salinidad, el cual es evidenciado por el incremento de la pérdida de materiales del eje embrionario (Lamz et al., 2013, 11; Van, 2015, 99). Según Parés et al. (2008, 27) la salinidad reduce el crecimiento al afectar negativamente la germinación y/o la capacidad de emerger de las plántulas. La salinidad es uno de los principales factores abióticos que limitan la germinación y emergencia de las semillas, el efecto más común sobre las plantas es la reducción del desarrollo debido a una disminución del potencial osmótico del medio de crecimiento y, en consecuencia, de su potencial hídrico, la toxicidad iónica normalmente se asocia con la absorción excesiva de Na+ y de Cl- y un desequilibrio nutricional debido a la interferencia de los iones salinos con la absorción de los nutrientes esenciales que requiere la planta (García-Garrido et al., 2009, 449). El hecho de que la tasa y el porcentaje de emergencia de plántulas de albahaca fueron mayores en los tratamientos inoculados con HMA se atribuye a la fertilidad del sustrato del inóculo, pues en esta etapa no se encontró colonización. En estudios realizados por Colla et al. (2008, 501) encontraron que el arbúsculo, estructura micorrízica que garantiza el intercambio de sustancias esenciales durante la simbiosis, debe estar presente para que la planta obtenga los beneficios del endófito. En el presente estudio no se encontró arbúsculo por lo que en esta etapa no hubo beneficio de los HMA en las plántulas. El hecho que la tasa y el porcentaje de emergencia se incrementó en aquellas plántulas cuyas semillas se trataron con el consorcio de HMA, se atribuye a la capacidad de respuesta de cada variedad y no como un producto de la inoculación con los HMA, pues en esta etapa no se encontró colonización en la raíz de las plántulas. Estos resultados coinciden con los reportados por Fernández-Martin (2003, 13) quien indica que los HMA requieren de un periodo considerable para su establecimiento y reconocimiento de las raíces que está en dependencia de la edad del cultivo y del proceso de fotosíntesis. El presente estudio se realizó en la etapa fenológica de emergencia, por lo que indudablemente el tiempo no fue suficiente para que se estableciera una simbiosis micorrízica (Fernández-Martin, 2003, 13), aunque se observó un inicio del proceso con la presencia de micelio vegetativo penetrando en las raíces (Figura 1). La variedad Napoletano mostró valores superiores en la tasa y porcentaje de emergencia en la interacción de los factores, resultado que se relaciona con la capacidad de respuesta de esta variedad a la salinidad, la cual se clasificó previamente como tolerante al NaCl (Reyes-Pérez et al., 2013a, 101; 2013b, 869; 2013c, 257; Reyes-Pérez et al., 2014, 35; Batista-Sánchez et al., 2015, 265). En este estudio Genovese mostró valores inferiores de tasa y porcentaje de emergencia. Reyes-Pérez et al. (2013a, 101) también reportó que la variedad Genovese fue la más sensible al estrés por NaCl.
También las variedades mostraron diferencias en las variables morfométricas con respuesta diferencial a los tratamientos de NaCl y HMA aplicados. La altura de las plántulas fue mayor en Napoletano, Genovese y menor en Nufar. Esta variable que es el resultado de la asimilación de nutrientes y los procesos de división y elongación celular de manera normal, su respuesta en condiciones de salinidad alude a la tolerancia de la planta ante la interferencia en la nutrición mineral, la toxicidad iónica y a los daños en el aparato fotosintético (Paellob, 2010, 46). La altura de plántula fue mayor en aquellas que procedían de semillas inoculadas con HMA; sin embargo, este resultado pudiera estar relacionado con las características propias de la variedad y no a la inoculación pues en esta etapa no se manifestó el beneficio dado por este simbionte debido a la etapa fenológica del cultivo ya que fue muy poco tiempo para que se estableciera la simbiosis. Las afectaciones en el crecimiento y la acumulación de biomasa en las plantas en condiciones salinas, se mantienen a través de todo su ciclo vegetativo. Sin embargo, se requiere atención especial durante el periodo inicial de crecimiento de las plántulas, una vez aplicado el estrés abiótico, el cual se caracteriza por las variaciones que ocurren en los procesos del metabolismo de las plántulas (Khaliq et al., 2014, 18). Estos resultados se atribuyen a la restrinción en el crecimiento celular que provoca el estrés salino a las plántulas, debido a la interferencia de los iones salinos con la nutrición de las plántulas o a la toxicidad de iones acumulados que conducen a la muerte celular y esto a su vez afecta la biomasa fresca de la raíz (Chávez y Gonzáles, 2009, 231) . Argentel et al. (2006, 45) en plantas de trigo, encontraron que conforme se incrementaban los niveles de salinidad se redujo la altura de las plántulas, biomasa fresca y la longitud de la raíz, lo cual se atribuye a una disminución del crecimiento celular debido a una sequía fisiológica de la planta y a la interferencia de los iones salinos como son el Na+ y el Cl- ((Bray et al., 2000, 1158). Por su parte, Munns (2002, 301) plantea que la biomasa y la altura de las plántulas son características suficientes para conocer la tolerancia a la salinidad, a su vez la morfometría es uno de los principales factores que influyen en el crecimiento de las plantas. Los resultados del presente estudio muestran como tolerante a la salinidad en la etapa de emergencia a la variedad Napoletano con respecto a Nufar y Genovese. Las disminuciones en la altura de las plántulas es el resultado de una pérdida de turgencia a nivel celular, provocada por la disminución del potencial osmótico en el medio de crecimiento de los cultivares (Heidari y Jamshid, 2010, 39). Estos daños son el resultado de los trastornos provocados en el metabolismo de las plántulas, principalmente por los cambios en el potencial osmótico del suelo, el desbalance nutricional por la interacción entre los iones tóxicos y los nutrientes esenciales para el crecimiento y desarrollo, así como el estrés oxidativo, inducido a partir de los diferentes efectos por el aumento de las especies reactivas de oxigeno (ERO) en los componentes celulares (Nawaz et al., 2010, 5475).
La acumulación de biomasa fresca de parte aérea en estudios relacionados con la salinidad se atribuye al efecto osmótico que resulta de las concentraciones elevadas de sales disueltas que disminuyen el potencial osmótico de la solución del suelo y consecuentemente la disponibilidad del agua para la planta, tal efecto negativo trae como resultados una disminución de la biomasa fresca en las plántulas (Tadeo y Gómez-Cadena, 2008, 577). El hecho que la biomasa fresca de parte aérea fue mayor en 100 mM de NaCl con respecto a 0 mM de NaCl se atribuye a que al analizar por separado el factor NaCl, se consideran los valores de las tres variedades y en este caso los valores de Napoletano fueron superiores para esta variable lo que ocasiona que se incrementen estos valores por ser una variedad tolerante al estrés por NaCl; esta respuesta también se debe a que la biomasa fresca de parte aérea se considera una variable representativa en los estudios de estrés abiótico, ya que un valor alto de ésta, indica que la planta fue capaz de tolerar el estrés a que fue sometida.
Los resultados del presente estudio en relación a la biomasa fresca de la raíz están en correspondencia con los obtenidos por Meloni (2012, 79) quien reportó en el cultivo de algodón, que a medida se incrementaron los niveles de NaCl, disminuyó el crecimiento de las raíces y de la biomasa fresca. El efecto de la salinidad retarda el crecimiento de las plántulas a través de su efecto sobre varios procesos fisiológicos tales como fotosíntesis, conductividad estomática, ajuste osmótico, absorción de iones, síntesis de ácidos nucleicos, actividad enzimática y balance hormonal; además afecta el proceso de transporte de agua e iones, lo que promueve toxicidad iónica y desbalance nutricional y en consecuencia las variables de crecimiento como son altura de la planta y biomasa fresca de la raíz son afectadas (Evelin et al., 2012, 203). Uno de los principales efectos fisiológicos que provoca el estrés salino en las plantas es la reducción del crecimiento debido a una disminución en la capacidad de absorber agua por éstas, por lo que la variable altura de las plantas se convierte en un indicador muy importante para evaluar la capacidad de tolerancia de las plantas antes este tipo de estrés (Núñez et al., 2007, 95). Por su parte, Paellob (2010, 46) señala que a nivel de raíces, las sales alteran la absorción de agua por lo que afectan el crecimiento de estos órganos; disminuye considerablemente la cantidad de pelos adsorbentes, afectando la absorción de agua y nutrientes. Los resultados del presente estudio coinciden con lo reportado por Deinlein et al. (2014, 371) quien afirma que la salinidad es un fenómeno que afecta en gran medida el crecimiento de la parte aérea y el desarrollo de las raíces, al restringir la absorción de agua lo cual se relaciona con la disminución del potencial osmótico y a la vez el daño que ésto provoca al desarrollo general de las plántulas. La raíz como principal órgano de absorción de agua e iones, tiene gran importancia en la respuesta a corto y largo plazo al estrés salino. En este órgano se sintetiza ácido abscísico (ABA), una de las señales tempranas de estrés capaz de producir cambios fisiológicos locales (conductividad hidráulica) y a distancia (cierre estomático) (Hartung et al., 2002, 27). Las características anatómicas y morfométricas de la raíz tienen gran influencia en la capacidad de adaptación a la salinidad (Maggio et al., 2001, 999). El efecto de las sales sobre las raíces de las plantas siempre resulta negativo y se expresa en un crecimiento menor de estos órganos y afecta el crecimiento general de la planta al reducir el volumen de suelo que exploran las raíces (Almasoum, 2000, 773). También las sales afectan el crecimiento al alterar la absorción de agua por las raíces, fenómeno que se denomina componente osmótico y es el efecto inicial que reciben las plantas (Shannon y Grieve, 1999, 5).
Respecto a la colonización de raíces por HMA, en este estudio no se presentaron evidencias de la aparición de vesículas, arbúsculos y/o hifas cenocíticas (hifas) típicas de los HMA. Lo anterior es probable que se deba a que en la etapa fenológica de emergencia, no fue suficiente la edad o el desarrollo de las plántulas para que ocurra el proceso simbiótico entre la planta y el hongo, ya que sino existe exudación radical no hay reconocimiento entre el hongo y las raíces y el proceso se ve limitado por lo que es de gran importancia el estado fenológico en que se encuentre el cultivo (Arriagada et al., 2010, 118). De acuerdo con Fernández-Martin (2003, 13) el proceso simbiótico se inicia a partir de una hifa de penetración, originada desde una espora germinada (propágulo de HMA más resistente), raicilla infectada o segmento de hifa que se encuentran en el suelo o sustrato y activan su crecimiento en condiciones de humedad y temperatura adecuadas o señales químicas favorables. Al hacer contacto con la planta en los pelos absorbentes o células epidérmicas situadas detrás de la región meristemática, se forma una hifa especializada llamada apresorio que funciona como sostén en la fase primaria de penetración a la raíz. Por su parte, Colla et al. (2008, 501) mencionan que la colonización fúngica ocurre de manera continua y en dos sentidos, hacia el interior y exterior de la raíz. Una vez dentro de la raíz, se origina una hifa infectiva denominada haustorio, la cual penetra en el interior radical ramificándose intensamente de manera dicotómica para formar el arbúsculo, estructura micorrízica que garantiza el intercambio de sustancias esenciales durante la simbiosis y que debe estar presente para que la planta obtenga los beneficios que reporta este endófito. Se sabe que los compuestos exudados por las raíces de las plantas (flavonoides, auxinas, strigolactona) permiten el reconocimiento de los HMA, estimulando la germinación de esporas, el crecimiento y ramificación de las hifas. Para que ocurra este proceso, las plantas realizan el proceso fotosintético del cual la planta utiliza los elementos necesarios para su desarrollo y otros compuestos son desechados por las raíces a través de los exudados radicales (Akiyama et al., 2002, 334), por lo que la diversidad de las plantas y su edad son importantes en este proceso simbiótico (Arriagada et al., 2010, 118).
Conclusiones
Ninguna de las raíces de las plántulas de las variedades en estudio mostraron presencia de vesículas, arbúsculos y/o hifas cenocíticas (hifas) típicas de los hongos micorrízicos arbusculares (HMA). El periodo de emergencia (21 días) fue insuficiente para lograr la simbiosis micorrízicas entre las plántulas de albahaca y los HMA. Sin embargo, todas las variables mostraron valores superiores en aquellas plántulas cuyas semillas se inocularon con HMA. Las variedades mostraron diferencias para la mayoría de las variables evaluadas, siendo Napoletano superior respecto a Nufar y Genovese. La mayoría de las variables disminuyeron sus valores conforme las concentraciones de NaCl incrementaron.











 text new page (beta)
text new page (beta)



