Introducción
Un amplio rango de estreses ambientales, tales como baja temperatura, sequía, alcalinidad, salinidad, deficiencia y toxicidad de nutrientes son potencialmente dañinos para las plantas (Van Breusegem et al., 2001; Rivero et al., 2014). El papel del nitrógeno como nutriente esencial y componente estructural de aminoácidos, proteínas, ácidos nucleicos y otros constituyentes esenciales para el desarrollo ha sido ampliamente documentado en varias especies debido a la importancia en los procesos de crecimiento y producción agrícola (Lattanzi et al., 2004; Colla et al., 2011). No obstante, el nitrógeno es uno de los factores de mayor estrés en las plantas cultivadas, ya sea por deficiencia o toxicidad. Se reconoce que el nitrógeno puede ser un factor limitante del crecimiento, rendimiento y calidad de los cultivos, especialmente, bajo condiciones de déficit de nitrógeno, las cuales tienden a disminuir el peso seco, el número de hojas y el área foliar (Ciompi et al., 1996; González-Dugo et al., 2010). En la actualidad, existe escasa literatura del efecto de la toxicidad de nitrógeno sobre los compuestos osmoreguladores como indicadores de estrés en plantas.
Por otro lado, el N es el fertilizante más usado en la agricultura actual debido a que es relativamente barato, pero puede contribuir a contaminar el agua superficial y subterránea a través de la lixiviación y la erosión del suelo (von Wirén et al., 1997; Britto y Kronzucker, 2013).
Un denominador común a los estreses ambientales es la generación de un estrés osmótico. La síntesis y acumulación de osmoprotectores (o solutos compatibles) es una de las vías que utilizan las plantas para hacer frente a dicho estrés osmótico generado. Éstas son moléculas pequeñas y eléctricamente neutras, no son tóxicas a concentraciones molares, y son capaces de estabilizar proteínas y membranas, en contra del efecto desnaturalizante que poseen otros osmóticos y otros solutos perjudiciales, como son altas concentraciones de sal dentro de la célula (Yancey, 2005). La composición y contenido de los diferentes solutos en plantas estresadas puede variar consideradamente, dependiendo de la especie, así como de la intensidad y duración del estrés (Evers et al., 2010).
La acumulación de prolina representa una de las respuestas metabólicas comunes a la mayoría de las plantas superiores bajo condiciones de déficit hídrico, principalmente sequía y salinidad. Sin embargo, la prolina parece estar ampliamente distribuida como osmoprotector y es acumulado en condiciones de estrés en plantas (Kuznestov y Shevyakova, 1997; Lv et al., 2011). En plantas superiores, la prolina puede ser sintetizada a partir del glutamato o de la ornitina. En condiciones normales, la síntesis de prolina en plantas se realiza a partir de la ornitina, mientras que en situación de estrés se utiliza principalmente glutamato como precursor (Delauney y Verma, 1993; Fozouni et al., 2012).
La glicinabetaína, (GB), es uno de los compuestos amonio cuaternario más importantes y de los más estudiados en la protección de las plantas frente al estrés debido a sus versátiles funciones (Ahmad et al., 2013). GB no sólo protege a las plantas frente a ciertos estreses, sino que también protege a ciertas enzimas implicadas en la protección frente al estrés, incluyendo la protección de la estructura cuaternaria de proteínas y otras macromoléculas en condiciones de estrés (Papageorgiou y Murata, 1995; Kalaji et al., 2011). La GB se sintetiza a partir de colina mediante dos pasos de ozidación, iniciada por la colina monoxigenasa seguida por la enzima betaína aldehído deshidrogenasa, con betaína como molécula intermedia (Nuccio et al., 1998; Chen y Murata, 2011).
La colina es un precursor fundamental de fosfatidilcolina, un componente dominante de fosfolípidos en organismos eucariotas. De esta manera, una gran proporción de colina libre se libera en el citoplasma bajo estrés ambiental (Rathinasabapathi et al., 2000; Rivero et al. 2014).
En general, existe limitada literatura disponible sobre este tema, por lo que el objetivo del presente trabajo fue estudiar los compuestos nitrogenados indicadores de estrés (prolina, glicinabetaina y colina) en respuesta a las dosis tóxicas y deficientes de N en frijol ejotero desarrollado en cámara de cultivo bajo condiciones controladas y sistema hidropónico.
Materiales y Métodos
Manejo del cultivo y diseño experimental
Las semillas del frijol (Phaseolus vulgaris L.) cv. Strike fueron germinadas en una cámara a 28°C durante 48 h. Posteriormente, las plantas de frijol ejotero fueron cultivadas en cámara de cultivo en Granada, España, bajo condiciones ambientales controladas: humedad relativa de 60-80%, temperatura 28/22°C (día/noche), fotoperiodo de 16/8 h (día/noche) e intensidad luminosa de 350 μmol m-2 s-1. Las plantas crecieron en macetas individuales (25 cm de diámetro superior y 25 cm de altura) de 8 L, rellenas completamente con vermiculita. Durante 30 días a partir del trasplante y antes de la aplicación de los tratamientos experimentales, las plantas recibieron una solución nutritiva completa de Hoagland (pH 6.0-6.1 y C.E. de 1 dS m-1), la cual fue renovada cada 3 días y estuvo compuesta de: 6 mM de NH4NO3, 1.6 mM de K2HPO4, 2.4 mM de K2SO4, 4.0 mM de CaCl2•2H2O, 1.4 mM de MgSO4, 5 μM de Fe- EDDHA, 2 μM de MnSO4•H2O, 1.0 μM de ZnSO4•7H2O, 0.25 μM de CuSO4•5H2O, 0.3 μM de (NH4)6M07O24•4H2O y 0.5 μM de H3BO3 preparada con agua destilada (Sánchez et al., 2004). Posteriormente, 30 días después de la germinación, durante 30 días se aplicaron los siguientes tratamientos de N en la forma de NH4NO3: N1 = 1.5 mM, N2 = 3.0 mM, N3 = 6.0 mM, N4 = 12 mM, N5 = 18 mM y N6 = 24 mM, y se consideró la dosis N3 como la óptima, según Sánchez et al. (2004). El diseño experimental consistió en la distribución al azar de los distintos tratamientos y de sus repeticiones. Cada tratamiento tuvo seis repeticiones con cuatro plantas tratadas por repetición.
Muestreo vegetal
Las plantas completas fueron muestreadas a los 60 días después de germinadas, en la fase fenológica de desarrollo completo y madurez del fruto. Las raíces y hojas fueron lavadas tres veces con agua destilada y detergente no iónico al 1% (Wolf, 1982). A continuación, las muestras de raíces y hojas se introdujeron en una estufa con corriente de aire a una temperatura de 70°C y hasta su total desecación (24 h), para posteriormente proceder a pesar los dos órganos (peso seco). Este material seco fue utilizado para la cuantificación de la biomasa, determinación de prolina, glicinabetaina y colina. La producción de biomasa radical y foliar se obtuvo como un promedio de cada órgano estudiado, con base en materia seca. Para cada variable analizada se utilizaron cuatro repeticiones por tratamiento.
Análisis Vegetal
Extracción y cuantificación de glicinabetaina y colina. Se utilizó el método propuesto por Jolivet et al. (1982) y Grive y Gratton (1983), para lo cual se pesaron entre 0.1 y 0.2 g de material vegetal molido y seco. El material vegetal se introdujo en tubos de ensayo, que tenían tapón de rosca, y se le adicionó 10 ml de H2O desionizada. Las diferentes muestras fueron sometidas a un proceso de agitación vuelta-vuelta durante 24 h. Transcurrido dicho tiempo se procedió a su filtrado con papel Whatman No. 4. A 1 ml del extracto obtenido se le añadió 1 ml de HSO4 2 N. Seguidamente, se puso 0.5 ml de la dilución anterior en tubos de tapa de centrifuga y se le añadieron 0.2 ml de la mezcla de reacción. Se agitaron vigorosamente y se dejó reposar durante 16 horas a 4°C en oscuridad. Posteriormente se procedió a centrifugar a 12360 g durante 15 minutos y a 0°C. Finalizada la centrifugación se procedió a eliminar el sobrenadante con una pipeta Pasteur, quedando en el fondo unos pequeños cristales de color parduzco y con este residuo se prosiguió el proceso. Al residuo se le adicionaron 9 ml de 1,2-Dicloroetano. A continuación se taparon los tubos y se agitaron hasta lograr la resuspensión del residuo. Finalmente, se dejó reposar y pasado 2 h y 30 min se procedió a su lectura (λ = 365 nm) frente a una curva de trabajo de betaina que se sometió a las mismas condiciones que las muestras problema.
Con el extracto obtenido para glicinabetaina, se realizó una dilución (1:1) con un tampón fosfato potásico (0.2 M, pH 6.8). Los diferentes pasos realizados fueron similares que para la cuantificación de glicinabetaina. Pasado 2 h y 30 min se procedió a su lectura (λ = 365 nm) frente a una curva de trabajo de colina y que fue sometida a las mismas condiciones que las muestras problema.
La concentración de glicinabetaina se expresó como μg de betaina por g de peso seco y la colina como μg de colina por g de peso seco.
Extracción y cuantificación de prolina. Se utilizó el método propuesto por Irigoyen et al. (1992), para lo cual una cantidad aproximada de 0.5 g de material vegetal fue homogeneizada inicialmente con 5 ml de etanol al 96% y posteriormente dos veces con 5 ml de etanol al 70%. El homogeneizado fue centrifugado a 3740 g durante 10 min y el sobrenadante resultante se utilizó para la determinación de prolina. Del extracto resultante se tomó un volumen de 2 ml y se depositó en un tubo de ensayo. A continuación se procedió a adicionar los siguientes reactivos: 2.5 ml de reactivo de ninhidrina, 2.5 ml de ácido acético glacial del 99% y 4 ml de agua desionizada. Se agitó enérgicamente. La mezcla resultante se introdujo en un abaño de agua a 100°C durante 45 min. Para posteriormente añadir 5 ml de benceno al 99%. Pasados 15 min se procedió a la lectura de las muestras (λ = 515 nm) frente a una curva patrón de prolina. La concentración de prolina se expresó como μg por g de peso fresco (Irigoyen et al., 1992).
Análisis estadístico
Todos los datos fueron sometidos a análisis de varianza. Para la diferencia entre las medias de los tratamientos se utilizó la prueba de LSD a 95% (SAS, 1987).
Resultados y Discusión
Producción de biomasa
En previos trabajos, se ha visto que la acumulación de biomasa es uno de los parámetros esenciales en la investigación sobre eficiencia de nutrientes (Moran et al., 2002; Szarka et al., 2012). En plantas, el estrés afecta negativamente el crecimiento y desarrollo, y también genera especies de oxígeno reactivo, los cuales dañan numerosas macromoléculas y estructuras celulares. Consecuentemente, bajo condiciones adversas, uno de los más confiables y ampliamente usados indicadores del estrés en las plantas es la biomasa (Blasco et al., 2008). En el presente experimento, el tratamiento N3 mostró la máxima producción de biomasa foliar, con un incremento de 43%, en relación a N6 que presentó el valor mínimo (Figura 1, P < 0.01). El tratamiento N1 presentó la mayor biomasa radicular con un incremento de 51% en relación a N6, que mostró la biomasa radicular más baja.
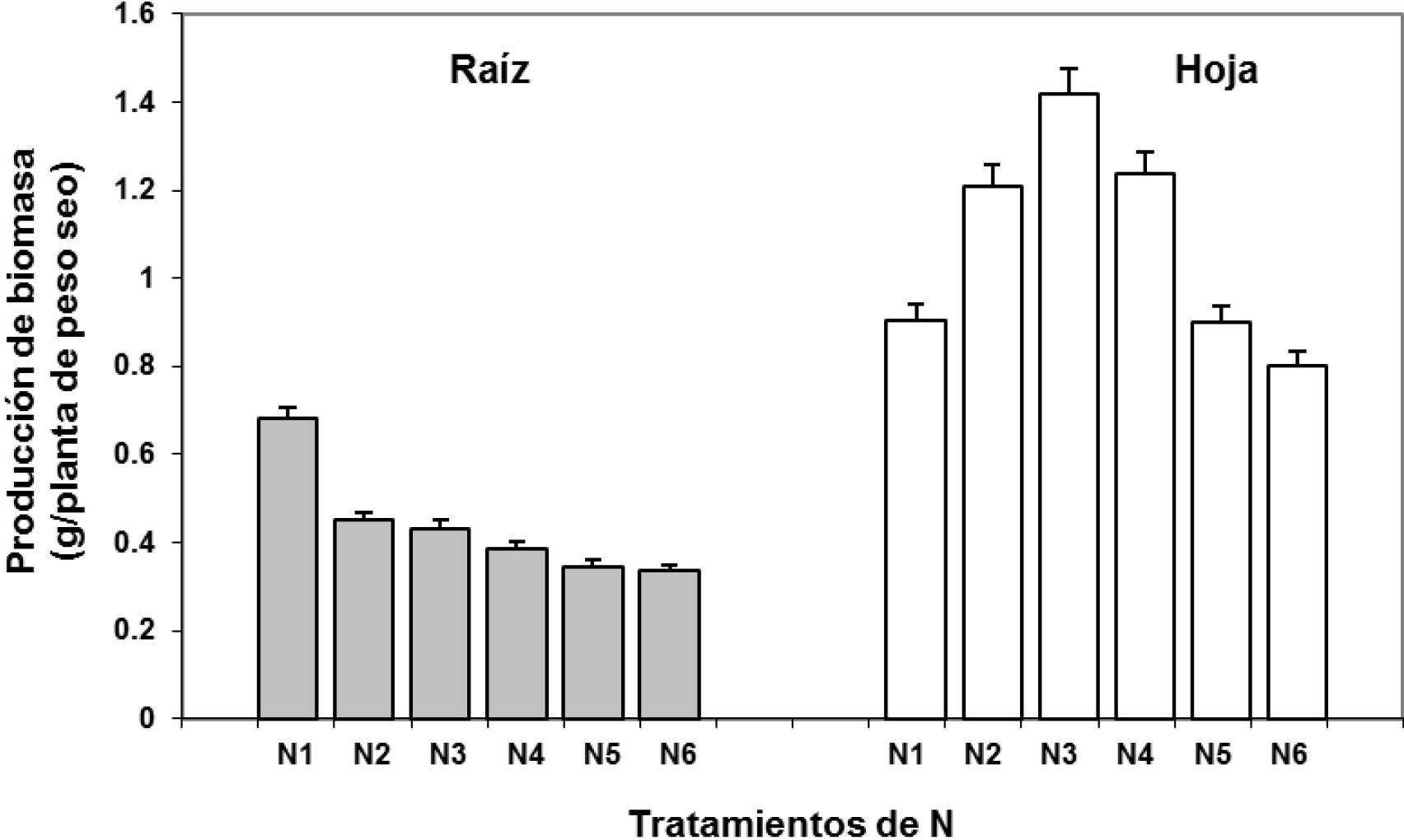
Figura1. Efecto de los tratamientos de N (N1=1.5 mM, N2 = 3.0 mM, N3 = 6.0m M, N4 =12.0 mM, N5 =18.0 mM y N6 = 24.0 mM de N) sobre la producción de biomasa radicular y foliar expresada en g de peso seco en plantas de frijol ejotero. Los datos son medias ± error estándar (n=6).
La aplicación de 6 mM de N (N3) resultó ser el mejor tratamiento para minimizar la producción de biomasa foliar y radical en plantas de frijol ejotero. Así, los tratamientos por debajo de N3 (N1 y N2) poder ser considerados como deficientes en N, y se caracterizaron por aumentar el crecimiento radical y reducir el crecimiento de la parte aérea y, por tanto, incrementan el cociente raíz/parte aérea. Y esto que significa o implica Por otro lado, las dosis por encima del óptimo, es decir N4, N5 y N6, se podrían considerar como de elevadas a tóxicas por la disminución que provocaron en el crecimiento radical y, sobre todo de la parte aérea.
Compuestos nitrogenados indicadores de estrés
Acumulación de prolina en raíces y hojas
Es conocido que la prolina se acumula en plantas durante la adaptación a diferentes tipos de estrés ambientales tales como sequía, salinidad, elevadas y bajas temperaturas, deficiencias de nutrientes, exposición a metales pesados y pH elevados (Delauney y Verma, 1993; Zaifnejad et al., 1997; Hare et al., 1999; Fozouni et al., 2012). En nuestro estudio, los niveles de prolina en raíces y hojas (Tabla 1, P < 0.01) presentaron las más elevadas concentraciones en ambos órganos en el tratamiento N6. Nuestros resultados indican que la acumulación de prolina en raíces y hojas son debido a las dosis elevadas de N, es mediado principalmente por la ruta de la ornitina, tal y como lo indican Rhodes et al. (1986), Delauney y Verna (1993) y Rivero et al. (2014).
Tabla 1. Efecto de los tratamientos de N sobre la concentración de prolina, colina y glicinabetaina en raíces y hojas de plantas de frijol ejotero.

Prolina expresada en μg g-1 p.f.; Glicinabetaina y Colina expresados en μg g-1 p.s. Las líneas verticales en cada barra corresponden a la desviación estándar. Promedios con letras iguales en cada barra no son estadísticamente diferentes (LSD, 0.05). LSD = Diferencia mínima significativa.
Uno de los factores que pueden ser determinantes en la regulación de los procesos de síntesis de prolina es la disponibilidad y la concentración de las formas de nitrógeno inorgánico (NO3 - y NH4 +) en las plantas (Delauney et al., 1993; Britto y Kronzucker, 2013). En plantas superiores, el papel fisiológico de la acumulación de prolina aún no sido completamente determinado. A parte de actuar como un “osmoregulador”, la acumulación de prolina tiene otras funciones celulares importantes. La prolina puede actuar como una fuente de N en la célula bajo condiciones de estrés, donde la acumulación de este compuesto nitrogenado pudiera ser utilizada como una forma de N almacenado (Dandekar y Uratsu, 1988; Colla et al., 2011).
En nuestro estudio, la deficiencia de N (N1 y N2) es caracterizada por una disminución en la acumulación de prolina en raíces y hojas. Por el contario, bajo condiciones adecuadas de N (6.0 mM de N) en plantas de frijol ejotero, la planta pudiera no necesitar degradar prolina para la síntesis de otros compuestos nitrogenados. Por otro lado, la aplicación de elevadas dosis de N en Phaseolus vulgaris L. es caracterizada por la acumulación de prolina en raíces y hojas. Finalmente, bajo nuestras condiciones experimentales, la prolina puede ser definida como un buen indicador del estado nutricional de N en plantas de frijol ejotero. Considero que es necesario la separación de medias p en su defecto la diferencia mínima significativa.
Acumulación de prolina en vaínas y semillas
En nuestro estudio, la acumulación de prolina en vaínas y semillas se presentan en la Tabla 1, las máximas concentraciones en ambos órganos aparecieron bajo los tratamientos N6. Nosotros sugerimos que la biosíntesis y acumulación de prolina en vaínas y semillas, en nuestro experimento, debido quizás a las elevadas dosis de N, favoreció la ruta de la ornitina. Nuestros resultados de la acumulación de prolina en vaínas y semillas de Phaseous vulgaris tratadas con las elevadas dosis de N pudieran ser explicados por los efectos negativos causados por la toxicidad de este nutriente. Como se ha indicado en diversos estudios, una de las características por la cual la toxicidad de N es definida, es la restricción del crecimiento radical, la desorganización del tejido vascular, lo que finalmente se traduce en una restricción en la absorción de agua (Benton Jones, 1997; Haghighi et al., 2012), este último síntoma es similar a los causados por la sequía y salinidad (Delauney y Verma, 1993; Rivero et al., 2014). Normalmente, las plantas responden a un estrés hídrico activando la biosíntesis de prolina, estos resultados son similares a los encontrados en nuestro experimento.
La respuesta metabólica de prolina bajo condiciones de toxicidad de N es reflejada principalmente en las semillas, en las cuales la acumulación de prolina es más elevada que la encontrada en las vaínas. Estos resultados definen a la acumulación de prolina como un bioindicador de la toxicidad de N en las semillas de las plantas de frijol ejotero.
En nuestro experimento, la deficiencia de N fue caracterizada por una disminución en la acumulación de prolina en vaínas y semillas. Estos resultados son consistentes con otros resultados, los cuales indican que bajo condiciones de deficiencia de N, la degradación de prolina produce glutamato, el cual es utilizado como una fuente de nitrógeno para la síntesis de otros aminoácidos (Dandekar y Uratsu, 1988; Brill et al., 2011). Contrariamente, bajo condiciones óptimas de N, la planta pudiera no necesitar degradar prolina para la síntesis de otros compuestos nitrogenados.
En resumen, bajo nuestras condiciones experimentales, el contenido de prolina pudiera ser definido como un bioindicador de la deficiencia de N, particularmente en semillas, puesto que las diferencias en concentraciones de este aminoácido en semillas tratadas fueron más elevadas que las encontradas en vaínas. Por otro lado, las dosis altas de N favoreció la acumulación de prolina en ambos órganos. Finalmente, la acumulación de prolina en ambos órganos es considerado un bioindicador de la toxicidad de N en frutos de plantas de frijol ejotero.
Acumulación de glicinabetaina y colina en raíces y hojas
Distintos estreses abióticos como los provocados por la sequía, la salinidad, las temperaturas extremas, el encharcamiento (hipoxia), así como la toxicidad iónica provocan la reducción del potencial hídrico de los tejidos. Las plantas responden a este cambio sintetizando una amplia gama de compuestos denominados “osmoprotectores”, que actúan bien como osmolitos facilitando la retención de agua por el citoplasma y reajustando así el potencial hídrico intracelular, o bien como verdaderos compuestos protectores que estabilizan la estructura de las membranas y de las macromoléculas (Sairam y Tyagi, 2004; Ashraf y Foolad, 2007). Los osmoprotectores son, pues, solutos compatibles con el funcionamiento celular en condiciones de estrés osmótico. Los compuestos nitrogenados orgánicos de bajo peso molecular son por lo tanto importantes para la adaptación de las plantas a los substratos salinos. Entre los osmoprotectores encontramos compuestos nitrogenados siendo los más estudiados por su importancia la prolina y los compuestos amonios cuaternarios, tales como glicinabetaina y colina (Katschnig et al., 2013). En nuestro estudio, la aplicación de N, incremento significativo de la concentración de prolina, colina y glicinabetaina tanto en raíces como en hojas, presentándose las máximas concentraciones en N6 (Tabla 2, P < 0.01). La acumulación de estos compuestos se ha observado principalmente cuando existen condiciones de estrés. En nuestro experimento, observamos que solamente se acumulan bajo condiciones de toxicidad de N (N6), sin embargo en condiciones de estrés provocadas por la deficiencia de N no se produce la acumulación de estos compuestos por lo que se podrían definir como bioindicadores solamente del estrés por toxicidad de N.
Tabla 2. Efecto de los tratamientos de N sobre la concentración de prolina, colina y glicinabetaina en vaínas y semillas de plantas de frijol ejotero.

Prolina expresada en μg g-1 p.f.; Glicinabetaina y Colina expresados en μg g-1 p.s. Las líneas verticales en cada barra corresponden a la desviación estándar. Promedios con letras iguales en cada barra no son estadísticamente diferentes (LSD, 0.05). LSD = Diferencia mínima significativa.
Nuestros resultados son lógicos ya que por un lado bajo deficiencia de N las plantas como mecanismo de supervivencia removilizan todos los compuestos nitrogenados con el fin de transportar los aminoácidos a las zonas de crecimiento. En condiciones de toxicidad la acumulación de compuestos osmoprotectores se debe por un lado a su función de protección y por otro lado estos compuestos actúan como una fuente de almacenamiento de N.
Acumulación de glicinabetaina y colina en vaínas y semillas
Como podemos comprobar, y al igual que ocurría en raíces y hojas, la prolina, colina y glicinabetaina (Tabla 2, P < 0.01), fueron influenciadas por las dosis crecientes de N, presentando el tratamiento N6 las máximas concentraciones, en relación a las mínimas de N1. La acumulación de estos compuestos en frutos se podría explicar también como un mecanismo de detoxificación de los NO3 - y NH4 + en el tratamiento N6. La asimilación y acumulación fundamentalmente de prolina en las semillas podría actuar como un proceso de utilización de NO3 - y NH4 + con el fin de evitar una mayor acumulación de estas formas inorgánicas de N en la planta.
En resumen, bajo nuestras condiciones experimentales, el contenido de glicinabetaina y colina en ambos órganos pudiera ser definido como un bioindicador de la toxicidad de N en frutos de plantas de frijol ejotero, particularmente en semillas, puesto que las diferencias en concentraciones de estos compuestos nitrogenados en semillas tratadas fueron más elevadas que las encontradas en las vaínas. Las elevadas dosis de N aplicadas pudieran explicar la gran acumulación de glicinabetaina y colina encontrada en nuestras semillas estudiadas. Finalmente, la acumulación de glicinabetaina y colina puede actuar como una fuente de N en la célula bajo condiciones de estrés, donde la acumulación de estos compuestos nitrogenados pudiera ser utilizada como una forma de almacenar N.
Conclusiones
La aplicación de dosis deficientes y tóxicas de N afectó la producción de biomasa en frijol, siendo las dosis tóxicas las que afectaron más este parámetro. Por otro lado, resaltar que los osmoreguladores prolina, glicinabetaina y colina solamente se acumularon bajo condiciones de toxicidad de N (N6), sin embargo, en condiciones de estrés provocada por la deficiencia de N (N1) no se produce la acumulación de estos compuestos, por lo que se podría definir como un bioindicador solamente del estrés por toxicidad de N. Finalmente, la acumulación de prolina, glicinabetaina y colina pudieran actuar como una fuente de N en la célula bajo condiciones de estrés, donde la acumulación de estos compuestos nitrogenados pudieran ser utilizados como una forma de almacenar N.











 nueva página del texto (beta)
nueva página del texto (beta)


