Introducción
La albahaca (Ocimum basilicum L.) es uno de los principales cultivos de hierbas aromáticas de mayor importancia económica a nivel mundial (Garibaldi et al., 1997, 124). La diversidad de aceites esenciales derivadas de terpenos y fenilpropanoides que poseen las hojas, reflejan una variedad de aromas y sabores que las hace atractivas a nivel comercial en el uso culinario, perfumería y productos de aromaterapia (Wyenandt et al., 2010, 1416). Actualmente existen alrededor de 150 especies de albahaca distribuidas a nivel mundial con una demanda constante en el mercado internacional de Estados Unidos y la Unión Europea. Debido a lo anterior, se deben buscar estrategias que ayuden a incrementar la producción de esta especie y a su vez mejorar las características de calidad.
Estudios anteriores han determinado que uno de los procesos esenciales para incrementar el rendimiento con respecto a la cantidad y calidad, es la velocidad y uniformidad de la germinación, así como la emergencia y el desarrollo vegetativo de la planta en campo (Hacisalihoglu y Ross, 2010, 214). Estos parámetros están relacionados con el vigor, el cual a su vez, se relaciona con una resistencia mayor a los distintos factores estresantes (Bittencourt et al., 2005, 319). Existen algunas técnicas que estimulan el vigor de las plantas mediante el acondicionamiento previo de la semilla para reaccionar con mayor rapidez a la exposición posterior de algún tipo de estrés (Haigh et al., 1986, 660; Bittencourt et al., 2005, 319). Este mecanismo de sensibilización, conocido también como “priming”, surgió como parte importante en el desarrollo óptimo de la planta (Capanoglu, 2010, 399). Su principio se basa en someter a la semilla a diferentes tratamientos que permitan la activación de eventos metabólicos pre-germinativos, para permitir la protrusión de la radícula (Selvarani y Umarani, 2011, 857). Durante la activación de estos eventos metabólicos se producen cambios físicos, bioquímicos y fisiológicos que determinan un incremento en el rendimiento de la producción, en la tolerancia al estrés abiótico o en la síntesis de metabolitos secundarios en las semillas y las plantas (Randhir et al., 2002, 1247). Se ha demostrado que la temperatura es uno de los factores más importantes en la activación y estimulación de procesos metabólicos de la semilla (Castillo y Santibáñez, 1987, 1; Adhikary y Tarai, 2013, 629), considerado un método relevante en los tratamientos de acondicionamiento previo a la siembra (Lee et al., 1995, 10432). En algunas especies como Triticum sativum (Yari et al., 2010, 1), Stevia rebaudiana, Salvia sclarea y Tagetes minuta (Kumar y Sharma, 2012, 468), así como Corchorus olitorious (Denton et al., 2013, 98), Juniperus macrocarpa Sm (Pinna et al., 2014, 338), se demostró que la exposición a diferentes temperaturas y tiempos, provoca un incremento en el vigor de la planta. Estos estudios revelan el efecto de la temperatura en la estimulación del desarrollo vegetativo, garantizando un efecto en el aumento del rendimiento (Yari et al., 2010, 2). Sin embargo, estudios basados en tratamientos de temperatura en semillas de albahaca para estimular el vigor de la planta son escasos. La mayoría de las investigaciones sobre acondicionamiento con calor se basan en tratamientos de agua caliente, lo que en el caso de la semilla de albahaca es algo complejo debido a que presenta una característica muscilaginosa al ser sometida a humedad (Rafe y Razavi, 2013, 556). Asimismo, los estudios que consideran la respuesta fisiológica de plantas cuyas semillas reciben tratamientos térmicos como pre-acondicionamiento son aún más escasos. Las respuestas fisiológicas de las plantas dependen de los factores climáticos y microclimáticos en el medio en que se desarrollan (Kinoshita y Seki, 2014, 1859). Así, en zonas áridas y semiáridas las temperaturas altas, tasas evaporativas y radiación son parte de las condiciones a las que se exponen las especies vegetales. En este sentido, mientras mayor es el vigor de una planta mayor será la capacidad de adaptación a estas condiciones adversas (Haigh et al., 1986, 660; Bittencourt et al., 2005, 319). Las estrategias fisiológicas de las plantas a estas condiciones incluyen especies de plantas aromáticas. La disminución de la pérdida de agua a través de la transpiración mediante el cierre estomático forma parte de estas estrategias para realizar los procesos metabólicos básicos (Ojeda et al., 2013, 145) y de esta forma realizar los procesos metabólicos básicos.
Basado en las premisas anteriores, la hipótesis del presente estudio es que el pre- acondicionamiento térmico en semilla de albahaca mejorará los índices de vigor propuestos por Abdul y Anderson (1970, 31), Parera y Cantliffe (1991, 942), Hampton et al. (2000, 861), Bita y Gerats (2013, 18) que involucra un incremento en el porcentaje y tasa de germinación y emergencia, en el crecimiento y producción de biomasa de plántulas en la etapa temprana de crecimiento, como consecuencia de diferentes estrategias fisiológicas, en comparación con plantas cuyas semillas no fueron pre-acondicionadas. El objetivo del presente estudio fue determinar el umbral óptimo de acondicionamiento de la semilla con diferentes gradientes de escarificación sobre las características de vigor relacionadas a variables morfométricas y fisiológicas en plántulas de albahaca durante las etapas de germinación, emergencia y desarrollo vegetativo inicial.
Método
Área de estudio. El estudio se realizó en el laboratorio de fisiotecnia vegetal y en el campo experimental del Centro de Investigaciones Biológicas del Noroeste, S.C. (CIBNOR), ubicado a 17 km al Noroeste de La Paz, Baja California Sur, México (24°08´LN 110°24´LO). El área se caracteriza por tener un clima Bw (h’) hw (e) considerado como semiárido y de vegetación xerofita (García, 2004, 98), con temperaturas medias anuales de 24.7oC con máximas en verano de 35oC y mínimas de 17oC, con precipitación promedio anual de 334.7 mm (CONAGUA, 2014, 27).
Material genético. Se utilizaron semillas de albahaca (Ocimum basilicum L.) de la variedad Nufar, las cuales se obtuvieron de la compañía Vis Seed® Company Inc. (Arcadia, CA, USA).
Tratamientos. Las semillas de albahaca se trataron con temperaturas de 40, 50, 60 y 70°C a diferentes tiempos de exposición de 30, 60 y 90 min, lo cual se realizó en un horno de secado (Shel-Lab® modelo FX-5, serie-1000203). Se utilizó un grupo control comparativo de semillas sin tratamiento térmico, que consistió en mantener las semillas a temperatura ambiente del laboratorio (25oC) durante los mismos tiempos de exposición (ISTA, 1996, 299).
Germinación. Las semillas tratadas se colocaron en cajas Petri de 150 × 15 mm, que contenían como sustrato un papel filtro Whatman No. 2 humedecido previamente. Se colocaron 50 semillas en cada caja Petri, correspondiendo una repetición por caja. El diseño experimental fue completamente al azar con arreglo factorial con cuatro repeticiones. El factor 1 fueron las temperaturas, con cuatro niveles (40, 50, 60 y 70°C) y el factor 2 fueron los tiempos de exposición de las semillas a las diferentes temperaturas, con tres niveles (30, 60 y 90 min) y un control (25°C). Las cajas con las semillas se depositaron en cámara de germinación (Lumistell®, modelo IES-OS) en condiciones controladas de temperatura (25±1°C), humedad constante (80%) y fotoperiodo de 12 horas de luz/oscuridad (14,168 luxes). La tasa y el porcentaje de germinación se cuantificaron mediante conteos diarios de las semillas, considerando como semilla germinada la que presentaba 3 mm de longitud en su radícula. La tasa de germinación (M) se calculó de acuerdo con la ecuación de Maguire (1962, 176):
M= n1/t1 + n2/t2 +...n30/t7; donde n1, n2,... n30, son el número de semillas germinadas en los tiempos “t” (hasta los 30 días). El porcentaje de germinación (PG) se calculó con la ecuación: PG=ni/N×100, donde “ni” es el número de semillas germinadas y “N” el total de semillas sembradas. El registro de la germinación se realizó durante 15 días y a este tiempo, se seleccionaron al azar 10 plántulas de cada tratamiento a las cuales se les midió longitud de raíz y tallo (cm) utilizando un analizador de imágenes (WinRhizo®, Regent Instruments Inc.).
El peso fresco y seco (g) de raíz y parte aérea se determinó con balanza analítica (Mettler Toledo®, modelo AG204). Para obtener el peso seco de los tejidos, estos se introdujeron en bolsas de papel y luego a un horno de flujo laminar a 70°C hasta conseguir peso constante. Con los valores de % de germinación, peso seco y longitud de plantula, se calcularon los índices de vigor I y II, acorde con Abdul y Anderson (1970, 31), con las siguientes ecuaciones:
Índice de vigor I= germinación (%) × longitud de la planta (cm).
Índice de vigor II= germinación (%) × peso seco de la planta (g).
Asi mismo, con los valores obtenidos de peso fresco y seco de parte aérea de la plántula y de la raíz, se calcularon los índices de peso fresco y seco para determinar la proporción de desarrollo de la planta, acorde con Nieto (2009, 405), mediante las siguientes ecuaciones:
Índice de peso fresco = peso fresco de parte aérea / peso fresco de raiz (g).
Índice de peso seco = peso seco de parte aérea/ peso seco de raiz (g).
Emergencia. Este experimento se realizó en una malla sombra, modelo 1610 PME CR, 16×10 hilos cm-2 con agujeros de 0.4 × 0.8 mm, color cristal, con 40% de sombreo, de monofilamento de polietileno estabilizado. Las semillas tratadas, se colocaron en charolas de poliestireno de 200 cavidades con sustrato comercial (Sunshine®), aplicando riego diariamente para mantener la humedad a capacidad de campo. El diseño experimental fue completamente al azar con arreglo factorial con cuatro repeticiones. El factor 1 fueron las temperaturas, con cuatro niveles (40, 50, 60 y 70°C) y el factor 2 fueron los tiempos de exposición de las semillas a las diferentes temperaturas, con tres niveles (30, 60 y 90 min) y un control (25°C). Las temperaturas máxima, mínima y media dentro de la malla sombra fueron 40, 19 y 26.5° C, respectivamente, mientras que la humedad relativa promedio fue de 66.06%. El porcentaje y la tasa de emergencia se calcularon con las mismas ecuaciones para tasa y porcentaje de germinación. Se consideró como plántula emergida cuando la superficie del sustrato se rompió por la presión ejercida por la plántula en crecimiento. El registro de la emergencia se realizó durante 21 días y este día, se seleccionaron al azar 10 plántulas por repetición de cada tratamiento y se les determinó peso fresco y seco (g) de parte aérea y de raíz, así como los índices de vigor propuestos por Abdul y Anderson (1970, 31) y los índices de peso fresco y seco, propuestos por Nieto et al. (2009, 405).
Crecimiento vegetativo inicial. Este experimento se realizó dentro de la misma malla sombra donde se realizó el experimento de emergencia. Las semillas tratadas se colocaron en charolas de poliestireno de 200 cavidades con sustrato comercial (Sunshine®), aplicando riego diariamente para mantener la humedad a capacidad de campo. Una vez que las plántulas alcanzaron una altura de 15 cm, se trasplantaron en macetas de plástico con capacidad de 500 g con el mismo sustrato comercial. Se aplicaron dos riegos por semana y una fertilización por mes (1 mL planta-1), utilizando como solución nutritiva un producto comercial (Triple 17) cuyo contenido es 17-17-17 de N, P y K, respectivamente. El diseño experimental fue completamente al azar con arreglo factorial con cinco repeticiones. El factor 1 fueron las temperaturas, con cuatro niveles (40, 50, 60 y 70°C) y el factor 2 fueron los tiempos de exposición de las semillas a las diferentes temperaturas, con tres niveles (30, 60 y 90 min) y un control (25°C). Se utilizó una planta por maceta. Las temperaturas máxima, mínima y media dentro de malla sombra fueron 33.50, 8.90 y 22.70°C, respectivamente, mientras que la humedad relativa promedio fue de 65.86%. Sesenta días después de la siembra (DDS) se midió longitud de tallo y raíz (cm), área foliar (cm2) con un medidor LiCor®, modelo Li- 3100C, peso fresco y seco (g) de raíces, tallo y hojas y se determinaron los índices de peso fresco y seco de la planta. Las variables fisiológicas se registraron a los 50 y 60 días después de la siembra con un analizador portátil de gas infrarrojo (IRGA) y un sistema de fotosíntesis portátil LCpro-SD con una cámara de amplificación de la hoja (ADC®, Hoddesdon, Herts, UK). Se registró tasa fotosintética (A, μmol m-2 s-1), transpiración (E, mmol m-2 s-1), temperatura de la hoja (°C), conductividad estomática (g, mol m-2s-1) y contenido sub- estomático de carbono (Ci, μmol mol-1). Estas mediciones se realizaron a las 11:00 horas en la tercera hoja inferior del meristemo apical de cada planta, en hoja completamente turgente y sana, la cual posteriormente se cosechó para cuantificar la clorofila a, b y total mediante la metodología de Bruinsma (1963, 241), utilizando un espectrofotómetro (Beckman® Coulter, modelo 800). El promedio de la radiación fotosintéticamente activa durante el periodo de crecimiento de las plantas y duración del experimento fue de 378.49 ± 83.92 μmol m-2s-1. La concentración de CO2 fue de 391.12 ± 2.07 μmol mol-2. El promedio de la temperatura de la hoja durante las mediciones de las variables fisiológicas fue de 33.96 ± 0.67°C.
Análisis estadístico. Se realizaron análisis de varianza y comparaciones múltiples de medias (Tukey HSD, p=0.05). En todas las variables, los valores promedio se consideraron diferentes estadísticamente cuando p≤0.05. Los valores de porcentaje de germinación y emergencia se transformaron mediante arcoseno (Little y Hills, 1989, 270; Steel y Torrie, 1995, 622). Los análisis estadísticos se realizaron con el programa Statistica v. 10.0 para Windows (StatSoft®, Inc., 2011, 1098).
Resultados
Porcentaje y tasa de germinación. Para porcentaje de germinación, se encontraron diferencias significativas entre temperaturas (F4,45=78.90; p≤0.0001), pero no para tiempos de exposición (F2,45=1.50; p≥0.23) ni la interacción de temperaturas × tiempos (F8,45=0.591; p≥0.77). Entre temperaturas, el porcentaje de germinación mayor se presentó en semillas tratadas con 50°C y estadísticamente iguales, en orden decreciente las semillas con tratamiento de 25° (control) > 60 > 40°C, mientras que el porcentaje menor se presentó en semillas tratadas con 70°C (Tabla 1). Para tiempos de exposición, aunque no se presentaron diferencias estadísticas, se observó que el porcentaje de germinación fue mayor en semillas expuestas a 90 min, seguido por las expuestas a 30 min y con menor porcentaje las de 60 min (Tabla 2). La interacción de los factores no mostró una tendencia clara en cuanto a la respuesta de la semilla a los tratamientos de acondicionamiento térmico a diferentes tiempos de exposición; sin embargo, se observó que los porcentajes de germinación mayores se presentaron en semillas tratadas con 50°C a 30 y 90 min, respectivamente, mientras que éstos disminuyeron significativamente en semillas tratadas con 70°C, expuestas a 30, 60 y 90 min (Tabla 3). La tasa de germinación mostró diferencias significativas entre temperaturas (F4,45=254.66; p≤0.00001), pero no entre tiempos de exposición (F2.45=2.47; p≥0.095) ni en la interacción temperaturas × tiempos (F8,45=0.52; p≥0.830). En la tabla 1 se observa que entre temperaturas, se exhibieron valores similares en la tasa de germinación de semillas tratadas con 25 (control), 40, 50 y 60oC, observándose en este último una diferencia numérica mayor. En el caso de semillas tratadas con 70oC, se observó una marcada diferencia entre los tratamientos anteriores, al provocar una disminución cercana al 50%. Entre tiempos de exposición, aunque no se presentaron diferencias significativas, se observó que semillas expuestas a 90 min, mostraron un ligero incremento en la tasa de germinación, a diferencia de las expuestas a los 30 y 60 min (Tabla 2). El análisis de la interacción temperaturas × tiempos, a pesar de no existir diferencias significativas, el efecto de prolongar el tiempo de exposición de las semillas a 90 min y aumentar a cierto grado la temperatura, se apreciaron cambios relevantes en la tasa de germinación en semillas tratadas con 40, 50 y 60oC, mientras que en las tratadas con 70°C, tanto en 30 como en 60 y 90 min, disminuyeron considerablemente la tasa de germinación (Tabla 3).
Tabla 1 Acondicionamiento térmico en semillas de Ocimum basilicum L. y su efecto en la tasa, porcentaje y variables morfométricas de plántulas en la etapa de germinación.
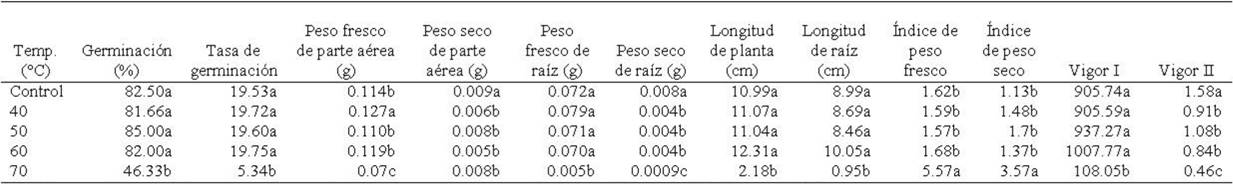
*Medias con letras distintas en una misma columna difieren estadísticamente (Tukey HSD, p=0.05). Control= 25oC.
Tabla 2 Tiempos de exposición al acondicionamiento térmico en semillas de Ocimum basilicum L. y su efecto en la tasa, porcentaje y variables morfométricas de plántulas en la etapa de germinación.
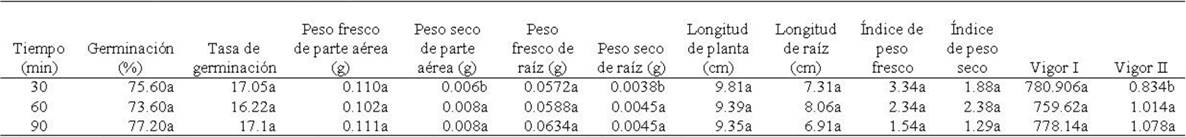
*Medias con letras distintas en una misma columna difieren estadísticamente (Tukey HSD, p=0.05).
Tabla 3 Interacción del acondicionamiento térmico × tiempos de exposición en semillas de Ocimum basilicum L. y su efecto en la tasa, porcentaje y variables morfométricas de plántulas en la etapa de germinación.
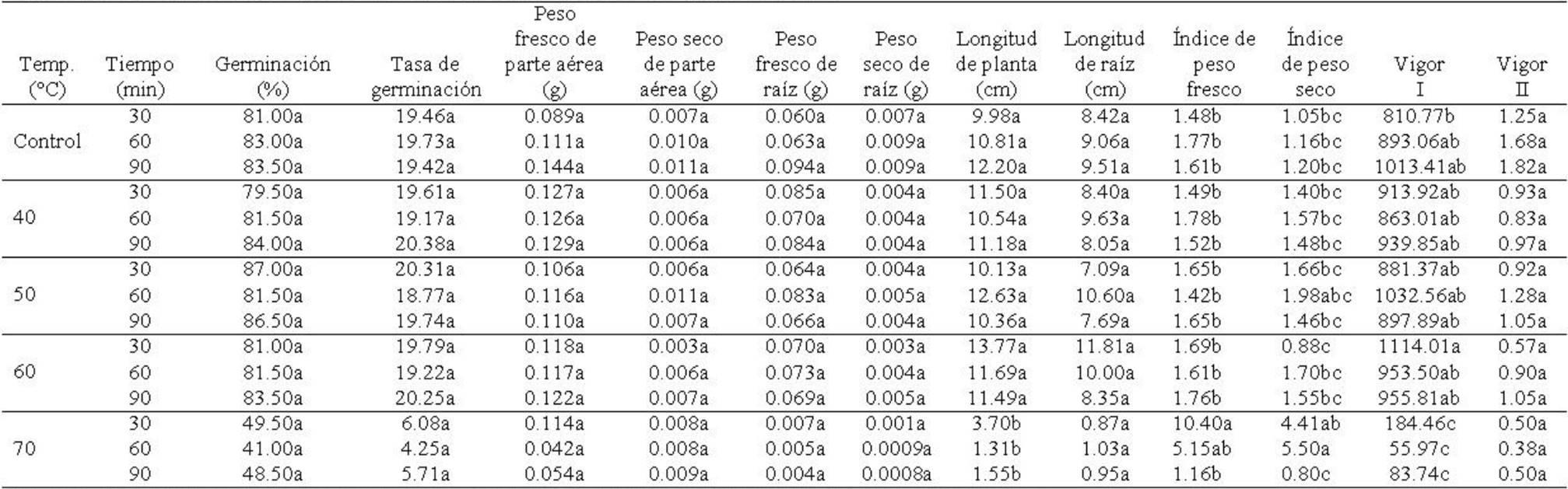
*Medias con letras distintas en una misma columna difieren estadísticamente (Tukey HSD, p=0.05). Control= 25oC.
Peso fresco y seco de parte aérea. El peso fresco de parte aérea presentó diferencias significativas entre temperaturas (F4,45=5.69; p≤0.00085), pero no en el factor tiempo (F2,45=0.50; p≥0.60) ni en la interacción temperaturas × tiempos de exposición (F8,45=2.04; p≥0.062). En el factor temperatura, el peso fresco de parte aérea fue mayor en las plántulas cuya semilla se sometió a 40oC, seguido en orden decreciente por 60°C, 25 (control) y 50oC, observándose que éste disminuyó considerablemente en 70oC (Tabla 1). Durante los tres tiempos de exposición se presentaron valores similares; sin embargo, el tiempo de exposición de 90 min incrementó ligeramente el valor de esta variable (Tabla 2). Para la interacción temperaturas × tiempos de exposición, el peso fresco de parte aérea fue mayor en las plántulas de semillas relacionadas al grupo control (25°C) seguido de las tratadas a 40oC y 90 min de exposición (Tabla 3). El peso seco de parte aérea mostró diferencias significativas entre temperaturas (F4,45=4.09; p≤0.006) y tiempos de exposición (F2,45=3.31; p≤0.04530), pero no en la interacción temperaturas × tiempos (F8,45=1.39; p≥0.22). El análisis del factor temperatura mostró que las plántulas cuyas semillas del grupo control (25oC) mostraron peso seco de parte aérea mayor, mientras que el valor más bajo se presentó en aquellas plántulas de semilla sometida a un tratamiento térmico de 60oC (Tabla 1). Para tiempos de exposición se observó que el peso seco fue mayor en plántulas cuya semilla se sometió a 60 y 90 min, mientras que el valor inferior fue en 30 min (Tabla 2). Para la interacción temperaturas × tiempos de exposición, las plántulas procedentes de semillas expuestas con 25°C (control) y 50oC a los 60 min de exposición mostraron valores superiores en esta variable (Tabla 3).
Peso fresco y seco de raíz. El peso fresco de raíz presentó diferencias significativas en la temperatura (F4,45=66.44; p≤0.0000) y en la interacción temperatura × tiempo (F8,45=2.78; p≤0.013), pero no en el factor tiempo (F2,45=1.24; p≥0.297). Para el factor temperatura, las plántulas cuya semilla se sometió a 70oC provocaron una disminución significativa en esta variable; sin embargo, se incrementó en 40oC (Tabla 1). Para el factor tiempos de exposición, a pesar de que no hubo diferencias significativas, el peso fresco de raíz de las plántulas de semillas tratadas por 90 min, presentaron un ligero incremento, comparadas con las que se sometieron a 30 y 60 min (Tabla 2). La interacción temperaturas × tiempos de exposición mostró que el peso fresco de raíz fue superior en las plántulas cuya semilla se sometió a 40oC a 30 y 90 min (Tabla 3). El peso seco de raíz presentó diferencias significativas para temperaturas (F4,45=94.14; p≤0.00001) y para tiempos de exposición (F2,45=3.27; p≤0.046), pero no para la interacción temperaturas × tiempos (F8,45=2.06; p≥0.06). Para temperaturas, las plántulas de semilla a 25°C (control) presentaron los valores más altos, mientras que en 70oC se observó el valor inferior (Tabla 1). Para tiempos de exposición, los valores fueron superiores los mostraron las plántulas de semilla sometida a 60 y 90 min (Tabla 2). En la interacción temperaturas × tiempos, se observó que numéricamente el peso seco de raíz fue superior en aquellas plántulas de semilla tratada con 25°C (control) (Tabla 3).
Longitud de plántula y raíz. La longitud de plántula mostró diferencias significativas en el factor temperaturas (F4,45=87.08; p≤0.00001) y en la interacción temperaturas × tiempos de exposición (F8,45=2.70; p≤0.016), pero no para el factor tiempo (F2,45=0.55; p≥0.58). Respecto a la temperatura, la longitud mayor se presentó en las plántulas de semilla tratada con 60°C mientras que la menor fue en 70oC (Tabla 1). Aunque para el factor tiempo no se presentaron diferencias significativas para esta variable, la tabla 2 muestra que el tiempo de 30 min provocó un aumento ligero en esta variable en aquellas plántulas cuya semilla se expuso por ese tiempo, respecto a los tiempos de 60 y 90 min. El análisis de la interacción temperaturas × tiempos de exposición, mostró que la semilla sometida a 60oC y 30 min, procovó un incremento en la longitud de las plántulas (Tabla 3). La longitud de raíz presentó diferencias significativas en el factor temperatura (F4,45=44.72; p≤0.00001), mientras que en tiempos (F2,45=1.89; p≥0.16) y la interacción temperaturas × tiempos (F8,45=1.59; p≥0.1523), las diferencias no fueron significativas. Para el factor temperaturas, la longitud de raíz fue mayor en las plántulas cuya semilla se sometió a 60°C y el valor inferior en aquellas plántulas de semilla tratada a 70oC (Tabla 1). Para tiempos de exposición, aunque no se presentaron diferencias significativas, se observó una longitud mayor en las plántulas de semilla expuesta durante 60 min (Tabla 2). Para la interacción temperaturas × tiempos de exposición, la longitud de raíz fue mayor en las plántulas de semilla tratada con 60oC y 30 min de exposición, mientras que los valores menores se presentaron en las plántulas de semilla sometida a 70°C en los tres tiempos de exposición (Tabla 3).
Índice de peso fresco y seco. El índice de peso fresco presentó diferencias significativas entre temperaturas (F4,45 =5.93; p≤0.0006) y para la interacción temperaturas × tiempos de exposición (F8,45=2.77; p≤0.013), mientras que para el factor tiempos de exposición, no se presentaron diferencias significativas (F2,45=2.57; p≥0.087). Considerando las temperaturas, el índice de peso fresco fue mayor en plántulas cuya semilla se sometió a 70°C, mientras que en el resto de temperaturas, esta variable presentó valores similares (Tabla 1). En el factor tiempos de exposición, aunque no se presentaron diferencias significativas, se observó que las plántulas de semilla expuesta por 30 min, mostraron índice de peso fresco mayor (Tabla 2). En la interacción temperaturas × tiempos de exposición, las plántulas de semilla tratada con 70°C y 30 min, mostraron un índice de peso fresco mayor (Tabla 3). El índice de peso seco de igual manera presentó diferencias significativas entre temperaturas (F4,45 =5.92; p≤0.0006) y en la interacción temperaturas × tiempos de exposición (F8,45 =2.50; p≤0.024), pero no mostró diferencias en el factor tiempos de exposición (F2,45=3.028; p≥0.058). El análisis entre temperaturas muestra que esta variable fue superior en aquellas plántulas cuya semilla fue tratada con 70°C, con valores estadísticamente iguales en el resto de las temperaturas (Tabla 1). Para tiempos de exposición, aunque no se presentaron diferencias significativas, se observó un incremento de esta variable en las plántulas procedentes de semilla tratada durante 60 min (Tabla 2). En la interacción de los factores en estudio, esta variable mostró valores superiores en plántulas de semilla tratada con 70°C y 60 min (Tabla 3).
Índice de vigor I y II. El índice de vigor I presentó diferencias significativas entre temperaturas (F4,45=135.34; p≤0.00001) y entre la interacción temperaturas × tiempos (F8,45=2.51; p≤0.023) pero no para tiempos de exposición (F2,45=0.216; p≥0.80). El índice de vigor I fue menor en las plántulas de semilla tratada con 70oC, mientras que en las plántulas de semilla expuesta a 60oC, este índice se incrementó (Tabla 1). Para tiempos de exposición, se observó que el índice de vigor I mostró valor superior en plántulas de semilla expuesta a 30 min (Tabla 2). En la interacción, se observó que el índice de vigor I lo mostraron las plántulas de semilla tratada a 60°C y 30 min, mientras que los valores inferiores se presentaron en plántulas cuya semilla fue tratada con 70°C y 30 min y 60oC y 90 min (Tabla 3). El índice de vigor II mostró diferencias significativas entre temperaturas (F4,45=27.98; p≤0.00001) y entre tiempos de exposición (F2,45=4.42; p≤0.01), pero no en la interacción temperaturas × tiempos (F8,45=1.54; p≥0.17). El índice de vigor II fue mayor en plántulas de semilla con 25°C (control), seguido en orden descendente por plántulas procedentes de semilla tratada con 50, 40, 60 y 70oC (Tabla 1). Para tiempos de exposición, este índice fue superior en plántulas cuya semilla fue tratada durante 60 y 90 min (Tabla 2). Para la interacción de los factores el índice de vigor II fue superior en las plántulas de semilla con 25°C (control) (Tabla 3).
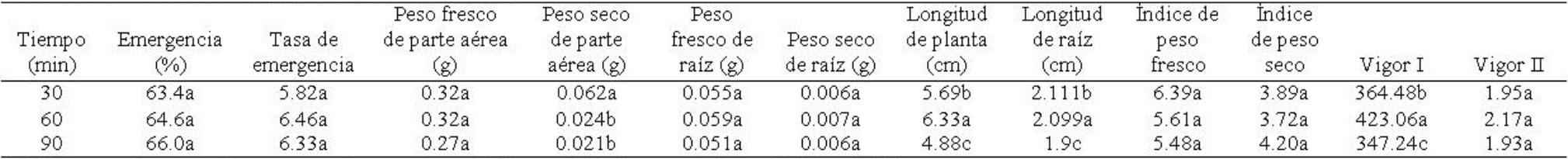
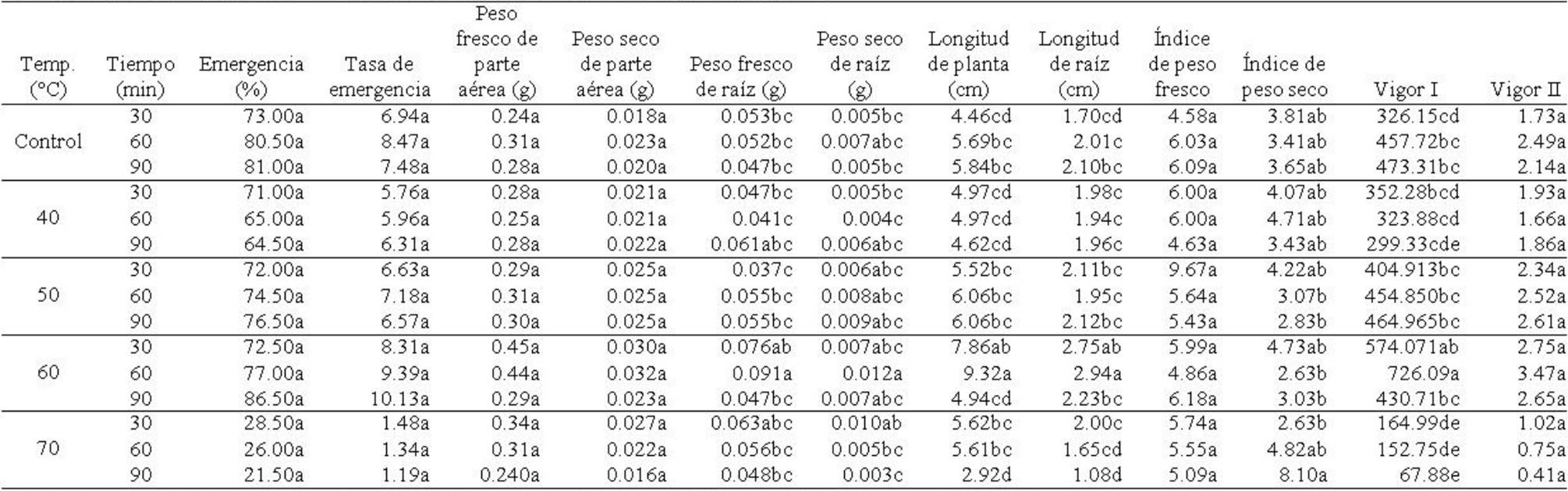
Porcentaje y tasa de emergencia. Porcentaje de emergencia mostró diferencias significativas entre temperaturas (F4,45=80.43; p≤0.00001) pero no para tiempos de exposición (F2,45=0.44; p≥0.64) ni para la interacción temperaturas × tiempos (F8,45=1.23; p≥0.29). Las semillas tratadas con 60oC y 25°C (control) mostraron porcentaje de germinación mayor, pero éste disminuyó en semillas tratadas con 70°C (Tabla 4). Para tiempos de exposición, esta variable mostró un valor superior en semillas expuestas a 90 min (Tabla 5). En la interacción de los factores, esta variable fue superior en semillas tratadas con 60°C y 90 min, mientras que en semillas con tratamiento de 70°C a 30, 60 y 90 min de exposición, mostró valores inferiores (Tabla 6). Tasa de emergencia presentó diferencias significativas entre temperaturas (F4,45=93.53; p≤0.00001), pero no entre tiempos de exposición (F2,45=2.00; p≥0.14651) ni entre la interacción temperaturas × tiempos (F8,45=0.94; p≥0.49). La tasa fue mayor en semillas tratadas con 60°C, seguido de las semillas sometidas al tratamiento control (25°C), disminuyendo significativamente en semillas tratadas con 70°C (Tabla 4). Para tiempos de exposición, las semillas expuestas a 60 min mostraron una tasa mayor, la cual disminuyó en semillas expuestas a 30 min (Tabla 5). Para la interacción de los factores, la tasa se incrementó en semillas tratadas con 60° y 90 min de exposición, mostrando valores menores las semillas tratadas con 70°C en los tres tiempos de exposición (Tabla 6).
Tabla 4 Acondicionamiento en semillas de Ocimum basilicum L. en la tasa, porcentaje y variables morfométricas de plántulas en la etapa de emergencia.
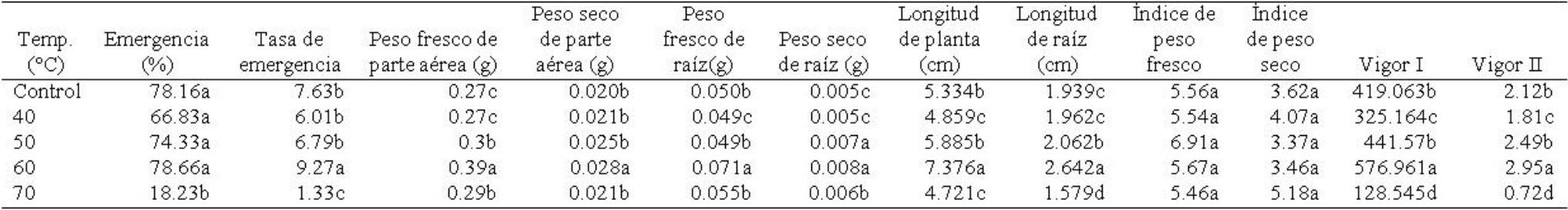
*Medias con letras distintas en una misma columna difieren estadísticamente (Tukey HSD, p=0.05). Control= 25oC.
Tabla 5 Tiempos de exposición al acondicionamiento térmico en semillas de Ocimum basilicum L. y su efecto en la tasa, porcentaje y variables morfométricas de plántulas en la etapa de emergencia.
*Medias con letras distintas en una misma columna difieren estadísticamente (Tukey HSD, p=0.05).
Tabla 6 Interacción del acondicionamiento térmico × tiempos de exposición en semillas de Ocimum basilicum L. y su efecto en la tasa, porcentaje y variables morfométricas de plántulas en la etapa de emergencia.
*Medias con letras distintas en una misma columna difieren estadísticamente (Tukey HSD, p=0.05). Control= 25oC.
Peso fresco y seco de parte aérea. El peso fresco de parte aérea presentó diferencias significativas entre temperaturas (F4,45=6.76; p≤0.0002), pero no entre tiempos de exposición (F2,45=2.99; p≥0.059) ni entre la interacción temperaturas × tiempos (F8,45=2.03; p≥0.063). El análisis del factor temperaturas, mostró que el peso fresco de parte aérea fue mayor en plántulas de semilla tratada con 60°C, seguido de las tratadas con 50 y 70°C, respectivamente (Tabla 4). Entre tiempos de exposición, se observó que esta variable fue superior en las plántulas expuestas a 30 y 60 min (Tabla 5). En la interacción de los factores, esta variable fue superior en plántulas de semillas expuestas a 60°C a 30 y 60 min de exposición (Tabla 6). El peso seco de parte aérea mostró diferencias significativas entre temperaturas (F4,45=5.67; p≤0.0008) y en el tiempo (F2,45=3.52; p≤0.0037), pero no en la interacción de los factores (F8,45=1.99; p≥0.068). El peso seco de parte aérea fue mayor en plántulas de semillas tratadas con 60°C con valores similares en los otros tratamientos térmicos (Tabla 4). Entre tiempos de exposición, esta variable fue superior en plántulas de semilla expuesta a 30 min (Tabla 5), mientras que en el análsis de la interacción, las plántulas de semillas tratadas con 60°C y 60 min, mostraron mayor peso seco de parte aérea, mostrando valor inferior las plántulas cuya semilla fue tratada con 70°C y 90 min de exposición (Tabla 6).
Peso fresco y seco de raíz. Peso fresco de raíz mostró diferencias significativas entre temperaturas (F4,45=5.53; p≤0.001) y entre la interacción temperaturas × tiempos (F8,45=3.75; p≤0.001), pero no entre tiempos de exposición (F2,45=1.38; p≥0.26). El peso fresco de raíz fue mayor en las plántulas procedentes de semilla tratada con 60°C, mostrando el valor inferior las plantas de semilla tratada con 40°C (Tabla 4). Entre tiempos de exposición, aunque no existieron diferencias estadísticamente significativas, el peso fresco de raíz mostró valor ligeramente superior en plántulas de semillas expuestas por 60 min (Tabla 5). En la interacción, el peso fresco de raíz fue mayor en plántulas de semillas tratadas con 60°C y 60 min de exposición, mostrando valor inferior las plántulas de semilla tratada con 50°C y 30 min (Tabla 6). El peso seco de raíz mostró diferencias significativas entre temperaturas (F4,45=5.38; p≤0.001) y en la interacción temperaturas × tiempos (F8,45=4.38; p≤0.0005) pero no entre tiempos de exposición (F2,45=0.98; p≥0.38). El peso seco de raíz fue mayor en plántulas de semilla tratada con 50 y 60°C; las plántulas cuya semilla recibió tratamiento de 25 (control) y 40°C, disminuyeron en esta variable (Tabla 4). Entre tiempos de exposición, el peso seco de raíz fue ligeramente superior en plántulas de semilla expuesta a 60 min aunque no existieron diferencias significativas (Tabla 5). En la interacción de los factores, el peso seco de raíz fue superior en plántulas de semilla tratada con 60°C y 60 min de exposición, con valores inferiores las plántulas cuya semilla fue tratada con 40°C y 60 min y 70°C con 90 min de exposición (Tabla 6).
Longitud de plántula y raíz. Longitud de la plántula mostró diferencias significativas entre temperaturas (F4,45=16.05; p≤0.000001), tiempos de exposición (F2,45=12.25, p≤0.00006) y entre la interacción temperaturas × tiempos (F8,45=6.30; p≤0.00002). Entre temperaturas, esta variable se incrementó en plántulas cuya semilla fueron tratadas con 60°C; las plántulas de semilla tratada con 70°C disminuyeron significativamente (Tabla 4). La longitud de plántula fue mayor en las plántulas de semilla expuesta a 60 min y menor en plántulas de semilla expuesta a 90 min (Tabla 5). En la interacción de los factores, esta variable fue superior en plántulas de semilla tratada con 60°C y 60 min de exposición, siendo menor en las plántulas cuya semilla se sometió a 70°C y 90 min de exposición (Tabla 6). La longitud de raíz presentó diferencias significativas entre temperaturas (F4,45=25.44; p≤0.00001), tiempos de exposición (F2,45=4.05; p≤0.024) y en la interacción temperaturas × tiempos (F8,45=4.77; p≤0.0002). La longitud de raíz fue mayor en plántulas de semilla tratada con 60°C; las plántulas cuya semilla recibió 70°C disminuyeron la longitud de raiz (Tabla 4). Esta variable mostró valor mayor en plántulas de semilla expuesta a 60 min y disminuyó en las plántulas de semilla expuesta a 90 min (Tabla 5). La interacción de los factores mostró que las plántulas de semilla tratada con 60°C y 60 min de exposición incrementaron la longitud de raíz, pero las plántulas de semilla sometida a 70°C y 90 min de exposición, disminuyeron significativamente (Tabla 6).
Índice de peso fresco y seco. El índice de peso fresco no presentó diferencias significativas entre temperaturas (F4,45 =1.34; p≥0.26), tiempos de exposición (F2,45=1.46; p≥0.24), ni en la interacción temperaturas × tiempos de exposición (F8,.45=1.96; p≥0.073). Sin embargo, esta variable mostró un valor ligeramente superior en plántulas de semillas tratadas con 50°C (Tabla 4). En relación a tiempos de exposición, el índice de peso fresco fue mayor en plántulas de semilla expuesta a 30 min (Tabla 5). En la interacción de los factores, el índice de peso fresco fue mayor en plántulas sometidas a los tratamientos de 50°C y 30 min de exposición (Tabla 6). El índice de peso seco no mostró diferencias significativas entre temperaturas (F4,45=1.69; p≥0.16), ni en tiempos de exposición (F2,45=0.30; p≥ 0.73), pero si en la interacción temperaturas × tiempos (F8,45=2.43; p≤0.027). El índice de peso seco fue mayor en plántulas de semillas tratadas con 70°C y menor en plántulas de semillas que recibieron 50°C como tratamiento (Tabla 4). Para tiempos de exposición, esta variable fue superior en las plántulas de semilla que se expuso durante 90 min (Tabla 5). Para la interacción de los factores, el índice de peso seco mostró valor superior en plántulas de semillas sometidas a 70°C y 90 min de exposición (Tabla 6).
Índice de vigor I y II. Índice de vigor I presentó diferencias significativas entre temperaturas (F4,45=37.43; p≤0.00001), tiempos de exposición (F2,45=3.57; p≤0.036) y entre la interacción temperaturas × tiempos (F8,45=2.82; p≤0.012). En el factor temperatura el índice de vigor I fue mayor en aquellas plántulas de semilla tratada con 60°C, pero se redujo significativamente en las plántulas cuya semilla fue tratada con 70°C (Tabla 4). Entre tiempos de exposición, esta variable fue superior en las plántulas de semilla expuesta durante 60 min y se redujo en las plántulas de semilla expuesta a 90 min (Tabla 5). La interacción de los factores mostró que el índice de vigor I fue superior en las plántulas de semilla tratada con 60°C y 60 min y este se redujo significativamente en plántulas de semilla tratada con 70°C y 90 min (Tabla 6). El índice de vigor II mostró diferencias significativas entre temperaturas (F4,45=30.92; p≤0.00001), pero no en tiempos de exposición (F2,45=1.31; p≥0.27), ni en la interacción temperaturas × tiempos (F8,45=1.39; p≥0.22). El índice de vigor II fue mayor en plántulas de semillas que recibieron el tratamiento térmico de 60°C, reduciendo significativamente en plántulas de semilla tratada con 70°C (Tabla 4). Para el factor tiempos de exposición, esta variable mostró valor ligeramente superior en plántulas de semilla expuesta duante 60 min (Tabla 5). El índice de vigor II mostró un valor superior en plántulas de semilla tratada con 60°C y 60 min pero disminuyó significativamente en aquellas plántulas procedentes de semillas que recibieron tratamientos de 70°C, tanto a 60 como a 90 min de exposición (Tabla 6).
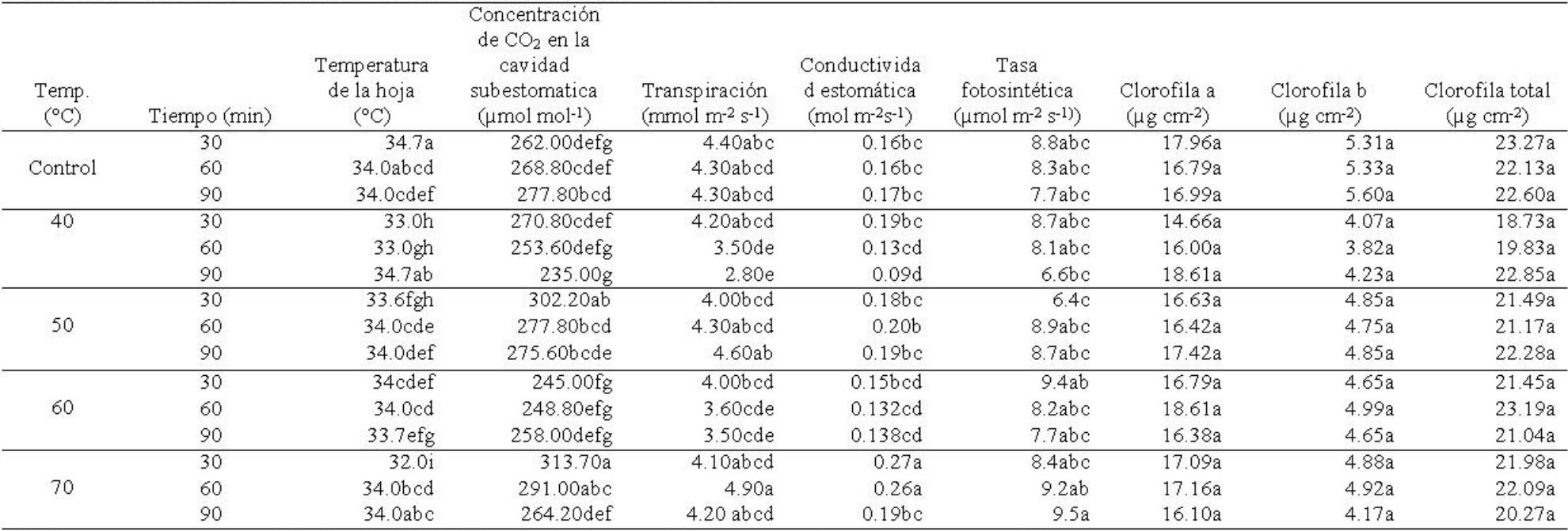
Crecimiento vegetativo inicial
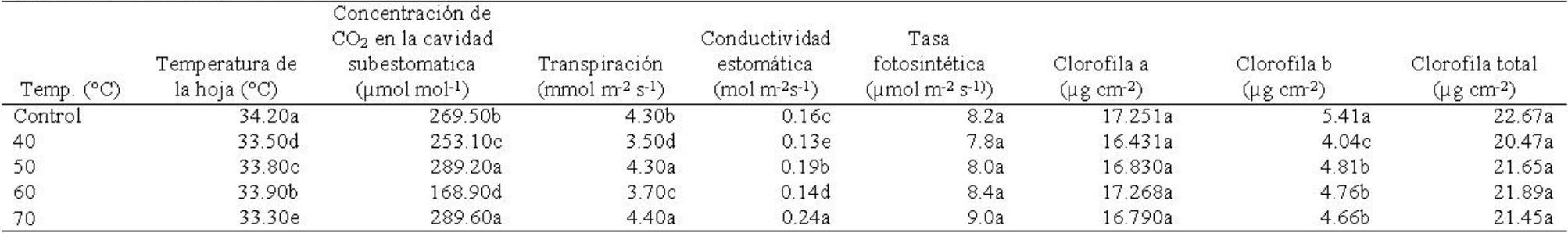
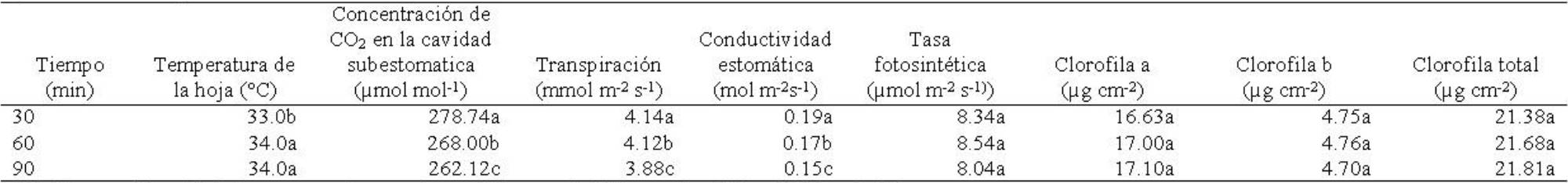
Temperatura de la hoja. La temperatura de la hoja mostró diferencias significativas entre temperaturas (F4,135=30.25; p≤0.00001), tiempos de exposición (F2,135=67.17; p≤0.00001) y en la interacción temperaturas × tiempos (F8,135=57.64; p≤0.00001). Las plantas cuyas semillas se expusieron a 25°C (control) mostraron valor mayor en esta variable (Tabla 7). La temperatura de la hoja fue mayor en plantas obtenidas de semilla sometida a 60 y 90 min de exposición (Tabla 8). La temperatura de la hoja fue superior en las plantas cuya semilla fue expuesta a 25°C (control) y 30 min de exposición, siendo menor en aquellas plantas de semilla sometida a 70°C y 30 min (Tabla 9).
Tabla 7 Acondicionamiento térmico en semillas de Ocimum basilicum L. y su efecto en variables fisiológicas de plantas en la etapa de crecimiento vegetativo inicial.
*Medias con letras distintas en una misma columna difieren estadísticamente (Tukey HSD, p=0.05). Control= 25oC.
Tabla 8 Tiempos de exposición al acondicionamiento térmico en semillas de Ocimum basilicum L. y su efecto en las variables fisiológicas de plantas en la etapa de crecimiento vegetativo inicial.
*Medias con letras distintas en una misma columna difieren estadísticamente (Tukey HSD, p=0.05).
Tabla 9 Interacción del acondicionamiento térmico × tiempos de exposición en semillas de Ocimum basilicum L. y su efecto en variables fisiológicas de plantas en la etapa de crecimiento vegetativo inicial.
*Medias con letras distintas en una misma columna difieren estadísticamente (Tukey HSD, p=0.05). Control= 25oC.
Concentración de CO 2 . La concentración de CO2 en la cavidad estomática mostró diferencias significativas entre temperaturas (F4,135=28.44, p≤0.00001), tiempos de exposición (F2,135 =10.16; p≤0.00008) y en la interacción temperaturas × tiempos (F8,135=6.46; p≤0.00001). Esta variable fue superior en las plantas cuya semilla fue tratada con 50 y 70°C y disminuyó en las tratadas con 60oC (Tabla 7). Las plantas cuya semilla se expuso durante 30 min, mostraron mayor concentración de CO2 (Tabla 8). La concentración de CO2 incrementó en las plantas cuya semilla fue tratada con 70°C y 30 min de exposición, reduciendo esta concentración en las plantas cuya semilla fue tratada con 40°C y 90 min de exposición (Tabla 9).
Transpiración. La transpiración presentó diferencias significativas entre temperaturas (F4,135=14.93; p≤0.00001), tiempos de exposición (F2,135=3.37; p≤0.037) y en la interacción temperaturas × tiempos (F8,135=5.61; p≤0.00001). La transpiración fue mayor en las plantas cuya semilla fue tratada con 70 y 50oC y se redujo en las plantas tratadas con 40 y 60°C (Tabla 7). Las plantas cuya semilla se expuso durante 30 min, mostraron mayor traspiración con respecto a las plantas cuya semilla se expuso a 90 min (Tabla 8). Las plantas de semilla tratada con 70°C y 60 min de exposición mostraron mayor transpiración, reduciéndose en las plantas de semilla tratada con 40°C y 90 min de exposición (Tabla 9).
Conductividad estomática. La conductividad estomática mostró diferencias significativas entre temperaturas (F4,135=32.70; p≤0.00001), tiempos de exposición (F2,.135=9.47; p≤0.0001) y en la interacción temperaturas × tiempos (F8,135=4.05; p≤0.0002). La conductividad estomática fue mayor en las plantas de semilla tratada con 70°C, pero se redujo en plantas tratadas con 40o y 60oC (Tabla 7). Esta variable fue superior en plantas cuya semilla se expuso por 30 min y se redujo conforme se incrementó el tiempo de exposición (Tabla 8). La interacción de 70°C con 30 y 60 min de exposición, provocó mayor conductividad estomática en las plantas cuya semilla se sometió a estos tratamientos (Tabla 9).
Tasa fotosintética. La tasa fotosintética mostró diferencias significativas en la interacción temperaturas × tiempos (F8,135=3.04; p≤0.003), pero no entre temperaturas (F4,135=2.01; p≥0.09), ni en tiempos de exposición (F2,135=1.11, p≥0.33). Las plantas cuyas semillas fueron tratadas con 70oC mostraron mayor tasa fotosintética y esta se redujo en las plantas de semillas tratadas con 40°C (Tabla 7). La tasa fotosintética fue mayor en las plantas de semillas expuestas al tratamiento térmico durante 60 min y se redujo a los 90 min (Tabla 8). La tasa fotosintética mayor la mostraron aquellas plantas cuyas semillas se trataron con 70°C y 90 min, mientras que las plantas de semillas sometidas a 50°C y 30 min, redujeron su tasa fotosintética (Tabla 9).
Clorofila “a”. No mostró diferencias significativas en los factores temperatura (F4,59=0.43; p≥0.78), tiempos de exposición (F2,59=0.40; p≥0.66) ni en la interacción de temperaturas × tiempos (F8,59=2.04; p≥0.055). Las plantas de semilla tratada con 60°C, mostraron valor superior de clorofila “a” y el valor menor en las plantas procedentes de semillas tratadas con 40°C (Tabla 7). El análisis del tiempo mostró que la clorofila “a” fue mayor en las plantas de semillas expuestas a 90 min (Tabla 8). La interacción de los factores mostró que las plantas cuyas semillas recibieron pretratamientos térmicos de 40°C y 90 min y 60°C y 60 min, mostraron valores superiores de clorofila “a” (Tabla 9).
Clorofila “b”. Mostró diferencias significativas entre temperaturas (F4,59=8.98; p≤0.00001), pero no en tiempos de exposición (F2,59=0.07; p≥0.93) ni en la interacción temperaturas × tiempos (F8,59=0.91; p≥0.50). Las plantas de cuya semilla expuesta a 25°C (control) mostraron mayor contenido de clorofila “b” y el valor menor se presentó en las plantas de semillas sometidas a 40°C (Tabla 7). El contenido de clorofila “b” mostró un valor ligeramente superior en las plantas procedentes de semilla expuesta durante 60 min (Tabla 8). La interacción de los factores, mostró que el contenido de clorofila “b” fue mayor en las plantas de semillas expuestas a 25°C (control) y 90 min de exposición, mientras que el contenido menor fue en las plantas de semilla tratada con 40°C y 60 min (Tabla 9).
Clorofila total. No presentó diferencias significativas en los factores temperaturas (F4,59=1.59; p≥0.18), tiempos de exposición (F2,59=0.20; p≥0.81) ni en la interacción temperaturas × tiempos de exposición (F8,59=1.59; p≥0.14). El contenido de clorofila total fue superior en las plantas de semillas tratadas con 60°C (Tabla 7), mientras que al considerar el factor tiempos, la clorofila total fue mayor en las plantas de semilla sometida al tratamiento térmico durante 90 min (Tabla 8). En la interacción de los factores en estudio, la clorofila total fue mayor en las plantas de semillas tratadas con 25°C y 30 min (control), así como en el tratamiento de 60°C y 60 min (Tabla 9).
Peso fresco y seco de parte aérea. El peso fresco de parte aérea presentó diferencias significativas entre temperaturas (F4,59=4.93; p≤0.001), tiempos de exposición (F2,59=5.28; p≤0.007) y la interacción temperaturas × tiempos (F8,59=4.37; p≤0.0003). El peso fresco de parte aérea fue mayor en las plantas de semilla tratada con 70°C y disminuyó en las plantas de semilla tratada con 40°C (Tabla 10). Las plantas cuya semilla se expuso a 30 min, mostraron valores superiores en el peso fresco de parte aérea (Tabla 11). En la interacción de los factores, el peso fresco de parte aérea fue mayor en plantas de semilla tratada con 40°C y 30 min de exposición, seguido de 60°C y 90 min (Tabla 12). El peso seco de parte aérea mostró diferencias significativas entre temperaturas (F4,59=6.28; p≤0.0002), tiempos de exposición (F2,59=9.68; p≤0.0002) y la interacción temperaturas × tiempos (F8,59=6.31; p≤0.00001). El valor superior de peso seco de parte aérea se presentó en las plantas de semilla tratada con 50°C y 70°C (Tabla 10). Las plantas de semilla expuesta a 30 min incrementaron el peso seco de parte aérea (Tabla 11). En la interacción de los factores, las plantas de semilla tratada con 50°C y 30 min de exposición, incrementaron el peso seco de parte aérea, mientras que las plantas de semilla tratada con 40°C y 90 min de exposición, disminuyeron los valores en esta variable (Tabla 12).
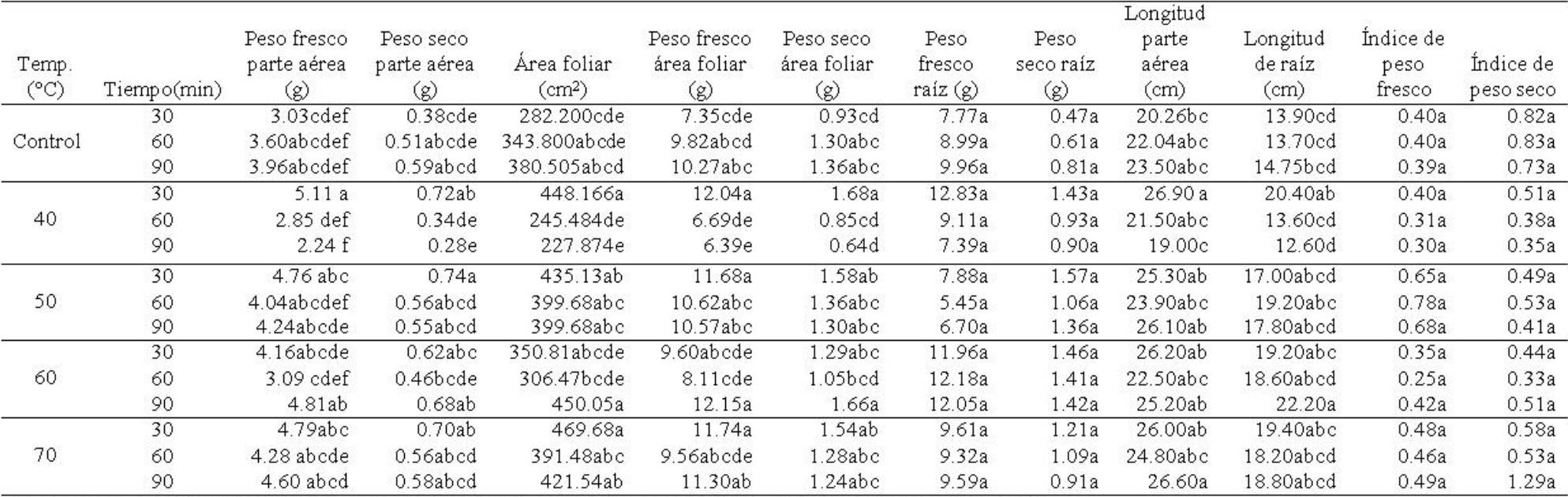
Tabla 10 Acondicionamiento térmico en semillas de Ocimum basilicum L. y su efecto en variables morfométricas de plantas en la etapa de crecimiento vegetativo inicial.

*Medias con letras distintas en una misma columna difieren estadísticamente (Tukey HSD, p=0.05). Control= 25oC.
Tabla 11 Tiempos de exposición al acondicionamiento térmico en semillas de Ocimum basilicum L. y su efecto en las variables morfométricas de plantas en la etapa de crecimiento vegetativo inicial.

*Medias con letras distintas en una misma columna difieren estadísticamente (Tukey HSD, p=0.05).
Tabla 12 Interacción del acondicionamiento térmico × tiempos de exposición en semillas de Ocimum basilicum L. y su efecto en variables morfométricas de plantas en la etapa de crecimiento vegetativo inicial.
*Medias con letras distintas en una misma columna difieren estadísticamente (Tukey HSD, p=0.05). Control= 25oC.
El área foliar mostró diferencias significativas entre temperaturas (F4,59=11.19; p≤0.000001), tiempos de exposición (F2,59=6.79; p≤0.002) y la interacción temperaturas × tiempos (F8,59=7.42; p≤0.000001). Las plantas cuya semilla se expuso a 70°C mostraron mayor área foliar, mientras que plantas procedentes de semilla tratada con 40°C, redujeron el área foliar (Tabla 10). Para tiempos de exposición, las plantas de semilla expuesta a 30 min incrementaron el área foliar (Tabla 11). La interacción de los factores mostró que el área foliar se incrementó en las plantas de semilla tratada con 40°C y 30 min, 60°C y 90 min y 70°C y 30 min, mientras que las plantas procedentes de semilla sometida a 40°C y 90 min de exposición, mostraron área foliar menor (Tabla 12).
Peso fresco y seco de área foliar. Peso fresco de área foliar mostró diferencias significativas entre temperaturas (F4,59=8.19; p≤0.00003), tiempos de exposición (F2,59=7.04; p≤0.001) y la interacción temperaturas × tiempos (F8,59=8.45; p≤0.000001). Las plantas cuya semilla se sometió a 50°C incrementaron el peso fresco de área foliar, seguido de las plantas de semilla tratada con 70°C (Tabla 10). Las plantas de semilla expuesta durante 30 min a los tratamientos térmicos, mostraron peso fresco de área foliar superior con respecto al resto de los tiempos de exposición (Tabla 11). En la interacción de los factores, las plantas procedentes de semillas tratadas con 60°, 40°, 70° y 50°C, todas con 30 min, presentaron peso fresco de área foliar mayor (Tabla 12). El peso seco de área foliar presentó diferencias significativas entre temperaturas (F4,59=5.12; p≤0.001), tiempos de exposición (F2,59=6.08; p≤0.003) y la interacción temperaturas × tiempos (F8,59=8.71; p≤0.000001). Para temperaturas, las plantas de semilla tratada con 50°C incrementaron el peso seco de área foliar, mientras que lo contrario mostraron las plantas cuya semilla fue tratada con 40°C (Tabla 10). El tiempo de exposición fue determinante para incrementar el peso seco de área foliar en las plantas de semilla tratada por 30 min (Tabla 11). La interacción de los factores mostró que el peso seco de área foliar incrementó en plantas de semilla tratada con 40°C y 30 min, 60°C y 90 min, mientras que lo contrario lo sucedió en las plantas cuya semilla se sometió a 40°C y 90 min (Tabla 12).
Peso fresco y seco de raíz. Peso fresco de raíz presentó diferencias significativas entre temperaturas (F4,59=10.15; p≤0.000001), pero no en tiempos de exposición (F2,59=1.33; p≥0.27) ni en la interacción temperaturas × tiempos (F8,59=2.00; p≥0.62). La temperatura a la cual se sometió la semilla y que propició un incremento en el peso fresco de raíz de las plantas fue 60°C, seguido de 40°C (Tabla 10). Para tiempos de exposición, la exposición de la semilla al tratamiento térmico por 30 min, estimuló ligeramente el peso fresco de raíz de las plantas (Tabla 11). Para la interacción de los factores, las plantas de semilla tratada con 40°C y 30 min mostraron valores superiores en el peso fresco de raíz, mientras que lo contrario fue para plantas de semilla tratada con 50°C durante 60 y 90 min (Tabla 12). El peso seco de raíz reveló diferencias significativas entre temperaturas (F4, 59=11.25; p≤0.000001) pero no tiempos de exposición (F2,59=2.38; p≥0.10) ni en la interacción temperaturas × tiempos (F8,59=1.48; p≥0.18). Las plantas de semilla tratada con 60°C estimularon un incremento en el peso seco de raíz mientras que las procedentes de semilla de 25°C (control) mostraron lo contrario (Tabla 10). Para tiempos de exposición, las plantas de semillas expuestas a 30 min incrementaron ligeramente el peso seco de raíz (Tabla 11). Los tratamientos de la interacción que indujeron un incremento en las plantas en el peso seco de raíz fueron las que procedían de semilla tratada con 50, 60 y 40°C con 30 min de exposición (Tabla 12).
Longitud de parte aérea y de raíz. Longitud de parte aérea presentó diferencias significativas entre temperaturas (F4,59=5.56; p≤0.007), tiempos de exposición (F2,59=3.29; p≤0.043) y la interacción temperaturas × tiempos (F8,59=3.24; p≤0.004). Esta variable mostró valores mayores en las plantas cuya semilla recibió tratamiento térmico de 70°C y menores en aquellas que recibieron tratamiento de 40°C (Tabla 10). Longitud de parte aérea expresó valor mayor en plantas de semilla expuesta a 30 min (Tabla 11). En la interacción de los factores, la longitud de parte aérea fue mayor en plantas de semilla tratada con 40°C y 30 min, seguido de 70°C y 90 min (Tabla 12). La longitud de raíz exhibió diferencias significativas entre temperaturas (F4,59=10.70; p≤0.000001) y la interacción temperaturas × tiempos (F8,59=3.39; p≤0.002) pero no en tiempos de exposición (F2,59=1.38; p≥0.25). Para temperaturas, las plantas cuyo origen de la semilla fue tratada con 60°C presentaron longitud de raíz mayor, mientras que las tratadas con 40oC, mostraron lo contrario (Tabla 10). La longitud de raíz fue mayor en las plantas de semilla expuesta a 30 min (Tabla 11). En la interacción temperaturas × tiempos, las plantas de semilla tratada con 60°C y 90 min, mostraron longitud de raíz mayor, mientras que las plantas de semilla tratada con 40°C y 90 min mostraron lo contrario (Tabla 12).
Índice de peso fresco y seco. Índice de peso fresco presentó diferencias significativas entre temperaturas (F4,59=28.22; p≤0.001) pero no entre tiempos de exposición (F2,59=0.28; p≥0.75) ni en la interacción temperaturas × tiempos (F8,59=2.12; p≤0.04). El índice de peso fresco se incrementó en las plantas de semillas tratadas con 50°C, mientras que este disminuyó en plantas cuya semilla se sometió a 40°C (Tabla 10). Para tiempos de exposición se observó que las plantas de semilla expuesta a 30 y 90 min, presentaron valores ligeramente superiores respecto a las plantas de semilla expuesta por 60 min (Tabla 11). En la interacción, el índice de peso fresco fue mayor en plantas de semillas tratadas con 50°C expuestas a 60 y 90 min (Tabla 12). El índice de peso seco exhibió diferencias significativas entre temperaturas (F4,59=2.79; p≤0.03) pero no entre tiempos de exposición (F2,59=0.58; p≥0.56) ni en la interacción temperaturas × tiempos (F8,59=1.11; p≥0.36). El índice de peso seco fue mayor en las plantas de semillas tratadas con 70oC y 25°C (control) (Tabla 10). Esta variable mostró valor superior en plantas de semilla expuestas durante 90 min (Tabla 11). En la interacción de lo factores, el índice de peso seco fue mayor en las plantas de semilla tratada con 70oC y 30 min de exposición, seguido de las plantas cuya semilla fue tratada con 25°C (control) (Tabla 12).
Discusión
Los efectos del acondicionamiento térmico de las semillas fueron evidentes en la inhibición de la germinación en semillas tratadas a 70°C. Los resultados de éste trabajo coinciden con lo encontrado por Iloh et al. (2014, 806), quienes evaluaron el efecto de diferentes gradientes de temperatura (40, 42, 45 y 50°C) en la germinación y emergencia de semillas de cereales, observando una disminución en el porcentaje de germinación conforme los rangos de temperatura incrementaron. Asimismo, Wahid et al. (2007, 199) mencionan que las temperaturas altas provocan la desnaturalización de proteínas, el incremento de la fluidez de la membrana y la inactivación de enzimas claves en el proceso de la germinación. Otro efecto asociado a la inhibición de la germinación se debe a la inducción alterada del ácido ascórbico, donde se ha demostrado que una sobreproducción de este compuesto induce muerte celular en los tejidos (Essemine et al., 2010, 565). El 50% de las plántulas germinadas a 70°C, lograron un desarrollo como plántula presentando los valores menores de vigor I y II, siendo consistentes con los resultados de Iloh et al. (2014, 806), Kumar et al. (2004, 101) y Piramila et al. (2012, 194) en Phaseolus aureus.
Respecto a los resultados obtenidos en el experimento de emergencia, Bruce et al. (2007, 603) mencionan que en algunos casos, los efectos del acondicionamiento de la semilla ocurren después de la germinación, es decir, son más visibles en estados de crecimiento más avanzados, como la emergencia y/o el desarrollo vegetativo, lo que se observó en este trabajo. Los resultados obtenidos en este estudio donde la temperatura a 60oC por 30, 60 y 90 min de exposición fue el mejor tratamiento para las variables medidas, son consistentes con los realizados por Gashaw y Michelsen (2002, 159) quienes reportan resultados similares a temperaturas de 60 y 90°C con tiempos de exposición de 1 a 5 min, en 5 de 15 especies de bosques y pastizales de sabana. La variación en los resultados encontrados en este estudio en el porcentaje de germinación y emergencia, desarrollo de plántulas y vigor, cuyas semillas fueron pre-acondicionadas con tratamientos térmicos en diferentes tiempos, es consistente con los resultados de investigaciones que explican que las variaciones son debidas en un alto grado a las especies y variedades estudiadas que responden de forma diferente (Gashaw y Michelsen 2002, 159; Zinn et al., 2010, 1959; Melander y Kristensen, 2011, 194). A diferencia de la albahaca, se registran especies como Corchorus olitorious cuya germinación, emergencia y vigor en tres variedades se inició a una temperatura de 80°C, mientras que el rango óptimo de temperatura fue de 120°C por un tiempo de exposición de 5 minutos (Denton et al., 2013, 98). Las diferencias encontradas en el desarrollo de los órganos de las plantas originadas de las semillas que se sometieron a una combinación de tratamientos de temperatura y tiempos de exposición permitieron determinar los mejores tratamientos para la estimulación del crecimiento de los mismos. Dentro de las posibles razones de esta estimulación se ha reportado la activación de procesos metabólicos que provocan la división y el crecimiento celular debido a procesos termodinámicos (Parent et al. 2010, 2057). Sin embargo, el desarrollo vegetativo es influido por la respuesta fisiológica de la planta debido a las condiciones ambientales en donde se desarrolla. En este trabajo fue evidente que los tratamientos de pre-acondicionamiento térmico determinan las estrategias fisiológicas de las plantas que siguieron durante esta etapa de desarrollo como respuesta a su ambiente. Lo anterior se demuestra en la diferencia que presentaron los tratamientos en la relación entre el cierre estomático, la disminución de la transpiración, la tasa fotosintética y la concentración de carbono en la cavidad sub-estomática. Esta relación se ha estudiado y permite una adaptación de las plantas al incremento en las temperaturas ambientales y de la hoja, reduciendo la pérdida de agua de la planta para que lleve a cabo su metabolismo (Tardieu et al., 2011, 283). El crecimiento mayor, la producción mayor de peso fresco y seco de las plantas en tratamientos de pre-acondicionamiento térmico durante la semilla, mostró un efecto positivo. Lo anterior se logró mediante diferentes estrategias fisiológicas presentadas por las plantas como respuesta a los tratamientos de la semilla. Las plantas obtenidas de semillas tratadas con temperaturas de 40oC y 60°C disminuyeron su conductividad estomática seguida de una disminución en la transpiración, lo cual se ha estudiado como una respuesta a altas temperaturas y déficit hídrico que se presentan tanto de forma diurna, como estacional o como un estrés abiótico en zonas áridas (Kirschbaum, 2004, 242; Ruelland y Zachowski, 2010, 225). La pérdida de agua disminuye con el cierre estomático, la planta conserva durante más tiempo el agua en su interior permitiendo llevar a cabo los procesos metabólicos, en algunos de los casos el costo de esta estrategia fisiológica es la disminución en la entrada de CO2 asociada a una tasa fotosintética baja (Yamori et al. 2012, 871; Kirschbaum, 2004, 242). A diferencia de lo anterior, en este estudio la tasa fotosintética se mantuvo en los tratamientos de 40o y 60°C pese al cierre estomático. Lo anterior se ha observado como una estrategia de adaptación haciendo más eficiente la respuesta de la planta en sus procesos metabólicos específicamente en los procesos de carboxilación, la regulación y niveles de la expresión enzimática (Sassenrathcole et al., 1994, 295). En plantas de semillas tratadas con 60°C y 90 min fue más evidente esta estrategia ya que las plantas procedentes de esta semilla, presentaron cierre estomático mayor conservando la tasa fotosintética. Otra de las estrategias fisiológicas observadas la presentaron plantas cuya semilla se pre-acondicionó con 50°C, a diferencia de los tratamientos mencionados arriba, donde la producción de biomasa vegetal mayor de sus órganos, principalmente el aumento de tallo y hojas con respecto al control parece asociarse a la concentración de Ci más que a la tasa fotosintética. Las plantas en estos tratamientos no presentaron diferencias en las variables fisiológicas con respecto al grupo control, excepto en la concentración de carbono sub-estomático. Similar a la eficiencia que se relaciona con la tasa fotosintética, una mayor concentración de Ci conlleva a una mayor concentración de la enzima ribulosa-1,5-bisfosfato carboxilasa-oxygenasa (RuBisCO) (la primera enzima dentro del ciclo Calvin), la cual incrementa la fijación del carbono inorgánico en orgánico dentro de los cloroplastos en el tejido del mesófilo de la hoja (Raines et al., 1999, 1; West et al., 2011, 311; Yu et al., 2014, 1). Consecuentemente la producción de biomasa fue mayor con respecto al grupo control. Por el contrario, la temperatura de 70°C a los 30 y 60 min de exposición, presentó una apertura mayor de estomas, ocasionando un efecto superior en la transpiración, tasa fotosintética y contenido de carbono sub-estomático. En principio, esto favoreció una producción mayor de biomasa foliar y de tallo a menor tiempo de exposición (30 y 60 min). Sin embargo, con un mayor tiempo de exposición (90 min) esta tendencia se revirtió. Los primeros efectos asociados al daño de las altas temperaturas observados en plantas es una disminución en el flujo de carbono en el estroma del cloroplasto y en la membrana del tilacoide (Wise et al., 2004, 717), así como la modificación del flujo a nivel molecular, que ocasiona un funcionamiento negativo de los compuestos involucrados en la fotosíntesis, tales como la inhibición de RuBisCO (Medlyn et al., 2002, 1167) o en la producción de enzimas clave para regular el sistema de la planta durante los cambios de temperatura ambiental (Berry y Bjorman, 1980, 491). Uno de los factores relevantes como parámetro de calidad y vigor en las plantas aromáticas es el color de las hojas (Gazula et al., 2005, 1731). En el caso de la albahaca, es determinante en su comercialización a nivel mundial, por lo que es importante que los tipos de pigmentos a y b que forman parte de la clorofila total de los vegetales que proporcionan las diferentes tonalidades de verdes, se encuentren estables para su óptimo funcionamiento. Aunque se observó una ligera tendencia a disminuir en el contenido de clorofila b en los diferentes gradientes de temperatura con respecto al control, respuesta contraria a lo que propone Erge et al. (2008, 225) quienes mencionan que la clorofila b es más estable al calor que la clorofila a. El presente estudio coincide con lo determinado por Gazula et al. (2005, 1731) que mencionan que la temperatura modula las concentraciones de estos dos tipos de pigmentos.
Conclusión
La exposición de las semillas a diferentes gradientes de temperatura, activó y estimuló los procesos metabólicos de la semilla, demostrando efectos contundentes en la etapa de germinación, emergencia y de desarrollo vegetativo temprano. Dicho efecto se vio reflejado en el incremento del porcentaje y tasa de emergencia, así como en el crecimiento y producción de biomasa de plántulas. Lo anterior asociado a diferentes estrategias fisiológicas que la planta utiliza como respuesta para propiciar una tolerancia mayor a factores estresantes. Dentro de los aspectos más relevantes para los productores en zonas áridas de estos cultivos de albahaca está la capacidad de adaptación de estos cultivos a las condiciones climáticas características de estas zonas. Los resultados de este estudio proporcionan información acerca de dicha capacidad de esta especie para adaptarse a estas condiciones respondiendo con diferentes estrategias fisiológicas como resultado a sus tratamientos previos de pre- acondicionamiento, finalmente expresados en una mayor producción de biomasa. Éste último parámetro como el más importante económicamente hablando para los productores de este cultivo.











 nueva página del texto (beta)
nueva página del texto (beta)


