Introducción
El cacao es un árbol tropical originario de América y se cultiva en los trópicos húmedos (Lanaud et al., 2009, 361). El fruto es la base para la elaboración del chocolate y sus derivados (Borrone et al., 2007, 236). La propagación del cacao se realiza generalmente por semillas, acodo e injertación (Minyaka et al., 2008, 853). En la actualidad, el desarrollo de un protocolo eficiente por embriogénesis somática (ES) para la propagación clonal de plantas de cacao sería de gran importancia. La ES es el desarrollo de procesos por el cual las células somáticas se reestructuran para generar células embriogénicas (Yang y Zhang, 2010, 36). Las células atraviesan por cambios morfológicos y bioquímicos que dan como resultado la formación de embriones somáticos (ESo) y regeneración de plantas (Komamine et al., 2005, 6).
Los ESo son parecidos a los embriones cigóticos y tienen los mismos estados del desarrollo, sin embargo los ESo no son producto de la fecundación sino de una respuesta de los tejidos de una planta a la inducción de la ES (Yang y Zhang, 2010, 36). Alternativamente, los ESo pueden ser utilizados como explantes para producir ESo adicionales a través de la embriogénesis somática secundaria (ESS) (Vasic et al., 2001, 121). La ESS puede ser repetida varias veces y contribuye a incrementar el rendimiento de la formación del ESo, especialmente en las plantas de baja capacidad embriogénica, por ejemplo, la estimación de la producción de ESo en Cocos nucifera L., se puede incrementar en 50 mil veces al utilizar como explantes ESo primarios que generaron callos embriogénicos y que a su vez producen ES secundarios en comparación con la embriogénesis somática primaria (Pérez-Núñez et al., 2006, 37). La ESS también ha sido reportado para ayudar a retener la competencia embriogénica durante prolongados tiempos de cultivo, de hasta 10 años (Martinelli et al., 2001, 279). Por otra parte, los embriones obtenidos a través de la ESS suelen ser más desarrollados que los obtenidos a través de la ES primaria (Pérez-Núñez et al., 2006, 37).
Diversos estudios para el desarrollo de protocolos para la propagación clonal de cacao han sido reportados desde las pasadas seis décadas, pero los resultados más relevantes se han obtenido a través de la ES utilizando diversas fuentes de explante como embriones cigóticos, estaminoides y pétalos, pero aun con baja eficiencia (López-Báez et al., 1993.; Alemanno et al., 1996, Li et al., 1998). A principios de 1990, fue reportada la embriogénesis somática a partir de tejido asexual (de estructuras florales) y la conversión de embriones somáticos a plantas (Lopez-Báez et al., 1993; Sôndahl et al., 1993).
La ES podría representar un método alternativo para la producción de clones de cacao y su inducción es obtenida de tejidos iniciales, principalmente de pétalos y estaminoides. Estos explantes son los que mayor importancia tienen en la actualidad para la propagación in vitro del cultivo. Actualmente no se cuenta con un protocolo eficiente para la propagación de cacao por ES, sin embargo, su desarrollo permitirá una rápida multiplicación vegetativa de los genotipos de élite (Minyaka et al., 2004, 853). Los resultados indican que muchos genotipos de cacao son recalcitrantes (Minyaka et al., 2008, 306), mientras que la respuesta a la ES se ve afectado por los genotipos y el medio de cultivo (Tan y Furtek, 2003, 407).
La ES es utilizada para una rápida propagación de plantas, sin embargo, es necesario conocer los aspectos de diferenciación celular y la histogénesis para poder entender mejor la morfogénesis (Yeung, 1999, 137). Los estudios histológicos han auxiliado para mejorar parámetros prácticos como la eficiencia (Saénz et al., 2006, 19). La histogénesis facilita la descripción de procesos que conducen a un tejido a readquirir sus potencialidades embriogénicas y esto puede ser determinado para diferentes tejidos y especies de plantas (González et al., 2005, 37). Por ejemplo, en Hevea brasiliensis el tiempo adecuado para el subcultivo fue determinado por procedimientos histológicos (Michaux-Ferriere y Philippe-Carron, 1989, 243). En palma de aceite la formación de ESo a partir de células perivasculares de la hoja ha sido bien documentada (Schwendiman et al., 1988, 43). Asi mismo, en palma de coco se han descrito los cambios morfológicos e histológicos de la ES originada a partir de plúmula (Sáenz et al., 2006, 19). Pinto et al. (2010, 763) analizaron muestras histológicas de Eucalyptus globulus procedentes de embriones cigóticos, de embriones somáticos tipo globular y cotiledonar para determinar la acumulación de reservas y su relación con su conversión a plantas.
Para el caso del cacao (Theobroma cacao L.) Alemanno et al. (1996, 187) realizaron una comparación entre embriones cigóticos de cacao y ESo procedentes de botones florales, ellos encontraron que los ESo carecen de almidón y proteínas de reservas en comparación a los embriones cigóticos. Posteriormente Máximova et al. (2002, 252) reportaron cambios morfológicos que ocurren durante la ES primaria y secundaria. Los embriones primarios se presentaron en racimos de células que forman nódulos embrionarios, mientras que los embriones secundarios se formaron de la división de una célula, similar a la embriogénesis cigótica. En cuanto a información sobre la conversión y aclimatación de plantas de cacao, estos son escasos, recientemente Urrea et al. (2011, 39) reportan la regeneración del genotipo de cacao Biob, obtuvieron la conversión a plántula en 68% y 66% de plantas aclimatadas, sin embargo, no menciona el tiempo requerido ni el número de de plantas regeneradas en relación a los explantes iniciales.
En los estudios realizados en ESS a partir de explantes de fragmentos de cotiledones, está se ha generado a partir de la inclusión de fitohormonas al medio de cultivo, por lo que en este trabajo el objetivo fue evaluar la respuesta de los cotiledones en presencia de fitohormonas y sin estas con el genotipo inifap 1, asi como describir los eventos de la embriogénesis somática secundaria que se presentaron desde los 30 días hasta los 240 de cultivo.
Método
Material vegetativo e inducción de la embriogénesis somática primaria
Fueron colectados botones florales del genotipo inifap1 del banco de germoplasma del inifap en Huimanguillo, Tabasco y trasladados al laboratorio. Estos, fueron desinfectados, con hipoclorito de sodio al 1% por 20 minutos. Adicionalmente, se realizaron tres lavados con agua destilada estéril y al final fueron cultivadas las bases de los pétalos en cajas petri para inducir la ES primaria. El medio de cultivo utilizado fue el PCG (Primary Callus Growth) de acuerdo a Driver y Kuniyuki (1984, 507) suplementado con 5 µgL-1 de thidiazuron (TDZ) y de 2 mgL-1 del ácido 2,4-diclorofenoxiácetico (2,4-D). Los cultivos se mantuvieron en oscuridad por 14 días a una temperatura de 25±1° C. Después de esta etapa de cultivo, los explantes fueron transferidos a un medio para crecimiento de callos secundarios (SCG), posteriormente continuaron con la formación de callo embriogénico (medio para el desarrollo de embriones [ED4]) (Li et al. 1998, 293), desarrollo de embriones somáticos primarios (medio EDL) y de regeneración de plantas (medio PR) (Li et al. 1998, 293). Los cultivos se mantuvieron en obscuridad y a una temperatura de 26±1°C, renovando el medio cada 14 días. En la Fig. 1 se describen los diferentes medios de cultivo para la formación de la embriogénesis somática primaria y secundaria.
Establecimiento de experimento
Los ESo primarios en condiciones in vitro formaron cotiledones y a partir de estos, fueron utilizados fragmentos de cotiledones de 5 mm2 aproximadamente, procedentes del híbrido inifap 1 generados después de cuatro meses de cultivo. Los fragmentos se cultivaron en un medio básico denominado medio de regeneración de plantas (PR, Fig. 1), de acuerdo a Li et al., 1998, 293). Este medio de cultivo fue suplementado con 30 gL-1 de sacarosa, glucosa 5 gL-1, 0.2 gL-1 de nitrato de potasio y 3 gL-1 de Gelrite. Los cultivos procedentes de fragmentos de cotiledón incluyendo fitohormonas, fueron cultivados durante dos semanas en un medio básico PR, después cambiados a medio PR sin fitohormonas. Se establecieron cuatro tratamientos, los cuales se presentan en el Cuadro 1.
Cuadro 1 Tatamientos realizados con fragmentos de cotiledón procedentes de embriones somáticos primarios generados a partir de petalos florales.

Estos tratamientos fueron establecidos en un diseño completamente al azar con 20 repeticiones y cada uno establecido en frascos tipo Gerber con cinco fragmentos de cotiledón. Las variables a medir fueron: a) Número de embriones somáticos formados y b) Porcentaje de oxidación. Los resultados se examinaron por medio de un análisis de varianza y prueba de comparación de medias de Tukey (0.05). Solamente se analizaron los valores máximos entre tratamientos durante el periodo de cultivo.
Descripción del proceso histológico
El proceso histológico realizado, fue de acuerdo a Buffard-Morel et al. (1992, 735). Para llevar a cabo los cortes histológicos (de 3 micras) se utilizaron muestras con fragmentos de cotiledón cultivados a los 30, 60, 90, 120, 150, 180, 200, 210 y 240 días, procedentes de un medio de cultivo sin fitohormonas. Se utilizaron 10 fragmentos de cotiledón para cada periodo, haciendo un total de 90 muestras procesadas. Las secciones fueron observadas y fotografiadas en un microscopio Carl Zeiss (Alemania) con cámara digital acoplada.
Resultados y discusión
Número de embriones somáticos secundarios
El mayor número de embriones somáticos generados fue alcanzado a los 210 días en el tratamiento testigo formado por el medio de cultivo desprovisto de fitohormonas, esté fue superior estadísticamente con seis ESs al tratamiento con fitohormonas (2,4-D y thidiazuron) el cual solamente presentó dos ESs a los 120 días (Fig. 2).
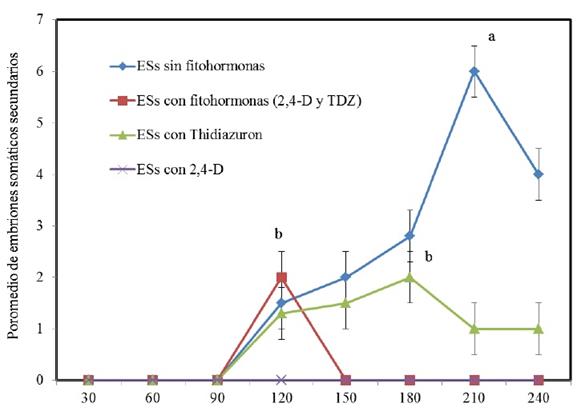
Figura 2 Número promedio de embriones somáticos secundarios que se observaron desde los 30 días hasta los 240 días en fragmentos de cotiledón (n=20 dónde cada repetición se formó con 5 fragmentos de cotiledón). Los valores con la misma letra son iguales estadísticamente (Tukey 0.05).
Para el tratamiento con Thidiazuron, el promedio de ESs fue de uno, mientras que con 2,4-D la formación de ESs fue nula. Las auxinas, son conocidas en mediar la transición de las células somáticas a embriogénicas, estas son los principales agentes para inducir la ES (Jiménez, 2001, 196). En cacao, se ha reportado la ESS pero con inclusión de fitohormonas (2,4-D y kinetina) en un medio SCG (Young, et al., 2003, 1) durante lapsos cortos de dos semanas. Por otra parte, Solano (2008, 1) reportó la ESS en un medio M21 con la fitohormona 2,4,5- triclorofenoxiacético (2,4,5-T) con cambios a medio fresco cada 30 días hasta la aparición de los embriones somáticos secundarios. En los resultados que se obtuvieron, la ESS fue generada en un medio PR sin fitohormonas. Es conocido que el proceso de la embriogénesis somática se inicia en un medio con altos niveles de auxina, especialmente el 2,4-D, pero los embriones no desarrollan hasta que la concentración de auxinas se reduce (George, 1993, 3). En cereales y palmas se utilizan niveles altos del 2,4-D en el crecimiento de callos (Krikorian, 1995, 774). En el caso de cacao, al cultivar los fragmentos de cotiledón en un medio de cultivo desprovisto de fitohormonas favoreció la formación de ESS. Las células que forman el tejido del cotiledón de un ESo primario son competentes porque continuarón formando ESS. Las células que representan un estado intermedio entre células somáticas y embriogénicas son llamado competente y la competencia celular se asocia con la desdiferenciación de las células somáticas que les permite responder a las nuevas señales de desarrollo (Fehér, 2005, 85). Estas señales son traducidas en una diferenciación del tejido que conduce a la formación de un ESs de cacao.
Porcentaje de oxidación. La oxidación en el tejido afectó a los ESo. En el tratamiento testigo sin fitohormonas fue del 15% a los 210 días de cultivo y de 20% a los 240 días, mientras que con fitohormonas fue del 100% en ambos periodos de cultivo. Con TDZ, el porcentaje fue del 80% al final del experimento, mientras que con 2,4-D, fue del 100% desde los 180 días de cultivo. El obscurecimiento de los tejidos cultivados in vitro se define como la oxidación por radicales libres, de diferentes componentes celulares, así como la oxidación de compuestos fenólicos catalizados por la enzima polifenol oxidasa que produce quinonas, las cuales generan daño y muerte celular (Bray et al., 2000, 1158). En este trabajo, el tratamiento a base de fitohormonas, los explantes se oxidarón al 100% a los 210 días, al respecto se ha reportado que cuando se cultivan cotiledones inmaduros de Arachis hypogaea, en presencia del 2,4-D, los explantes se oxidan (Baker y Wetzstein, 1994, 361).
Iniciación de la formación de embriones somáticos secundarios. De acuerdo a Minyaka et al., (2008, 853), la ES primaria en cacao comprende tres etapas principales: inducción de callo primario, inducción de callo secundario y desarrollo de embriones somáticos. Sin embargo, la embriogénesis somática secundaria ha sido poco estudiada. En este estudio, se encontró a los 30 días el inicio del proceso de ESS (Fig. 3).
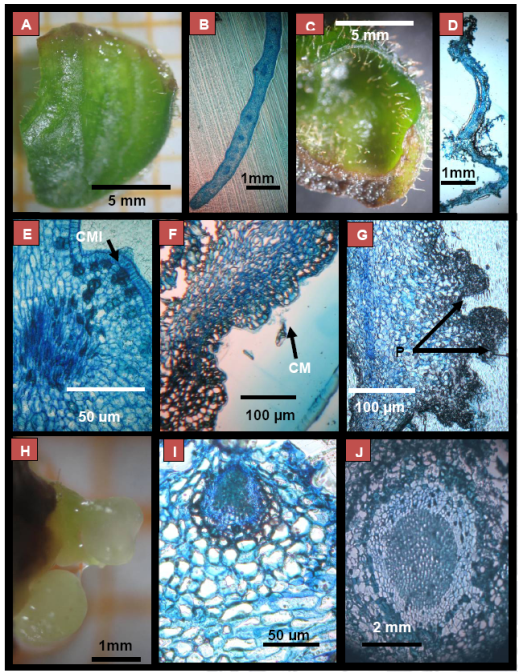
Figura 3 Fragmento de Cotiledón (A); Corte transversal de cotiledón cuando se inició el cultivo (B), Fragmento de cotiledón después de un mes (C), corte transversal de cotiledón después de un mes e inicio de la ES (D) formación de centros meristemáticos iniciales (CMI [E]). Centros meristemáticos definidos en la periferia del cotiledón (F). Estructuras nodulares que formaron los proembriones (G). Primeros ESs (H) ESo globular definido (I y J).
Observaciones similares han sido realizados en Solanum tuberosum L., el cual menciona que la formación de ESo globulares ocurre de divisiones anticlinales (Sharma y Millam, 2004, 115). Los fragmentos de cotiledón cultivados in vitro sufrieron cambios en su superficie, engrosando su estructura. A partir de este momento la ESS se inicia con divisiones periclinales en la periferia del cotiledón.
Estas divisiones anticlinales y periclinales dán origen a grupos de células embriogénicas (centros meristemáticos iniciales). Estos centros meristemáticos iniciales (CMI) pueden ser observados a los 60 días (Fig. 3E y F).
En el caso de cocotero y palma durazno durante la ES, se ha reportado la formación de nódulos o centros meristemáticos que están dispuestos en la forma de anillos concéntricos con células meristematicas (Sáenz et al., 2006, 19; Simone de Alencar et al ., 2010, 263).
Formación de embriones somáticos secundarios
De los CMI se forman los proembriones a los 90 días aproximadamente (Fig. 3G). Estos destacan de la periferia del cotiledón. No se observaron embriones somáticos secundarios en 30-90 días de cultivo, posteriormente se observaron estructuras nodulares que dan origen a los embriones globulares en un periodo aproximado de 120 días (Fig. 3 H), los cuales muestran una estructura interna bien definida y delimitada con el resto de tejido del cotiledón sin observarse suspensor (Fig. 3 I y J). Al respecto es indicado que el suspensor como estructuras ha sido poco reportada (Quiroz-Figueroa et al., 2002, 1141). Estos embriones en su fase inicial se muestran esféricos y conforme desarrollan adquieren una forma elíptica, similares a lo reportado en Cleome rosea Vahl (Simões et al., 2010, 679). Las formas elípticas de los embriones somáticos han sido reconocidos como una etapa de transición entre la forma corazón y torpedo (Simões et al., 2010, 679).
Estos embriones somáticos globulares se muestran de color blanco translúcido y en el corte transversal es posible observar sus haces vasculares y protoderma, sin observarse aún el meristemo apical (Fig. 4A). Los embriones globulares presentaron un protoderma formado por células que se dividen en el plano anticlinal.
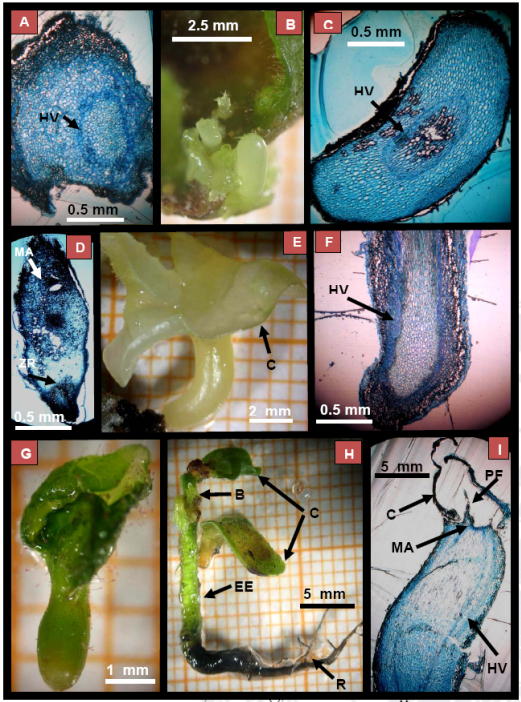
Figura 4 ESo globulares (A). En B se muestran Grupos de ESo bien definidos con haces vasculares (C), Zona de la raíz (ZR) y meristemo apical (MA) en D. (E) ESo con cotiledones (C) y sus haces vasculares se apreciaron bien conformados (HV). ESo verde (G) Planta completa (H), con sus cotiledones, (C) ápice (B) y sistema radicular (R). En el corte longitudinal (I) se muestran sus cotiledones (C) meristemo apical (MA), primordios foliares (PF) y haces vasculares (HV).
Esta observación ha sido reportada en Solanum tuberosum, donde el protoderma es considerado como una de las únicas características del desarrollo de los embriones somáticos y que regula los procesos embriogénicos (Sharma y Millam 2004, 115). La formación de ESo globulares de cacao es de cuatro meses y no se observó el suspensor. En el caso de café, los embriones en la etapa globular fueron observados 7-9 días después de la transferencia a medio de cultivo con 2,4-D en concentración reducida y algunos de ellos presentarón una proliferación de células cerca del tejido de callo, parecida a un suspensor (Quiroz-Figueroa et al., 2002, 1141).
Hasta los 150 días se observó un promedio de 2 embriones somáticos por fragmento de cotiledón (Fig. 4) y se identificaron embriones que presentaron cotiledones con haces vasculares bien definidos (Figura 4 D y E), zona de la raíz (ZR) y meristemo apical (MA). Estos resultados coinciden a lo indicado en palma durazno (Simone de Alencar et al., 2010), pero no mencionan el tiempo de cultivo hasta la formación de ESo. Durante este periodo, la formación de embriones somáticos son generados sin presentar sincronización, mostrando diferentes estados del desarrollo, desde globular, torpedo y cotiledonar (Figura 4 C).
A los 180 días (8F) se observaron ES con cotiledones (C) y sus haces vasculares se apreciaron bien conformados (HV). La formación de ESo se incrementó a un promedio de 2.8 ES por fragmento de cotiledón. Los embriones somáticos en condiciones de luminosidad adquieren su color verde a los 210 días de cultivo (Fig. 4H) y se cuantificaron seis ES en promedio por fragmento de cotiledón y a los 240 días se desarrolló una planta completa (Figura 4I), con sus cotiledones (C) brote (B) y sistema radicular (R). En el corte longitudinal se muestran sus cotiledones (C) meristemo apical (MA), primordios foliares (PF) y haces vasculares (HV). En este periodo de cultivo se observó una disminución del promedio de ESo de cacao (cuatro ES/fragmento de cotiledón) ocasionado por un proceso de desdiferenciación que conduce a la formación de callo, este proceso ha sido reportado en forma similar en cocotero (Azpeitia et al., 2003, 309).
Después de 240 días de cultivo, se observaron ESo bien definidos con estructuras externas como cotiledones, brote y raíces. En cacao, la ES primaria ocurre de forma indirecta pasando por la formación previa de callo, callo embriogénico y formación de ESo. Sin embargo, la ESS a partir de cotiledones procedentes de embriones somáticos primarios fuerón generados de forma directa. En este caso fue posible evidenciar la formación de células embriogénicas agrupadas en centros embriogénicos en medio libre de fitohormonas, muy parecidos a los observados en cocotero (Sáenz et al., 2006, 19) y que posteriormente estos centros meristemáticos se replicaron y proliferaron de forma lenta e indiferenciada. Después, se produjeron divisiones celulares rápidas y sucesivas en distintas zonas del centro meristemático y se conformaron embriones globulares, que al crecer pasan por los estados de corazón y torpedo y tras una fase de maduración y germinación dan origen a plantas completas, resultados similares han sido reportados por Ammirato, (1983, 82).
Se ha reportado previamente la ESS, sin embargo, ha sido inducida por inclusión de fitohormonas al medio (Li, et al., 1998, 293; Máximova et al., 2002, 252). Los resultados mostraron que la exclusión del 2,4-D y el thidiazuron no son importantes para inducir la ESS. El mayor número de ESs se encontró en un medio desprovisto de fitohormonas por lo que esta información es relevante, debido a que los explantes de cotiledones procedentes de ES primarios, generan mayor número de embriones somáticos en esta especie.
Los resultados aquí mostrados, han sido repetidos en cuatro ciclos de ESS iniciando con fragmentos de cotiledon de ESo primario, de donde se han obtenido resultados similares a los reportados en este trabajo con el genotipo inifap 1. Actualmente en el laboratorio, los ESS obtenidos en medio semisólido han sido uilizando para el desarrollo de un sistema de multiplicación de ESS de cacao por inmersión temporal en medio líquido desprovisto de fitohormonas, con resultados alentadores (datos inéditos).
Conclusiones
El mayor número de embriones somáticos fue alcanzado a los 210 días en el tratamiento testigo formado por el medio de cultivo desprovisto de fitohormonas. El tratamiento con fitohormonas (2,4-D y TDZ) solamente presentó dos ESs a los 120 días, mientras que con TDZ mostró un máximo de 2 ESo a los 180 días y con 2,4-D, la formación de ESs fue inhibida. La oxidación en el tratamiento testigo sin fitohormonas fue del 20% a los 240 días, mientras que el tratamiento con fitohormonas fue del 100% en ambos periodos de cultivo.
El proceso de embriogénesis somática secundaria se inició a los 30 días. A los 60 días se observaron CMI. De estos CMI se formaron los proembriones a los 90 días aproximadamente en la periferia del cotiledón. A los 120 días se observaron estructuras nodulares que dan origen a los embriones globulares. Estos embriones somáticos globulares se muestran de color blanco translúcido y en el corte transversal fue posible observar haces vasculares y protoderma, sin la presencia del meristemo apical. Hasta los 150 días se identificaron haces vasculares bien definidos, zona de la raíz y meristemo apical. A los 180 días se observó ES con cotiledones y con haces vasculares bien conformados. Los Eso en condiciones de luminosidad adquieren su color verde a los 210 días de cultivo. Durante este periodo se cuantificaron seis ES por fragmento de cotiledón y a los 240 días se desarrolló una planta completa.
Los resultados mostraron que la exclusión del 2,4-D y el thidiazuron no son importantes para inducir la ESS. El mayor número de ESs se encontró en un medio desprovisto de fitohormonas por lo que esta información es relevante, debido a que los explantes de cotiledones procedentes de embriones somáticos primarios, generan mayor número de embriones somáticos secundarios en esta especie.











 text new page (beta)
text new page (beta)



