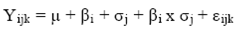Introducción
Las paredes celulares de las plantas están formadas por un complejo de polisacáridos y compuestos fenólicos (CF) (Jung et al., 1991). Principalmente la lignina y su asociación con los carbohidratos limitan el acceso de las enzimas degradantes de polisacáridos (EDP) y en consecuencia obstaculizan la hidrólisis enzimática de la celulosa y la hemicelulosa en las paredes celulares de la planta (Cheng et al., 2009). La EDP tales como celulasas, beta-glucanasa y xilanasas se han utilizado como aditivos en las dietas de los rumiantes con el objetivo de mejorar la digestibilidad, pero los resultados han sido muy variables (Beauchemin et al. 2004; Mendoza et al. 2014). Wang et al. (2004) mencionan a la esterasa como una de las EDP con mejor eficiencia en la digestión microbiana y la degradación de las paredes celulares.
Los hongos del rumen ocupan del 8 al 20% de la biomasa microbiana en dietas con forraje (Rezaeian et al., 2004). Específicamente Anaeromyces, Orpinomyces, Caecomyces, Piromyces, y Neocallimastix spp. tienen actividades enzimaticas hidrolíticas en la degradación de la fibra (Nagpal et al., 2011). Qi et al. (2011) han identificado una esterasa ferúlica (Fae1A del hongo rumen Anaeromyces mucronatus) que desdobla ácido ferúlico (AF) y el ácido p-cumárico (APC), en dietas experimentales con paja de cebada. El AF está ligado a diversos polisacáridos y lignina, por enlaces éster, unidos a arabinoxilano; éste complejo ejerce un efecto negativo sobre el grado de digestión de la celulosa (McAllister y Wang, 2002). El objetivo de esta investigación fue evaluar el efecto de una nueva enzima esterasa de AF (Fae1A) sobre la hidrólisis en heno de alfalfa y paja de trigo.
Material y Métodos
Producción de la enzima
Se utilizó una cepa Fae1A esterasa, proporcionada por el Laboratorio de Ciencia Animal del Centro de Investigación Lethbridge, Alberta Canadá. Dicha cepa proviene del aislamiento del hongo A. mucronatus, clonada y hetero-expresada en una cepa de E. coli (BL21-DE3). Los detalles del aislamiento, caracterización y clonación están descritos en un trabajo previo publicado por Qi et al (2011).
El estudio se realizó en el centro de investigación canadiense ya citado. Como rutina del presente trabajo experimental, la cepa de E. coli BL21-DE3 se cultivó en 1L de caldo de Luria-Bertani más 100 g/mL de kanamicina incubada a 37ºC a una densidad óptica de 600 nm, en aproximadamente 3 h. Se agregó isopropil-beta-D-tiogalactopiranósido, hasta alcanzar una concentración final de 1 mM. Posteriormente la temperatura de incubación se descendió a 22 °C durante 15 h, y las células se obtuvieron por centrifugación a 5000 G por 15 min. Los sedimentos celulares se re-suspendieron en 25 mL de solución buffer con 20 mM de fosfato de sodio (pH 8,0) que contenía 10 mM de imidazol, 300 mM de NaCl y un inhibidor de proteasa libre de etil-diaminotetraácetico. Las células se lisaron en un proceso de 3 pases con una prensa de origen francesa (SLM Instruments Inc, Urbana, IL) a una presión de 105 kPa. Los restos celulares, incluyendo cuerpos de inclusión, se eliminaron por centrifugación (15.000 x g, 30 min, 4 ° C). El sobrenadante del extracto celular se colocó en una columna de níquel NTA (Qiagen), lavándose dos veces con un buffer, preparado con 20 mM de imidazol, 20 mM fosfato de sodio, y 300 mM de NaCl. Ésta solución fue regulada a un pH de 8.0 en el medio de cultivo para E. coli, con el propósito de obtener aproximadamente la cantidad de 450 mg de la enzima Fae1A esterasa.
Identificación de la enzima
La proteína de la esterasa Fae1A se identificó en 10% de sulfato de sodio dodecil por electroforesis en un gel de poliacrilamida, técnica descrita por Laemmli (1970). La concentración de proteína, en el buffer con la enzima Fae1A, se determinó por el método de Bradford (Bio-Rad(r) Lab. Inc.), utilizando albúmina de suero bovino como estándar para la calibración. La enzima Fae1A con valor promedio 9.0 mg/mL de proteína se almacenó a -20 ºC antes de ser utilizada.
Degradación ruminal In vitro
Se prepararon 6 tratamientos, cada uno con 15 repeticiones. Estos fueron: 1) heno de alfalfa (HA), 2) HA + 1 mL de la enzima Fae1A (9 mg proteína/mL) (HAE1), 3) HA + 2 mL de la enzima Fae1A (18 mg proteína/2 mL) (HAE2), 4) paja de trigo (PT), 5) PT + 1 mL de la enzima Fae1A (9 mg proteína/mL) (PTE1), 6) PT + 2 mL de la enzima Fae1A (18 mg proteína/2 mL) (PTE2).
En el procedimiento se pesaron 100 mg de cada sustrato de HA y PT. Posteriormente a cada tubo de 20 mL con tapón de baquelita (Kimax(r)), se le agregó 2mL de líquido ruminal liofilizado, 5 mL (0.1M) de acético buffer (pH 4.5) con 0.01% (p/v) de sodio azida, como agente antimicrobiano y 1 o 2 mL de la enzima Fae1A según el tratamiento. A los tratamientos testigo y con un mL de la enzima se les agregó agua deionizada estéril para aforar a 9 mL. Se agregaron 10 tubos más, solo con líquido ruminal y el buffer como referencia de corrección en las variables de respuesta de los tratamientos.
El líquido ruminal se obtuvo de 2 novillos alimentados con una dieta ensilaje y grano de cebada, directamente de la cánula ruminal, éste se filtró en 4 capas de gasa y se centrifugó (1000 xg, 4 ° C, 10 min) para eliminar las partículas de alimento. El sobrenadante se sonificó con tres pulsos de 30 y15 s, separados por intervalos, en un procesador de Vibra-Cell (Sonic & Materials, Inc. Newtown, CT USA).
Los tubos con las muestras se mezclaron, se taparon y se incubaron a 39 °C colocados sobre una plancha con agitación. Posteriormente alícuotas de 500 µL de la fracción líquida, se tomaron a las 4, 8, 12 y 24 h de incubación, e inmediatamente se hirvieron durante 10 min para desactivar las enzimas.
Determinación de reducción de azúcares y compuestos fenólicos
Las alícuotas se analizaron con la técnica de reducción de azúcares (RA) usando el método descrito por Wang et al. (2004). Posterior a 24 h de la incubación, las mezclas se centrifugaron a 5,000 x G por 20 min, y los sedimentos se secaron por liofilización durante 48 h para determinar la degradación de la materia seca (DMS) y CF. Los CF totales de la materia seca residual se expresó como equivalentes de AF, determinado por el método descrito por Lau y Van Soest (1981) y modificado por Wang et al (2004). El AF, APC y ácido sinapínico (AS) se calcularon con estándares de cada ácido fenólico y se expresaron en g/mg de MS residual; éstos se determinaron con un equipo HPLC de fase inversa utilizando una columna C18 HPLC-Ascentis (250 x 4,6 mm) (Sigma-Aldrich). Diez microlitros de muestra se inyectaron, utilizando un gradiente de acetonitrilo (20 a 50%) en una solución de ácido acético al 2%.
Análisis y modelo estadístico
El experimento se diseñó con un arreglo en bloques al azar, con el fin de identificar el sustrato y 3 niveles de proteína proporcionados por la enzima (0, 9 y 18). Se utilizó el procedimiento Mixed de SAS Institute (2007) con el siguiente modelo:
Donde Yijk es el valor de cada observación individual para la variable dependiente, μ la media general, βi e tipo de sustrato i (i = 1, 2), + бj el efecto del nivel de proteína en j enzima (= 0, 1, 2), βi x бj la interacción i sustrato y la j nivel de proteína en la enzima xj y εijk el error residual. Las medias de los tratamientos se compararon en cada punto de tiempo de incubación. Las diferencias significativas entre los tratamientos se calcularon con el procedimiento LSMEANS con la opción PDIFF.
Resultados y Discusión
Purificación de la esterasa recombinante Fae1A de E. Coli
La esterasa se purificó con un peso molecular aproximado de 40 kDa. Se determinó con SDS-PAGE a través de una banda principal que correspondió al tamaño esperado Fig. 1.

Fig. 1 SDS-PAGE: Análisis del sobrenadante de E coli BL21 (DE3) conteniendo células lisadas y purificadas. Línea M, estándar de proteína molecular como marcador, indicado a la derecha. Línea 1, indica la proteína BL21.
Otras esterasas de AF se han reportado con diferentes pesos moleculares, por ejemplo, la expresión de proteínas en E. coli Xyn10D-Fae1A (identificado en Prevotella ruminocola) fue de aproximadamente 124 kDa y el peso molecular de un monómero de Su-Xyn10D-Fae1A fue ~ 84 kDa (Dodd et al., 2009). Las enzimas feruloyl esterasas aisladas y purificadas de Neocallimastix MC-2 tienen pesos moleculares de 69 y 24 kDa para FAE-I y FAE-II respectivamente (Borneman et al., 1992).
Degradación de Materia Seca y reducción de azucares
El heno de alfalfa y la paja de trigo, inoculadas con los dos niveles de proteína contenidos en la enzima, mostraron diferencias significativas en la DMS y RA, durante los diferentes tiempos de incubación. Tabla 1.
Tabla 1 Efecto de la esterasa ácido ferúlico (Fae1A) en heno de alfalfa y paja de trigo en la desaparición de materia seca (DMS) y reducción de azucares (RA)

La DMS en el tratamiento con HA mejoró en un 4 y 3% con la adición de 9 y 18 mg de proteína contenida en la enzima Fae-1A (P<0.05), en el caso de la PT la adición de ambas cantidades de enzima no tuvo efecto sobre la DMS (P>0.05). Los valores de RA en el HA entre los tiempos de incubación de 4 y 12h incrementaron en un 29% con la adición de ambos niveles de enzima (P<0.05). No hubo diferencias a las 24h de incubación, incluso el tratamiento con HA sin enzima presentó mayor contenido de RA, esta respuesta fue a la rápida acción que actuó la enzima, mientras que en el testigo tuvo un efecto más retardado debido a la acción de los microorganismos ruminales viables hasta este tiempo y a la presencia del sustrato. En la PT la respuesta a la RA fue diferente, los dos niveles de enzima utilizados no mejoraron la reducción de azucares en los 3 tiempos de estudio, e incluso hubo una interacción significativa entre el sustrato y las concentraciones de RA (P<0.05). Esta respuesta se asocia a las diferencias de la estructura en la pared celular de ambos sustratos, la PT contiene más pared celular que el HA, resultando una mejor degradación en el sustrato de alfalfa que de trigo. Específicamente, la PT contiene más celulosa y la hemicelulosa (xilano principalmente) junto con compuestos aromáticos incluyendo la lignina. El xilano es una cadena lineal de (1-4), combinado con residuos de β-D-xilopiranosilo, que puede ser altamente sustituido por varios grupos, incluyendo uronyl, arabisosyl, y O-acetilo. La biodegradación de xilano esterasas actúa conjuntamente con la xilanasa para liberar los grupos sustituidos en la cadena de xilano (Borneman et al 1991).
Perfiles de compuestos fenólicos
El contenido de los ácidos fenólicos totales en alfalfa y paja de trigo se presenta en la Tabla 2. Los perfiles fenólicos difirieron significativamente entre los sustratos; el heno de alfalfa liberó más CF totales que la paja del trigo. Específicamente los CF totales e individuales en alfalfa se incrementaron de acuerdo con el nivel de la enzima adicionado (P <0,01). Todos los ácidos fenólicos aumentaron (P <0.05) proporcionalmente con el nivel de la enzima añadida. Pero por limitación en la purificación de la enzima, sólo se utilizó dos niveles de enzima y no se pudo calcular el porcentaje máximo de liberación de los compuestos fenólicos individuales.
Tabla 2 Efecto de la enzima ácido ferúlico esterasa (Fae1A) en heno de alfalfa y paja de trigo sobre la secreción de compuestos fenólicos en la materia seca residual
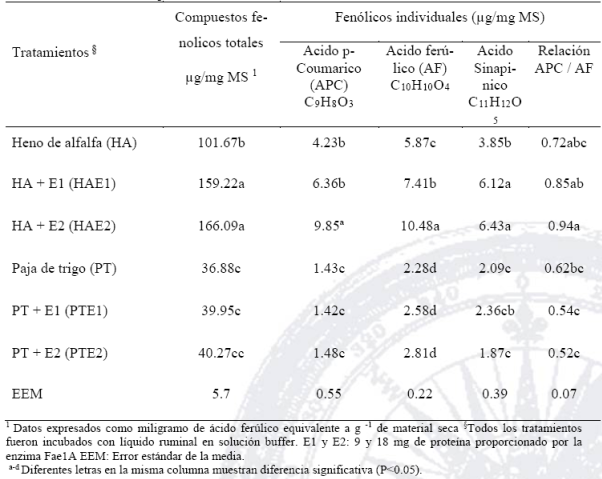
En general, las paredes celulares de forraje se caracterizan por la presencia de una gran cantidad de ferulatos esterificados y los componentes aromáticos de la pared celular (Koike y Kobayashi, 2009). Estos son ácidos fenólicos unidos, con pequeñas cantidades de lignina y uniones de aldehídos fenólicos (Rabinovich et al., 2002). Como sucedió en la RA, la cantidad menor de CF en la PT, comparado con el HA se debió a las diferencias en las estructuras de la pared celular, en consecuencia se reduce la accesibilidad de los polisacáridos (hemicelulosa y celulosa) y se limita la acción enzimática, debido a la heterogeneidad y complejidad de xilanos (Dodd et al., 2009). La hidrólisis enzimática requiere de la acción combinada de varios glucósido-hidrolasas, tales como β-1,4 endoxilanasas, arabinofuranosidasas, glucuronidasas, β-1,4 xilosidasas y esterasas carbohidratos (Shallom y Shoham, 2003).
La extracción de los CF mediante el tratamiento enzimático, demostró que el AF, APC y AS integran la pared celular y existe una correlación entre la cantidad de compuestos fenólicos liberados y biodegradabilidad de la pared (Akin et al., 1992). Específicamente, el AF se liberó de sus ésteres metílicos y las paredes de las células, en cantidades mayores para el APC; éste ácido se asocia principalmente con la lignina, mientras que AF está ligado a componentes de la pared celular (Akin y Rigsby, 2008). En la PT, el AF incrementó el doble en comparación con el APC. Sin embargo, la mayor cantidad de AF se presentó en ambos sustratos y se asoció con la mayor dosis de la enzima. En las paredes celulares, la diferencia puede ser debido al modo de unión del AF, puede ser más accesible a una acción enzimática (Buanafina et al., 2006). Otro reporte menciona que la esterasa libera con facilidad el AF en la fibra de salvado de trigo, cultivado en Streptomyces olivochomogenes (Mackenzie et al. 1987), lo que indica que estas enzimas pueden tener mayor especificidad con xilo-oligómeros.
Conclusión
En conclusión, los resultados indican que las condiciones óptimas de tratamiento difieren entre el HA y la PT. La adición de la enzima Fae1A tuvo mejor resultado en el HA que en la PT. Sin embargo la esterasa Fae1A tuvo una actividad importante en la degradación de la pared celular de los forrajes estudiados.











 nueva página del texto (beta)
nueva página del texto (beta)