Introducción
La importancia de los sitios arqueológicos se asocia con el tipo de información histórica y científica que puede obtenerse de los mismos (Kaneko 2011). Además, han sido decretados como zonas sujetas a protección, lo que permite que constituyan un hábitat para muchas especies de plantas y animales (Patten et al. 2011, Estrella et al. 2014). En México muchos sitios arqueológicos se ubican dentro de polígonos en los que se preserva el entorno natural (López-Vila et al. 2018). Sin embargo, estos sitios han sido poco explorados respecto a su valor para el mantenimiento y conservación de la biodiversidad (Avila-Torresagatón et al. 2012, Estrella et al. 2014).
En Chiapas, las zonas arqueológicas que cuentan con estudios biológicos son principalmente aquellas que están inmersas dentro de Áreas Naturales Protegidas administradas por la Comisión Nacional de Áreas Naturales Protegidas (CONANP 2010a, CONANP 2010b, Patten et al. 2011). En estos casos, la información biológica generada ha permitido no sólo la gestión y manejo de la riqueza arqueológica, sino también la conservación de su biodiversidad. No obstante, no todas las zonas arqueológicas de la entidad cuentan con un plan de manejo que involucre su diversidad biológica, tal es el caso del sitio arqueológico Iglesia Vieja, el cual es uno de los pocos y más importantes indicios de la cultura Mixe-Zoque en la costa de Chiapas (Kaneko 2011). Esta zona destaca como un área ecológica importante al estar ubicada entre la región fisiográfica de la Planicie Costera del Pacífico y las estribaciones de la Sierra Madre de Chiapas (Kaneko 2006). Esta última región fue considerada como una de las regiones fisiográficas con mayor riqueza de especies de aves en México (Rangel-Salazar et al. 2013).
Las aves representan un grupo diverso y ecológicamente clave en la dinámica y funcionalidad de los ecosistemas naturales, y son organismos potencialmente bioindicadores para detectar señales de cambios en el ambiente, tanto naturales como antropogénicas (Berlanga 2001, Feria-Arroyo et al. 2013). Por lo general, la composición de la avifauna en los distintos ambientes, depende de factores que actúan tanto a escala temporal como espacial (Echevarria y Fanjul 2016, Santillán et al. 2018). A escala temporal, estos cambios pueden estar asociados a fluctuaciones en la disponibilidad de alimento (Echevarria y Fanjul 2016), o al arribo, partida y/o establecimiento de especies migratorias (Ramírez-Albores 2010, Rangel-Salazar et al. 2009). Por lo tanto, la distribución y abundancia temporal de las aves pueden ser utilizadas como referentes para planificar adecuadamente el manejo de áreas naturales protegidas (Altamirano-González Ortega et al. 2003).
A pesar de la importancia ecológica de las aves, el estudio de este grupo en sitios arqueológicos se ha centrado principalmente en el análisis arqueológico de restos óseos y sus usos, tanto rituales como domésticos (Steadman et al. 2003, Bartosiewicz y Gál 2007, Bejenaru y Serjeantson 2014, Estrella et al. 2014). No obstante, los estudios biológicos sistematizados sobre aves en estos sitios son escasos y suelen limitarse a inventarios o listas comentadas (CONANP 2010a, Patten et al. 2011). En los últimos años ha surgido el interés de ofertar al sitio arqueológico Iglesia Vieja como un área turística regional. Esto podría aumentar el número de visitantes en la zona arqueológica y alterar el espacio natural (Kaneko 2011), que a su vez puede influir en los procesos ecológicos y en la dinámica anual de las poblaciones de aves. Por lo tanto, es necesario realizar investigaciones que aporten información básica general, además de dar respuesta a preguntas ecológicas sobre su diversidad, distribución y abundancia, tomando en cuenta el efecto temporal que pueden significar los patrones estacionales de lluvias y secas en la estructura de la avifauna. Por consiguiente, el propósito de este estudio fue analizar la dinámica temporal de la comunidad de aves en el sitio arqueológico Iglesia Vieja del estado de Chiapas, México.
Métodos
Área de estudio
El sitio arqueológico Iglesia Vieja se localiza aproximadamente a 4 km al norte de la cabecera municipal de Tonalá (16°07´55.4” N y 93°44´53.4” O), Chiapas, México, con una extensión aproximada de 60 ha. Esta área se ubica entre la región fisiográfica de la Planicie Costera del Pacífico y las estribaciones de la Sierra Madre de Chiapas, a una altitud de 711 m.s.n.m (Fig. 1). El clima es cálido-subhúmedo con dos estaciones bien definidas: lluvias (mayo-octubre) y secas (noviembre-abril); y tiene una precipitación anual de 1,650 mm y temperatura media de 27.6 °C (Kaneko 2006, INEGI 2014). La vegetación del área se conforma por fragmentos de selva mediana subcaducifolia, inmersos en un mosaico de sabanas y pastizales inducidos por actividades agropecuarias (Pennington y Sarukhán 2005).
Muestreo
Llevamos a cabo muestreos durante los meses de mayo-agosto y octubre-diciembre de 2017, y marzo-abril de 2018, a través de la técnica de puntos de conteo propuesta por Ralph et al. (1996). Establecimos dos transectos, uno de 1.75 km y otro de 2 km, compuestos por 8 y 9 puntos respectivamente, con una distancia de 250 m entre puntos (González-García 2011). Para establecer los transectos se utilizaron los senderos existentes en el sitio arqueológico. En cada punto permanecimos por 15 minutos y registramos las aves vistas y escuchadas dentro de un radio de 25 m (Ralph et al. 1996). Las observaciones las realizamos entre las 6:00 y 12:00 h, abarcando un día por transecto una vez al mes. Aquellas especies registradas fuera de este horario y método sólo fueron consideradas para completar el inventario avifaunístico del sitio arqueológico Iglesia Vieja. Para la observación utilizamos binoculares marca Vanta (8 x 40), y para la identificación de las aves utilizamos las guías de campo de Howell y Webb (1995), Van Perlo (2006), Peterson y Chalif (2008) y Sibley (2014). La temporalidad de este estudio contempló cinco meses de lluvias (mayo-agosto y octubre) y cuatro meses de secas (noviembre, diciembre, marzo y abril).
Caracterización de la avifauna y análisis de datos
Elaboramos una lista taxonómica con base en el sistema de clasificación y nomenclatura del suplemento 61 de la American Ornithological Society (AOS 2020). Para indicar el grado de vulnerabilidad de las especies utilizamos los criterios de la normatividad Mexicana NOM-059-SEMARNAT (SEMARNAT 2010) y la clasificación de Stotz et al. (1996), que indica la sensibilidad que tienen las especies de aves a las perturbaciones humanas. Determinamos la estacionalidad de residente o migratorio conforme a las categorías establecidas por Howell y Webb (1995). También corroboramos la distribución de las especies de acuerdo con los mapas de distribución potencial de Howell y Webb (1995) y los elaborados por el Geoportal de la CONABIO (2020).
Para evaluar el grado de similitud entre la avifauna del sitio arqueológico Iglesia Vieja y la avifauna de las regiones fisiográficas del estado de Chiapas propuesta por Rangel-Salazar et al. (2013), elaboramos una matriz de similitud a partir del coeficiente de Sørensen, basada en la incidencia de especies. Posteriormente, estos resultados se expresaron de manera gráfica con la ayuda de un dendrograma elaborado con un análisis de clasificación (UPGMA). Analizamos la representatividad del esfuerzo de muestreo y calculamos la riqueza esperada utilizando la información de los muestreos mensuales con el estimador no paramétrico Chao 1, el cual se basa en la abundancia de los organismos.
Para describir mensualmente la comunidad de aves en los meses lluviosos y secos, consideramos la abundancia total (número de individuos registrados de todas las especies), riqueza observada (número de especies detectadas) y construimos curvas de rango-abundancia (Log10) para representar la dominancia específica (McGill et al. 2007). Los indicadores de diversidad que utilizamos fueron los propuestos por Jost (2006): el índice de equidad de Pielou (J´) y la primera serie de los números de Hill (N1), el logaritmo usado fue base e. Evaluamos la variación temporal al comparar entre meses de muestreo las medias de los descriptores antes mencionados mediante un modelo lineal generalizado mixto (GLMM; Bolker et al. 2009) utilizando una distribución de Quasi-Poisson. Este análisis se realizó en el programa estadístico InfoStat versión 2020e (Di Rienzo et al. 2020).
Para evaluar la similitud y el gradiente de variación temporal entre los eventos de muestreo, realizamos análisis de clasificación (UPGMA) y ordenación (NMDS) sobre una matriz de Bray-Curtis construida con base en los datos de abundancia transformados logarítmicamente y posteriormente estandarizados. Identificamos grupos con estructura interna formados en el dendrograma con un análisis SIMPROF. Comprobamos el efecto de la variabilidad en la avifauna sobre sobre grupos categorizados en meses lluviosos y secos. Realizamos la identificación de las especies que contribuyeron significativamente a definir cada grupo en el dendrograma con el análisis post-hoc SIMPER. Las pruebas estadísticas y análisis exploratorios las realizamos con paquetes de R v. 3.6.2 (R Core Team 2019) y PERMANOVA+ para PRIMER v. 6 (Clarke y Gorley 2006). En todos los casos consideramos un α= 0.05 como significativo.
Resultados
La avifauna del sitio arqueológico Iglesia Vieja estuvo representada por 88 especies agrupadas en 16 órdenes, 31 familias y 72 géneros (Tabla 1), con una abundancia total de 911 aves registradas. El orden mejor representado fue Passeriformes con 15 familias, seguido de Piciformes con dos; el resto de los órdenes estuvo representado por una familia. Las familias con más especies registradas fueron: Tyrannidae (11), Trochilidae (8), Parulidae (7) y Cardinalidae (7); mientras que 15 familias estuvieron representadas con una especie cada una.
Tabla 1 Lista de especies de aves del sitio arqueológico Iglesia Vieja, Tonalá, Chiapas, México. Se siguió el orden taxonómico del American Ornithological Society y suplemento 60 (AOS 2020). Presencia: (Mr) Marzo, (Ab) Abril, (Ma) May, (Jn) Junio, (Jl) Julio, (Ag) Agosto, (Oc) Octubre, (No) Noviembre, Di (Diciembre). NOM-059: (P) En peligro de extinción, (A) Amenazada, (Pr) Sujeta a protección especial (SEMARNAT 2010). Estacionalidad: (RR) Residente Reproductivo, (RV) Residente de Verano, (VINR) Visitante de Invierno No Reproductivo, (MT) Migrante Transitorio (Howell y Webb 1995). Sensibilidad a perturbaciones humanas (S): Baja, Media, Alta (Stotz et al. 1996). *Endémica a México
| Taxa | Presencia | NOM-059 | Estacionalidad | S |
| Aves | ||||
| Galliformes | ||||
| Cracidae | ||||
| Ortalis poliocephala (Wagler, 1830) * | Mr, Ab | RR | Baja | |
| Ortalis leucogastra (Gould, 1843) | Ma, Jn, Ag, Oc | Pr | RR | Baja |
| Penelope purpurascens Wagler, 1830 | Mr | A | RR | Media |
| Podicipediformes | ||||
| Podicipedidae | ||||
| Tachybaptus dominicus (Linnaeus, 1766) | Ag | Pr | RR | Media |
| Columbiformes | ||||
| Columbidae | ||||
| Columbina inca (Lesson, 1847) | Mr, Ab, Ma, Jn, Jl, Ag, Oc, No, Di | RR | Baja | |
| Leptotila verreauxi Bonaparte, 1855 | Mr, Ab, Ma, Jn, Jl, Ag, Oc, No, Di | RR | Baja | |
| Zenaida asiatica (Linnaeus, 1758) | Mr, A, Ma, Jn | RR | Baja | |
| Cuculiformes | ||||
| Cuculidae | ||||
| Crotophaga sulcirostris Swainson, 1827 | Ma, Jn, Jl, Ag, Oc, No, Di | RR | Baja | |
| Tapera naevia (Linnaeus, 1766) | Ag | RR | Baja | |
| Morococcyx erythropygus (Lesson, 1842) | Ab | RR | Baja | |
| Piaya cayana (Linnaeus, 1766) | Mr, Ab, Ma, Jn, Jl, Ag, Oc, Di | RR | Baja | |
| Caprimulgiformes | ||||
| Caprimulgidae | ||||
| Nyctidromus albicollis (Gmelin, 1789) | Oc | RR | Baja | |
| Nyctibiiformes | ||||
| Nyctibiidae | ||||
| Nyctibius jamaicensis (Gmelin, 1789) | Ab | RR | Baja | |
| Apodiformes | ||||
| Trochilidae | ||||
| Anthracothorax prevostii (Lesson, 1832) | Fe | VINR | Baja | |
| Heliomaster longirostris (Audebert & Vieillot, 1801) | Mr | Pr | RR | Media |
| Archilochus colubris (Linnaeus, 1758) | Fe | VINR | Baja | |
| Cynanthus canivetii (Lesson, 1832) | Jn | RR | Baja | |
| Campylopterus hemileucurus (Lichtenstein, 1830) | Oc | RR | Media | |
| Saucerottia beryllina (Lichtenstein, 1830) | Ab, Ma | RR | Media | |
| Amazilia rutila (De Lattre, 1842) | Ab, Ag, No | RR | Baja | |
| Leucolia viridifrons (Elliot, 1871) * | Mr, No | A | RR | Media |
| Cathartiformes | ||||
| Cathartidae | ||||
| Coragyps atratus (Bechstein, 1793) | Mr, Ab, Ma, Jn, Ag, No, Di | RR | Baja | |
| Cathartes aura (Linnaeus, 1758) | Ab, Ma, Jl, Oc, No, Di | RR | Baja | |
| Accipitriformes | ||||
| Accipitridae | ||||
| Rupornis magnirostris (Gmelin, 1788) | Ab | RR | Baja | |
| Spizaetus tyrannus (Wied, 1820) | Ab, Mr, Ma, Jl, Ag, | P | RR | Baja |
| Buteo plagiatus (Schlegel, 1862) | Mr, Ma, Jl, Ag, No | RR | Media | |
| Buteo brachyurus Vieillot, 1816 | Ag | RR | Media | |
| Buteo swainsoni Bonaparte, 1838 | Fe | Pr | MT | Media |
| Buteo jamaicensis (Gmelin, 1788) | No | RR | Baja | |
| Strigiformes | ||||
| Strigidae | ||||
| Glaucidium brasilianus (Gmelin, 1788) | Ma, Ag, Oc | RR | Baja | |
| Ciccaba virgata (Cassin, 1849) | Ab | RR | Media | |
| Trogoniformes | ||||
| Trogonidae | ||||
| Trogon caligatus Gmelin, 1788 | Mr, Jn, No | RR | Media | |
| Trogon collaris Vieillot, 1817 | Mr, Ab, Ma, J, Oc | Pr | RR | Media |
| Coraciiformes | ||||
| Momotidae | ||||
| Momotus mexicanus Swainson, 1827 | Mr, Ab, Ma, Jn, Jl, Ag, Oc | RR | Media | |
| Piciformes | ||||
| Rhampastidae | ||||
| Pteroglossus torquatus (Gmelin, 1788) | Jn | Pr | RR | Media |
| Picidae | ||||
| Melanerpes aurifrons (Wagler, 1829) | Mr, Ab, Ma, Jn, Oc, No, Di | RR | Baja | |
| Colaptes rubiginosus (Swainson, 1820) | Jn | RR | Baja | |
| Dryocopus lineatus (Linnaeus, 1766) | Ma, Oc | RR | Baja | |
| Falconiformes | ||||
| Falconidae | ||||
| Falco sparverius Linnaeus, 1758 | Fe | RR | Baja | |
| Psittaciformes | ||||
| Psittacidae | ||||
| Eupsittula canicularis (Linnaeus, 1758) | Mr, Ab, Ma | Pr | RR | Baja |
| Psittacara holochlorus (Sclater, 1859) * | Ab | A | RR | Media |
| Brotogeris jugularis (Müller, 1776) | Ab | A | RR | Media |
| Amazona albifrons (Sparrman, 1824) | Ab | Pr | RR | Media |
| Amazona autumnalis (Linnaeus, 1758) | Jl | RR | Media | |
| Passeriformes | ||||
| Thamnophilidae | ||||
| Thamnophilus doliatus (Linnaeus, 1764) | Ab | RR | Baja | |
| Furnariidae | ||||
| Dendrocincla homochroa (Sclater, 1859) | Ab | RR | Alta | |
| Pipridae | ||||
| Chiroxiphia linearis (Bonaparte, 1838) | Mr, Ab, Ma, Jn, Jl, Ag, Oc, No | Pr | RR | Media |
| Tityridae | ||||
| Tityra semifasciata (Spix, 1825) | Mr, Jl | RR | Media | |
| Tyrannidae | ||||
| Oncostoma cinereigulare (Sclater, 1857) | Ma | RR | Baja | |
| Tolmomyias sulphurescens (Spix, 1825) | Jl | RR | Media | |
| Myiarchus cinerascens (Lawrence, 1851) | Mr, Jl | VINR | Baja | |
| Myiarchus nuttingi Ridgway, 1883 | Mr | RR | Media | |
| Megarynchus pitangua (Linnaeus, 1766) | Mr, Ab, Ma, Jl, Ag, Oc, No, Di | RR | Baja | |
| Myiozetetes similis (Spix, 1825) | Ag | RR | Baja | |
| Pitangus sulphuratus (Linnaeus, 1766) | Mr, Ab, Ma, Jn, Jl, Ag, No, Di | RR | Baja | |
| Myiodynastes luteiventris Sclater, 1859 | Mr, Ma, Ag, No | RV | Baja | |
| Tyrannus melancholicus Baird, 1858 | Ab, Ma, Ag, Oc, No, Di | RR | Baja | |
| Mr, Ab, Ma, No, Di | VINR | Baja | ||
| Tyrannus forficatus (Gmelin, 1789) | ||||
| Contopus sordidulus Sclater, 1859 | Mr, Ma, Oc | RV | Media | |
| Empidonax virescens (Vieillot, 1818) | Ma, Jn | MT | Baja | |
| Vireonidae | ||||
| Vireo gilvus (Vieillot, 1808) | Mr, Ma, Jn, Ag, Oc, No, Di | VINR | Baja | |
| Corvidae | ||||
| Calocitta formosa (Swainson, 1827) | Mr, Ab, Ma, Jn, Jl, Oc, Di | RR | Media | |
| Cyanocorax yncas (Boddaert, 1783) | Ab | RR | Media | |
| Troglodytidae | ||||
| Pheugopedius maculipectus (Lafresnaye, 1845) | RR | Media | ||
| Jl, No | ||||
| Mr, Ab, Ma, Jn, Ag, Oc, No, Di | RR | Media | ||
| Thryophilus pleurostictus (Sclater, 1860) | ||||
| Polioptilidae | ||||
| Polioptila albiloris Sclater & Salvin, 1860 | Jn | RR | Media | |
| Turdidae | ||||
| Catharus ustulatus (Nuttall, 1840) | Ab | VINR | Baja | |
| Turdus grayi Bonaparte, 1838 | Mr, Ma | RR | Baja | |
| Fringillidae | ||||
| Euphonia hirundinacea Bonaparte, 1838 | Ab | RR | Baja | |
| Passerellidae | ||||
| Peucaea ruficauda (Bonaparte, 1853) | Ma, Jn, Jl, Oc, No | RR | Baja | |
| Icteridae | ||||
| Cassiculus melanicterus Bonaparte, 1825 | Ma, No, Di | RR | Baja | |
| Icterus pustulatus (Wagler, 1829) | Ma | RR | Baja | |
| Icterus gularis (Wagler, 1829) | Mr, Ab, Ma, Jn, Jl, Oc, No, Di | RR | Media | |
| Icterus galbula (Linnaeus, 1758) | Ab | VINR | Media | |
| Quiscalus mexicanus (Gmelin, 1788) | Ab, Di | RR | Baja | |
| Parulidae | ||||
| Mniotilta varia (Linnaeus, 1766) | Mr | VINR | Baja | |
| Leiothlypis ruficapilla (Wilson, 1811) | Ma, Oc, Di | VINR | Baja | |
| Setophaga citrina Boddaert, 1783 | Ab | VINR | Media | |
| Setophaga magnolia (Wilson, 1811) | Ab | VINR | Baja | |
| Setophaga fusca (Müller, 1776) | Ma | VINR | Media | |
| Setophaga petechia (Linnaeus, 1766) | Mr, Ma, Ag, Di | VINR | Baja | |
| Basileuterus lachrymosus (Bonaparte, 1850) | Ma | RR | Media | |
| Cardinalidae | ||||
| Habia rubica (Vieillot, 1817) | Ab | RR | Alta | |
| Pheucticus ludovicianus (Linnaeus, 1766) | Mr | VINR | Media | |
| Passerina caerulea (Linnaeus, 1758) | Mr | RR | Baja | |
| Passerina cyanea (Linnaeus, 1766) | Ab | VINR | Media | |
| Passerina rositae (Lawrence, 1874) * | A | RR | Media | |
| Passerina leclancherii Lafresnaye, 1840 * | Fe | RR | Media | |
| Passerina ciris (Linnaeus, 1758) | Pr | VINR | Baja | |
| Thraupidae | ||||
| Cyanerpes cyaneus (Linnaeus, 1766) | Mr | RR | Baja | |
Respecto a su estado de conservación, 16 especies se encontraron dentro de alguna categoría de riesgo propuesta por la NOM-059-SEMARNAT (SEMARNAT 2010). Se destacó Spizaetus tyrannus por encontrarse catalogada como especie en peligro de extinción, además cinco especies estuvieron en la categoría de amenazadas (Penelope purpurascens, Leucolia viridifrons, Psittacara holochlorus, Brotogeris jugularis y Passerina rositae) y 10 especies sujetas a protección especial (Ortalis leucogastra, Tachybaptus dominicus, Heliomaster longirostris, Buteo swainsoni, Pteroglossus torquatus, Chiroxiphia linearis, entre otras). Dos especies, Dendrocincla homochroa y Habia rubica, fueron clasificadas como altamente sensibles a las perturbaciones humanas de acuerdo con lo propuesto por Stotz et al. (1996). Adicionalmente, registramos cinco especies endémicas para México: Ortalis poliocephala, Leucolia viridifrons, P. sittacara holochlorus, Passerina rositae y P. leclancherii. En cuanto a la estacionalidad, registramos 68 especies residentes y 20 especies migratorias. Entre las especies migratorias más abundantes en el sitio arqueológico Iglesia Vieja encontramos a Vireo gilvus, Tyrannus forficatus y Contopus sordidulus.
De acuerdo con el análisis de similitud, el sitio arqueológico Iglesia Vieja se asemejó en un 32.9% con la región fisiográfica Planicie Costeras del Pacífico y en un 27.1% con la región fisiográfica Sierra Madre, siendo ubicada en las estribaciones de estas dos regiones fisiográficas. El sitio arqueológico Iglesia Vieja tuvo mayor semejanza con la Depresión Central (35.7%), mientras para el resto de las regiones fisiográficas fue: 24% con los Altos de Chiapas, 23.3% con las Montañas del Norte, 22.5% con las Montañas de Oriente y 25.5% con la Planicie Costera del Golfo. En cuanto a la representatividad del muestreo, el estimador Chao1 predijo 66 especies, por lo que, con base en nuestro esfuerzo, este estudio representó el 89.3% de la avifauna esperada para el sitio arqueológico Iglesia Vieja.
La riqueza de especies promedio más alta la registramos en mayo del 2017 (6.59 ± 2.79 especies), siendo más bajo en julio (2.88 ± 1.5 especies) y agosto (2.88 ± 1.83 especies) de 2017 (Tabla 2). Igualmente, la mayor diversidad promedio fue registrada en mayo de 2017 (5.8 ± 2.08) y el más bajo en julio (2.73 ± 1.23) y agosto (2.73 ± 1.63) de 2017 (Tabla 2). Por otro lado, hubo mayor equidad promedio en diciembre de 2017 (0.95 ± 0.06) y menor equidad en marzo de 2018 (0.65 ± 0.44; Tabla 2). De acuerdo con los modelos lineales generalizados mixtos, no hubo diferencias estadísticamente significativas en la riqueza, diversidad y equidad entre meses de muestreo. Con base en la variación estacional en riqueza de especies, encontramos un total de 47 especies en la época de lluvias y 46 en época de secas; sin embargo, la composición específica varió entre temporadas, sólo tuvieron en común 33 de las 88 especies registradas.
Tabla 2 Promedios (± DE) mensuales de los valores de riqueza, equitatividad y diversidad de la avifauna en el sitio arqueológico Iglesia Vieja, Chiapas, México.
| MES | Temporada | Riqueza | Equitatividad (J) | Diversidad (N1 Hill) |
| Mayo 2017 | lluvias | 6.59 ± 2.79 | 0.93 ± 0.06 | 5.80 ± 2.08 |
| Junio 2017 | lluvias | 4.06 ± 1.75 | 0.91 ± 0.24 | 3.91 ± 1.46 |
| Julio 2017 | lluvias | 2.88 ± 1.5 | 0.77 ± 0.37 | 2.73 ± 1.23 |
| Agosto 2017 | lluvias | 2.88 ± 1.83 | 0.77 ± 0.4 | 2.73 ± 1.63 |
| Octubre 2017 | lluvias | 3.53 ± 1.42 | 0.84 ± 0.32 | 3.29 ± 1.29 |
| Noviembre 2017 | secas | 3.82 ± 1.63 | 0.88 ± 0.19 | 3.47 ± 1.65 |
| Diciembre 2017 | secas | 3.65 ± 1.8 | 0.95 ± 0.06 | 3.37 ± 1.47 |
| Marzo 2018 | secas | 3.18 ± 2.38 | 0.69 ± 0.42 | 2.92 ± 1.93 |
| Abril 2018 | secas | 3.06 ± 1.71 | 0.78 ± 0.38 | 2.84 ± 1.5 |
De acuerdo con las curvas rango-abundancia, las especies dominantes en la época de lluvias fueron Calocitta formosa, Leptotila verreauxi, Momotus mexicanus y Thryophilus pleurostictus (Fig. 2), mientras que las menos dominantes fueron Basileuterus lachrymosus, Buteo brachyurus, Dryocopus lineatus, Setophaga fusca y T. forficatus (Fig. 2). Por otro lado, en la época de secas dominaron L.eptotila verreauxi, Columbina inca, Pitangus sulphuratus y Thryophilus pleurostictus (Fig. 2), y las especies menos dominantes fueron Amazilia rutila, Contopus sordidulus, Leiothlypis ruficapilla, Myiodynastes luteiventris, Passerina cyanea, Peucaea ruficauda, Pheucticus ludovicianus y Trogon collaris (Fig. 2). De acuerdo con los resultados de este análisis, las especies que dominaron durante todo el período de muestreo fueron Calocitta formosa, Columbina inca, Leptotila verreauxi y Thryophilus pleurostictus.
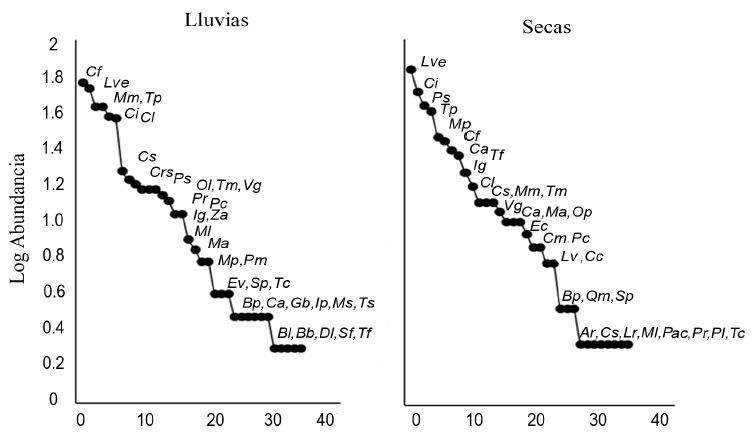
Figura 1 Curvas rango-especie para la avifauna del sitio arqueológico Iglesia Vieja en dos temporadas climáticas. Ar (Amazilia rutila), , Bb (Buteo brachyurus), Bl (Basileuterus lachrymosus), Bp (Buteo plagiatus), Ca (Cathartes aura), Cc (Cyanerpes cyaneus), Cf (Calocitta formosa), Ci (Columbina inca), Cl (Chiroxiphia linearis), Cm (Cassiculus melanicterus), Crs (Crotophaga sulcirostris), Cs (Contopus sordidulus), Dl (Dryocopus lineatus), Ec (Eupsittula canicularis), Ev (Empidonax virescens), Gb (Glaucidium brasilianum), Ig (Icterus gularis), Ip (Icterus pustulatus), Lr (Leiothlypis ruficapilla), Lve (Leptotila verreauxi), Lv (Leucolia viridifrons), Ma (Melanerpes aurifrons), Ml (Myiodynastes luteiventris), Mm (Momotus mexicanus), Mp (Megarhynchus pitangua), Ms (Myiozetetes similis), Ol (Ortalis leucogastra), Op (Ortalis poliocephala), Pc (Piaya cayana), Pac (Passerina cyanea)Pl (Pheucticus ludovicianus), Pm (Pheugopedius maculipectus), Pr (Peucaea ruficauda), Ps (Pitangus sulphuratus), Qm (Quiscalus mexicanus), Sf (Setophaga fusca), Sp (Setophaga petechia), Tc (rogon collaris), Tf (Tyrannus forficatus), Tm (Tyrannus melancholicus), Tp (Thryophilus pleurostictus), Ts (Tityra semifasciata), Vg (Vireo gilvus), Za (Zenaida asiatica).
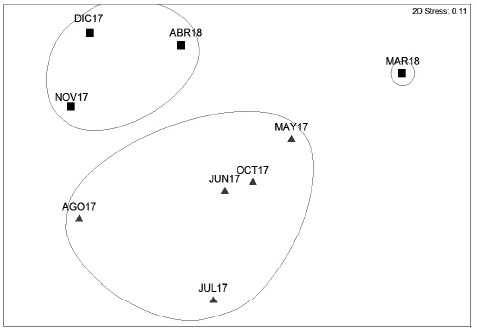
El dendrograma mostró que, a una similitud del 52%, se formaron tres grupos: uno que engloba a todos los meses de la temporada de lluvias, otro grupo grande con tres meses de la temporada de secas y un grupo pequeño que incluyó solo un mes de la temporada de secas (Fig. 3). A pesar de la similitud indicada, el análisis de SIMPROF no detectó estructura interna dentro del dendrograma obtenido, es decir, no se encontraron grupos estadísticamente distintos dentro de éste. Las especies más representativas dentro del dendrograma, con base en el análisis SIMPER, fueron: Leptotila verreauxi, Thryophilus pleurostictus, Columbina inca, Chiroxiphia linearis, Calocitta formosa, Icterus gularis, Momotus mexicanus y Pitangus sulphuratus. Los grupos obtenidos a una similitud del 52% mostraron ausencia de sobrelapamiento de las elipses (Fig. 4), lo que indica que hubo diferencias en la composición específica entre las dos estaciones en el porcentaje previamente señalado. El estrés de este análisis fue de 0.11, el cual aún se considera bajo y confiable para una representación en dos dimensiones

Figura 3 Dendrograma de la avifauna del sitio arqueológico Iglesia Vieja construido con datos mensuales. La línea de corte fue colocada a una similitud del 52%. Meses de secas (■), meses de lluvias (▲)
Discusión
El presente trabajo fue el primer estudio sistemático realizado para la comunidad de aves del sitio arqueológico Iglesia Vieja, registrando 88 especies de avifauna. Esto es menor que riqueza de aves reportadas para otras zonas arqueológicos como el Parque Nacional Palenque con 353 especies (Patten et al. 2011), Monumento Natural Yaxchilán con 216 especies (Meave del Castillo y Luis Martínez 2000) y Monumento Natural Bonampak con 180 especies (CONANP 2010a). La diferencia en riqueza de aves, se debió quizás a una mayor extensión territorial de estas otras áreas, así como al tipo y estructura de la vegetación.
Entre las especies registradas en el sitio arqueológico Iglesia Vieja, resaltaron Ortalis poliocephala, Leucolia viridifrons, Psittacara holochlorus, Passerina leclancherii y P. rositae por ser endémicas de México. Estas especies se registraron en los meses de secas y son consideradas como residentes reproductivos en el área de estudio. Además, destaca Spizaetus tyrannus, una especie considerada en peligro de extinción por las leyes mexicanas, que fue observada en abril (secas). En especies amenazadas resaltó P. rositae con una distribución restringida al Pacífico Sur de México (Oaxaca y Chiapas). Por último, como sujetas a protección especial se encontraron Ortalis leucogastra reportada en los meses de lluvias, y los psitácidos (Eupsittula canicularis y Amazona albifrons) en los meses de marzo y abril (temporada de secas). Ambas especies de psitácidos son vulnerables debido al tráfico y a la cacería (Peña-Álvarez 2014) y extracción para comercio ilegal (Cantú et al. 2021). Especies con alta sensibilidad a las perturbaciones humanas, como Dendrocincla homochroa y Habia rubica, fueron observadas en los meses de secas. La única ave acuática que se registró en este estudio fue Tachybaptus dominicus, la cual fue observada en agosto (lluvias) en un estanque artificial en las inmediaciones del sitio arqueológico.
La proporción de especies residentes y migratorias registradas concuerda con diversas listas de aves realizadas en selvas tropicales, donde se mostraron que ciertas especies residentes se reportan en mayores cantidades (Ramírez-Albores y Ramírez-Cedillo 2002, Ramírez-Albores 2010, Rangel-Salazar et al. 2009). Además, las especies migratorias (p. ej. Myiodynastes luteiventris, Leiothlypis ruficapilla, Setophaga fusca) sólo permanecen en la zona por algunos meses para posteriormente continuar con su migración más al sur o retornar a su área de reproducción (Ramírez-Albores y Ramírez-Cedillo 2002), por lo que su registro es bajo o nulo en algunos meses del año, influyendo directamente en su abundancia.
El menor número de especies registradas en Iglesia Vieja podría explicar la baja similitud encontrada con otras regiones fisiográficas del estado. A pesar de que el sitio arqueológico Iglesia Vieja se encuentra en una zona de transición entre las dos regiones fisiográficas (Planicie Costeras del Pacífico y Sierra Madre), encontramos un parentesco menor al 33%. Esto podría deberse a que se registraron un mayor número de especies en la Planicie Costera del Pacífico y Sierra Madre, 366 y 537 especies respectivamente (Rangel-Salazar et al. 2013), resultado de haber cubierto un área más grande y con mayor heterogeneidad ambiental.
A pesar de la menor riqueza registrada para Iglesia Vieja, el estimador Chao 1 indicó que logramos representar un 89% de la avifauna esperada para el sitio. En este sentido, Colwell y Coddington (1994) y Pineda y Halffter (2004) han planteado que una representatividad mínima del 80% es apropiada para validar inventarios o hacer comparaciones entre hábitats o temporadas. Por lo tanto, el esfuerzo de muestreo en Iglesia Vieja cubrió un elenco ornitofaunístico aceptable considerando el área estudiada. De tal manera que, registramos un número importante de riqueza de especies en el sitio arqueológico Iglesia Vieja, sobre todo porque es un área poco estudiada ornitológicamente.
A nivel temporal, a pesar de que no se encontraron conjuntos estadísticamente significativos dentro del dendrograma, la avifauna de los meses lluviosos tuvo una semejanza ligeramente por encima del 50% con la avifauna de los meses de secas. Si bien, en ambas épocas se registró la misma cantidad de especies, el 32% de estas fueron taxonómicamente diferentes, lo que nos indica una dinámica temporal de las especies marcado por la llegada y partida de especies migratorias, así como probablemente por la disponibilidad de los recursos que influye en la abundancia de ciertas especies (Chávez-Castañeda 2012). En los meses de lluvias destacaron por su abundancia Calocitta formosa y Momotus mexicanus, frecuentes de selvas bajas y áreas semiabiertas con vegetación secundaria (Vázquez et al. 2009). Por su parte, las especies numéricamente más abundantes en los meses secos fueron Columbina inca y Pitangus sulphuratus, que son especies residentes cuya presencia se ve favorecida en áreas con vegetación secundaria y pastizales, además de ser indicadoras de perturbación íntimamente ligada a la actividad humana (Salas-Correa y Mancera-Rodríguez 2020). Por otro lado, L. verreauxi y T. pleurostictus fueron especies frecuentes y abundantes durante todo el período de muestreo.
La mayor riqueza de especies promedio se observó en mayo, seguida por los meses de junio y octubre, que corresponden a la temporada lluviosa. La mayor presencia de especies en esta temporada podría deberse al registro y/o presencia de especies migratorias en el sitio arqueológico Iglesia Vieja (p. ej. Contopus sordidulus, L. ruficapilla, y S. fusca), cuyo paso otoñal en el sureste de México comienza en septiembre y alcanza su pico en octubre (Cabrera-Cruz et al. 2017). Por otro lado, la temporada de lluvias favorece una mayor productividad de insectos en bosques tropicales caducifolios del sureste de México (Zavala-León et al. 2016), así como la maduración de frutos en los bosques neotropicales (Williams-Linea y Meave 2002). A su vez, esto influye en los movimientos locales de las especies residentes que se desplazan de un sitio a otro en busca de alimento. Tal es el caso de aves frugívoras como Chiroxiphia linearis, Trogon collaris y T. caligatus especies residentes que se alimentan básicamente de frutos, pero que su incidencia dentro del área de estudio, se ve influenciada por los movimientos que realizan a través de su hábitat buscando los frutos que están distribuidos impredeciblemente tanto espacial como temporalmente (Núñez 2008, Jordano 2000).
La equidad no presentó un patrón bien definido entre lluvias y secas, ésta adquirió valores altos tanto en la temporada de lluvias como de secas, y lo mismo ocurrió con los valores más bajos. Esto último estuvo influenciado por la ausencia de organismos o la presencia de una sola especie en varios puntos de muestreo. La diversidad obtuvo sus promedios más bajos en los meses donde se registró una sola especie en varios puntos de conteo. Esto último ocasionó que el índice de diversidad de Shannon-Wiener (la base para calcular los números de Hill) adquiriera valores de cero (Magurran 1988) en distintas ocasiones.
La información generada en este estudio muestra que el sitio arqueológico Iglesia Vieja es de gran importancia para las aves debido a que alberga especies en riesgo o protegidas, endémicas, así también ofrece un espacio y recursos para aves migrantes. Aunque la curva de 89% de acumulación de especies indicó haber tenido una buena representatividad de las aves en el sitio, sigue siendo necesario continuar e incrementar los muestreos en términos espaciales y temporales para el registro de especies raras y de distribución restringida, así como realizar muestreos interanuales. También es pertinente prestar mayor atención a la temporada migratoria. No obstante, nuestros resultados muestran que a la par de la importancia cultural y turística de Iglesia Vieja, esta zona arqueológica posee potencial para las actividades asociadas al aviturismo (Perdomo et al. 2018), lo que podría contribuir como instrumento para la conservación y educación ambiental en el sitio. Por lo tanto, los resultados de este trabajo pueden y deben utilizarse como soporte biológico para la elaboración de un programa de manejo para la zona arqueológica.











 nueva página del texto (beta)
nueva página del texto (beta)