Introducción
Alrededor del mundo, la modificación de los hábitats naturales para el establecimiento de áreas urbanas se considera como una amenaza para la biodiversidad a diferentes escalas (Marzluff 2001, Grimm et al. 2008). En particular, la urbanización ha causado la reducción de la superficie de diferentes hábitats naturales en el mundo, y por consecuencia, una alteración en comunidades bióticas, cambios en la conectividad del paisaje, aumento en la densidad de especies invasoras, y homogeneización de la comunidad de aves (McKinney 2006, Olden 2006, Blair y Johnson 2008, Rudnick et al. 2012). Debido a la rápida transformación del paisaje en áreas urbanas, los estudios sobre ecología urbana se han convertido en una prioridad para la investigación y conservación.
En los ecosistemas urbanos, las zonas ribereñas son típicamente un componente pequeño del paisaje que representa un hábitat esencial para muchas especies nativas (Ruvalcaba-Ortega et al. 2008). Estas zonas albergan una mayor diversidad de especies con relación a los ambientes adyacentes, a pesar de su tamaño proporcionalmente más pequeño (Sabo et al. 2005). Para las aves, los corredores ribereños son de gran importancia ya que son sitios de anidación, sitios de reabastecimiento y descanso durante la migración, e incluso como corredores biológicos para movimientos locales de aves residentes (Pennington et al. 2008, Carlisle et al. 2009, Pennington y Blair 2011, Bennett et al. 2014). Pese a su importancia ecológica, las zonas ribereñas están disminuyendo a nivel global en las zonas sujetas a procesos de urbanización (Groffman et al. 2003, Jones et al. 2010).
Las aves son sistemas de estudio muy útiles para evaluar cambios ambientales y ecológicos tanto en entornos naturales como en entornos urbanos y naturales. En general, las aves son diversas y fáciles de identificar, respondiendo diferencialmente a las perturbaciones de los ecosistemas urbanos, ya sea evitando las ciudades, adaptándose e incluso explotando los recursos que ofrecen los asentamientos humanos (Blair 1996, Bibby et al. 2000, Shochat et al. 2010). Los estudios sobre el impacto de la urbanización en la biodiversidad a lo largo de un gradiente urbano-rural han mostrado una disminución en la riqueza de especies conforme la urbanización aumenta, así como cambios en la composición de especies desde áreas naturales hasta paisajes más urbanizados (Blair 1996; Clergeau et al. 2006; McKinney 2006). Las comunidades de aves en zonas urbanas generalmente tienen una riqueza de especies menor y una abundancia alta en comparación con los hábitats naturales, y sólo unas pocas especies logran obtener y utilizar los recursos que ofrecen las condiciones urbanas, incluyendo especies exóticas como la paloma doméstica (Columba livia) y el gorrión doméstico (Passer domesticus) (Marzluff 2001, Chace y Walsh 2006, Evans et al. 2009, MacGregor-Fors et al. 2010).
La ciudad de Monterrey y su área metropolitana son reconocidas principalmente por su importante desarrollo industrial y su auge económico en el noreste de México (McKinsey y Company 2012). Sin embargo, existen muy pocos estudios de ecología urbana en el noreste mexicano comparado con otras ciudades del centro y sur de México (Ortega-Álvarez y MacGregor-Fors 2009, Carbó-Ramírez y Zuria 2011, MacGregor-Fors y Schondube 2011, MacGregor-Fors et al. 2012, 2018, Malagamba-Rubio et al. 2013, Escobar-Ibáñez et al. 2020). En general, se ha encontrado que la riqueza de especies de aves aumenta en áreas urbanas con mayor cobertura vegetal (Carbó-Ramírez y Zuria 2011, MacGregor-Fors y Schondube 2011), mientras que decrece en zonas urbanas con alta densidad de edificios (Amaya-Espinel et al. 2019) e intensa actividad humana (Ortega-Álvarez y MacGregor-Fors 2009, MacGregor-Fors y Schondube 2011).
En el estado de Nuevo León, se han reportado 419 especies de aves (Contreras-Balderas et al. 2008), y con la aportación de nuevos registros realizados por observadores de aves en plataformas de ciencia ciudadana como aVerAves y Naturalista, el listado se ha incrementado a 467 especies de aves para el estado (eBird 2021). Dentro del área metropolitana de Monterrey, el Río La Silla es considerado como uno de los principales ecosistemas ribereños que atraviesan la ciudad y representa un área verde emblemática para los ciudadanos; sin embargo, no se ha considerado su importancia por las especies de aves que alberga y la relevancia de su conservación (Cantú et al. 2014). Para la región sur del Río La Silla en el municipio de Monterrey, se han reportado 77 especies de aves, siendo las especies más comunes el tordo sargento (Agelaius phoeniceus), la chara verde (Cyanocorax yncas), el pijije alas blancas (Dendrocygna autumnalis), el zanate mayor (Quiscalus mexicanus) y la paloma alas blancas (Zenaida asiatica) (Cantú et al. 2014). Gran parte de la extensión del Río La Silla cuenta con senderos de concreto para realizar actividades recreativas, aunque también hay áreas cercanas a zonas residenciales e industriales. Asimismo, la vegetación ribereña del Río La Silla va cambiando a lo largo de su caudal, por lo que, a mayor cantidad de disturbio en la zona, menor es la diversidad de especies arbóreas y herbáceas (López-Castillo et al. 2018).
El objetivo del presente estudio fue comparar la riqueza, estructura y composición de especies de las comunidades de aves en tres zonas recreativas de este corredor ribereño que ha sido modificado por las actividades humanas. Esperamos encontrar una menor diversidad de aves en las zonas recreativas cercanas a áreas industriales en comparación con la zona cercana al área residencial, debido a las características de la vegetación, las estructuras antropogénicas y las actividades humanas que se realizan.
Métodos
Sitios muestreo
El Río La Silla se encuentra dentro del área metropolitana de Monterrey en Nuevo León, al noreste de México, entre las regiones fisiográficas de la Llanura Costera del Golfo y la Sierra Madre Oriental (25° 41.5’ N y 100°20.8’ W). El río tiene una longitud de 31.4 km y nace en las estribaciones de la Sierra Madre Oriental, a unos 15 km al sur de la ciudad de Monterrey. Los principales tipos de vegetación a lo largo del río incluyen bosque de galería y vegetación secundaria. Las especies más abundantes del bosque de galería incluyen el gallito asiático (Cynodon dactylon), botón de oro (Acmella repens), Amapolilla (Argemone mexicana), zacate guineo (Panicum máximum), mozote (Bidens pilosa) y Helenium elegans en el estrato herbáceo. Las especies dominantes en el estrato arbóreo son Sauce (Salix nigra), sicómoro americano (Platanus occidentalis) y ciprés Moctezuma (Taxodium mucronatum) (López-Castillo et al. 2018). La vegetación secundaria incluye especies nativas como palo blanco (Celtis laevigata), ébano (Ebenopsis ebano), anacua (Ehretia anacua), girasol (Helianthus annus), retama (Parkinsonia aculeata) y huizache (Vachellia farnesiana), y especies exóticas como fresno americano (Fraxinus americana), guaje (Leucaena leucophala), canelo (Melia azedarach), tabaquillo (Nicotiana glauca) e higuerilla (Ricinus communis), algunas de estas consideradas invasoras (Cantú et al. 2014, López-Castillo et al. 2018). Debido a que los bosques de galería forman franjas a lo largo de las corrientes fluviales, el Río La Silla tiene una forma lineal, aunque el ancho del corredor ribereño puede variar a lo largo de su extensión. La anchura del cauce del Río La Silla oscila entre 5.9 y 48.4 m en las distintas zonas de manejo (Cantú et al. 2014). El clima predominante en la región es seco estepario, cálido y extremoso, con una temperatura promedio anual de 23ºC y una precipitación promedio anual es 591 mm (García 1973).
Llevamos a cabo el muestreo de las aves en tres zonas recreativas del Río La Silla: a) Cortijo, al sur de Monterrey, y b) El Realito y c) Tolteca-Riberas en el municipio de Guadalupe (Figura 1). A pesar de que los tres sitios de muestreo son visualmente similares en el tipo de vegetación, presentan variaciones con respecto las características de la vegetación, la actividad humana y las estructuras antropogénicas.

Figura 1 Ubicación de los puntos de conteo en tres sitios del Río La Silla en el área metropolitana de Monterrey, Nuevo León, México
La zona de Tolteca-Riberas está constituida por vegetación secundaria y bosque de galería. Esta zona cuenta con un mayor número de individuos de T. mucronatum en mejores condiciones de salud y de mayores dimensiones con respecto a los otros sitios de muestreo (López-Castillo 2014). En esta zona existen algunos tramos canalizados, impidiendo que algunas especies arbóreas se desarrollen en su máximo esplendor (López-Castillo 2014). En esta zona se encuentran diferentes estructuras antropogénicas con fines recreativos (áreas para picnics, juegos infantiles, aparatos para ejercicio, luminarias) y representa una vía para peatones y ciclistas, y está rodeada por zonas residenciales e industriales.
El Realito está constituido por vegetación secundaria y bosque de galería, y cuenta con ejemplares de T. mucronatum de gran talla y buen estado. Sin embargo, algunos tramos canalizados y los andadores de concreto han ocasionado que un considerable número de ejemplares se sequen debido a la lejanía del cuerpo de agua. Esta zona está rodeada por zonas residenciales e industriales, con cercanía a edificaciones (estadio de fútbol y parque de diversiones) y un parque urbano (Bosque La Pastora).
Por último, Cortijo se compone principalmente por bosque de galería con diferentes impactos antropogénicos, destacando la remoción selectiva en ciertas áreas dejando en su mayoría individuos de T. mucronatum, P. deltoides y S. nigra (Cantú et al.2014). El sitio Cortijo está rodeado en su mayoría por una zona residencial, por lo que se encuentra en constante impacto de las actividades antropogénicas principalmente por las casas habitaciones que se encuentran muy cerca del borde y por la vitapista que se encuentra a lo largo del parque. En esta zona se realizan con mayor frecuencia actividades al aire libre (caminatas, ejercicio, conciertos, pasear mascotas, festivales), en comparación con los otros dos sitios de muestreo.
Censos de aves
Desde febrero del 2018 hasta enero de 2020, realizamos salidas mensuales a los tres sitios de muestreo por el Río La Silla. Debido a que el fin de semana (sábado y domingo) hay una mayor afluencia de usuarios en estas zonas recreativas del Río La Silla, realizamos las salidas entre lunes y viernes con el fin de evitar sesgos en los datos obtenidos. Establecimos 11 puntos de conteo de radio variable para El Realito y Cortijo, y 12 para Tolteca-Riberas. El monitoreo de aves comenzaba 10 mins antes del amanecer, entre 06:00 a 10:30 h. En cada punto de conteo y durante 5 minutos, M Castillo-Muñoz registró y cuantificó todas las especies de aves observadas y escuchadas que utilizaron activamente el área muestreada. No se consideraron las especies observadas entre puntos de conteo o que sobrevolaban el área. Los puntos de conteo estaban distanciados a 250 m entre sí para evitar pseudoréplicas (Wunderle 1994). Las salidas a cada sitio de muestreo se realizaron una vez al mes durante 24 meses. La identificación de especies se realizó mediante guías de campo (Howell y Webb 1995, Sibley 2014). Para completar el inventario avifaunístico del Río La Silla, incorporamos cinco especies observadas únicamente durante el premuestreo realizado entre abril y noviembre de 2017. Para el ordenamiento de las especies de aves, consideramos la propuesta de la Sociedad Americana de Ornitología (Chesser et al. 2021a) y los cambios incorporados a través su suplemento más reciente (Chesser et al. 2021b). El listado de la avifauna incluye: orden, familia, especie, estacionalidad, gremio alimenticio, estatus de conservación, grado de endemismo y abundancia relativa.
Con base en lo que observamos durante el muestreo y lo sugerido por Howell y Webb (1995), consideramos cinco categorías de estacionalidad: residentes, residente de verano, visitante de invierno, transitorias y ocasionales u accidentales. Clasificamos los gremios alimenticios de acuerdo con su dieta principal durante la época reproductiva, incluyendo diez categorías: carnívoro, carroñero, frugívoro, granívoro, herbívoro, invertebrados acuáticos, invertebrados terrestres, nectarívoro, omnívoro y piscívoro (Ehrlich et al. 1988). Debido a que en la dieta que incluye invertebrados terrestres predominan los insectos, haremos referencia a este gremio alimenticio como insectívoros. Determinamos el estatus de conservación utilizando las categorías de riesgo de la Norma Oficial Mexicana NOM-059SEMARNAT-2010 (SEMARNAT 2010) y la Lista Roja de Especies Amenazadas (IUCN 2020). Clasificamos el origen de las especies en nativas y exóticas, así como su grado de endemismo incluyendo cuatro categorías: endémica (especies que sólo habitan en México), cuasiendémica (especies que se extienden ligeramente a algún país vecino debido a la continuidad de los hábitat o sistemas orográficos), semiendémica (especies que son endémicas a un país o a una región durante una época del año) y no endémica (González-García y Gómez de Silva 2003, Berlanga et al. 2019).
Análisis estadístico
Evaluamos la completitud del esfuerzo de muestreo en cada sitio mediante estimadores no paramétricos basados en datos de incidencia: ICE, Chao2 y Bootstrap (Chao 1984, Chao y Bunge 2002). Con alrededor del 85% de completitud se considera que el muestreo es fiable y representativo (Villareal et al. 2004). La riqueza específica para cada sitio la determinamos a través de la riqueza de especies estimada (Sest) generados con el programa EstimateS v.9.1.0. (Colwell 2013) y posteriormente construimos curvas de rarefacción basada en individuos. Determinamos si la riqueza de especies estimada (Sest) es estadísticamente diferente entre sitios, utilizando los intervalos de confianza del 84% para cada sitio, ya que realiza la comparación por pares e imita las pruebas estadísticas con una alpha de 0.05, por lo que se consideran diferencias estadísticamente significativas cuando no se superponen las curvas (Payton et al. 2003, MacGregor-Fors y Payton 2013). Posteriormente, generamos el gráfico con las curvas de rarefacción mediante el paquete ggplot2 (Wickham 2016) del programa R (R Core Team 2016).
Obtuvimos la abundancia relativa dividiendo el número de individuos de la especie i entre el número total de individuos, multiplicado por 100 para obtener el porcentaje de abundancia relativa. (P1=ns1/ Σn, donde P1 representa la abundancia relativa de la especie 1, ns1 el número de individuos de la especie 1, Σn el número total de individuos). Utilizamos el criterio de Pettingill (1969) para determinar las categorías de abundancia relativa para cada especie: 90-100% = abundante (A), 65-89% = común (C), 3164% = moderadamente común (MC), 10-30% = poco común (PC) y 1-9% = rara (R).
Para probar las diferencias significativas en la abundancia de aves entre los sitios de muestreo, utilizamos la prueba de Kruskal-Wallis, y posteriormente la prueba de Mann-Whitney U como prueba post-hoc. Asimismo, comparamos la abundancia total de las aves registradas entre los dos años de muestreo para todos los puntos de conteo mediante la prueba de Wilcoxon para muestras relacionadas.
Comparamos la estructura (dominancia) de los ensambles de aves entre sitios y construimos curvas de rango/abundancia representando la distribución de las abundancias de las especies dentro de una comunidad (Magurran 2004). Para cada sitio, transformamos los datos de abundancia relativa (log10). Cada gráfico contiene la abundancia relativa de cada especie contra el rango de la especie, ordenadas de la especie más abundante a la menos abundante. Por último, analizamos la composición de especies entre los tres sitios muestreados mediante agrupamiento utilizando el coeficiente de similitud de Jaccard con algoritmo de grupos pareados mediante el programa PAST v.4.0 (Hammer et al. 2001)..
Resultados
Avifauna del Río La Silla
En total, registramos 152 especies pertenecientes a 106 géneros, 40 familias y 17 órdenes. El orden Passeriformes fue el más representativo con 82 especies (53.9% de las especies). Las familias con mayor número de especies fueron Tyrannidae (18 spp), Parulidae (17 spp), Accipitridae (10 spp) y Ardeidae (9 spp). La gran mayoría de las especies eran nativas (148 spp), mientras solo cuatro fueron especies exóticas: C. livia, la paloma de collar turca (Streptopelia decaocto), la garza ganadera (Bubulcus ibis) y P. domesticus. Adicionalmente, encontramos diez especies nativas con algún grado de endemismo: el loro corona lila (Amazona finschi) y el loro tamaulipeco (Amazona viridigenalis), que son endémicas; las especies cuasiendémicas: el colibrí vientre canelo (Amazilia yucatanensis), el rascador dorso verde (Arremonops rufivirgatus), el chipe gorra canela (Basileuterus rufifrons), la calandria capucha negra (Icterus graduacauda) y el cuicacoche pico largo (Toxostoma longirostre); y las especies semiendemicas: el colibrí pico ancho (Cynanthus latirostris), la calandria dorso negro menor (Icterus cucullatus) y el vireo de Cassin (Vireo cassinii) (Anexo 1).
En cuanto a la estacionalidad, más de la mitad de las especies (85 spp, 55.8%) fueron residentes permanentes, y 23.6% fueron visitantes de invierno (36 spp), mientras las otras categorías de estacionalidad tuvieron pocas especies (Tabla 1). Con respecto a la abundancia, registramos un total de 8,735 aves durante todo el muestreo, encontrando 87 especies raras (57.2%), 38 poco comunes (25%), 20 moderadamente comunes (13.2%), mientras solo 7 especies fueron comunes o abundantes (Tabla 1). De los tres sitios, encontramos un mayor número de especies abundantes en El Realito comparado con Tolteca-Riberas y Cortijo (Tabla 1). Los gremios alimenticios más representativos para los tres sitios de muestreo fueron insectívoros con 73 especies (48.1%), carnívoros con 20 spp (13.2%) y piscívoros con 13 spp (8.6%), mientras que el resto de los gremios alimenticios fueron representados por menos especies (Tabla 1). La especie insectívora más abundante fue el luis bienteveo (Pitangus sulphuratus), mientras que el carnívoro más abundante fue el aguililla gris (Buteo plagiatus) y el piscívoro más abundante fue la garza dedos dorados (Egretta thula) (Anexo 1).
Tabla 1 Distribución de la riqueza de especies de aves de acuerdo con las categorías de estacionalidad, gremios alimenticios y abundancia relativa para cada sitio de muestreo en el Río La Silla.
| El Realito | Tolteca-Riberas | Cortijo | Global | |
| Estacionalidad | ||||
| Residentes | 76 | 65 | 56 | 85 |
| Residentes de verano | 9 | 7 | 4 | 10 |
| Visitantes de invierno | 30 | 19 | 21 | 36 |
| Transitorias | 11 | 6 | 2 | 13 |
| Ocasionales/accidentales | 3 | 6 | 0 | 8 |
| Gremios alimenticios | ||||
| Carnívoro | 17 | 9 | 7 | 20 |
| Carroñero | 2 | 2 | 2 | 2 |
| Frugívoro | 5 | 7 | 6 | 9 |
| Granívoro | 9 | 7 | 7 | 11 |
| Herbívoro | 3 | 2 | 1 | 3 |
| Invertebrados acuáticos | 7 | 4 | 2 | 7 |
| Invertebrados terrestres | 60 | 48 | 42 | 73 |
| Nectarívoro | 3 | 2 | 2 | 3 |
| Omnívoro | 11 | 8 | 6 | 11 |
| Piscívoro | 12 | 13 | 7 | 13 |
| Abundancia relativa | ||||
| Abundante | 6 | 3 | 1 | 3 |
| Común | 7 | 7 | 5 | 4 |
| Moderadamente común | 31 | 17 | 16 | 20 |
| Poco común | 35 | 35 | 28 | 38 |
| Rara | 50 | 41 | 32 | 87 |
Registramos 16 especies que se encuentran bajo alguna categoría de protección de acuerdo con la Norma Oficial Mexicana NOM-059-SEMARNAT-2010, además de 4 especies consideradas En Peligro o Vulnerable en la Lista Roja de Especies Amenazadas (IUCN 2020). Esto incluyó 4 especies de psitácidos en peligro: la guacamaya verde (Ara militaris), el loro cabeza amarilla (A. oratrix) y los loros endémicos a Mexico (A. viridigenalis, y A. finschi), además de dos especies consideradas Vulnerables: el halcón peregrino (Falco peregrinus, y el perico mexicano (Psittacara holochlorus) (Anexo 1). Otras 10 especies se consideran de Protección Especial en la legislación mexicana (Anexo 1). Por otra parte, el papamoscas boreal (Contopus cooperi) es considerado casi amenazado en la Lista Roja de Especies Amenazadas (IUCN 2020). Trece de las 17 especies encontradas bajo alguna categoría de riesgo fueron registradas en El Realito, mientras que Tolteca-Riberas contó con 10 especies y Cortijo con 7 especies.
Entre los registros más relevantes para el Río La Silla se encuentran el gorrión cantor (Melospiza melodia) y el chipe dorado (Protonotaria citrea), especies migratorias registradas únicamente durante el premuestreo en el sitio Tolteca-Riberas. Buteogallus anthracinus, el ibis blanco (Eudocimus albus) y M. semitorquatus fueron registradas por primera vez dentro del área metropolitana de Monterrey en los sitios El Realito y Cortijo (Figura 2A-D). También confirmamos la actividad reproductiva de la garza tricolor (Egretta tricolor) y la garza azul (E. caerulea) en los sitios El Realito y Tolteca-Riberas. Por tres años consecutivos, observamos adultos de E. tricolor transportando material para el nido, así como juveniles utilizando las ramas de T. macronatum como sitio de percha (Figura 2E), junto a otras seis especies de garzas que anidan en el sitio: garza blanca (Ardea alba), garza morena (A. herodias), E. thula, garza nocturna corona negra (Nycticorax nycticorax), garza nocturna corona clara (Nyctanassa viola-cea), y B. ibis. Únicamente en 2017, observamos actividad reproductiva en una pareja de E. caerulea y un juvenil fue observado hasta octubre del mismo año (Figura 2F). Adicionalmente, observamos actividad reproductiva de diferentes grupos de aves incluyendo B. plagiatus, la calandria dorso negro menor (Icterus gularis) y P. aglaiae (Figura 2G-I).

Figura 2 Registros relevantes y confirmación de actividad reproductiva de distintas especies de aves que utilizan el corredor ribereño urbano Río La Silla. (A) Chipe dorado Protonotaria citrea registrado en Tolteca-Riberas durante el premuestreo; (B) halcón selvático de collar Micrastur semitorquatus, registrado en Cortijo; (C) aguililla negra menor Buteogallus anthracinus, adulto registrado en El Realito; (D) ibis blanco Eudocimus albus, adultos y juveniles registrados en El Realito y Tolteca-Riberas; (E) garza tricolor Egretta tricolor, juvenil en Tolteca-Riberas; (F) garza azul E. caerulea, juvenil en El Realito; (G) calandria dorso negro mayor Icterus gualris, adulto construyendo nido en Tolteca-Riberas; (H) aguililla gris Buteo plagiatus, juvenil en El Realito; y (I) cabezón degollado Pachyramphus aglaiae, macho adulto colectando material para nido en El Realito.
Variación entre sitios
Los valores de completitud para todos los tres sitios de muestreo fueron mayores al 80%, por lo que consideramos que el muestreo en cada sitio fue representativo. Hubo diferencia significativa en la abundancia de aves entre los tres sitios de muestreo (X22, 72 = 11.4, P < 0.001). Las comparaciones de pares posthoc mostraron que el sitio Cortijo tuvo significativamente menor número de aves comparado con El Realito (U = 161, P < 0.001) y Tolteca-Riberas (U = 132.5, P < 0.001). Registramos una mayor abundancia de aves en El Realito con 3,499 aves, seguido de Tolteca-Riberas con 3,172 aves, con un número menor de 2,064 aves en Cortijo que se encuentra en un área mayormente urbano con constante actividad antropogénica. Las curvas de rarefacción también mostraron que el sitio El Realito tuvo significativamente mayor riqueza con 129 especies, comparado con los sitios de Tolteca-Riberas (103 spp) y Cortijo (82 spp; Figura 3). Por otro lado, las curvas de rango-abundancia mostraron un patrón similar en la distribución de las abundancias para los tres sitios del Río La Silla, teniendo pocas especies abundantes, algunas especies con abundancias intermedias y muchas especies raras (Figura 4). Las cinco especies de aves dominantes de acuerdo con su abundancia relativa fueron cinco residentes: Q. mexicanus (16.2%), P. holochlorus (7.9%), P. sulphuratus (5.8%), M. aurifrons (4.7 %) y P. caerulea (4.7%), lo que juntos representan el 39.3% de los individuos registrados en este estudio. Adicionalmente, El Realito mostró una mayor abundancia de zopilote común (Coragyps atratus) (2.7%) y zopilote aura (Cathartes aura) (2.1%) en comparación con los otros dos sitios de muestreo (Figura 4). De los tres sitios, El Realito mostró un mayor número de especies residentes permanentes (60.8%), residentes de verano (5.9%), visitantes de invierno (19.7%), transitorias (7.2%) y ocasionales (1.9%) en comparación con Tolteca-Riberas y Cortijo (Tabla 1). Dentro de este corredor ribereño, 41.2% de las aves insectívoras pertenecían a las familias Tyrannidae y Parulidae, de las cuales registramos únicamente nueve especies en el sitio El Realito durante la temporada de migración (Anexo 1).
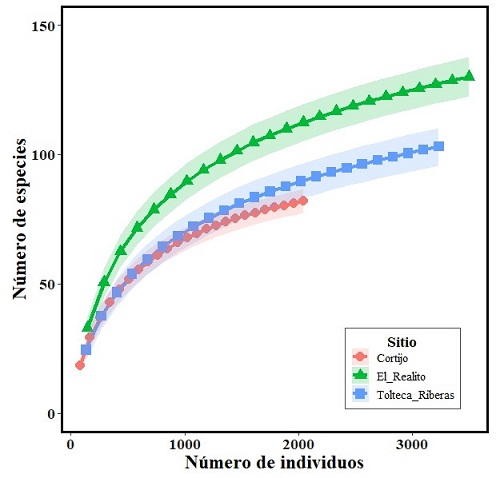
Figura 3 Curvas de rarefacción basada en individuos representando la riqueza de especies para los sitios de muestreo El Realito, Tolteca-Riberas y Cortijo en el Río La Silla. La región transparente representa el intervalo de confianza para cada sitio

Figura 4 Curvas rango-abundancia representando la estructura de la comunidad de aves en los tres sitios de muestreo (El Realito, Tolteca-Riberas y Cortijo) en el Río La Silla. Los números representan las diez especies más abundantes para cada sitio: 1 = Quiscalus mexicanus; 2 = Coragyps atratus; 3 = Cathartes aura; 4 = Psittacara holochlorus; 5 = Zenaida asiatica; 6 = Pitangus sulphuratus; 7 = Polioptila caerulea; 8 = Melanerpes aurifrons; 9 = Egretta thula; 10 = Ortalis vetula; 11 = Amazona viridigenalis; 12 = Setophaga coronata; 13 = Baeolophus atricristatus; 14 = Cyanocorax yncas; 15 = Turdus grayi.
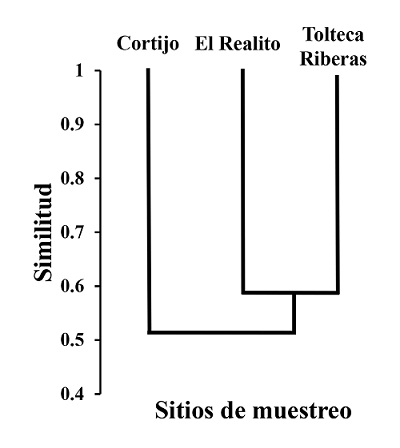
Respecto a la similitud de especies entre sitios de muestreo, El Realito incluyó 35 especies exclusivas, mientras que Cortijo y Tolteca-Riberas sólo contaron con 7 y 6 especies exclusivas, respectivamente. Los tres sitios comparten 63 especies (41.5%). El análisis de agrupamiento mostró una mayor similitud entre los sitios El Realito y Tolteca-Riberas, que con Cortijo (Figura 5). En El Realito encontramos 86% de la avifauna del Río La Silla (73% de las aves compartidas entre los tres sitios son residentes y 23% son migratorias), incluyendo cinco aves acuáticas que sólo registramos en El Realito: pato arcoíris (Aix sponsa), agachona norteamericana (Gallinago delicata), zambullidor pico grueso (Podilymbus podiceps), cerceta alas azules (Spatula discors) y Zambulldiro menor (Tachybaptus dominicus. Por otra parte, únicamente en Tolteca-Riberas registramos P. citrea y M. melodia, especies consideradas como ocasionales para Nuevo León. Adicionalmente, sólo en el sitio Cortijo registramos al chinito (Bombycilla cedrorum). Por último, no encontramos una diferencia significativa en la abundancia de aves registradas entre los dos años de muestreo (W = 445, Z = 1.759, P = 0.07).
Discusión
Las 152 especies que registramos en el río La Silla representan 36.3% de la avifauna reportada para Nuevo León de acuerdo con el último inventario avifaunístico (Contreras-Balderas et al. 2008) y 32.4% de las especies de aves registradas en la plataforma eBird.org (Sullivan et al. 2009, eBird 2021). Además, la riqueza de especies que registramos para el Rio La Silla demostró ser casi dos veces mayor a los 77 especies reportado por Cantú et al. (2014), cuyo trabajo se limitó a una sección al sur de este río en Monterrey. A pesar de su ubicación dentro de la metrópoli, el Río La Silla mostró una riqueza y abundancia considerable de aves, debido tanto a las especies residentes como a las presentes durante los periodos migratorios. Monterrey y su área metropolitana se encuentran dentro de la Ruta Migratoria del Centro, por la cual viajan aves de las grandes praderas norteamericanas, pasando por México a través de la Sierra Madre Oriental y Occidental, y por el Altiplano Central (Berlanga y Rodríguez 2010). Aunado a ello, los corredores ribereños proporcionan un hábitat para descansar y alimentarse, fomentando que las especies puedan continuar su viaje migratorio (Manci 1989). Debido a su posición geográfica y su conexión con la Sierra Madre Oriental, el Río La Silla es probablemente un valioso punto de escala y tránsito para las aves migratorias mientras atraviesan la mancha urbana.
En el presente estudio mostramos que las especies introducidas de C. livia, P. domesticus y S. decaocto conformaron sólo 2% del total de aves registrados. La mayor abundancia corresponde a Q. mexicanus, una especie nativa del sur de México y cuyo rango de distribución se ha ampliado hacia el norte de América debido a su preferencia por los ambientes urbanizados (Wehtje 2003). Dentro de los paisajes urbanos, la presencia humana se asocia con una mayor densidad de especies introducidas que son favorecidas por su capacidad de explotar los recursos antropogénicos y su dieta omnívora (Chace y Walsh 2006, Aouissi et al. 2017). Asimismo, se considera que en general los omnívoros están bien representados por especies nativas y exóticas de amplia distribución (Chace y Walsh 2006). Sin embargo, nuestra área de estudio no cumple con este patrón ya que sólo registramos 11 especies omnívoras, que representaron únicamente 16.3% de la abundancia de aves registrados, siendo Q. mexicanus la más abundante en los tres sitios de muestreo.
El gremio alimenticio más abundante en el Río La Silla fue los insectívoros, representando casi la mitad de las especies de aves registradas. Varios estudios han encontrado que las aves insectívoras son las más vulnerables a los efectos negativos de la urbanización (Clergeau et al. 1998, Jokimäki et al. 2002), aunque algunas especies han mostrado una mejor adaptación a una amplia variedad de hábitats y nichos ecológicos (Traylor y Fitzpatrick 1982). La abundancia de las aves insectívoras en el Río La Silla pudiera estar asociado con la vegetación arbórea que se desarrolla a la orilla del río. Se ha demostrado que las áreas verdes de mayor extensión y con mayor cobertura vegetal son preferidos por las aves insectívoras dentro de los sistemas urbanos (Kark et al. 2007, Carbó-Ramírez y Zuria 2011, MacGregor-Fors y Schondube 2011), ya que estos hábitats proveen una mayor densidad y diversidad de insectos que hábitats altamente urbanizados (DeGraaf y Wentworth 1986). La abundancia y diversidad de insectívoros sugiere que el Río La Silla ofrece una fuente valiosa de alimento para las aves insectívoras, tanto residentes como migratorias, mostrando el importante papel de estos hábitats ribereños como potenciadores de la biodiversidad en zonas urbanas (Sabo et al. 2005, Oneal y Rotenberry 2008, Domínguez-López y Ortega-Álvarez 2014).
El segundo gremio alimenticio mejor representado en el Río La Silla fue los carnívoros, y se ha encontrado que las áreas urbanas albergan mayores densidades de aves y pequeños mamíferos, que representan presas potenciales para aves rapaces (Ranazzi et al. 2000, Mannan y Boal 2000, Rullman y Marzluff 2014, La Porte et al. 2020). Las aves rapaces pueden encontrar sitios para la crianza en áreas urbanizadas, siempre que haya una cobertura de vegetación adecuada que proporcione estructura para la anidación (Rullman y Marzluff 2014). Lo anterior podría explicar la presencia de nidos e individuos juveniles de A. cooperii y B. plagiatus en los tres sitios de muestreo, especies capaces de tolerar la perturbación humana (Chace y Walsh 2006) y que se ven favorecidas por la presencia de agua dentro de la ciudad (Boal y Mannan 1998). Nuestros resultados sugieren que el Río La Silla proporciona suministro suficiente de recursos alimenticios y hábitat de anidación para estas aves rapaces, como ocurre en otros hábitats ribereños de zonas urbanas y suburbanas (Newton 1979, Love y Bird 2000). En particular, en el sitio El Realito encontramos abundancia de C. aura y C. atratus, dos especies comunes en entornos urbanos y que están asociadas a la acumulación de desechos en las ciudades (Novaes y Cintra 2015). Factores como la cobertura vegetal y la disponibilidad de sitios de descanso regulan el uso del hábitat de las aves rapaces y carroñeras (Schnell 1968, Preston 1990, Kirk y Currall 1994). Lo anterior resulta relevante para el correcto manejo del río La Silla, ya que las aves son indicadoras potenciales de la salud del ecosistema en general y de la calidad del hábitat ribereño en particular (Larsen et al. 2010).
En el presente estudio, registramos siete de las doce especies de psitácidos reportados para el área metropolitana de Monterrey, cuyas poblaciones dentro de la ciudad son consideradas ferales (Valdés-Peña y González-Rojas 2006, Mori et al. 2017). Por lo general, las áreas verdes en zonas urbanas proveen árboles nativos y exóticos para psitácidos que se adaptan y hacen uso de recursos alimenticios y sitios para anidar (Santos y Ragussa-Netto 2014, Diamond y Ross 2019). Lo anterior podría explicar la abundancia de psitácidos en el Río La Silla, que utilizan los individuos de gran talla del ciprés Moctezuma (T. mucronatum) como sitios de percha y las cavidades en estos árboles como como sitios de anidación. Además, la presencia de árboles nativos y ornamentales dentro del área de estudio (e.g. C. laevigata, E. anacua, M. azedarach y Morus rubra) cuyos frutos son carnosos ofrecen una fuente de alimento para las aves frugívoras residentes, así como para especies de aves que ocasionalmente visitan el Río La Silla como el chinito (B. cedrorum), un frugívoro de presencia irregular que se mueve en migraciones nómadas e impredecibles siguiendo el suministro de alimento (Ehrlich et al. 1988).
Por primera vez, confirmamos la actividad reproductiva de E. tricolor dentro del área urbana y su presencia a lo largo del año en Nuevo León. Esta especie es considerada ocasional para el estado de acuerdo con Contreras-Balderas et al. (2008), ya que sus sitios de reproducción se encuentran principalmente a lo largo de la línea costera del Atlántico, el Golfo de México, el Pacífico y en el este de la Península de Yucatán (Howell y Webb 1995). Después de la época reproductiva, algunos individuos se dispersan hacia el norte a lo largo de la costa y tierras interiores (Willard 1977, Telfair 1979). Sin embargo, estudios recientes han demostrado que algunas aves acuáticas como E. tricolor y E. albus son capaces de utilizar lagos urbanizados cerca de zonas costeras durante las temporadas de verano e invierno (Traut y Hostetler 2004, McKinney et al. 2011, Oliver et al. 2011). La persistencia de E. tricolor en el Río La Silla sugiere que puede depender de la provisión de hábitat para forrajeo, descanso y anidación dentro de este entorno urbano.
A pesar de que en el presente estudio no trabajamos en función de un gradiente de urbanización, encontramos que la riqueza de especies cambió significativamente entre sitios, siendo mayor en el sitio El Realito. Cabe destacar que los sitios El Realito y Tolteca-Riberas presentaron un mayor número de especies raras, lo que incrementó su riqueza específica a pesar de las condiciones ambientales y las actividades recreativas que están presentes a lo largo del Río La Silla. Aunque la riqueza de especies es diferente entre localidades del Río La Silla, los tres sitios de muestreo presentaron un patrón similar en las curvas de rango-abundancia debido a la evidente dominancia de unas pocas especies. La presencia de algunas especies muy abundantes y otras con un bajo número de individuos dentro de las comunidades de aves puede ser un reflejo de la perturbación del hábitat (Pearson et al. 1983, Clergeau et al. 1998, Cháux y Velasquez 2009). Además, encontramos una mayor similitud de especies de aves entre los sitios El Realito y Tolteca-Riberas, posiblemente por los tipos de vegetación presentes en ambos sitios de muestreo, así como su cercanía y conectividad entre sí.
Nuestros resultados muestran que el Río La Silla es un corredor ribereño urbano que alberga una tercera parte de la avifauna del estado, proporcionando recursos alimenticios y sitios de anidación para las aves residentes y migratorias en esta metrópoli del noreste de México. Alentamos a las autoridades civiles y políticas a considerar lo publicado en este documento, así como la intervención de ornitólogos para tomar acciones de conservación con base en el conocimiento previo sobre la biología y ecología de las especies de aves. Del mismo modo, es necesario promover entre los regiomontanos la participación ciudadana y actividades enfocadas a la concientización y educación ambiental, utilizando herramientas como la observación de aves en el Río La Silla para consolidar el contacto con la naturaleza dentro de la ciudad.











 nueva página del texto (beta)
nueva página del texto (beta)