Introducción
El análisis de egagrópilas ha sido calificado como una buena técnica para el estudio de la ecología trófica de las aves rapaces (Redpath et al. 2001, Yalden y Morris 2003, Magrini y Facure 2008). Analizar los huesos de presas también puede ser una herramienta indirecta no invasiva que permite conocer la composición de vertebrados en un determinado ambiente (Davis 1959, Chaline et al. 1974, Libiois 1984, Andrews 1990, Teixeira y Giovanelli 1999).
El búho listado, Asio clamator (Vieillot, 1807), presenta una distribución Neotropical que va desde el sur de México hasta el norte de Argentina (Narosky y Giacomo 1993, Martínez et al. 1996). La especie tiene hábitos de caza crepuscular y nocturna (Pautasso y de la Peña 2001), y ocupa una amplia variedad de hábitats como pastizales, zonas inundadas abiertas o semiarbóreas (Riaño et al. 2017). Los estudios alimenticios del búho listado provienen principalmente de la parte sur Amazónica de su distribución, donde se alimenta de una variedad de vertebrados pequeños y artrópodos, cuya masa oscila entre 2 - 1250 g (Massoia 1988, Isacch et al. 2000, Motta-Junior et al. 2004, Delgado-V et al. 2005, Pautasso 2006, Aguiar y Naiff 2009, Baladrón y Bó 2017).
Particularmente en Ecuador, los estudios publicados basados en el análisis de egagrópilas de Strigiformes son escasos (Freile et al. 2012), y en el caso del búho listado el conocimiento es nulo. Por lo tanto, este trabajo tiene por objeto estudiar por primera vez la composición de la dieta de un individuo del búho listado en un ambiente desértico árido de Atahualpa, provincia de Santa Elena. Asimismo, proponemos evaluar la variación de las presas entre dos épocas estacionales.
Métodos
El área de estudio pertenece a la provincia biogeográfica de Tumbes-Guayaquil (Chinchero et al. 2013), por lo que el clima se caracteriza por ser desértico árido. Recolectamos egagrópilas íntegras y disgregadas en noviembre de 2015 (tras época seca: agosto-noviembre) y en agosto de 2016 (tras época húmeda: diciembre-julio) en una quebrada (2°18’56.19”S, 80°46’56.64”W) a 36 msnm, localizada al suroeste del pueblo de Atahualpa en la provincia de Santa Elena. Las egagrópilas provén de un individuo, sexo indeterminado, y se encontraron bajo una percha en una construcción abandonada, seguramente algún tipo de acueducto o sistema para el transporte de agua. En noviembre de 2015, recolectamos 48 egagrópilas completas y 202.2 g de egagrópilas disgregadas, mientras que durante agosto del siguiente año se colectaron 24 egagrópilas enteras y 82.2 g de egagrópilas disgregadas.
Cada egagrópila fue colocada en fundas independientes a las que se asignó un código único para evitar confusiones. Posteriormente, se procedió a la inmersión en agua y detergente para su ablandamiento, facilitando así su disgregación con la ayuda de pinzas. El material disgregado fue separado según los grupos taxonómicos a los cuales pertenecían los restos y luego clasificados a nivel de género o especie. El número mínimo de individuos fue determinado por el conteo de cráneos y mandíbulas homologas para mamíferos y aves, y cabezas para invertebrados, descartando los otros restos para evitar reconteo (Manning y Jones 1990). Para el cálculo de la biomasa se multiplicó el peso promedio (en gramos) por el número mínimo de individuos de la especie (Herrera y Jaksic 1980). Los diferentes componentes alimenticios fueron identificados mediante el uso de guías disponibles (Brito et al. 2021, Ron et al. 2021, Torres-Carvajal et al. 2021), y mediante comparación con material de referencia depositado en el Instituto Nacional de Biodiversidad (INABIO).
Aplicamos un χ 2 de tabla de contingencia (especies y frecuencias) usando el programa Past (Hammer et al. 2001) para evaluar la asociación de clases de presas en la dieta del búho con las dos épocas (seca y húmeda); y para determinar relación de frecuencia de presa con la masa corporal, realizamos una regresión lineal simple. Para determinar qué tan especialista es la especie, se calculó la amplitud de nicho con el Índice estandarizado de Levins que tiene valores que van desde 0 hasta 1 sobre las presas (Levins 1968, Krebs 1999, Rau 2000) con la ayuda del programa HaviStat 2.2 (Montenegro et al. 2014). Expresamos los resultados en número mínimo de individuos por egagrópila, peso referencial de las presas y porcentaje de consumo de presas.
Resultados
Colectamos un total de 72 egagrópilas, determinando un número mínimo total de 1145 presas individuales, con 717 presas en la época seca y 428 presas en la época húmeda (Tabla 1). Las presas de mayor consumo fueron los grillos (437 individuos), seguidos por el ratón doméstico, Mus musculus (348 individuos) y la salamanquesa de la costa, Phyllodactylus reisii (167 individuos). Los otros ítems tuvieron representatividad menor (Tabla 1). El búho listado presentó un amplitud de nicho de Levins B = 0.25, representando una dieta especialista. No encontramos relación entre la masa corporal de las presas y su frecuencia en las egagrópilas (r 2 =0.105, gl = 11, P = 0.330).
Tabla 1 Presas del Búho listado Asio clamator en Atahualpa, Santa Elena. NMI = Número Mínimo de Individuos.
| Orden/Familia/Especie | Peso corporal (g) | Época seca CORT | Época húmeda GRE | ||
| NMI (%) | Biomasa g (%) | NMI (%) | Biomasa g (%) | ||
| Didelphimorphia | |||||
| Didelphidae | |||||
| Marmosa simonsi | 70 | - | - | 1(0.23) | 70.0 (2.8) |
| Rodentia | |||||
| Cricetidae | |||||
| Sigmodon peruanus | 72 | 1(0.13) | 72 (1.5) | 1 (0.23) | 72.0 (2.8) |
| Muridae | |||||
| Mus musculus | 14 | 284 (39.60) | 1176 (25.1) | 64 | 896.0 (35.2) |
| (14.95) | |||||
| Rattus rattus | 160 | - | - | 1 (0.23) | 160.0 (6.3) |
| Aves | 4(0.55) | - | 1 (0.23) | - | |
| Emberizidae | 3 (0.41) | - | - | - | |
| Columbidae | |||||
| Columbina sp. | 25 | 4 (0.55) | 100 (2.1) | - | - |
| ANURA | |||||
| Ceratophrys stolzmanni | 15 | - | - | 3 (0.70) | 45.0 (1.8) |
| Squamata | |||||
| Tropiduridae | |||||
| Microlophus occipitalis | 13 | 90 (12.55) | 1170 (25) | - | - |
| Phyllodactylidae | |||||
| Phyllodactylus reisii | 12 | 105 (14.64) | 1260 (26.9) | 62 (14.49) | 744.0 (29.3) |
| Teiidae | |||||
| Ameiva edracantha | 18 | 31 (4.32) | 558 (11.9) | 8 (1.87) | 144.0 (5.7) |
| Dicrodon guttulatum | 22 | 8 (1.11) | 176 (3.8) | 6 (1.40) | 132.0 (5.2) |
| Coleoptera | 1 | 2 (0.27) | 2 (0.03) | 1 (0.23) | 1.0 (0.01) |
| Carabidae | 0.5 | - | - | 2 (0.47) | 1.0 (0.01) |
| Orthoptera | |||||
| Gryllidae | 1 | 161 (22.45) | 161 (3.4) | 276(64.49) | 276.0 (10.9) |
| Acridae | 0.5 | 17 (2.37) | 8.50 (0.2) | 1 (0.23) | 0.5 (0) |
| Schistocerca sp. | 0.5 | 7 (0.97) | 3.5 (0.1) | 1 (0.23) | 0.5 (0) |
| Total | 717 (100) | 4687 (100) | 428(100) | 2542 (100) | |
Encontramos una asociación significativa de presa en la dieta por época (seca y húmeda) del año ( χ 2 = 9.3, gl = 1, P < 0.006). En la época seca hubo un promedio de 5.3 ± 5.1 presas por egagrópila (rango 2 23 presas, n = 24 egagrópilas). Las presas con mayor frecuencia en la dieta fueron los mamíferos (39.7%), principalmente roedores (Tabla 1), seguido por los reptiles (32.6%) y los insectos (30.3%), mientras las aves y anfibia representaron <5% de su dieta (Fig. 1A). Entre las especies de roedores, el ratón doméstico fue la presa más consumida con un total de 284 individuos, lo que constituyó el 39.6% del total de individuos en la dieta durante la época seca (Tabla 1). Entre los reptiles, la salamanquesa común de la costa destacó por sus 105 individuos, lo que representó el 14.6% de individuos consumidos en la dieta en la época seca (Tabla 1). Para la época húmeda, hubo un promedio de 11.2 ± 6.2 presas por egagrópila (rango 2 - 25 presas, n = 48 egagrópilas), donde los insectos (65.7%) constituyeron el componente más importante de la dieta (Fig. 1A), seguido por reptiles (17.8%) y mamíferos (15.6%), con poco representación por anfibios y aves (Fig. 1A).
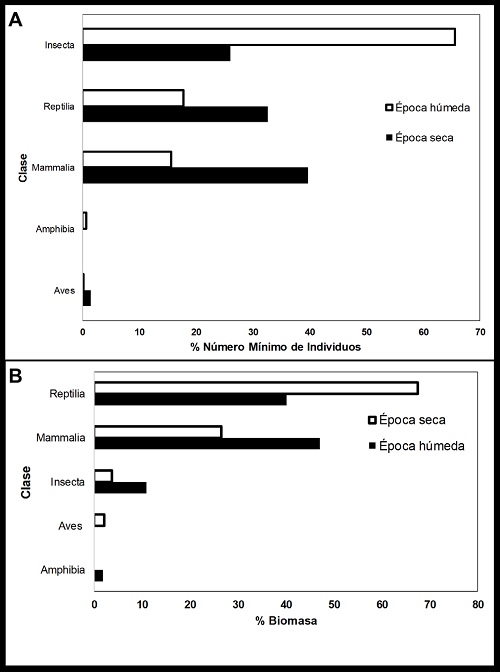
Figura 1 Composición de presas por clase en la dieta del búho listado durante la época seca y húmeda en Santa Elena, Ecuador. A) porcentaje del Número Mínimo de Individuos consumidos; B) porcentaje de la biomasa consumida.

Figura 2 Algunas presas fuente principal de biomasa en la dieta del búho listado en Atahualpa, Ecuador. A = Ceratophrys stolzmanni, B = Rattus rattus, C = Mus musculus, D = Sigmodon peruanus, E = Dicrodon guttulatum, F = Marmosa simonsi. Barras = 5 mm.
En términos de biomasa, para la época seca los reptiles (67.5% de biomasa en la época seca) contribuyeron con la mayor cantidad de biomasa consumida por el búho listado (Fig. 1B), seguido de los mamíferos (26.6% biomasa en época seca), mientras los insectos, aves y anfibios proporcionaron <5% de la biomasa de la dieta cada uno (Fig. 1B). En cambio, para la época húmeda los mamíferos representaron la mayor cantidad de 47.4% de biomasa consumida (Fig. 1B), seguido de los reptiles con un 40.1% de biomasa y los insectos con un 11.0% de biomasa en la época húmeda (Fig. 1B).
Discusión
En nuestro estudio registramos un alto número de hasta 25 individuos de presas por egagrópila, y un promedio de 5 a 11 individuos por egagrópila. Existe poca información del número de individuos consumidas por egagrópila en el búho listado, a excepción del trabajo presentado por Lo Coco et al. (2012) donde dieron a conocer una cantidad de un individuo por egagrópila. Esta diferencia podría estar ligada al tamaño de la presa. En nuestro estudio, las presas tuvieron peso promedio de 28.3 g en comparación con 150 g reportados en Lo Coco et al. (2012), >100 g en Motta-Junior et al. (2004), y 32 -315 g en Pautasso (2006).
Además, encontramos tendencias estacionales en la dieta del búho listado, donde los mamíferos alcanzaron los valores máximos de abundancia en la dieta en la época seca, siendo sustituidos durante la época húmeda por los insectos, aunque ambas épocas mostraron un consumo relativamente alto de reptiles. Igualmente para biomasa de la dieta, los reptiles aportaron la mayor cantidad de biomasa para la época seca y para la época húmeda fueron los mamíferos. Una tendencia de variación estacional distinta a la encontrada en este estudio fue reportado en Brasil, donde las aves fueron más consumidas y con más aporte de biomasa en la época seca y los mamíferos en la época húmeda (Motta-Junior et al. 2004).
Nuestros resultados de amplitud de nicho sugieren que el búho listado en Atahualpa presenta una moderada especialización individual (Bolnick et al. 2003) en su uso de las presas en la dieta y con táctica de caza oportunista. Además, el búho listado estaría proporcionando un servicio ecosistémico valioso como controlador de poblaciones de del roedor M. musculus una especie invasora en Ecuador, que además de plaga suelen ser portadora de enfermedades (Gollop et al. 1993, Lowe et al. 2000, Lobos et al. 2005, Kross et al. 2016). Nuestro estudio también da a conocer por primera vez al anuro Ceratophrys stolzmanni Steindachner, 1882 (Ceratophryidae) como componente dietético del búho listado. Entre los anfibios, los anuros de las familias Hylidae, Leptodactylidae y otros fueron reportados en la dieta del búho listado en Brasil por Motta-Junior et al. (2004) y en Colombia por Delgado et al. (2005).
Finalmente, considerando que en el presente trabajo se encontró un alto número de presas por egagrópila y diferente composición de presas en la dieta del búho listado en un ambiente seco en Ecuador, destaca la importancia de realizar estudios de dieta en otros ambientes y áreas de distribución. Asimismo, estudios complementarios que incluyan evaluaciones a largo plazo de las especies nativas e invasoras, tratando variables como uso de hábitat, conducta, densidad y dinámica poblacional ayudará a comprender la interacción y sus efectos sobre el ambiente.











 nueva página del texto (beta)
nueva página del texto (beta)


