Introducción
Los humedales del noroeste de México son áreas de reproducción esenciales para muchas aves acuáticas (Everett y Anderson 1991, Velarde et al. 2005), incluidas entre ellas las aves playeras (Massey y Palacios 1994, Mellink y Riojas-López 2005, Palacios et al. 2017). A pesar de su importancia ecológica, estos humedales se encuentran sometidos a fuertes presiones antropogénicas (Moreno-Casasola 2008, Díaz-García y Ojeda-Revah 2013) las cuales pueden y en algunos casos han provocado modificaciones y una degradación de las zonas de reproducción y alimentación de las aves acuáticas (Landgrave y Moreno-Casasola 2012), lo que a su vez podría resultar en una disminución en el éxito de anidación, así como la posible erradicación de sus poblaciones (Thomas et al. 2006).
En México las aves playeras están representadas por seis familias: Burhinidae (una especie), Recurvirostridae (2), Haematopodidae (2), Charadriidae (12), Jacanidae (1) y Scolopacidae (41; Escalante et al. 2014). Son predominantemente migratorias, y conforman uno de los grupos más abundantes en el Neártico (Myers et al. 1987, Paulson 1993). En el país estas aves son en su mayoría migratorias y muy numerosas durante el invierno, particularmente en la región noroeste (p. ej. Page et al. 1997, Engilis et al. 1998, Carmona et al. 2011a), en donde representan en conjunto, abundancias que rebasan el millón de individuos (Carmona y Danemann 2014), aunque también hay poblaciones, más pequeñas, de especies residentes que se reproducen en el país.
En México anidan 11 especies (Semarnat 2008), nueve de las cuales están reportadas para el noroeste del país. Cuatro de ellas se consideran en alguna categoría de amenaza, por la normativa mexicana (DOF 2019): Charadrius nivosus (chorlo nevado), Ch. wilsonia beldingi (chorlo pico grueso), Haematopus palliatus frazari (ostrero americano) y H. bachmani (ostrero negro); la tercera en peligro de extinción y las otras amenazadas.
Las nueve especies de aves playeras que se reproducen en el noroeste del país anidan en ambientes variados, como sitios dulceacuícolas, salobres y marinos. Algunas especies utilizan también áreas artificiales, como salinas (Carmona y Danemann 1998), lagunas de oxidación (Carmona et al. 2003), granjas acuícolas (Young y Chan 1997) y sitios de depósito de material de dragado (islas artificiales) conocidos como “tarquinas” (Bustamante 2013).
El número de estudios publicados sobre poblaciones reproductoras de aves playeras en México es menor a los estudios para poblaciones invernantes, hasta 2010 era de 20 y 120 trabajos, respectivamente (Carmona et al. 2011b). Esto se debe en parte a que la abundancia de las aves reproductoras es menor, así como a la dificultad de localizar sus nidos porque generalmente son dispersos (Mellink et al. 2009, Galindo-Espinosa y Palacios 2015).
No obstante, existen estudios donde se ha documentado la relevancia del país para la reproducción de algunas especies, como el chorlo nevado (Palacios et al. 1994, Bustamante 2013, Galindo-Espinosa y Palacios 2015) y el ostrero americano, para este último se indica que más del 90% de la subespecie frazari anida en territorio nacional (Palacios et al. 2017, Carmona et al. 2018).
Por región, los sitios peninsulares están mejor caracte rizados. Por ejemplo, el área con más información es su costa occidental (p. ej. Palacios et al. 1994, Galindo-Espinosa y Palacios 2015). En contraste, para las lagunas continentales, aunque se sabe que existen sitios potencialmente adecuados para la reproducción de aves playeras, la información existente se limita a listados para algunas áreas, como Laguna Las Garzas, Nayarit (Bustamante 2013) o a nuevos registros específicos, como los realizados para Charadrius collaris (chorlo de collar) en Ensenada Pabellones (González-Bernal et al. 2007) y Marismas Nacionales (Ortega-Solís et al. 2017).
Los sitios de anidación de las aves playeras se ven severamente afectados por la pérdida de hábitat asociada con actividades antropogénicas, como el turismo, la acuacultura, la agricultura y el crecimiento de asentamientos urbanos, lo anterior es notoriamente evidente en el noroeste del país dada su tasa de desarrollo (Díaz-García y Ojeda-Revah 2013), por lo que es relevante estudiar aspectos asociados con la ecología reproductiva de estas aves en la región, sobre todo al considerar la escasa información existente para la mayoría de los sitios. Como una contribución a paliar dicha carencia, este estudio evaluó la importancia de 12 humedales del noroeste de México para la reproducción de 9 especies de aves playeras, con información de la temporada reproductiva de 2017.
Métodos
Área de estudio
La zona costera del noroeste de México se extiende por 3,624 km, y comprende la península de Baja California, Sonora, Sinaloa y Nayarit, lo que representa el 33% de la línea costera del país (Ortiz-Pérez y de la Lanza-Espino 2006). De esta región seleccionamos 12 humedales considerados prioritarios por su importancia para las aves playeras debido al número de individuos que los utilizan (Semarnat 2008; Figura 1). De estos sitios, 11 también han sido designados como áreas de importancia para la conservación de las aves (AICAS), seis como áreas naturales protegidas (ANP), 10 son humedales de importancia internacional (Ramsar) y 11 pertenecen a la Red Hemisférica de Reservas para Aves Playeras (Cuadro 1). Seis sitios tienen los cuatro reconocimientos, tres de ellos tres RECONOCIMIENTOS y los tres restantes sólo dos (Cuadro 1). Tres se localizan en Baja California Sur, uno es compartido entre Baja California y Sonora, tres se localizan en el último estado, cuatro se ubican en Sinaloa y uno más es compartido entre Sinaloa y Nayarit (Cuadro 1). Su superficie total va de 7,100 (Yavaros-Moroncárit) a 934,000 ha (Alto Golfo de California; Cuadro 1). Diez de los humedales se encuentran inmersos en un clima seco desértico, sólo Huizache-Caimanero (al sur de Sinaloa) presenta un clima seco tropical y Marismas Nacionales (entre Sinaloa y Nayarit) un clima cálido subhúmedo.
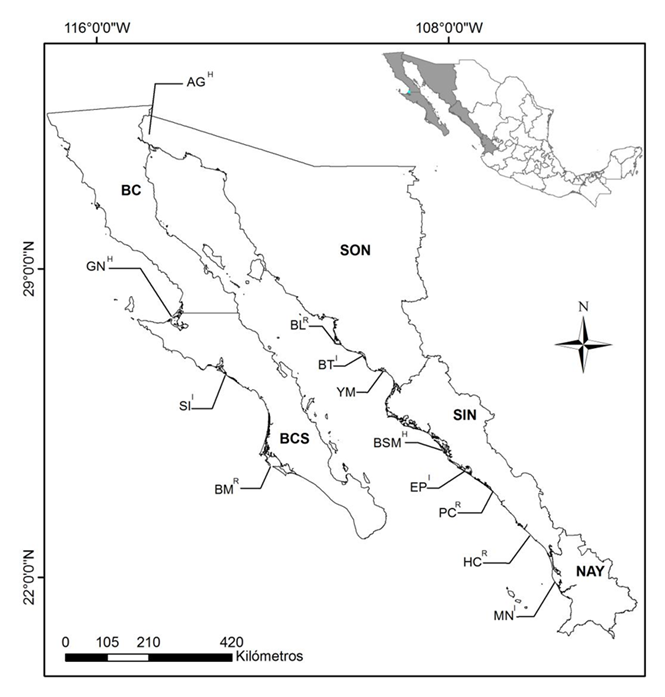
Figura 1 Ubicación de los 12 sitios de estudio de aves playeras en el noroeste de México (BCS = Baja California Sur, BC = Baja California, SON = Sonora, SIN = Sinaloa y NAY = Nayarit). Bahía Magdalena (BM), Complejo San Ignacio (SI), Complejo lagunar Ojo de Liebre-Guerrero Negro (GN), Alto Golfo de California y Delta del Río Colorado (AG), Bahía de Lobos (BL), Yavaros-Moroncárit (YM), Bahía de Tóbari (BT), Bahía Santa María (BSM), Ensenada Pabellones (EP), Playa Ceuta (PC), Sistema lagunar Huizache-Caimanero (HC) y Marismas Nacionales (MN). Se indica en superíndice la categoría de cada sitio en la Red Hemisférica de Reservas para Aves Playeras RHRAP: R = Regional, I = Internacional y H = Hemisférica.
Cuadro 1 Doce sitios visitados donde se indica la zona, el nombre del sitio, el (los) estado (s) al que pertenece (BCS = Baja California Sur, BC = Baja California, Son = Sonora, Sin = Sinaloa y Nay = Nayarit), sus coordenadas centrales, la fecha de visita, la superficie total y su estatus de conservación: (A) Área de Importancia para la Conservación de las Aves, (B) Área Natural Protegida, (C) Sitio Ramsar y (D) Red Hemisférica de Reservas para Aves Playeras.
| Zona | Sitio | Estado | Coord. centrales | Fechas conteos | Estatus | Sup. Total (ha) |
|---|---|---|---|---|---|---|
| Peninsular | Bahía Magdalena | BCS | 24°37’ N y 111°58’ O | 21-23/mayo | (A) NA4-C, (D) R | 139,000 |
| Complejo San Ignacio | BCS | 26°44’N y 113°12’ O | 26-27/mayo | (A) G4-C, (B) RB, (C), (D) I | 15,000 | |
| Complejo lagunar Ojo de Liebre-Guerrero Negro | BCS | 28°05´ N y 114°22 | 22-25/mayo | (A) NA4-C, (B) RB, (C), (D) H | 92,000 | |
| Continental | Alto Golfo de California y Delta del Río Colorado | BC-Son | 31°35’ N y 114°25’O | 18-23/mayo | (A) G1, (B) RB, (C), (D) H | 934,756 |
| Bahía de Lobos | Son | 27°21’N y 110°33’ | 16-17/mayo | MEX4-C, APFF, (C), (D) R | 13,600 | |
| Bahía de Tóbari | Son | 27°01’ N y 109°55’O | 18-19/mayo | MEX4-C, APFF, (D) I | 16,700 | |
| Yavaros-Moroncárit | Son | 26°42’ N y 109°32’ O | 20-21/mayo | (A) MEX4-C, (C) | 7,100 | |
| Bahía Santa María | Sin | 24°59’ N y 108°05’ O | 28-30/mayo | (A) G4-C, (C), (D) H | 135,000 | |
| Ensenada Pabellones | Sin | 24°30’ N y 107°44’ O | 26-27/mayo | (A) G4-A, (C), (D) I | 36,000 | |
| Playa Ceuta | Sin | 24°15’ N y 107°17’ O | 25/mayo | (C), (D) R | 7,300 | |
| Sistema lagunar Huizache-Caimanero | Sin | 22°59’ N y 106°07’ O | 24/mayo | (A) G4-A, (C), (D) R | 17,500 | |
| Marismas Nacionales | Sin-Nay | 22°07´ N y 105°32´ O | 16-23/mayo | (A) G4-A, (B) RB, (C), (D) I | 300,000 |
Criterio (A). Áreas de Importancia para la Conservación de las Aves: G1: contiene una población de una especie considerada como globalmente amenazada, en peligro o vulnerable. G4-A: sitios que contienen a más del 1% de la población mundial de una especie acuática gregaria. G4-C: sitios que contienen más de 500,000 aves playeras. NA4C: sitio que contiene más de 100,000 aves playeras. MEX4C: sitio que contiene más de 20,000 aves playeras (tomado y resumido de Arizmendi y Márquez 2000).
Criterio (B). Categorías Área Natural Protegida: RB = Reserva de la Biosfera, APFF = Área de Protección de Flora y Fauna.
Criterio (D). Categorías Red Hemisférica de Reservas para las Aves Playeras: en orden creciente: Regional (R), Internacional (I) y Hemisférico (H). Para detalles ver: RHRAP 2020.
Diseño de muestreo y toma de datos
Visitamos los 12 sitios entre el 15 y el 28 de mayo de 2017. En la toma de datos participamos 18 personas que, divididas y coordinadas en cuatro equipos de trabajo, recorrimos todos los sitios en 14 días (para detalles ver abajo). Para cada sitio y dependiendo de su tamaño, la vistita duró entre uno y siete días (Cuadro 1).
En cada sitio realizamos un conteo de especies de aves playeras (que potencialmente se pudieran reproducir en las zonas) y búsqueda de evidencias de reproducción (comportamiento de distracción antidepredador, nidos con huevos o pollos y presencia de pollos o volantones). Los conteos se realizaron desde diferentes tipos de vehículos, dependiendo de la naturaleza del terreno (embarcaciones menores, aerobotes, anfibios, carros, cuatrimotocicletas y a pie). En cada sitio los conteos implicaron un esfuerzo espacial lo más exhaustivo posible, tratando de abarcar la mayor parte del perímetro interno de cada humedal, los recorridos los realizamos lo más cerca posible a la línea de costa. La búsqueda de evidencia reproductiva la realizamos mediante caminatas en zonas con posibilidad de presencia de nidos (p. ej., playas arenosas, islas y barras arenosas).
En cada humedal identificamos a las especies con la ayuda de binoculares (8 y 10x), telescopios (15-60x) y guías de campo (p. ej. Van Perlo 2006, Dunn y Alderfer 2011). Contamos a las aves de manera directa en parvadas de hasta 300 individuos, en parvadas mayores realizamos estimaciones utilizando el método de conteo por bloques (Howes y Bakewell 1989); el tamaño del bloque varió de 20 a 100 individuos, dependiendo del número de aves en la parvada. Estimamos el número de cada bandada con dos observadores, si las estimaciones diferían se repitió el conteo. La información así generada es robusta desde una óptica cualitativa (presencia/ ausencia de anidación), pero cuantitativamente representan sólo el número mínimo de nidos, dado que llevamos a cabo únicamente una visita por sitio (Carmona y Danemann 1994).
Resultados
En 14 días de conteos realizados en 2017 en los 12 sitios del noroeste de México obtuvimos un total de 6,960 registros de aves playeras potencialmente reproductivas, correspondientes a nueve especies (Cuadro 2) y un híbrido (H. palliatus x H. bachmani). Por sitio, las lagunas con mayor número de registros (independientemente de las especies) fueron Marismas Nacionales (2,433 registros), Huizache-Caimanero (910), Yavaros-Moroncárit (870) y Bahía de Tóbari (831); estos cuatro humedales se ubican entre el sur de Sonora y el norte de Nayarit y, en conjunto, acumularon el 72.5% de los registros.
Cuadro 2 Abundancia (número de individuos) de 9 especies de aves playeras reproductivas en 12 sitios de la zona costera del noroeste de México visitados en mayo del 2017. La letra mayúscula como superíndice en el nombre científico indica su estatus de protección en México (A = amenazada y P = en peligro de extinción). Las literales en superíndice en la abundancia indican el tipo de evidencia que confirma su reproducción (a = conducta, b = presencia de nidos y huevos, c = presencia de pollos y d = presencia de volantones).
| Sitio | Himantopus mexicanus | Recurvirostra americana | Haematopus palliatusP | Haematopus bachmaniA | Charadrius vociferus | Charadrius wilsoniaA | Charadrius collaris | Charadrius nivosusA | Jacana spinosa |
|---|---|---|---|---|---|---|---|---|---|
| Bahía Magdalena | 4a,b,c | 3 | 22a | 16c | |||||
| Complejo San Ignacio | 1 | 98a | 2a | ||||||
| Complejo lagunar Ojo de Liebre-Guerrero Negro | 2 | 4 | 236b,c | 6b,c | 8c | 36a,b,c | |||
| Alto Golfo de California y Delta del Río Colorado | 128a,b,c | 49a,b | 100a,b | 13a,b | 45b,c | 50c | |||
| Bahía de Lobos | 3 | 65a,b | 58a,b,c | 2 | |||||
| Yavaros-Moroncárit | 137a,b,c | 629 | 73b | 22a,b,c | 9a,b,c | ||||
| Bahía de Tóbari | 17 | 201 | 533b,c,d | 72c | 8 | ||||
| Bahía Santa María | 113b | ||||||||
| Ensenada Pabellones | 114a,b | 355 | 2 | 6a | 21c | 7c | |||
| Playa Ceuta | 82 | 203 | 5 | 6 | 14b | ||||
| Sistema lagunar Huizache- Caimanero | 467 | 426 | 7 | 2a | 8b | ||||
| Marismas Nacionales | 1,977 | 345 | 10c | 6a | 48b,c | 6 | 28b | 13c | |
| Total | 2,927 | 2,213 | 1,278 | 9 | 32 | 302 | 6 | 180 | 13 |
Por número de especies presentes, sobresalieron Marismas Nacionales (Sinaloa y Nayarit) con ocho, así como Guerrero Negro (Baja California Sur) y el Alto Golfo de California (Baja California y Sonora), cada uno con seis; el sitio con el menor número fue Bahía Santa María (Sinaloa) con sólo una especie (Cuadro 2). En cuanto a especies con evidencia de anidación, los sitios con mayor número fueron el Alto Golfo y Marismas Nacionales con seis y cinco, respectivamente, mientras que aquellos con menor número fueron Bahía Santa María y Ceuta, con sólo una (Cuadro 2). De las nueve especies de aves playeras que supuestamente se reproducen en el noroeste de México, confirmamos la anidación de ocho (Cuadro 2).
Por especie, independientemente del sitio, la abundancia mayor le correspondió a Himantopus mexicanus (candelero americano), con 2,927 registros (Cuadro 2). Marismas Nacionales fue el sitio con el mayor número de individuos de esta especie (1,977), e incluso, considerando los registros de todas las especies de aves playeras en dicho sitio, el 81% correspondió a esta especie. Por región, fue amplio su predominio en los humedales continentales con 2,925 registros. Observamos evidencia de su anidación en el Alto Golfo de California, Yavaros-Moroncárit y Ensenada Pabellones.
Recurvirostra americana (avoceta americana) fue la segunda especie en abundancia global con 2,213 registros (Cuadro 2). Los sitios numéricamente más importantes fueron Yavaros-Moroncárit (629), Huizache-Caimanero (426), Ensenada Pabellones (355) y Marismas Nacionales (345); estos cuatro sitios acumularon el 79% del total de sus registros, los números ma yores se ubicaron en los humedales continentales (2,208). Sin embargo, sólo observamos evidencias de su reproducción en el Alto Golfo de California (Cuadro 2).
Se realizaron 1,278 registros de Haematopus palliatus, especie en peligro de extinción (dof 2019; Cuadro 2). Respecto a los conteos por sitio, observamos a la especie en todos los humedales, con excepción de Ceuta (Sinaloa). Los números más grandes los observamos en Bahía de Tóbari (533 registros) y Guerrero Negro (236). Por región, en el continente se conjuntaron 903 registros y en la península los 375 restantes. Fue, junto con Charadrius nivosus, la especie para la que recabamos evidencias de su reproducción en la mayor cantidad de sitios, con nueve (Cuadro 2).
Respecto a H. bachmani, especie amenazada (dof 2019; Cuadro 2), sólo lo observamos en dos humedales del Pacífico sudcaliforniano, Guerrero Negro y Bahía Magdalena, con nueve registros (Cuadro 2). Además, observamos su reproducción únicamente en Guerrero Negro, en donde se observaron dos parejas mixtas con H. palliatus; una de las parejas presentó un nido con dos huevos y la otra con un pollo. Adicionalmente, registramos cuatro ostreros híbridos (H. palliatus x H. bachmani) en Guerrero Negro, de los que uno anidó, a su vez, con un ostrero americano.
A Ch. vociferus (chorlo tildío) lo observamos en bajas abundancias en cinco sitios (con solo 32 registros), todos ellos continentales (Cuadro 2). Para esta especie, el lugar de mayor relevancia fue el Alto Golfo de California (13 registros). En cuatro sitios observamos evidencia reproductiva (Cuadro 2).
A Ch. wilsonia lo observamos en nueve sitios que en total fueron 302 registros. Los sitios más importantes fueron Bahía de Tóbari (72), Bahía de Lobos (58), Marismas Nacionales (48) y el Alto Golfo de California (45). En el continente realizamos 272 observaciones y 30 en la península. Registramos evidencias de su reproducción en ocho sitios (Cuadro 2).
La especie con menor número de registros fue Ch. collaris, con sólo seis individuos (Cuadro 2); a todos ellos los observamos en Marismas Nacionales. Para esta especie no detectamos evidencias de reproducción.
A Ch. nivosus, especie amenazada (dof 2019; Cuadro 2), la registramos en 11 sitios, únicamente no la registramos en Bahía Santa María (Cuadro 2). En conjunto, presentó una abundancia de 180 individuos (Cuadro 2). Los humedales en donde se realizaron los registros más altos fueron el Alto Golfo de California (50 registros), Guerrero Negro (36) y Marismas Nacionales (28). Realizamos 126 registros en el continente y 54 en los sitios peninsulares. Registramos evidencias de su reproducción en nueve localidades (Cuadro 2).
A Jacana spinosa (jacana norteña) la registramos únicamente en Marismas Nacionales, con 13 individuos y evidencias de reproducción, dada la presencia de pollos (Cuadro 2).
Discusión
La especie Himantopus mexicanus ha sido considerada históricamente como transeúnte o visitante de invierno para la península (Grinnell 1928, Wilbur 1987, Howell y Webb 1995). Sin embargo, se ha documentado su reproducción en sitios norteños de la región, como el Río Colorado (Wilbur 1987, Mellink et al. 1996), Bahía San Quintín y Laguna Figueroa (Palacios y Alfaro 1991) y sureños, como las lagunas de oxidación adyacentes a la ciudad de La Paz (Carmona et al. 2000).
Para los humedales continentales en la costa de Sonora, H. mexicanus se considera un ave común en invierno, con probable reproducción local (Van Rossem 1945, Russell y Monson 1998). Aunque el único sitio en Sonora para el que existía evidencia de su reproducción es la Ciénega de Santa Clara (Eddleman 1989, Mellink et al. 1996, Hinojosa-Huerta et al. 2013). Por lo que las observaciones de su reproducción en Yavaros-Moroncárit, 770 km al sureste de la Ciénega, representan el primer registro sonorense fuera de dicho sitio.
Para Sinaloa y Nayarit su estatus es incierto, pues aunque Howell y Webb (199)5 caracterizan a H. mexicanus como una especie con reproducción en la región, no existen registros puntuales conocidos. Por lo que las evidencias que observamos en Ensenada Pabellones representan el primer registro para la zona.
La reproducción de Recurvirostra americana en sitios peninsulares se ha reportado para Bahía San Quintín, Laguna Figueroa, Laguna San Ignacio y Bahía Magdalena (Massey y Palacios 1994), Ensenada de La Paz (Carmona et al. 2000) y Guerrero Negro (Ayala-Pérez et al. 2014).
Para los humedales continentales, Mellink et al. (1996) confirman la reproducción de la especie en Sonora con la presencia de nidos, huevos y pollos en El Doctor, humedal aledaño a la Ciénega de Santa Clara, al norte de la entidad. Para Sinaloa y Nayarit no existe evidencia de su reproducción.
Tanto H. mexicanus como R. americana son consideradas aves playeras de talla grande (que inician su reproducción a los dos años (Robinson et al. 2020, Ackerman et al. 2020). Por lo tanto, es probable que los juveniles de poblaciones reproductivas norteñas permanezcan durante el verano en los sitios de invernada, como se ha documentado para especies similares (Carmona et al. 2011a), lo que explicaría la presencia de ambas especies durante la época reproductiva y los bajos números de nidos típicamente encontrados en la región.
Para Haematopus palliatus (subespecie H. p. frazari) se ha reportado un tamaño poblacional cercano a 3,000 individuos (Clay et al. 2014, Carmona et al. 2018), en consecuencia, la abundancia que observamos en los 12 sitios visitados representa el 43% de la población. Para todos los sitios hay registros previos de reproducción de esta especie (Bancroft 1927a, Van Rossem 1945, Danemann y Guzmán-Poo 1992, Mellink y Palacios 1993, Massey y Palacios 1994, Palacios y Mellink 1995, Russell y Monson 1998, Danemann y Carmona 2000, Palacios et al. 2017).
El sitio con mayor abundancia fue Bahía de Tóbari (533 registros), en donde la presencia de siete tarquinas podría estar favoreciendo su anidación. Adicionalmente, éste es un sitio relevante durante el invierno debido a la presencia de entre 260 y 390 individuos (Carmona y Danemann 2013, 2014). Sin embargo, Palacios y Mellink (1995) registraron sólo 20 parejas reproductivas allí y Palacios et al. (2017), ocho adultos. Por otra parte, Palacios et al. (2017) registraron 724 individuos en Bahía Santa María, mientras que nuestros datos del sitio indican apenas el 15% de dicha abundancia; es decir, podría existir un uso interanual diferente de cada sitio.
En México, H. bachmani tiene una distribución geográfica restringida que se limita a los humedales peninsulares del Pacífico norte (Massey y Palacios 1994, Howell y Webb 1995). En los inviernos de 2013 y 2014 registramos 37 y 36 individuos, respectivamente, en Guerrero Negro, San Ignacio y Bahía Magdalena (Carmona y Danemann 2013, 2014). En los mismos humedales nuestros números fueron menores en verano, lo que sugiere que una fracción de los individuos, en inverno, en estos humedales se desplazó hacia sus sitios de reproducción al norte de su intervalo geográfico, sugiriendo, al menos para invierno, una población mixta con individuos residentes y migratorios (Andres y Falxa 2020).
Entre los humedales de Guerrero Negro y San Ignacio exis te una franja de 400 kilómetros, en la que las distribuciones reproductivas de las dos especies de ostrero se superponen, creando una zona de hibridación (Jehl 1985), donde es común la presencia de híbridos. Al parecer, tales “híbridos” son fértiles, ya que observamos una pareja con un pollo, formada por uno de ellos y un H. palliatus. Este registro, junto con otros anteriores (Jehl 1985, Carmona et al. 2011a, Palacios et al. 2017), obligan a revisar la validez de estos taxones (H. palliatus y H. bachmani) y considerar que, en realidad, podría tratase de morfos de una sola especie (Jehl 1985, Hebert et al. 2004).
Charadrius vociferus se distribuye ampliamente y utiliza una variedad amplia de ambientes, incluyendo muchos sitios tierra adentro, como campos de cultivo y de golf, entre otros (Jackson y Jackson 2020). Por consiguiente, todos los estados del noroeste de México (costa y tierra adentro) se incluyen dentro del área de reproducción (Howell y Webb 1995, Jackson y Jackson 2020); nuestro estudio confirmó su reproducción en cuatro humedales.
Charadrius wilsonia se ha registrado anidando en tres de los humedales peninsulares que recorrimos: Guerrero Negro, San Ignacio y Bahía Magdalena (Bancroft 1927a, 1927b, Massey y Palacios 1994). Sin embargo, tiende a anidar de manera dispersa, lo que dificulta encontrar los nidos.
En Sonora se tienen registros para Puerto Peñasco (Van Rossem 1945, Russell y Monson 1998), Ciénega de Santa Clara (Hinojosa-Huerta et al. 2013), Bahía de Lobos (Russell y Monson 1998, Mellink y Palacios 1993) y Bahía de Tóbari (Palacios y Mellink 1995). Nuestras observaciones para Yavaros-Moroncárit (70 km al sureste de Bahía Tóbari), por lo tanto, son las primeras para esta laguna.
Para Sinaloa existen registros en Ceuta (50-100 parejas; Küpper datos sin publicar en: Zdravkovic 2013) y en Isla El Rancho, Bahía Santa María (González-Bernal et al. 2003), sin especificar el número de parejas o individuos. Nosotros adicionamos Ensenada Pabellones, a 70 km al sureste de Bahía Santa María. En Marismas Nacionales el único reporte de reproducción es de laguna Las Garzas, donde comparte las tarquinas artificiales para anidar con Ch. nivosus y Sternula anti llarum (charrán mínimo; Bustamante 2013); mismo sitio donde observamos nidos con huevos y pollos.
Charadrius collaris se considera de afinidad tropical, consecuentemente sólo lo observamos en el humedal más sureño, Marismas Nacionales, aunque sin evidencias de reproducción. Sin embargo, se ha reportado la presencia de nidos activos en Ensenada Pabellones (González-Bernal et al. 2007) y en la propia Marismas Nacionales (Ortega-Solís et al. 2017), por lo que nuestro fracaso para detectarla pudo estar relacionado con el corto periodo del estudio a la par de que es una de las especies de playeros menos abundante (Mendoza et al. 2019).
La reproducción de Ch. nivosus se ha reportado, para la península de Baja California, en los principales humedales de la costa del Pacífico, incluidos los tres sitios peninsulares que recorrimos: Bahía Magdalena (Palacios et al. 1994, Galindo-Espinosa y Palacios 2015), Laguna San Ignacio (Palacios et al. 1994, Galindo-Espinosa y Palacios 2015) y Guerrero Negro (Danemann y Carmona 2000, Galindo-Espinosa y Palacios 2015).
También existen reportes de la reproducción de Ch. nivosus en el humedal El Doctor, Sonora, adyacente a la Cié nega de Santa Clara (Eddleman 1989, Hinojosa-Huerta et al. 2013). A éstos se pueden añadir los del oasis de La Salina, en el noroeste de Sonora (Mellink y Palacios 1993), de Bahía de Tóbari (Palacios y Mellink 1995) y ahora, en Yavaros-Moroncárit (Cuadro 2), lo que sugiere que hay sitios adecuados para su anidación a lo largo de todos los humedales de la costa sonorense. Para Sinaloa se cuenta con registros de la anidación de Ch. nivosus en Isla El Rancho dentro de Bahía Santa María (González-Bernal et al. 2003) y Playa Ceuta (Küpper et al. 2009). Este último sitio albergó (2008-2009) hasta el 7% de la población total de la especie (Küpper et al. 2007). Las observaciones de Huizache-Caimanero y Ensenada Pabellones que incluimos representan el primer reporte para estos sitios.
Nuestras observaciones en Marismas Nacionales correspondieron a la laguna Las Garzas, sitio con reporte previo de anidación (Martínez-Sarabia 2012, Bustamante 2013); donde se registraron 93 parejas reproductoras en la temporada 2011 (Bustamante 2013). A Las Garzas se suman las lagunas Pericos (Mellink y Riojas-López 2005) y Chumbeño (Villar et al. 2010).
En el noroeste del país, Jacana spinosa presenta una distri bución restringida a los humedales del sur de Sinaloa y Nayarit (Jenni y Mace 2020), aunque es probable que sea un residente local en la mayor parte de la llanura costera sinaloense (González-Bernal et al. 2007). Coincidentemente, el único sitio donde observamos esta especie y evidencias (pollos) de su reproducción fue Marismas Nacionales.
En general, nuestros conteos se realizaron en las zonas costeras, por lo que las especies con mayor probabilidad de detección de evidencias reproductivas fueron las que prefieren para anidar estas zonas: los ostreros y los chorlos nevado y pico grueso. Otras especies como la R. americana, H. mexica nus y Ch. vociferus presentan preferencia por anidar en zonas dulceacuícolas (Russell y Monson 1998), por lo que sólo los registramos en las lagunas con presencia de agua dulce.
En este estudio documentamos la presencia en el noroeste de México de nueve especies de aves playeras que hipotética mente anidan allí, pero constatamos la reproducción de ocho de ellas. Consideramos que de los tamaños poblacionales totales (Andres et al. 2012, Clay et al. 2014, Carmona et al. 2018), las fracciones anidantes en el noroeste son pequeñas para cinco especies (R. americana, H. mexicanus, H. bach mani, Ch. vociferus y J. spinosa). En contraste para las tres restantes: H. palliatus, Ch. nivosus y Ch. wilsonia, representaron fracciones importantes de su poblacional total, con 42.6, 6.2 y 3.35%, respectivamente. Así en términos generales el noro este de México es un sitio importante de reproducción de este taxón, importancia que se resalta para especies protegidas por el Gobierno Mexicano, como: H. palliatus, Ch. nivosus y Ch. wilsonia. El presente trabajo permite, además, reconocer los sitios de mayor relevancia, para así poder encauzar esfuerzos de conservación, que partan de la protección del hábitat, ya que en esta región las amenazas se asocian constantemente a la pérdida de hábitat por actividades antropogénicas.











 nueva página del texto (beta)
nueva página del texto (beta)



