Introducción
Los nidos artificiales son una herramienta de gran potencial para recuperar poblaciones silvestres. Sin embargo, la res puesta de los psitácidos a las cajas-nido es muy variable. En el caso de Forpus passerinus, 40 cajas-nido instaladas para estudiar su ciclo de crianza fueron rápidamente ocupadas sin problema (Waltman y Beissinger 1992). En contraste, cinco nidos de PVC de estructura similar a los nidos naturales de palmas cortadas del pantano donde anidan en el Perú las guacamayas azul amarillas (Ara ararauna) no fueron ocupadas, aunque sí por Ara macao (Brightsmith y Bravo 2006). Después de muchos esfuerzos en diseño, de 47 cajas-nido colocadas, 29 fueron usadas por Psittacula eques para la puesta y en el siguiente año, 41 de 65 fueron usadas en la Isla Mauricio (Tatayah et al. 2007). Lo mismo se aplicó en el caso de Amazona vittata donde se ha ido perfeccionando un nido artificial de PVC para esta especie que asemeja las cavidades naturales y el hábitat a las que ellas muestran mucha fidelidad (White et al. 2005).
En México, la guacamaya roja (Ara macao cyanoptera) se encuentra en peligro de extinción (P) de acuerdo con la NOM-059-SEMARNAT-2010 (DOF 2010), sus poblaciones han disminuido drásticamente debido a la pérdida de su hábitat y al saqueo de sus nidos. El aumento de la deforestación en los bosques tropicales, la tala ilegal de árboles de talla grande y la destrucción de las cavidades-nido por traficantes, han provocado una disminución de la disponibilidad de sitios donde las guacamayas puedan anidar, así como la disminución de sus poblaciones. La altura de las cavidades en las que suelen anidar es en promedio a los 20 m del suelo (Marineros 1993, Picado y Mayorga 2010, Vaughan et al. 2006).
De acuerdo con Britt (2010), la falta de conexión focal interarbórea es el factor más importante para reducir el acceso de depredadores no voladores a los nidos naturales y las copas de los árboles que los conectan tienen la mayor influencia negativa en la supervivencia diaria del nido. Cockle et al. (2011) documentaron que los grandes psitácidos de zonas neotropicales prefieren anidar en cavidades de árboles con poca o ninguna cobertura, y con mayor posibilidad de ser vigilados. White et al. (2005), Cockle et al. (2011), y Britt (2011) sugieren que la visibilidad desde el nido es un atributo importante en la selección de sitios para nido para las guacamayas rojas, así como de otros loros y aves neotropicales que dependen de nidos en cavidades secundarias, y se cree que puede disuadir incidentes de depredación adulta.
En una población natural de guacamayas rojas en La Lacandona, de 20 cajas-nido de PVC y 20 cajas-nido de madera, ninguna fue ocupada, sólo en 10 cavidades naturales anidaron las guacamayas durante el estudio, y las cajas de madera se deterioraron rápidamente (Carreón-Arroyo 2006). Sin embargo, Radachowsky (2002) consideró la posibilidad de introducir cajas-nido a lo largo del rango de distribución de la guacamaya en la selva maya. Asimismo, en Costa Rica se reportaron mejores resultados de éxito reproductivo en cajas-nido de plástico que de madera (Vaughan et al. 2006). En las cajas nido de plástico, se su giere, al menos para el loro amazona ecuatoriana (Amazona lilacina), proporcionar una caja-nido que posea un sustrato compuesto por viruta de madera (Pilgrim y Biddle 2016). Es importante enfatizar la importancia de reunir todas las condiciones (entrada de cierto diámetro y acolchonada con viruta y trozos del mismo material) para la reproducción, el desarrollo de los pollos y la adaptación de individuos reintroducidos. En el caso de nidos artificiales de plástico, aunque es posible que sean más resistentes a condiciones adversas, de éstos no podrían aprender a formar sustrato por lo que es indispensable añadirlo (Álvarez et al. 2005). La invasión de las cajas-nido por abejas es reconocida ampliamente como un problema para los psitácidos (CONAP y WCS 2008). Una sugerencia que se ha probado es la aplicación de permetrina al 5% en la caja-nido (Boyd y McNab 2008), como repelente, el cual no es dañino para las aves.
El grado de riesgo de un nido depende entonces de su localización, visibilidad, altura y accesibilidad. Por lo tanto, es necesario conocer las características que favorezcan la supervivencia de los pollos y la comodidad de las hembras reproductoras, con el fin de posibilitar la reproducción de la guacamaya y su conservación. En este trabajo instalamos y monitoreamos 12 cajas-nido, en conjunto con 5 cajas instaladas en años anteriores, durante los meses de octubre de 2017 a agosto de 2018 con el fin de determinar si existen preferencias de los reproductores de Ara macao para su ocupación, en relación con la conectividad de la caja y a la visibilidad desde la caja-nido, así como al uso de aditivos para evitar la invasión de insectos.
Métodos
Área de Estudio
La región de Los Tuxtlas se localiza al sur del estado de Veracruz (18°05’ y 18°43’ N, 94°35’ y 95°25’ O), con una superficie mayor a 4500 km2, es uno de los últimos reductos de selva húmeda en la costa del Golfo de México, donde se establece el bosque tropical húmedo más al norte de América. Sin embargo, las grandes extensiones de pastizales y potreros dentro de la región hacen que el sector ganadero ocupe un 56% del territorio total de la reserva (Mayer 1962, Rappole et al. 1997, Guevara et al. 2004, Leal-Rojas 2005). El clima de la zona está representado por el grupo de climas cálido A, y el subgrupo semicálido A(C), es decir, con temperaturas máximas que varían de 30 a 36ºC en el mes de mayo, y las más bajas (10 a 16ºC) en enero. Se distingue una época húmeda de junio a febrero con precipitaciones medias anuales que varían entre los 1500 y 4500 mm y una seca entre marzo y mayo (Soto y Gama 1997). La vegetación representativa de la región es el bosque tropical perennifolio, además del bosque tropical subperennifolio, el bosque mesófilo de montaña-pinar, bosque de pino-encino, encinar enano, pastizal de altura, sabana, manglar y vegetación de dunas costeras (De Labra et al. 2010).
El presente estudio lo realizamos dentro de la Reserva de la Biosfera Los Tuxtlas, y forma parte del “Proyecto de re-introducción de la guacamaya roja (Ara macao cyanoptera) en la Reserva de la Biósfera Los Tuxtlas”, realizado por el Instituto de Biología de la Universidad Nacional Autónoma de México y otros aliados, a partir de 2014. Lo llevamos a cabo en zonas de previas liberaciones de guacamaya roja criadas en cautiverio, con unas 120 guacamayas ya libres, aproximadamente. Estas zonas son: Reserva Ecológica Nanciyaga, parche de selva que junto con otros predios conforma unas 40 ha de superficie, la Reserva Ejidal Benito Juárez que consiste en una cañada de cafetal con sombra, y zonas aledañas a Nanciyaga: Rancho Xococapan zona modificada con arbolado y La Flor de Catemaco zona de cultivo de palmas con sombra y parches de selva, en los cuales han reportado avistamientos frecuentes de las guacamayas libe radas (Figura 1, coordenadas en el Cuadro 1).
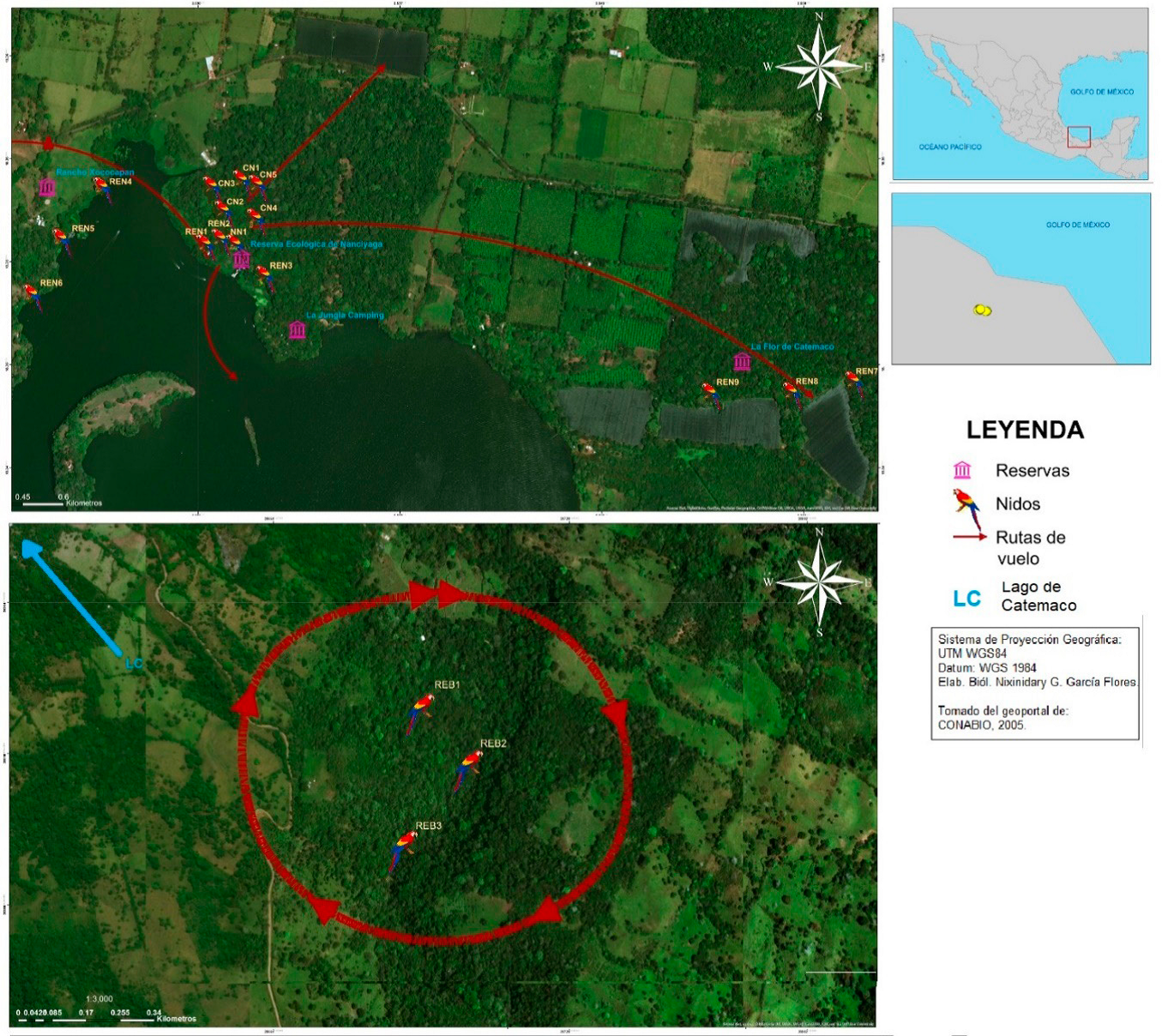
Figura 1 Rutas de vuelo y nidos instalados en la Reserva Ecológica de Nanciyaga y áreas aledañas (Sup.) y Reserva Ejidal Benito Juaréz (Inf.), tomando en cuenta las principales rutas observadas a través de los transectos realizados durante el mes de octubre. Realizado con el programa ArcGis 10.5 con base en imagen de Google Earth.
Cuadro 1 Características y sitios de colocación de nidos artificiales para la guacamaya roja en la región de Los Tuxtlas. ren estipula la Reserva Ecológica Nanciyaga y anexos. reb se refiere a la Reserva Ejidal Benito Juárez. cn se refiere a cajas-nido preinstaladas. Se indica con * las cajas ocupadas por guacamayas. Las cajas CN1 y REN7 fueron invadidas por abejas Apis melifera.
| Clave nido | Especies árbol (nombre común) | Coordenadas | Aditivo / Material | Altura nido (m) | Conectividad focal (m) | Visión (%) |
|---|---|---|---|---|---|---|
| Reserva Ecológica Nanciyaga | ||||||
| rphandrum | N= 18º27’00.7” W= 095º04’07.7” | ninguno / madera de pino | 20.8 | 5 | 20 | |
| CN2* | Ficus insipida (amate blanco) | N= 18º26’56.6” W= 095º04’10.5” | ninguno / madera de pino | 20.9 | 6 | 50 |
| CN3 | Ficus insipida (amate blanco) | N= 18º26’58.8” W= 095º04’11.6” | ninguno / madera de pino | 24.3 | 4 | 10 |
| CN4* | Ficus insipida (amate blanco) | N= 18º26’55.9” W= 095º04’06.3” | ninguno / plástico | 25.2 | 8 | 70 |
| CN5 | Sapium lateriflorum (amate capulín) | N= 18º26’59.9” W= 095º04’06.4” | ninguno / plástico | 27.1 | 4 | 40 |
| REN1 | Enterolobium cyclocarpum (guanacaste) | N= 18º26’53” W= 095º04’12” | aceite de linaza / madera tropical dura | 15.2 | 4 | 40 |
| REN2* | Ficus insipida (amate blanco) | N= 18º26’54” W= 095º04’09” | permetrina / madera tropical dura | 22.2 | 7 | 70 |
| REN3* | Sapium lateriflorum (amate capulín) | N= 18º26’49” W= 095º04’05” | vinagre / madera tropical dura | 18.6 | 6 | 90 |
| Rancho Xococapan | ||||||
| REN4 | Mangifera indica (mango) | N= 18º26’59.7” W= 095º04’25.2” | aceite de linaza / madera tropical dura | 15.4 | +10 | 10 |
| REN5* | Ficus insipida (amate blanco) | N= 18º26’53.2” W= 095º04’29.8” | permetrina / madera tropical dura | 24.1 | 6 | 90 |
| REN6 | Ficus insipida (amate blanco) | N= 18º26’46.6” W= 095º04’33.7” | dera tropical dura | 70 | ||
| La Flor de Catemaco | ||||||
| REN7 | Ficus insipida (amate blanco) | N= 18º26’37.1” W= 095º02’50.9” | aceite de linaza / madera tropical dura | 15.1 | 9 | 100 |
| REN8 | Spondias mombin (jobo de mono) | N= 18º26’35.8” W= 095º02’59.1” | permetrina / madera tropical dura | 25.1 | 8 | 90 |
| REN9* | Spondias mombin (jobo de mono) | N= 18º26’35.6” W= 095º03’09.0” | vinagre / madera tropical dura | 24.8 | 7 | 60 |
| Reserva Ecológica Benito Juárez | ||||||
| REB1 | Brosimum alicastrum (ojoche) | S= 18º21’34.8” W= 095º00’54.1” | aceite de linaza / madera tropical dura | 23.3 | +10 | 50 |
| REB2 | Ulmus mexicano (Olmo mexicano) | S= 18º21’30.1” W= 095º00’50.2” | permetrina / madera tropical dura | 20.2 | 8 | 60 |
| REB3 | Spondias mombin (jobo de mono) | S= 18º21’23.5” W= 095º00’55.5” | vinagre / madera tropical dura | 27.8 | +10 | 90 |
Instalación y monitoreo de las cajas-nido
Durante el mes de octubre de 2017 diseñamos y construimos 12 cajas-nido de madera tropical dura (Figura 2a) cha-gane-gén: Platymiscium en forma de caja rectangular (70 x 30 x 30 cm), con una inclinación de 1cm en la tapa superior que evitara el estancamiento de agua y una entrada circular delantera de 25 cm de diámetro y una percha frontal de 40 cm situada debajo de la entrada (recomendaciones de Olah et al. 2014 modificadas ligeramente). Realizamos dos orificios en cada lado para facilitar su contención a los árboles. Las cajas instaladas en un previo año fueron reinstaladas para su posible ocupación, éstas fueron de dos tipos: las tres primeras creadas con madera de pino (GÉN: Pinus), y dos hechas con tambos de polietileno de 120 l (Figura 2b), ambas con dimensiones similares a las cajas-nido ya descritas. Las doce nuevas cajas-nido instaladas fueron tratadas con tres aditivos diferentes para evitar la invasión de insectos (permetrina al 5%, 4) (Boyd y McNab 2008), aceite de linaza sin diluir (4), o vinagre (4). Las rotulamos con listones conforme al aditivo: permetrina (amarillo), aceite de linaza (verde) y vinagre (blanco).

Figura 2 Cajas-nido artificiales visitadas por parejas de guacamaya escarlata (Ara macao cyanoptera): a) Caja-nido de madera tropical. b) Caja-nido de plástico tipo PVC, c) Viruta y plumas contenidas en REN3, d) Huevo registrado en CN2.
Para instalarlas realizamos transectos aleatorios siguiendo el vuelo de las guacamayas con el fin de conocer sus zonas de vuelo en la Reserva Ecológica de Nanciyaga y anexos, y la Reserva Ejidal Benito Juárez (Figura 1), y así instalar las cajas de manera visible y atractiva para ellas. Al conocer estas zonas, tuvimos reuniones con los dueños de los terrenos y realizamos convenios con ellos, en éstos, expusimos la importancia del proyecto y su responsabilidad para el monitoreo y protección de los nidos en sus territorios, además se les solicitó permiso para la búsqueda de nidos naturales. Con ayuda de un equipo de rapel instalamos en noviembre y diciembre del mismo año. La selección de árboles donde fueron colocadas las cajas-nido las hicimos siguiendo las observaciones sobre el uso de cajas-nido por guacamayas rojas en Perú por Olah et al. (2014), en Guatemala y Belice por Britt (2011), en Costa Rica por Vaughan et al. (2003), y en Chiapas por Estrada (2014). Priorizamos distancias vastas entre los nidos, con el fin de no causar interferencias conductuales, siendo una limitación por la disponibilidad de árboles en el área. La altura de las cajas-nido varió entre 15.2 a 27.1 m, tomamos la medida con una cuerda de rappel de la base del árbol a la base de la caja-nido. Sumado a esto, verificamos que los nidos instalados previamente siguieran en su sitio, los aseguramos y etiquetamos como CN (Cuadro 1). Instalamos nueve cajas-nido en la Reserva Ecológica Nanciyaga y anexas, y tres en la Reserva Ejidal Benito Juárez, además reforzamos cinco preinstaladas.
Una vez ubicados los sitios de instalación de las cajas-nido medimos el grado de conectividad interarbórea, al calcular la distancia entre las ramas del árbol de instalación y las ramas cercanas de los árboles colindantes y la conectividad focal interarbórea. Posteriormente, ya instalada la caja-nido, determinamos la visión periférica que iban a tener las guacamayas desde el árbol de instalación a través de esquemas porcentuales de visión, los cuales consistían en observar en 360 grados alrededor del sitio de instalación cuál era el porcentaje de visión que obstruían las ramas a la caja nido. Con los resultados de visión periférica, conectividad y altura de la caja-nido realizamos pruebas de Pearson (Xi2) para comparar las preferencias observadas contra las esperadas.
Todos los nidos los georreferenciamos (GPS Garmin®), numeramos y ordenamos de acuerdo con prefijo de su zona (REN = Reserva Ecológica Nanciyaga, REB = Reserva Ejidal Benito Juárez) y su orden de instalación. Las coordenadas, altura de la caja nido, aditivo, especies de árbol de instalación, conectividad focal y visión periférica se muestran en la Cuadro 1. Durante la instalación de las cajas-nido, y a través de la observación de interacciones positivas registramos la existencia de seis parejas de guacamayas dentro de la población en REN y anexas.
Los monitoreos los realizamos dos veces al mes durante los meses de octubre de 2017 a agosto de 2018, y consistieron en transectos a lo largo de los terrenos en donde se observaban las cajas-nido a distancias discretas, con el fin de no asustar a las parejas, ya que observamos que en presencia humana las guacamayas vuelan del sitio donde posan. Les dedicamos 1496 horas-persona al monitoreo, distribuidos a lo largo de 11 meses en cuatro sitios distintos, y con 4 horas de monitoreo por caja por sesión, con dos monitoreos al mes. Posteriormente, cuando se observaba la presencia constante de alguna guacamaya o pareja en las cajas-nido o en cavidades naturales, los árboles los escalamos con equipo de rappel, y revisamos para registrar la presencia de huevos, plumas pectorales o cáscaras de huevo, y así confirmar la ocupación por alguna pareja. La revisión se limitó a una vez al mes, para evitar contaminar el nido con olores humanos o ahuyentar a la pareja que habitaba ese nido.
Resultados
Monitoreo de cajas-nido
El 42.8% (6) de las cajas-nido no invadidas por abejas tuvieron visitación por las guacamayas rojas. Para la Reserva Ecológica Nanciyaga y anexos, registramos la presencia e ingreso de parejas de guacamayas en seis cajas-nidos (REN2, REN3, REN5, REN9, CN2 y CN4, Cuadro 1). En REN2 y REN 3 encontramos viruta de la madera de la caja en el fondo (colocada por las guacamayas y que desprendieron de la entrada y bordes interiores del nido) y plumas pectorales pequeñas (Figura 2c), y la presencia de un huevo, acompañado de plumas pectorales y una timonera en la caja REN2 (Figura 2d). En la Reserva Ejidal Benito Juárez no hubo ocupación de cajas-nido. Registramos la invasión y establecimiento de colmenas de abejas Apis mellifera en CN1 y REN7, y la presencia de una martucha (Potos flavus) en CN4, y éstas ya no fueron tomadas en cuenta para analizar las variables. En cuanto a los de plástico, uno sí fue ocupado y otro no.
Las especies de árboles donde registramos el ingreso de parejas de guacamayas en las cajas-nido fueron Ficus insi pida (REN2, REN5, CN2, CN4), Sapium lateriflorum (REN3) y Spondias mombin (REN9). Las cajas-nido ocupadas fueron las que estuvieron a una altura promedio de 22.6 ± 2.55 m (DS), con rango desde 18.6 m (REN3) hasta 25.2 m (CN4). Sin embargo, la altura en el árbol de esta ocupación no fue diferente (X2 = 3.4, k = 6, P > 0.05).
Las cajas-nido tuvieron un grado de conectividad de 4 a 10 m, con un promedio de 6.86m ± 2.13 (DS), mientras que las visitadas por las guacamayas tuvieron un grado de conectividad ≥ 6 m desde el árbol focal donde se encuentra la caja-nido hacia otros árboles a su alrededor, sin embargo, esta ocupación no fue diferente (X2 = 10, k = 6, P > 0.05) (Cuadro 1).
Las cajas-nido ocupadas (CN2, CN4, REN2, REN3, REN5 y REN9) estaban en sitios abiertos con vista periférica libre de entre 50 y 90% (Figura 3), aunque otras cajas-nido con buena visibilidad no fueron ocupadas (REN6, REN8, y las tres de la Reserva Benito Juárez REB1,2,3). Para otras cuatro cajas-nido disponibles nos percatamos que tuvieron una visibilidad del 10 al 40%. Comparando la ocupación de las cajas-nido disponibles encontramos que las que tuvieron una visibilidad mayor al 50% fueron ocupadas en un 71.6%, sin embargo, esta ocupación no fue mayor (X2 = 5.5, k = 4, P > 0.05).

Figura 3 Visión periférica de cada uno de los nidos, el centro de los puntos indica el tronco donde se instaló, las partes som-breadas representan las ramas que interceptaban la vista desde arriba. El símbolo ♦ indica nidos encontrados con viruta (es decir, en preparación por las guacamayas), los nidos marcados con ● indican nidos visitados por parejas de guacamayas.
En cuanto a la conectividad focal las seis cajas-nido ocupadas se encontraban a una distancia de 6.9 m en promedio (rango 6-8 m, N = 6), mientras las no ocupadas estuvieron colocadas a un promedio de 7 m (rango 4-10 m, N = 9). Por lo que respecta al aditivo aplicado a las cajas-nido tenemos que con la permetrina dos cajas sí fueron ocupadas y dos no, lo mismo pasó con el vinagre, y con el aceite de linaza, ninguna se ocupó, y una sí fue invadida por las abejas. De las que no se le aplicó ningún aditivo (control) dos se ocuparon, y dos no, y una fue invadida por abejas.
Discusión
En el presente estudio, el 42.8% (6) de las cajas-nido fueron visitadas por la guacamaya roja en la región de Los Tuxtlas. Renton et al. (2015) señala que de las tres especies de guacamayas de la selva tropical de Perú, sólo Ara macao ha registrado ocupación de cajas-nido, Vaughan et al. (2006) registró un 80% de visitación de guacamayas rojas en cajas-nido instaladas en Costa Rica, lo cual contrasta con Carreón-Arroyo (2006) quien no registró visitas directas en 20 cajas-nido instaladas en la Selva Lacandona, sólo acercamientos a las ramas donde instaló los nidos y en algunos casos las guacamayas únicamente utilizaron las cajas-nido como perchas.
El ingreso de parejas de guacamayas en los nidos colocados en arboles de la especie Ficus insipida y Sapium lateriflorum coincide escasamente con las especies de otros trabajos registrados. Por ejemplo, coincide sólo en un 10% con los resultados de Guittar et al. (2009), aunque tuvimos varias especies de árboles donde se colocaron cajas-nido, una de las más comunes fue el amate blanco (Ficus insipida), siendo la mejor representada. Por otra parte, la altura de las cajas-nido que fueron ocupadas coincide con trabajos previos (Marineros 1993, Picado y Mayorga 2010, Vaughan et al. 2006), quienes obtuvieron registros de visitas en cajas-nido instaladas desde los 8 m hasta los 30 m. Stojanovic et al. (2017) sugieren que las características de la cavidad de nido a escala fina no influyen en el éxito del nido del loro migrador (Lathamus discolor), más allá de su efectividad para excluir a los depredadores.
La presencia de parejas de guacamayas se registró tanto en cajas-nido hechas de madera, como de plástico (CN4), esta última, aparte de la presencia de la pareja, no presentó ninguna evidencia interior (sustrato o plumas), posteriormente, fue invadida por una martucha (Potos flavus). Estas observaciones coinciden con varios trabajos previos de uso de cajas-nido de ambos materiales para las guacamayas rojas (Vaughan et al. 2006, Romero 2012).
En el presente estudio se probaron varios métodos para evitar el problema de la invasión por insectos, mencionado por CONAP y WCS (2008). Dos de los nidos instalados fueron invadidos por abejas (Apis mellifera), a pesar de que uno de estos había sido cubierto con vinagre al 100%, lo que nos indica que este aditivo puede no ser funcional para repeler este tipo de insectos. Sin embargo, también apoyan el experimento con la permetrina al 5% de Boyd y McNab (2008), ya que ninguna de las cajas bañadas con este aditivo (dentro y fuera) fue invadida, lo que sugiere que la aplicación de este insecticida puede ser efectivo contra las abejas.
Los nidos que registraron visitas de parejas de guacamayas fueron los que tenían una conectividad focal mayor a 6 m, pero los que no fueron ocupados tuvieron un promedio de 7 m, entre estos últimos se encuentran cajas-nido de sitios en que no se ocupó ninguna caja como la Reserva Benito Juárez. Estos resultados por lo tanto no son conclusivos y no se puede descartar algún otro factor por lo que las guacamayas no hayan ocupado las cajas. Los nidos que presentaron mayor interacción de guacamayas fueron los que tuvieron mayor visibilidad periférica (71.6%), aunque no pudimos obtener una diferencia significativa, en concordancia con White et al. (2005), Cockle et al. (2011), y Britt (2011) quienes sugieren que la visibilidad desde el nido es un atributo importante en la selección de nidos para guacamayas rojas, ya que a mayor visibilidad se obtiene un punto de ventaja para la vigilancia contra posibles depredadores, que permite a los padres estar alerta ante cualquier peligro.
Sin embargo, debe tomarse en cuenta que, al ser un proyecto de reintroducción, lo más importante es que la especie se vuelva independiente y autosuficiente. Cabe destacar que, en la región de Los Tuxtlas, debido a la escasez de árboles altos, sugerimos que la disponibilidad de cavidades para anidar podría ser un factor determinante para la reintroducción de la guacamaya roja, por lo que es importante seguir haciendo esfuerzos para la adaptación y desarrollo de la especie, mientras avanzan esfuerzos de reforestación en marcha.
Conclusiones
La instalación de las cajas-nido y las condiciones idóneas para la anidación de Ara macao cyanoptera no dependen de factores físicos como el repelente o la especie del árbol, pero podría estar relacionada directamente con la altura del nido, la visibilidad y la conectividad interarbórea. Al parecer los nidos que se encontraban más alejados de otros árboles y con mayor visión periférica, presentaron mayor presencia de parejas de guacamayas, aunque es importante acumular más datos de estas variables.
Tanto los nidos de madera como los de plástico fueron visitados por las guacamayas, sin embargo, los nidos de madera tropical podrían proporcionar una ventaja adaptativa al servir como enseñanza para la preparación de un nido natural, ya que de ellos han aprendido a desprender viruta para el fondo del nido.
Se podría continuar utilizando la permetrina al 0.5% como repelente de Apis spp. Conforme a los tratamientos utilizados, los menos efectivos resultaron el de vinagre y el de aceite de linaza.











 nueva página del texto (beta)
nueva página del texto (beta)


