Introducción
Las interacciones bióticas juegan un papel fundamental en la estructuración y composición de comunidades ecológicas (Araújo y Rozenfeld 2014). En particular, las interacciones mutualistas están involucradas en el establecimiento y mantenimiento de las comunidades vegetales a través de la polinización y la dispersión de semillas (Bascompte y Jordano 2007). Los colibríes han establecido relaciones muy estrechas con las plantas que polinizan ya que, debido a su alta tasa metabólica y a su tamaño corporal, necesitan tener garantizada disponibilidad de recursos que cubran sus demandas energéticas (Cotton 2007). Estos requerimientos energéticos son cubiertos principalmente a través del consumo diario del néctar de gran número de flores (Montgomerie y Gass 1981). Sin embargo, el néctar floral es variable espacial y temporalmente, lo que obliga a los colibríes a buscar de manera constante recursos florales (Lara 2006). Durante esta búsqueda, los colibríes están expuestos a nuevos recursos florales que pueden aprender a explotar e incluir en su dieta (Lara et al. 2008).
Conocer la riqueza, identidad y cantidad de los recursos florales utilizados por un polinizador permite identificar la amplitud de su nicho trófico, el grado de especialización de su dieta e incluso la vulnerabilidad de estas interacciones a procesos de extinción (Memmott et al. 2004). Este conocimiento es fundamental en ecosistemas insulares por la presencia de endemismos, ya que la integración de especies vegetales exóticas a las redes de interacción biótica puede provocar graves efectos ecológicos en la biota nativa (Richardson et al. 2000, Sax et al. 2002, Traveset y Richardson 2014). Los procesos de colonización y establecimiento de asentamientos humanos en islas oceánicas han provocado la extirpación o extinción de gran número de especies nativas (Olson y James 1982). Estos procesos de pérdida de la biota nativa son generados por la modificación y fragmentación del hábitat, el pastoreo de herbívoros introducidos, la introducción de flora exótica, la depredación por fauna exótica, la persecución directa y depredación por humanos de la fauna nativa, así como por la introducción de patógenos (Franklin y Steadman 1991). En particular, una mayor riqueza de especies de mamíferos y plantas vasculares exóticas se ha relacionado positiva y significativamente con el tamaño de las islas y el tamaño de la población humana que ocupa las islas oceánicas (Chown et al. 1998).
El colibrí esmeralda de Cozumel (Chlorostilbon forficatus), restringido a la isla, es una de las 14 especies de colibríes endémicas de México (Arizmendi y Berlanga 2014). Es un colibrí de tamaño pequeño de 8-9.5 cm y presenta dimorfismo sexual. El macho se caracteriza por presentar un plumaje verde esmeralda brillante en la cabeza y el cuerpo. Por el contrario, el plumaje en la hembra es de color verde pálido en la nuca y el dorso, mientras que la garganta y el vientre son de color gris. Esta especie tiene el pico corto y recto, y en el macho es de color rojo con la punta negra. Ambos sexos tienen la cola bifurcada de color negro azulado; sin embargo, la del macho es de mayor longitud con las puntas de las plumas interiores grises, mientras que en la hembra son blancas. La hembra tiene una franja blanca postocular. Los individuos inmaduros presentan características muy parecidas a las hembras (Del Hoyo et al. 2019). En la isla Cozumel se han registrado cuatro especies de colibríes: el colibrí esmeralda de Cozumel (C. forficatus) y el colibrí garganta negra (Anthracotorax prevostii) -ambos residentes y los colibríes más comunes en la isla-, el colibrí garganta rubí (Archilochus colubris), residente invernal (Buffa y Morris 1999), mientras que el colibrí canela (Amazilia rutila) se considera como accidental o raro dentro de la isla (LePage 2014).
Las características morfológicas de C. forficatus permiten inferir que es un visitante floral generalista; es decir, tendría la capacidad de visitar y polinizar de forma efectiva especies de plantas con una gran variación morfológica (Traveset y Richardson 2006). En general, las especies pequeñas de colibríes tienden a ser expulsadas del acceso de los mejores recursos por especies de colibríes con tamaño corporal mayor (Márquez-Luna et al. 2018), por lo que suelen utilizar estrategias de forrajeo: como el uso de rutas de alimentación (colibríes ruteros), el “robo” de néctar en parches florales defendidos por colibríes territoriales (Feinsinger y Colwell 1978) o incluso el uso de recursos no defendidos por colibríes como flores con corolas no tubulares y de colores poco llamativos, características asociadas a la polinización por insectos (Arizmendi y Ornelas 1990, Dalsgaard et al. 2012).
Actualmente, el colibrí esmeralda de Cozumel no se encuentra bajo ningún esquema de protección nacional (e.g., NOM-059-2010, Semarnat-2010) o internacional (IUCN 2019); no obstante, se ha sugerido que es vulnerable debido a su distribución geográfica altamente restringida (Arizmendi et al. 2016, Ortiz-Pulido 2018) al ser una especie endémica a la isla Cozumel. A pesar de lo anterior, esta especie ha sido poco estudiada y se desconocen muchas características de su biología, entre ellas los recursos florales que constituyen su dieta, donde sólo existe un registro anecdótico (Buffa y Morris 1999). En este contexto, asumimos que C. forficatus deberá comportarse como un polinizador generalista, que su dieta incluye especies vegetales exóticas a la isla y que la inclusión de estos recursos florales exóticos será mayor dentro y cerca de las zonas de influencia humana en la isla (asentamientos humanos y caminos). Para probar estas suposiciones, en el presente estudio: (1) describimos de forma sistemática los recursos florales utilizados por C. forficatus, (2) identificamos si dentro de su dieta existen especies vegetales exóticas a la isla y (3) evaluamos si la probabilidad de que C. forficatus se alimente de una planta nativa está asociada a la distancia a zonas de influencia humana de isla Cozumel.
Métodos
Área de estudio
La isla Cozumel se localiza a poco más 17 km del noreste de la península de Yucatán (20°26’ N, 86°55’ O). Se considera una isla oceánica de origen coralino y es la de mayor superficie del Caribe mexicano con un área de casi 480 km2. De acuerdo con los datos colectados por la estación climatológica en la isla (20°30’36” N, 86°56’45.9” O) de 1994 a 2012 la temperatura media anual fue de 27.2°C y la precipitación anual promedio de 1207.5 mm (SMN 2019). En general, la isla presenta una temporada de secas de febrero a mayo y lluvias de junio a octubre. Durante la temporada de lluvias, la isla Cozumel está expuesta a tormentas tropicales y huracanes que, de acuerdo con su intensidad, pueden afectar la estructura de la vegetación. La isla contiene cinco principales tipos de vegetación: selva mediana subcaducifolia, selva baja subcaducifolia, manglar, tasistal y vegetación halófila (Téllez-Valdez et al. 1989, Flores 1992, Martínez-Morales 1996). Este estudio lo realizamos en la selva mediana subcaducifolia, la selva baja subcaducifolia y el manglar. Las selvas se caracterizan por tener una estructura definida por uno o dos estratos arbóreos que oscilan entre 8 y 20 m de altura, y un estrato arbustivo con escasa presencia de plantas epífitas y trepadoras. Por otro lado, la estructura del manglar está definida por presentar un estrato arbóreo de 5 a 10 m y por la presencia de algunas epífitas y trepadoras (Téllez-Valdez et al. 1989).
Registro de recursos florales
El registro de las especies vegetales usadas por C. forficatus lo llevamos a cabo mediante el recorrido de 14 senderos espacialmente independientes dentro de zonas con vegetación nativa de la isla (Figura 1). La longitud de los senderos fue de 1,000 a 3,300 m con un total de 23.9 km, de los cuales 11.3 km correspondieron a senderos en la selva mediana subcaducifolia, 12.1 km a selva baja subcaducifolia y 0.5 km a manglar. Los 14 senderos se recorrieron de manera mensual de junio a noviembre de 2017, a partir de las 06:00 h y hasta por siete horas continuas. En total acumulamos 109 km de recorridos en los senderos y 287 horas de observación.
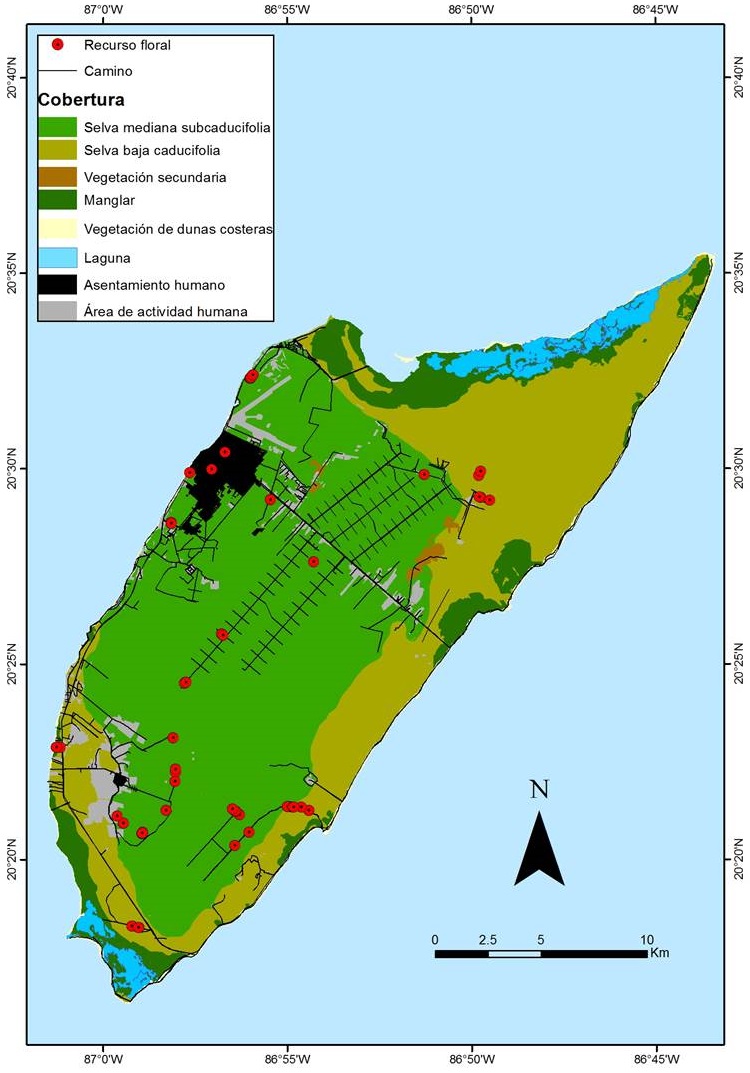
Figura 1 Registro de los recursos florales usados por Chlorostilbon forficatus en isla Cozumel obtenidos en campo y de la base de datos Naturalista. Se muestran los principales tipos de cobertura vegetal de la isla y la ubicación de las áreas de influencia humana.
Consideramos un registro o evento de forrajeo cuando observamos a un colibrí forrajeando en una especie de planta específica. Registramos la especie floral visitada, el día, la hora, el sendero y el sitio en el cual observamos el evento de forrajeo. Con el propósito de establecer si C. forficatus es un visitante floral generalista registramos el color y forma (i.e., tubular o no) de la corola de las especies vegetales que visitó. El síndrome tradicional de ornitofilia asume que las flores polinizadas por aves tendrán corolas tubulares con colores llamativos (amarillo, naranja, rojo; Van der Pijl 1961). El color de la corola se asignó con base en la percepción en campo del observador, y si existía algún otro elemento que formara parte del despliegue floral (e.g., brácteas o tallos) también fue incluido en la asignación del color (Dalsgaard et al. 2012). Consideramos una corola tubular cuando los pétalos estaban fusionados y reducido el margen (Van der Pijl 1961). Finalmente, construimos un registro fotográfico de las especies de plantas visitadas por C. forficatus. Estas fotografías fueron utilizadas para posteriormente identificar las especies vegetales. Asimismo, buscamos registros fotográficos de C. forficatus en la plataforma Naturalista (Naturalista 2019). Incluimos estos registros cuando las fotografías cumplían con los siguientes criterios: (1) la identidad de la especie había sido verificada por la comunidad y por los especialistas de Naturalista (i.e., observaciones con grado de investigación) y (2) el colibrí fue captado visitando un recurso floral (i.e., con el pico dentro de la corola de la flor o tocando las estructuras reproductoras de la flor). Las identificaciones de las especies vegetales fueron corroboradas por el Dr. Juan Tun-Garrido, investigador del Departamento de Botánica de la Universidad Autónoma de Yucatán. Asignamos a cada especie vegetal la categoría de “nativa” o “exótica” con base en el listado florístico de la península de Yucatán (Durán et al. 2000) y de la florula de la isla Cozumel (Téllez-Valdez y Cabrera 1987).
Análisis estadístico
Construimos un modelo lineal generalizado (GLM, por sus siglas en inglés) con distribución de error binomial y función de enlace probit para evaluar si la probabilidad de que C. forficatus se alimente de una especie vegetal nativa de la isla Cozumel está asociada a la distancia a las zonas de influencia humana de la isla. En este modelo utilizamos como variable explicativa la distancia euclidiana entre la zona de influencia humana (i.e., asentamientos humanos y caminos) más cercana al lugar donde se observaron los eventos de forrajeo o donde se realizaron los registros fotográficos de Naturalista. Cuando los registros fotográficos o eventos de forrajeo ocurrieron dentro de algún asentamiento humano, se consideró que estaban a una distancia “cero”. La variable de respuesta fue el evento de forrajeo; las visitas que C. forficatus realizó a una especie nativa de la isla las definimos como “1”, mientras que las visitas realizadas a especies exóticas de la isla como “0”. Realizamos el GLM en R v.3.5.3 (R Core Team 2019) y graficamos los resultados del modelo usando el paquete ggplot2 v. 3.1.0 (Wickham 2016).
Resultados
Durante los seis meses de muestreo obtuvimos 58 registros de individuos de C. forficatus que visitaron las flores de 11 especies vegetales, de los cuales 29 registros fueron en la selva mediana subcaducifolia, 26 en la selva baja subcaducifolia y tres en la ciudad de San Miguel. Adicionalmente, recabamos 69 registros fotográficos de C. forficatus verificados por la comunidad de Naturalista (con grado de investigación), de los cuales 12 registros fueron del colibrí cuando visitó ocho especies vegetales que no registramos durante este estudio (Cuadro 1). De las 19 especies visitadas por C. forficatus diez tuvieron un color llamativo (i.e., amarillo, naranja o rojo) en la corola o las brácteas (e.g., Megaskepasma erythrochlamys) como parte de su despliegue floral. Las restantes nueve especies presentaron un color claro en la corola (i.e., blanco o morado). Mientras que la corola fue tubular en seis de las 19 especies visitadas por C. forficatus y únicamente la corola de tres especies presentó ambas características (i.e., corola tubular de color llamativo; Cuadro 1).
Cuadro 1 Número de registros de las especies vegetales visitadas por el colibrí esmeralda de Cozumel (Chlorostilbon forficatus). Se especifica si las especies vegetales son nativas o exóticas a la isla, así como el color de la corola y si ésta presentaba forma tubular.
| Especie | Registros en campo |
Registros en Naturalista |
Nativa | Exótica | Color de corola |
Corola tubular |
|---|---|---|---|---|---|---|
| Acanthaceae | ||||||
| Megaskepasma erythrochlamys | 1 | X | Roja-blanca | Sí | ||
| Apocynaceae | ||||||
| Allamanda blanchetii | 3 | X | Rosa | No | ||
| Boraginaceae | ||||||
| Cordia dodecandra | 2 | X | Naranja | No | ||
| Cordia gerascanthus | 1 | X | Blanca | No | ||
| Cordia sebestena | 2 | X | Naranja | No | ||
| Fabaceae | ||||||
| Bauhinia divaricata | 2 | X | Blanca | No | ||
| Canavalia rosea | 1 | X | Morada | No | ||
| Delonix regia | 2 | X | Roja | No | ||
| Piscidia piscipula | 2 | X | Blanca | No | ||
| Lamiaceae | ||||||
| Ocimum campechianum | 1 | X | Blanca-morada | Sí | ||
| Scutellaria gaumeri | 16 | X | Morada | Sí | ||
| Vitex gaumeri | 2 | X | Morada | Sí | ||
| Malvaceae | ||||||
| Hibiscus rosa-sinensis | 3 | X | Roja | No | ||
| Malvaviscus arboreus | 17 | X | Roja | No | ||
| Orchidaceae | ||||||
| Brassavola grandiflora | 1 | X | Blanca | No | ||
| Passifloraceae | ||||||
| Passiflora yucatanensis | 1 | X | Blanca | No | ||
| Rubiaceae | ||||||
| Hamelia patens | 9 | X | Amarilla-roja | Sí | ||
| Ixora coccinea | 1 | X | Roja | Sí | ||
| Verbenaceae | ||||||
| Lantana camara | 3 | X | Amarilla-Roja | No | ||
Doce especies vegetales visitadas por C. forficatus son consideradas nativas de isla Cozumel, mientras que siete son exóticas. El mayor número de registros fue para tres especies nativas de la isla: Malvaviscus arboreus (24%), Scutellaria gaumeri (23%) y Hamelia patens (13%). Las especies exóticas más utilizadas fueron Hibiscus rosa-sinensis y Allamanda blanchetii, cada una con tres registros (Cuadro 1). La probabilidad de que C. forficatus se alimente de una especie nativa se asoció positiva y significativamente a la distancia euclidiana a las zonas de influencia humana de isla Cozumel (X 2 = 6.61, g. l. = 1, p = 0.01; Figura 2).
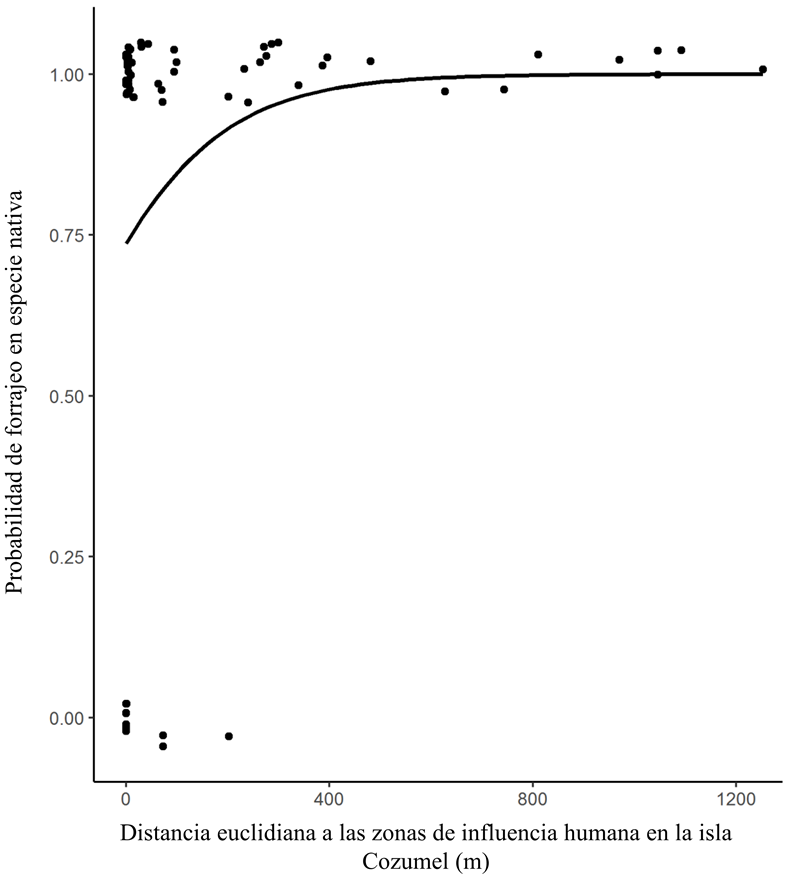
Figura 2 Modelo de la probabilidad de eventos de forrajeo de Chlorostilbon forficatus en especies vegetales nativas (puntos negros alineados en “1”) y exóticas (puntos negros alineados en “0”) en la isla Cozumel en función de la distancia euclidiana a las zonas de influencia humana en la isla. La probabilidad la estimamos a través de un GLM con distribución de error binomial.
Discusión
El colibrí esmeralda de Cozumel se alimentó del néctar de 19 especies de plantas. Se reporta que otras especies insulares del género Chlorostilbon se alimentan del néctar de entre 8 y 11 especies de plantas; por ejemplo: el colibrí esmeralda de Cuba (C. ricordii) se alimenta de entre 8 y 9 especies de plantas (Dalsgaard et al. 2012, Dalsgaard et al. 2018); la dieta del colibrí esmeralda de Puerto Rico (C. maugaeus) está compuesta por el néctar de entre 9 y 11 especies (Kodric-Brown et al. 1984, Dalsgaard et al. 2018), y el colibrí esmeralda de La Española (C. swainsonii) visita al menos 11 especies vegetales (Martén-Rodríguez et al. 2011, Martén-Rodríguez et al. 2015), aunque en este último caso los estudios citados se enfocaron solamente en las especies de las familias Gesneriaceae y Heliconiaceae, por lo que la riqueza de especies vegetales que componen la dieta de C. swainsonii podría ser más amplia. Si bien la composición de la dieta de las diferentes especies insulares del género Chlorostilbon es diferente en cada isla, coinciden en el uso de plantas pertenecientes a las familias Rubiaceae, Lamiaceae y Fabaceae.
De las especies de plantas que componen la dieta de C. forficatus únicamente tres especies tienen corolas tubulares de algún color llamativo. Este resultado respalda el considerar a C. forficatus como un visitante floral generalista, ya que tiene la capacidad de visitar especies florales con una gran variedad de características morfológicas. Lo anterior es consistente con lo reportado para otras especies pequeñas de colibríes en islas del Caribe. En dichas comunidades los colibríes pequeños se alimentan de especies vegetales sin las características del tradicional síndrome de ornitofilia; es decir, se comportan como visitantes florales generalistas (Dalsgaard et al. 2008, 2009, 2012). Este patrón puede ser explicado por la dominancia de los colibríes grandes sobre las especies pequeñas, lo que obligaría a estas últimas a explotar recursos no defendidos por especies territoriales o de mayor tamaño corporal (Arizmendi y Ornelas 1990). Pudimos observar a Anthracothorax prevostii perseguir a C. forficatus cuando intentaba forrajear en flores de Delonix regia. Sin embargo, es necesario realizar investigaciones que permitan conocer la dinámica de la jerarquía de dominancia del ensamble de colibríes en la isla Cozumel. Los visitantes florales generalistas, como las especies pequeñas de colibríes, podrían ser benéficos para las plantas de las que se alimentan, ya que una especie vegetal con un síndrome de polinización generalizado atraerá a una mayor variedad de polinizadores (e.g., insectos y colibríes), lo que incrementaría sus probabilidades de polinización y éxito reproductivo, así como la resiliencia de estas interacciones a fenómenos naturales (e.g., huracanes) que podrían afectar la abundancia de los polinizadores (Dalsgaard et al. 2008).
Por otro lado, nuestros resultados confirman que dentro de la dieta de C. forficatus hay especies exóticas a la isla. En general, las especies vegetales invasoras presentan un síndrome de polinización generalista y realizan despliegues florales muy abundantes y prolongados, lo que facilita que sean visitadas y polinizadas de forma exitosa por una gran variedad de polinizadores (Traveset y Richardson 2006). La inclusión de especies exóticas en la dieta de C. forficatus podría facilitar su incorporación a las redes de interacción biótica, lo cual promovería su establecimiento y propagación en la isla (Traveset y Richardson 2014). Debido a lo anterior es fundamental realizar estudios sistemáticos y de largo plazo donde se estime la frecuencia con la cual C. forficatus, y el resto del ensamble de colibríes, visita los diferentes recursos florales y así poder estimar la importancia de cada especie vegetal dentro de la red de interacción mutualista.
La probabilidad de observar a C. forficatus forrajeando en una especie vegetal nativa se incrementó significativamente en relación con la distancia euclidiana a las zonas de influencia humana (Figura 2). Sin embargo, el 82% (i.e., 56 registros) de los eventos de forrajeo registrados ocurrió a menos de 300 m de alguna zona de influencia humana. En la década de los ochenta, Téllez-Valdez et al. (1989) reportaron que la población humana en la isla no había alterado o modificado la vegetación original de manera notable; sin embargo, el número de habitantes se ha incrementado de manera considerable en la isla. En 1995 se estimó que más de 48 mil personas habitaban la isla; no obstante, para 2015 la población se incrementó en casi un 80% y ascendió a 86 mil habitantes (INEGI 2015). Además del crecimiento de la población humana residente, el turismo es la principal actividad económica de la isla, y esto incrementa notablemente las presiones antrópicas sobre la diversidad biológica insular (Palafox-Muñoz y Collantes-Chávez 2009). El incremento de la población humana en la isla promueve procesos de urbanización y un aumento en la demanda e importación de recursos. Esto incrementa la probabilidad de ingreso y establecimiento de especies exóticas, así como una reducción en la cobertura vegetal y la conectividad entre los fragmentos remanentes de vegetación nativa (Robinson et al. 2005, Hansen et al. 2005). Se ha reportado que especies de plantas herbáceas asociadas a estadios de sucesión temprana se ven favorecidas por perturbaciones que generan la formación de claros en la selva (Linhart et al. 1987); por ejemplo, algunas de las especies herbáceas que C. forficatus utilizó las observamos a los costados de los caminos (e.g., Scutellaria gaumeri y Hamelia patens). Las condiciones de perturbación natural y antropogénica también facilitan el establecimiento y propagación de especies vegetales exóticas (McKinney 2008). En islas oceánicas existe una correlación positiva entre el incremento en la riqueza de especies vegetales exóticas (principalmente angiospermas) y el tamaño de la población humana (Sax et al. 2002). Muchas de estas plantas exóticas son deliberadamente introducidas a los asentamientos humanos con fines ornamentales y de horticultura (Reichard y White 2001); este proceso es evidente en los asentamientos humanos de isla Cozumel, donde es muy frecuente el uso de vegetación exótica con fines ornamentales.
Dado que nuestro estudio estuvo acotado a la temporada de lluvias de un solo año, esperamos que C. forficatus utilice como alimento el néctar de otras especies vegetales y que su uso tenga variaciones anuales e interanuales. Es necesario realizar estudios sistemáticos de largo plazo para incluir esta variación a diferentes escalas temporales. En este sentido, las bases de datos generadas a través de la llamada ciencia ciudadana son útiles para desarrollar estudios extensos en tiempo y espacio. El uso de los datos verificados por la comunidad de la plataforma Naturalista nos permitió identificar recursos adicionales que utiliza C. forficatus y que no pudimos detectar en campo por las limitaciones espacio-temporales. La presente investigación aborda un vacío de información sobre los recursos florales usados y la conducta de forrajeo del colibrí esmeralda de Cozumel, pero a su vez evidencia la necesidad de realizar estudios con mayor detalle.











 nueva página del texto (beta)
nueva página del texto (beta)



